Производители мучных кондитерских изделий все чаще заменяют добавкой E 503 пищевую соду (Е 500) в составе бездрожжевого теста.
Этому есть объяснение: в отличие от натрия карбонатов вещество не требует строгой дозировки при внесении в рецептуру, не оставляет в готовом изделии неприятного привкуса.
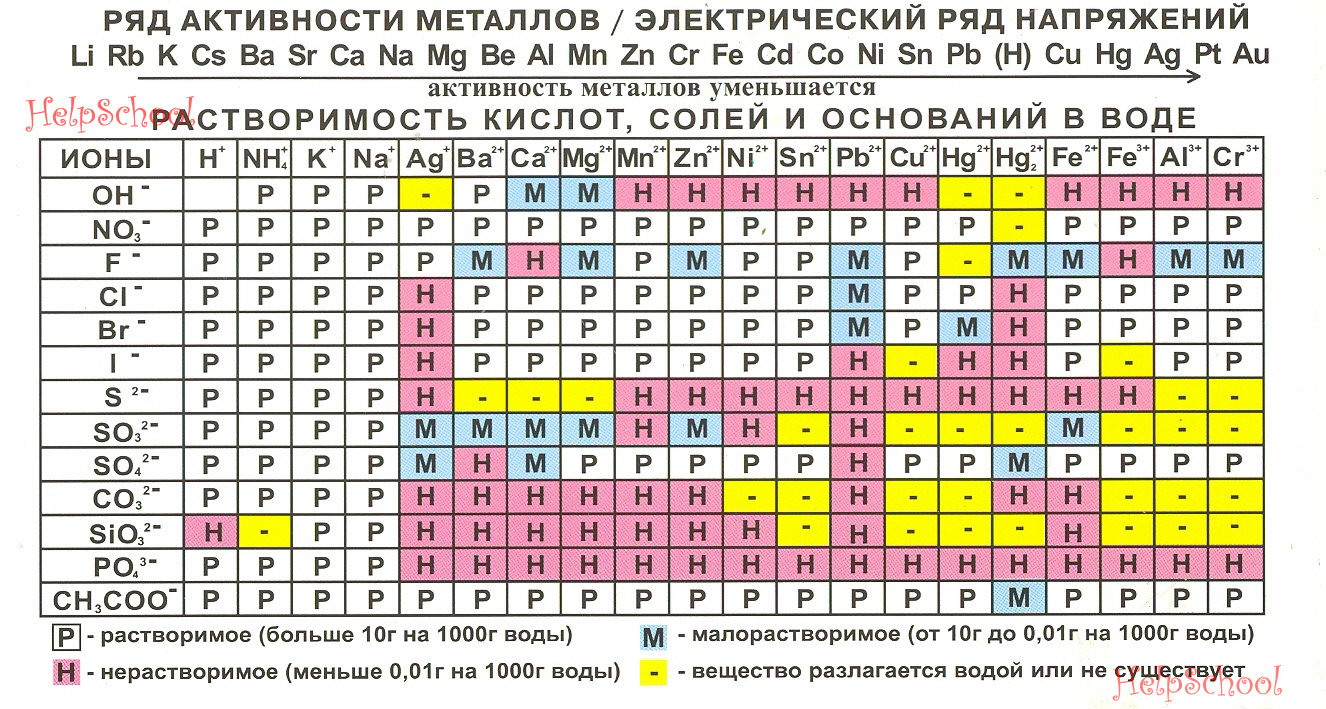
Название продукта
- Аммония карбонаты — официально принятое название добавки (ГОСТ 55580—2013).
- Индекс в европейской кодификации пищевых добавок — Е 503 (Е–503).
- Синонимы:
- Ammonium carbonates, международный;
- пищевые карбонаты аммония;
- углекислый аммоний (карбонат);
- бикарбонат, углекислый кислый аммоний (гидрокарбонат);
- углеаммонийные соли или соли аммония, название может быть указано на упаковке продуктов;
- carbonate de ammonium, немецкий;
- ammonium Carbonat, французский.
Тип вещества
Добавка E 503 относится к группе стабилизаторов пищевых продуктов, разрешена к применению как разрыхлитель и регулятор кислотности.

- смеси карбоната, гидрокарбоната и карбамата аммония (E503i);
- чистого гидрокарбоната аммония (Е503ii).
Существует несколько способов получения вещества.
Добавку для пищевой, фармацевтической, косметической отраслей производят путем взаимодействия двух газов: нитрида водорода (NH3), более известного как аммиак, и диоксида углерода (СО2). Реакция протекает в присутствии паров воды. Получившийся продукт быстро охлаждают и высушивают.
Свойства
| Показатель | Стандартные значения |
| Цвет | белый, допускается серый или розоватый оттенок |
| Состав | аммония карбонаты, формулы: (NH4)2CO3 (карбонат аммония); NH4HCO3 (гидрокарбонат); NH2COONH4(карбамат) |
| Внешний вид | кристаллический порошок |
| Запах | слабый аммиачный |
| Растворимость | хорошо в воде, не растворимы в этаноле и других органических жидкостях |
| Содержание основного вещества | 99% (Е503ii); 30–34% (E503i); |
| Вкус | слабощелочной |
| Плотность | 1,58 г/см3 |
| Другие | pH 8–8,6 (5% водный раствор); при контакте с воздухом разлагается с выделением аммония; подвержен гидролизу; вступает в реакцию с кислотами и сильными окислителями |
Упаковка

- мешки многослойные бумажные;
- мешки продуктовые из сплетенных синтетических нитей;
- ящики из гофрированного картона;
- навивные барабаны.
Добавку Е 503 весом до 1 кг поставляют в плотных полиэтиленовых пакетах или пластиковых банках. В розничную продажу поступает как пекарский порошок.
Применение
Основная сфера применения добавки E 503 — пищевая промышленность.
Допустимая норма неограничена.
В качестве стабилизатора аммония карбонаты разрешены в производстве изделий из шоколада и какао. Кодекс Алиметариус допускает 50 г/кг сухого вещества, СанПиН — 70. Добавка улучшает текстуру взбиваемой массы, фиксирует окраску.
Карбонат аммония включен в технологию изготовления вина. Он ускоряет процесс ферментации сусла, делает более ярким цвет готового напитка.

Добавку индивидуально или вместе с натрия карбонатами (Е 500) можно встретить в составе тортов, пряников, бубликов, печенья и подобных изделий, в том числе для питания детей с первого года жизни. Количество вносимого разрыхлителя не превышает 500 г на тонну сухого вещества.
Стабилизатор E 503 нашел применение в фармацевтической отрасли.
На основе карбоната аммония изготавливают гомеопатические растворы, сиропы, растирания для лечения затяжного кашля (в том числе при воспалении легких), сердечной недостаточности.
Препарат выступает антидотом при укусах змей и отравлении грибами.
Добавку Е 503 в качестве фиксатора окраски и стабилизатора уровня pH используют производители декоративной косметики.
Разрешена во всех странах.
Польза и вред
 По степени опасности для здоровья добавка E 503 относится к 3 классу (умеренно опасное по ГОСТ 12.1.007).
По степени опасности для здоровья добавка E 503 относится к 3 классу (умеренно опасное по ГОСТ 12.1.007).
Потенциальный вред карбонатов аммония связан с их химической особенностью выделять аммиачный газ при взаимодействии с кислородом. Реакция начинается уже при комнатной температуре. Вдыхание паров может спровоцировать спазм бронхов, боли в горле, воспаление слизистой оболочки глаз.
Аллергические реакции в виде сыпи, раздражения, зуда вызывает контакт добавки с кожей.
Важно! Опасность представляет только работа непосредственно с химическим веществом. Продукты, содержащие стабилизатор Е 503, вреда здоровью не причиняют. Аммиак — неустойчивое соединение. Он полностью улетучивается в процессе изготовления любой продукции.
По этой причине опытные мастера добавляют карбонат аммония в готовое тесто непосредственно перед выпечкой. Чем быстрее компонент будет введен в полуфабрикат, тем лучше будет конечный результат.
Основные производители
Среди российских производителей пищевых аммония карбонатов ведущую позицию занимает АО «СДС Азот» (город Кемерово).

- BASF (Германия);
- Foodchem International Corporation (Китай);
- MOLOBELA ML TRADING (ЮАР);
- ZIMA THAI TRADERS (Таиланд);
- Ruban Impex (Индия).
Независимые эксперты группы «Кедр» признали вещество опасным. В чем выражается вред вещества, исследователи не указали. Не была опубликована и доказательная база.
Более детальное исследование провели специалисты университета Саутгемптон (Великобритания) по заказу Агентства по пищевым добавкам.
Было установлено, что добавка E 503 при 60ºC распадается на составляющие: два газообразных вещества (аммиак и диоксид углерода) и воду. Аммиак как нестойкое вещество практически сразу улетучивается. Углекислый газ не опасен. В атмосфере его гораздо больше, чем в печенье. Он также улетучивается, но медленно. Остается один ингредиент — вода.
Вывод очевиден: бубликами с аммония карбонатами отравиться невозможно.
Источник: https://vkusologia.ru/dobavki/stabilizatory-emulgatory/e503.html
Карбонат аммония(пищевая добавка Е503): влияние на организм, опасна или нет
Любое вещество, что попадает в понятие “пищевые добавки”, автоматически причисляется к вредным. Но это большое заблуждение. В перечне Е-шек немало безобидных соединений. В какую категорию отнести карбонат аммония и стоит ли пугаться ингредиента Е503 на этикете?
Карбонат аммония — что это такое?

Соли угольной кислоты широко применяются в пищевой промышленности, поскольку способны при нагревании выделять газообразные соединение (углекислый газ). За счет этого можно получать пористые продукты. Наиболее популярными разрыхлителями являются обычная сода и пищевая добавка Е503 – карбонат аммония.
Выглядит вещество как белые кристаллы, что обладают легким запахом аммиака. Химическая формула аммониевой соли угольной кислоты (NH4)2CO3. Степень окисления NH4 составляет +1, а у CO3 она равна -2. Структурная формула приведена на рисунке:

Главный способ получения соли – это смешивание диоксида углерода, аммиака и воды с одновременным резким охлаждением. Образовавшееся вещество содержит небольшое количество примесей.
- Массовая доля азота в карбонате аммония равна 29,2%.
- Массовая доля кислорода в карбонате аммония равна 50%.
Показатели качества разрыхлителя регламентируются стандартом ГОСТ Р 55580-2013.
Возможные названия пищевой добавки
Химическое наименование вещества – это карбонат аммония или углекислый аммоний, аммониевая соль угольной кислоты. На этикетке пищевых продуктов оно может обозначаться в составе как разрыхлитель или регулятор кислотности Е503.
Также возможна надпись Е503(ii), что означает гидрокарбонат, в нем 99% основного вещества. Если добавка представляет собой смесь нескольких солей угольной кислоты, то маркируется как Е503(i), в ней 30-34% основного соединение в пересчете на NH3.
Международное наименование Ammonium carbonates.
Свойства карбонатов аммония

Главная характеристика Е503 – это разложение при температуре выше 60 градусов. Реакция происходит с выделением воды и газообразных соединений: аммиака и углекислого газа. Из-за этого вещество применяется как разрыхлитель в бездрожжевой выпечке.
Также среди свойств можно отметить:
- высокую растворимость в воде;
- изменение рН раствора в щелочную сторону;
- способность к гидролизу в воде с получением слабого основания и кислоты;
- взаимодействие с другими солями, щелочами и любыми неорганическими кислотами.
Молярная масса составляет 96 г/моль, плотность соединения 1,6 г/м3.
Пищевая добавка Е503 опасна или нет
Польза вещества в том, что более воздушные и пористые изделия лучше усваиваются организмом. Никакого КБЖУ в добавке нет, ее пищевая и энергетическая ценность равна нулю. Такой разрыхлитель пригодится веганам и противникам дрожжей.
Негативное отношение к аммонию связано с тем, что один из его продуктов разложения – аммиак является токсичным соединением. Но для отравления необходимо вдыхать его концентрированные пары, что в случае применения разрыхлителя по назначению невозможно.
Во время выпекания блюд в помещении присутствует не совсем приятный запах аммиака. У особо чувствительных людей он может вызывать слезотечение и першение в горле. В процессе приготовления аммиак, как и СО2 улетучивается, в самом продукте остается лишь вода.
Поэтому после остывания пищи в ней нет ни запаха аммония, ни какого-либо вреда для организма.
Добавка Е503 разрешена во всех странах, она считается безопасной. Эта соль угольной кислоты используется даже в детском питании для малышей первого года жизни. Ее количество не нормируется (не ограничивается).
Применение пищевого аммония в продуктах питания

Основная область использования разрыхлителя – это выпечка. Изделия с ним получаются пышные без дрожжей, причем тесто не нужно предварительно выдерживать в тепле. Оно поднимается в процессе термической обработки.
Добавку Е503 можно встретить на этикетке таких продуктов:
- хлеб и булочные изделия, особенно бездрожжевые категории;
- печенье;
- торты, пирожные, бисквиты;
- бублики;
- смеси для выпечки;
- детское питание;
- изделия с добавлением какао-продуктов.
Аммоний продается в супермаркетах в маленьких пакетиках. Самая популярная марка Dr. Oetker. Этот ингредиент можно в большинстве рецептов заменять любым другим разрыхлителем, в том числе содой.
Пищевая добавка Е503 относится к безопасным веществам. Не стоит пугаться, если в составе продукта промелькнет углекислый аммоний. Соединение не представляет никакой опасности, оно разрешено даже в детском питании.
Источник: https://good-looks.info/karbonat-ammonija-e503.html
Что такое карбонат аммония — свойства и вред пищевой добавки Е 503, применение
Содержание
Рассказать ВКонтакте Поделиться в Одноклассниках Поделиться в Facebook
Люди, заботящиеся о своем здоровье, внимательно изучают на упаковках продуктов состав. Не все из пищевых добавок безопасные, многие причиняют вред, запрещены для применения. Относится ли к ним Е 503, какое влияние она производит, – предстоит разобраться.
Что такое карбонат аммония
Люди ежедневно употребляют пищу, для приготовления которой используют это синтетическое вещество. Карбонат аммония – это соединение, состоящее из аммониевых солей уксусной кислоты – карбоната и бикарбоната. Химическая формула вещества – (NH4)2CO3. Препарат может иметь различные названия:
- добавка Е 503 – международное обозначение;
- углеаммонийная соль;
- углекислый аммоний;
- нашатырный спирт;
- аммоний пищевой.
По внешнему виду карбонат – это бесцветные кристаллы с небольшим запахом аммиака, легко растворимые водой, могут быть подвержены гидролизу. В соприкосновении с воздухом они превращаются в двууглекислый аммоний, запрещенный для производства продуктов – требуется их особое хранение. При повышении температуры вещество становится неустойчивым, проходят химические процессы:
- начиная с 36 градусов, выделяется летучий аммиак (ammonium), получается гидрокарбонат аммония – NH4HCO3;
- когда температура становится 60 градусов, – он дальше распадается на воду, углекислый газ, аммиак.

Применение пищевого аммония
Особенность карбоната аммония – вступать в реакцию с появлением углекислого газа – находит употребление в пищевой промышленности.
Вещество используют при выпечке хлеба, изготовлении кондитерских продуктов как замену дрожжам и соде.
Газ внутри готового изделия создает полости, придавая пышность, свойство долго не черстветь, сохранять свежесть. Углеаммонийные соли можно применять для выпечки продуктов:
- тортов;
- булок;
- печенья;
- пирогов.
Находится применение пищевого аммония в кондитерской промышленности при изготовлении мороженого, изделий из шоколада, конфет как эмульгатора. Даже при выпуске детского питания используется эта добавка. Углеаммонийные соли применяет:
- фармацевтическая промышленность – для изготовления нашатырного спирта, антидота при укусах змей, сиропа от кашля;
- косметические фирмы – как средство для стабилизации цвета в красках для волос;
- для изготовления удобрений;
- как составляющие средства для огнетушения.

Пищевая добавка Е503
Благодаря происходящим при температуре химическим процессам, пищевая добавка Е503 становится безвредной, разрешенной к употреблению во многих странах. Применяется как вспомогательное вещество:
- разрыхлитель – ускоряет процесс приготовления выпечки, добавляя ей пышности;
- эмульгатор – помогает сделать однородной смесь из несмешиваемых компонентов в кондитерских продуктах;
- регулятор кислотности – для выпуска вин, способствует быстрой ферментации.

Влияние на организм Е503
Соли карбоната считаются умеренно вредными – относятся к третьему классу опасности.
Что это означает, какое влияние производит на здоровье человека? Соединения карбоната способны выделять вредный аммиак, который вызывает аллергию, отравления, но только в первозданном состоянии.
При производстве продуктов под действием температуры опасные соединения распадаются, становятся безвредными. В готовых изделиях добавка не находится, влияние на организм Е503 не оказывает.
Видео
 Аммиак и соли аммония. Видеоурок по химии 9 класс
Аммиак и соли аммония. Видеоурок по химии 9 класс
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Источник: https://sovets.net/12456-karbonat-ammoniya.html
Карбонат аммония

Характеристика
На вид добавка е503 представляет собой кристаллы розового, серого, белого цветов, либо вообще бесцветные, имеющие характерный запах аммиака. Хорошо растворима в воде, неустойчива в растворе и на воздухе.
Уже при температуре 18-25 градусов по Цельсию начинает выделять аммиак и превращается в гидрокарбонат аммония. А при температуре 60 градусов вещество распадается на аммиак, углекислый газ и воду.
Собственно, именно выделение газов при разложении добавки позволяет использовать ее в пищевой промышленности, в основном, в хлебопекарной и кондитерской вместо дрожжей.
Получение карбоната аммония
Впервые получение карбоната аммония произошло из органических азотистых продуктов (волосы, ногти, рога) под воздействием высокой температуры путем дистилляции. На сегодняшний момент добавку е503 получают в промышленных масштабах путем нагревания смеси хлористого аммония, либо же в результате взаимодействия воды с углекислым газом и аммиаком при условии быстрого охлаждения.
Воздействие карбоната аммония на организм человека
Согласно некоторым неофициальным данным добавка е503 является потенциально небезопасной для человеческого организма. Возможно, вред добавки связывают с высокой токсичностью аммиака, который образуется в результате разложения карбоната аммония.
Однако точно известно, что в процессе разложения вещества (в ходе приготовления продукта) аммиак и углекислый газ полностью улетучиваются, а в готовой продукции остается только вода.
Так что добавку е503 можно назвать вредной для организма исключительно в своем исходном состоянии.
На сегодняшний день использование солей аммония е503 разрешено практически во всех странах мира.
Применение карбоната аммония
В пищевой промышленности добавку е503 используют преимущественно вместо дрожжей или соды в хлебопекарной и кондитерской промышленности. Таким образом, карбонат аммония можно встретить в следующих продуктах: бублики, различные виды печенья, хлебобулочные изделия, торты.
В странах Скандинавии и северной Европы добавку е503 применяют для приготовления фирменных видов печенья. Так, при выпечке исландского воздушного печенья применяют исключительно добавку е503. Если заменить ее на дрожжи или соду, то оригинальное печенье не получится.
Помимо пищевой промышленности карбонат аммония используют в косметике в качестве красителя, добавляют в лекарственные препараты (нашатырь, сиропы от кашля). Также добавка е503 является ускорителем ферментации при производстве вин и компонентом огнетушащих составов.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Источник: https://www.neboleem.net/karbonat-ammonija.php
Исчезающий порошок
- Проводите эксперимент на подносе.
- Снимите перчатки перед тем, как поджигать свечку.
Общие правила безопасности
- Не допускайте попадания химических реагентов в глаза или рот.
- Не допускайте к месту проведения экспериментов людей без защитных очков, а также маленьких детей и животных.
- Храните экспериментальный набор в месте, недоступном для детей младше 12 лет.
- Помойте или очистите всё оборудование и оснастку после использования.
- Убедитесь, что все контейнеры с реагентами плотно закрыты и хранятся по правилам после использования.
- Убедитесь, что все одноразовые контейнеры правильно утилизированы.
- Используйте только оборудование и реактивы, поставляемые в наборе или рекомендуемые текущими инструкциями.
- Если вы использовали контейнер для еды или посуду для проведения экспериментов, немедленно выбросьте их. Они больше не пригодны для хранения пищи.
Информация о первой помощи
- В случае попадания реагентов в глаза тщательно промойте глаза водой, при необходимости держа глаз открытым. Немедленно обратитесь к врачу.
- В случае проглатывания промойте рот водой, выпейте немного чистой воды. Не вызывайте рвоту. Немедленно обратитесь к врачу.
- В случае вдыхания реагентов выведите пострадавшего на свежий воздух.
- В случае контакта с кожей или ожогов промывайте поврежденную зону большим количеством воды в течение 10 минут или дольше.
- В случае сомнений немедленно обратитесь к врачу. Возьмите с собой химический реагент и контейнер от него.
- В случае травм всегда обращайтесь к врачу.
Рекомендации для родителей
- Неправильное использование химических реагентов может вызвать травму и нанести вред здоровью. Проводите только указанные в инструкции эксперименты.
- Данный набор опытов предназначен только для детей 12 лет и старше.
- Способности детей существенно различаются даже внутри возрастной группы. Поэтому родители, проводящие эксперименты вместе с детьми, должны по своему усмотрению решить, какие опыты подходят для их детей и будут безопасны для них.
- Родители должны обсудить правила безопасности с ребенком или детьми перед началом проведения экспериментов. Особое внимание следует уделить безопасному обращению с кислотами, щелочами и горючими жидкостями.
- Перед началом экспериментов очистите место проведения опытов от предметов, которые могут вам помешать. Следует избегать хранения пищевых продуктов рядом с местом проведения опытов. Место проведения опытов должно хорошо вентилироваться и находиться близко к водопроводному крану или другому источнику воды. Для проведения экспериментов потребуется устойчивый стол.
- Вещества в одноразовой упаковке должны быть использованы полностью или утилизированы после проведения одного эксперимента, т.е. после открытия упаковки.
Карбонат аммония разлагается на углекислый газ CO2, воду H2O и аммиак NH3. Аммиак-то мы и слышим! В этом опыте он выделяется в небольших количествах, поэтому такая концентрация безопасна. Кстати, водный раствор аммиака, — нашатырный спирт — известный медикамент, которым выводят из обморочного состояния.
- Поместите свечу в горелку для сухого горючего и подожгите ее.
- Накройте горелку пламярассекателем. Сверху положите кусочек фольги.
- Насыпьте в центр фольги одну большую ложку карбоната аммония (NH4)2CO3.
- Наблюдайте за исчезновением порошка.

Карбонат аммония разлагается при нагревании на аммиак, углекислый газ и водяной пар. Все три продукта реакции улетают в окружающий воздух, и от порошка ничего не остаётся.
Утилизируйте отходы эксперимента вместе с бытовым мусором.
Под влиянием высокой температуры происходит разложение карбоната аммония (NH4)2CO3 на составляющие его вещества: аммиак NH3, углекислый газ CO2 и воду H2O:
(NH4)2CO3 → 2NH3(газ) + CO2(газ) + H2O(газ)
NH3 и CO2 – это газы. Вода хоть и является жидкостью при комнатной температуре, при нагревании быстро улетучивается в виде водяного пара. Именно поэтому через некоторое время от порошка карбоната аммония остаётся только воспоминание.
Дополнение
- Карбонат аммония – неустойчивое вещество. При хранении он постепенно выделяет аммиак, превращаясь в бикарбонат аммония NH4HCO3:
- (NH4)2CO3 → NH4HCO3 + NH3(газ)
- Бикарбонат аммония при термическом разложении ведёт себя точно так же, как карбонат. Только газа в процессе выделяется немного меньше:
- (NH4)HCO3 → NH3(газ) + CO2(газ) + H2O(газ)
Какие ещё твёрдые вещества так себя ведут?
Существует множество твёрдых веществ, способных «улетучиться» при нагревании подобно карбонату аммония. Однако далеко не все они при этом разрушаются.
Дополнение
Многие вещества можно подвергнуть термическому разложению. При этом очень малое количество веществ распадается без образования твёрдого осадка. К примеру, помимо карбоната аммония, с выделением газа разлагается при нагревании щавелевая кислота C2O4H2:
C2O4H2 → CO2(газ) + CO(газ) + H2O(газ)
Многие вещества при нагревании плавятся и лишь затем испаряются. Но некоторые соединения способны миновать стадию плавления. Процесс прямого превращения твёрдого вещества в газ без разрушения называется возгонкой. К легковозгоняющимся веществам можно отнести, например, кристаллический йод (I2) и бензойную кислоту (C6H5COOH).
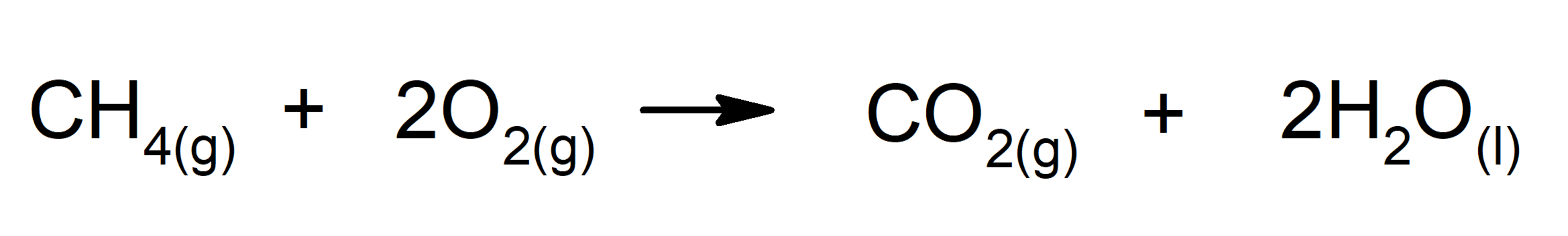
Следует помнить, что в процессах возгонки или термического разложения кислород воздуха не участвует. Если же вещество при нагревании «испаряется» за счёт взаимодействия с кислородом воздуха, то это уже обычная реакция окисления.
Интересный процесс происходит при нагревании хлорида аммония NH4Cl. Под действием высокой температуры он легко разлагается на аммиак NH3 и хлористый водород HCl. Стоит только газам попасть в более холодную зону, как они тут же снова образуют исходное вещество:
- NH4Cl NH3 + HCl
- Таким образом, процесс термического разложения в данном случае очень хорошо «маскируется» под процесс возгонки.
- На примере солей меди рассмотрим реакции, не все продукты термического разложения которых являются летучими.
- Формиат меди: Cu(HCOO)2 → Cu + H2O(газ) + CO(газ) + CO2(газ)
- Нитрат меди: 2Cu(NO3)2 → 2CuO + 4NO2(газ) + O2(газ)
Теперь понятно, что карбонат аммония лишь одно из множества веществ, с которыми можно проводить опыты по термическому разложению. Выбор именно этого вещества обусловлен его безопасностью для домашних экспериментов.
С порошком карбоната аммония можно провести познавательный опыт. Как вы могли узнать из научного описания эксперимента, (NH4)2CO3 разлагается при нагревании на аммиак, углекислый газ и воду:
(NH4)2CO3 → 2NH3(газ) + CO2(газ) + H2O
Вода при нагревании на алюминиевой фольге так же улетучивается. Но её можно поймать! Перед тем, как проводить опыт, возьмите химический стакан из стартового набора. Убедитесь, что он чистый и сухой. Выполните первые 3 пункта из инструкции к эксперименту.
Сразу после того, как вы высыплете карбонат аммония на фольгу, аккуратно поставьте стакан дном вверх на фольгу так, чтобы весь (NH4)2CO3 оказался «внутри» стакана. Внимательно наблюдайте за дном стакана.
Со временем там появятся маленькие капельки жидкости – это вода!
Дело в том, что вода, испаряясь при нагревании, устремляется вверх и встречает на своём пути холодное дно стакана. Оно выступает фактически в роли ловушки для воды. В такой ситуации ей ничего другого не остаётся, кроме как конденсироваться, образовывая капельки.
Из-за свойства полностью разлагаться при нагревании с выделением газа, карбонат аммония (NH4)2CO3 широко используется в пищевой промышленности. В общей классификации пищевых добавок он обозначается как E503 и разрешён к использованию практически во всём мире.
Мы все привыкли называть его разрыхлителем теста. Многие сотни лет для выпечки пышной пористой сдобы использовались дрожжи. Затем на помощь поварам пришёл винный камень (смесь солей винной кислоты).
Наши мамы и бабушки привыкли использовать для выпечки обыкновенную пищевую соду Na_HCO3. Современные рецепты большинства видов печенья, кексов и пирогов включают именно карбонат аммония.
Основным его преимуществом перед всеми остальными разрыхлителями является то, что в процессе выпекания он полностью испаряется, не влияя на конечный вкус продукта.
- Пищевая промышленность – не единственная сфера применения карбоната аммония. Большое его количество используется как сырье для получения сульфата аммония (NH4)2SO4 из гипса CaSO4:
- (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
- Полученный в результате сульфат аммония используется как азотно-серное удобрение, которое помогает растениям быстро расти, не насыщая при этом почву вредными для здоровья нитратами.
Как получают карбонат аммония?
Наблюдаемый в эксперименте процесс полностью противоположен получению карбоната аммония в промышленных масштабах. Для синтеза этой соли используют смесь аммиака, углекислого газа и водяного пара, которые сперва нагревают вместе, а затем быстро охлаждают продукты реакции, основным компонентом которой является карбонат аммония:
2NH3 + CO2 + H2O → (NH4)2CO3(тв)
Источник: https://melscience.com/RU-ru/experiments/disappearing-powder/
Е503 – Карбонаты аммония | Добавкам.нет
Добавка E503 (карбонат аммония) представляет собой аммониевую соль угольной кислоты. В быту получил распространение как нашатырный спирт. На вид это бесцветные кристаллы, хорошо растворимые в воде. Молекулярная формула вещества: (NH4)2CO3. Это очень не устойчивое соединение.
На воздухе уже при комнатной температуре начинает протекать химическая реакция окисления с выделением токсичного газа аммиака и превращением вещества в бикарбонат аммония (NH4HCO3). При температуре выше 60 °C карбонат аммония распадается на воду (H2O), углекислый газ (CO2) и аммиак (NH3). В связи с выделением газов при разложении добавки E503 она и применяется в пищевой промышленности.
Основное применение — использование карбонатов аммония в кондитерской промышленности и хлебопечении вместо дрожжей.
Впервые карбонат аммония был получен из азотистых органических продуктов (рога, волосы, ногти) методом дистилляции при высоких температурах. Сейчас в промышленности карбонат аммония получают путем нагревания смеси хлористого аммония (NH4Cl) или при реакции обратной разложению: взаимодействие аммиака и углекислого газа с водой при быстром охлаждении.
По некоторым данным, встречающимся в интернете, добавку относят к опасной для здоровья человека. Возможно эти слухи связаны с высокой токсичностью аммиака, образующегося при распаде карбоната аммония.
Однако как видно выше, в ходе химической реакции (в процессе приготовления продукта) углекислый газ и аммиак улетучивается, а в готовом продукте от исходного карбоната аммония остается лишь вода. Так что добавку можно считать вредной для здоровья человека лишь в исходном состоянии.
Использование солей аммония (пищевой добавки E503) разрешено практически во всех странах. Исследования государственного агентства по пищевым стандартам Великобритании (FSA) показали что добавка E503 безвредна для здоровья человека.
В пищевой промышленности карбонат аммония в качестве добавки E503 применяется вместо соды или дрожжей в кондитерской промышленности и хлебопечении. Основные продукты в которых используются карбонаты аммония: различные виды печенья, бублики, торты, хлебобулочные изделия.
В странах северной Европы и Скандинавии карбонат аммония издавна используется для выпечки фирменных видов печенья. Например при выпечке исландского воздушного печенья используется только карбонат аммония. При замене его на соду или дрожжи оригинальное печенье уже не получится.
Также карбонат аммония применяется:
- в лекарственных препаратах (сиропы от кашля, нашатырь и др.);
- в качестве ускорителя ферментации при производстве вина;
- в качестве компонента огнетушащих составов
- в косметике в качестве красителей
Источник: https://dobavkam.net/additives/e503
Гост р 55580-2013 добавки пищевые. аммония карбонаты е503. общие технические условия, гост р от 06 сентября 2013 года №55580-2013
ГОСТ Р 55580-2013
ОКС 67.220.20ОКП 91 1230
- Дата введения 2015-01-01
- 1 РАЗРАБОТАН Государственным научным учреждением Всероссийским научно-исследовательским институтом пищевых ароматизаторов, кислот и красителей Российской академии сельскохозяйственных наук (ГНУ ВНИИПАКК Россельхозакадемии)
- 2 ВНЕСЕН Техническим комитетом по стандартизации ТК 154 «Пищевые добавки и ароматизаторы»
- 3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 6 сентября 2013 г. N 855-ст
4 В настоящем стандарте учтены требования Единого стандарта на пищевые добавки Комиссии Кодекса Алиментариус CODEX STAN 192-1995* «General Standard for Food Additives» (пункт 3.
4) в части Спецификаций на пищевую добавку Е503 Единого свода спецификаций пищевых добавок Объединенного экспертного комитета по пищевым добавкам ФАО/ВОЗ «Combined compendium of food additive specification JECFA.
Volume 4″.________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. — Примечание изготовителя базы данных.
5 ВВЕДЕН ВПЕРВЫЕПравила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты».
В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске информационного указателя «Национальные стандарты».
Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (gost.ru)
1 Область применения
Настоящий стандарт распространяется на пищевую добавку Е503, представляющую собой аммониевые соли угольной кислоты: смесь карбоната аммония, гидрокарбоната аммония, карбамата аммония E503(i) и гидрокарбонат аммония E503(ii) (далее — пищевые карбонаты аммония), предназначенную для использования в пищевой промышленности как регулятор кислотности, разрыхлитель пищевых продуктов.Требования к качеству пищевых карбонатов аммония изложены в 4.1.2, 4.1.3, к безопасности — в 4.1.4, к маркировке — в 4.4.
2 Нормативные ссылки
Источник: http://docs.cntd.ru/document/471851237
Карбонаты аммония: карбонат аммония, гидрокарбонат аммония
Случайный факт:
До 40% всех онкологических заболеваний напрямую связаны с курением (рак легких, пищевода, горла) — Обновить
- Разрешающие применение — 5
- Упоминаний о добавке— 4
- Россия — разрешена
- Украина — разрешена
- Беларусь — разрешена
- Евросоюз — разрешена
- США — разрешена
- Канада — нет данных
Карбонаты аммония Е-503 широко применяется как разрыхлители теста при изготовлении выпечки.
Гидрокарбонат аммония применяет применяется вместо (или совместно) соды или дрожжей в кондитерской промышленности и хлебопечении.
В изначальном состоянии Е-503 является токсичным веществом из-за выделяющегося аммиака, однако при соблюдении технологии приготовления пищевых продуктов, под воздействием высоких температур, распадается на безвредные компоненты. В готовых, термически обработанных продуктах не встречается. Добавку можно считать вредной для здоровья человека лишь в исходном состоянии.
В некоторых странах карбонат аммония издавна используется для выпечки некоторых видов печенья. Например, при выпечке исландского воздушного печенья.
На сегодняшний день Е-503 синтезируется из химических соединений.
В случае применения карбонатов аммония на упаковке часто пишут просто «соли аммония».
Свойства карбонатов аммония
Карбонаты аммония это бесцветные кристаллы, хорошо растворимые в воде. Очень неустойчивы, так как уже при комнатной температуре выделяет аммиак, превращаясь в бикарбонат аммония NH4HCO3. При температуре, выше 60 °C быстро распадается на NH3, CO2 (Оксид углерода(IV)) и H2O.
Применение Е-503
Применение:
В пищевой промышленности добавка Е-503 обычно используется как заменитель соды и дрожжей в хлебопечении и кондитерской отрасли (печенье, торты, шоколадные изделия, бублики, хлебобулочные изделия).
Кроме этого, карбонат аммония применяется в фармацевтике при производстве сиропов от кашля, нашатырного спирта.
Многие косметические фирмы указывают в составе декоративной косметики карбонат аммония, играющий роль стабилизатора яркости цвета.
Часто добавку Е-503 используют при изготовлении вина, как ускоритель ферментации в процессе производства вин.
Кроме того, вещество добавляют в состав огнетушащих составов.
Пищевая добавка чаще всего встречается в категориях: торты, кондитерские изделия.
Пример продуктов, в состав которых может входить вещество:
Источник: https://prodobavki.com/dobavki/E503.html?page=all
Реакции разложения
При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
Разложение оксидов
- При нагревании разлагаются оксиды тяжелых металлов:
- 2Ag2O = 4Ag + O2
- 2HgO = 2Hg + O2
- 4CrO3 = 2Cr2O3 + O2
- 2Mn2O7 = 4MnO2 + 3O2
Разложение гидроксидов
- Как правило, при нагревании разлагаются нерастворимые гидроксиды.
Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
- 2LiOH = Li2O + H2O
- Гидроксиды других щелочных металлов при нагревании не разлагаются.
- Гидроксиды серебра (I) и меди (I) неустойчивы:
- 2AgOH = Ag2O + H2O
- 2CuOH = Cu2O + H2O
- Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
- В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
- 2Cr(OH)3 = Cr2O3 + 3H2O
- Mn(OH)2 = MnO + H2O
- Fe(OH)2 = FeO + H2O
- Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
- 2Fe(OH)3 = Fe2O3 + 3H2O
- 2Al(OH)3 = Al2O3 + 3H2O
Разложение кислот
- При нагревании разлагаются нерастворимые кислоты.
- Например, кремниевая кислота:
- H2SiO3 = H2O + SiO2
- Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
- H2SO3 = H2O + SO2↑
- H2CO3 = H2O + CO2↑
- В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
- Например, при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
- K2CO3 + H2O + CO2 = 2KHCO3
- Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
- 2HNO2 = H2O + NO2↑ + NO↑
- При нагревании выше 100оС продукты распада несколько отличаются:
- 3HNO2 = H2O + HNO3↑ + 2NO↑
- Азотная кислота под действием света или при нагревании частично обратимо разлагается:
- 4HNO3 = 2H2O + 4NO2 + O2
Разложение солей
- Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
- Хлорид серебра (I) разлагается под действием света:
- 2AgCl → Ag + Cl2
- Хлорид аммония при нагревании выше 340 оС разлагается:
- NH4Cl → NH3 + HCl
Разложение нитратов
- Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
- Например, разложение нитрата калия:
- 2KNO3 → 2KNO2 + O2
- Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 оС:
- Ca(NO3)2 → Ca(NO2)2 + O2
- Mg(NO3)2 → Mg(NO2)2 + O2
- Ba(NO3)2 → Ba(NO2)2 + O2
- Sr(NO3)2 → Sr(NO2)2 + O2
- При более сильном нагревании (выше 500оС) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
- 2Ca(NO3)2 → 2CaО + 4NO2 + O2
- 2Mg(NO3)2 → 2MgО + 4NO2 + O2
- 2Sr(NO3)2 → 2SrО + 4NO2 + O2
- 2Ba(NO3)2 → 2BaО + 4NO2 + O2
- Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
- 2Cu(NO3)2 → 2CuО + 4NO2 + O2
- 2Pb(NO3)2 → 2PbО + 4NO2 + O2
- 4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
- 4LiNO3 → 2Li2O + 4NO2 + O2
- Нитраты серебра и ртути разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
- 2AgNO3 → 2Ag + 2NO2 + O2
- Hg(NO3)2 → Hg + 2NO2 + O2
- Нитрат аммония разлагается при небольшом нагревании до 270оС оксида азота (I) и воды:
- NH4NO3 → N2O + 2H2O
- При более высокой температуре образуются азот и кислород:
- 2NH4NO3 → 2N2 + O2 + 4H2O
Разложение карбонатов и гидрокарбонатов
- Карбонаты натрия и калия плавятся при нагревании.
- Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
- Li2CO3 → Li2O + CO2
- CaCO3 → CaO + CO2
- MgCO3 → MgO + CO2
- Карбонат аммония разлагается при 30оС на гидрокарбонат аммония и аммиак:
- (NH4)2CO3 → NH4HCO3 + NH3
- Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
- NH4HCO3 → NH3 + CO2 + H2O
- Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
- 2NaHCO3 → Na2CO3 + H2O + CO2
- 2KHCO3 → K2CO3 + H2O + CO2
- Гидрокарбонат кальция при нагревании до 100оС разлагается на карбонат, углекислый газ и воду:
- Ca(HCO3)2 → CaCO3 + H2O + CO2
- При нагревании до 1200оС образуются оксиды:
- Ca(HCO3)2 → CaO + H2O + 2CO2
Разложение сульфатов
- Сульфаты щелочных металлов при нагревании не разлагаются.
- Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
- 2MgSO4 → 2MgO + 2SO2 + O2
- 2CuSO4 → 2CuO + 2SO2 + O2
- 2BaSO4 → 2BaO + 2SO2 + O2
- 2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
- 2Fe2(SO4)3 → 2Fe2O3 + 6SO2 + 3O2
- Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
- Ag2SO4 → 2Ag + SO2 + O2
- 2HgSO4 → 2Hg + 2SO2 + O2
Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
- 2Na2HPO4 → H2O + Na4P2O7
- 2K2HPO4 → H2O + K4P2O7
- 2CaHPO4 → H2O + Ca2P2O7
- Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
4Na2SO3 → Na2S + 3Na2SO4
Разложение солей аммония
- Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
- NH4Cl → NH3 + HCl
- NH4Br → NH3 + HBr
- NH4l → NH3 + Hl
- NH4H2PO4 → NH3 + H3PO4
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
- NH4NO3 → N2O + 2H2O
- NH4NO2 → N2 + 2H2O
- Видеоопыт разложения нитрита аммония можно посмотреть здесь.
- (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Разложение перманганата калия
2KMnO4 → K2MnO4 + MnO2 + O2
Разложение хлората и перхлората калия
- Хлорат калия при нагревании разлагается до перхлората и хлорида:
- 4KClO3 → 3KClO4 + KCl
- При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
- 2KClO3 → 2KCl + 3O2
- Перхлорат калия при нагревании разлагается до хлорида и кислорода:
- KClO4 → KCl + 2O2
Источник: https://chemege.ru/reakcii-razlozheniya/




