6.3.
Амфотерные гидроксиды, их свойства
- Амфотерные гидроксиды – электролиты,
образующие при диссоциации одновременно катионы Н+и анионы ОН–: - X+ + OH– ⇌ ХOH = HXO ⇌ H++ XO–.
- Амфотерные гидроксиды в кислой среде ведут
себя как основания, а в щелочной – как кислоты.
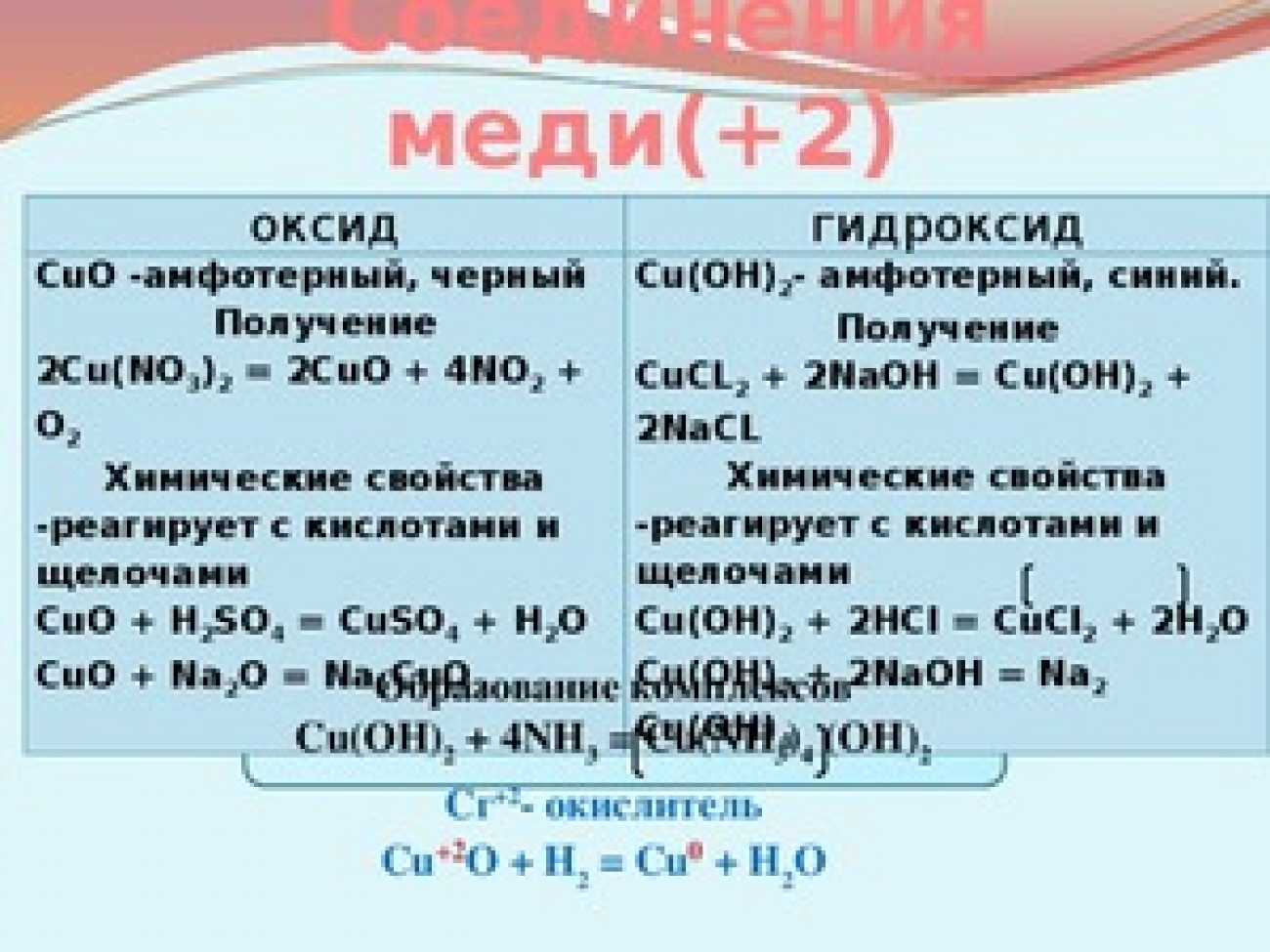
K амфотерным гидроксидам относятся Be(OH)2,
Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3,
Fe(OH)3,
Cr(OH)3 и некоторые
другие, им соответствуют амфотерные оксиды. Практически все они нерастворимы в
воде, являются слабыми электролитами и диссоциируют ступенчато.

Химические свойства
амфотерных гидроксидов
![]()
Например:
2Al(OH)3 + Na2O 2NaAlO2 + 3H2O↑.
![]()
Некоторые
амфотерные гидроксиды (Be(OH)2, Zn(OH)2, Pb(OH)2)
реагируют с кислотным оксидом СО2 с образованием осадков
основных солей и воды. Например:
2Be(OH)2 +
CO2 = (BeOH)2CO3 +
H2O.
![]()
- Например:
- Zn(OH)2 +
2KOH (тв.) K2ZnO2 + 2H2O↑, - Zn(OH)2 + 2KOH = K2[Zn(OH)4].

Например:
Al(OH)3 +
3HCl = AlCl3 + 3H2O.

- Все
амфотерные гидроксиды (как и большинство оснований) разлагаются при нагревании
на оксид и воду. Например: - 2Al(OH)3 Al2O3 +
3H2O. - В связи с
этим нужно учитывать, что фактически в процессе сплавления их со щелочами и
оксидами участвует не сам амфотерный гидроксид, а соответствующий ему оксид.
![]()
УПРАЖНЕНИЯ
1.
Гидроксид хрома взаимодействует с каждым из двух
веществ:
1) СО2 и
HCl 2) Н2 и NaOH 3) NО
и NaNO3 4) H2SO4 и NaOH
Решение:Гидроксид хрома –
амфотерный гидроксид. Амфотерные гидроксиды реагируют с кислотами и щелочами, с
кислотыми и основными оксидами. Поэтому нам подходит вариант 4 –серная кислота
и гидроксид натрия (щелочь):
- 2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
- Cr(OH)3 + NaOH
= Na[Cr(OH)4] - Ответ: 4
- ________________________________________________________________
- 2. Гидроксид калия взаимодействует с каждым из
двух веществ - 1) нитратом натрия и нитратом серебра
- 2) гидроксидом алюминия и нитратом серебра
- 3) гидроксидом цинка и оксидом меди(I)
- 4) хлоридом бария и оксидом фосфора(V)
- Решение:
Гидроксид калия это щелочь. она взаимодействует
с кислотами,кислотными оксидами, амфотерными оксидами и гидроксидами,растворами
солей при условии, если есть признак необратимости реакции (осадок,
газ, слабый электролит). Данному условию соответствует набор веществ
в варианте 2 — амфотерный гидроксид и соль.
________________________________________________________________
3.
Осуществить превращения:
| Al-1- Al2O3 -2— NaAlO2 -3— Al (OH)3 -4— Al2O3 |
- 1. 4Al + 3O2 = 2Al2O3
- 2. Al2O3 + Na2O 2NaAlO2
- 3. NaAlO2 + HCl + H2O = NaCl + Al(OH)3
- 4. 2Al(OH)3 Al2O3 +3H2O
- ________________________________________________________________
- 4.
Осуществить превращения:
| AlCl3 —1— Al(OH)3 -2— Na[Al (OH)4] —3— AlCl3 |
- 1. AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
- 2. Al(OH)3 + NaOH = Na[ Al(OH)4 ]
- 3. Na[ Al(OH)4 ]+ 4HCl = NaCl + AlCl3 + 4H2O
- ________________________________________________________________
- ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ - 1. Закончите уравнения реакций:
- Cr(OH)3 +
6HCl = ? - Cr(OH)3 +
NaOH = ? - 2. Напишите уравнения реакций, описывающие следующие
химические превращения: - а)
ZnCl2 + KOH(избыток) → осадок → растворение осадка; - б)
Cr(NO3)2 +
NaOH(избыток) → осадок
→ растворение осадка. - 3.
Закончи уравнения реакций:
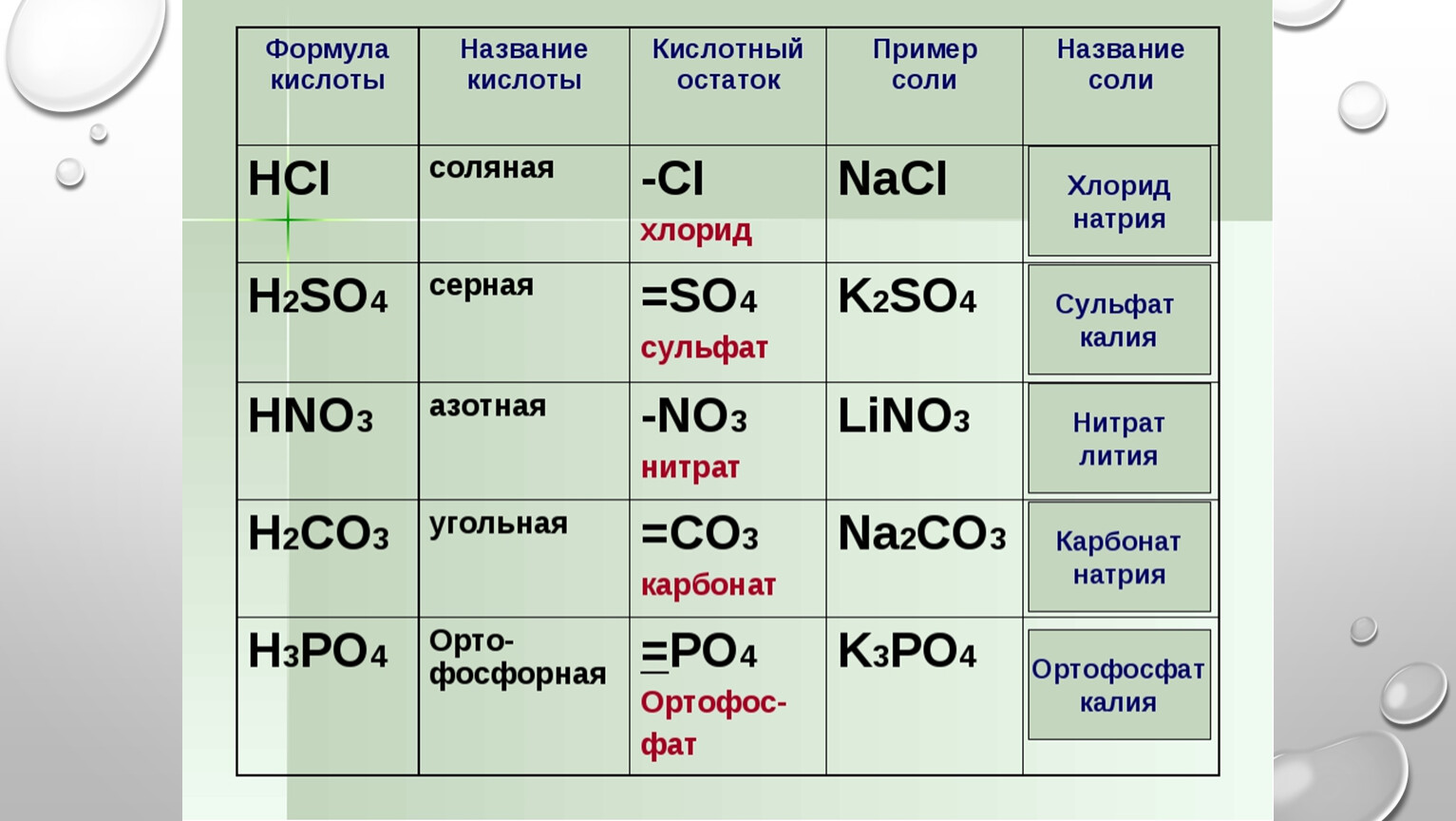
4. В предложенных рядах исключи (вычеркни) одну лишнюю
формулу – такую, которая не образует с остальными однородную группу. Объясни
свой выбор.
- а)
HClO4, H2SO3, HNO3, H3PO4;
б) KOH, Mg(OH)2, Al(OH)3; - в)
HBr, HCl, HF; г) Mg(OH)2, Ca(OH)2, Zn(OH)2,
Ba(OH)2; - д) H2CO3,
H2SO3, HNO3; е) ZnO, BeO, MgO. - 5. Составь уравнения реакций, соответствующие схемам:
- 1) Zn Na2→ZnO2 → ZnSO4 → Zn(OH)2 → ZnO;
- 2) Al2O3 → X → Al(OH)3 → Y → AlCl3;
6. Предложи cпособ разделения смеси KOH,
Mg(OH)2, Fe(OH)3. Напиши уравнения реакций.
………………………………………………………………………………………
……………………………………………………………………………………..
- ………………………………………………………………………………………
- 7.
Осуществите следующие превращения: - Al2O3 → Al → Al2O3 → NaAlO2 → AlCl3
8. Из порошкообразной смеси, содержащей
Na2CO3, Fe, Al и
BaSO4, выделите химическим путем все соединения в чистом виде.
Напишите уравнения реакций и последовательность их проведения (опишите
технологию всей работы).
- 9. Напишите схему диссоциации
гидроксида хрома (III), а также молекулярное и ионное уравнения реакций
растворения его в: - а) азотной кислоте;
- б) растворе гидроксида натрия.
10. Заполни таблицу по химическим свойствам амфотерных гидроксидов
(укажи продукты реакций). Напиши уравнения реакций на примере Zn(OH)2.
| Вещества-реагенты | Продукты реакции с амфотерными гидроксидами | |
| Основный оксид | щелочных/ щелочно-земельных металлов | ………………………………………………………….. |
| остальных металлов | ………………………………………………………….. | |
| Амфотерный оксид | ………………………………………………………….. | |
| Kислотный оксид | ………………………………………………………….. | |
| Основание | растворимое (щелочь) | ………………………………………………………….. |
| нерастворимое | ………………………………………………………….. | |
| Амфотерный гидроксид | ………………………………………………………….. | |
| Kислота | ………………………………………………………….. | |
| Соль | ………………………………………………………….. | |
| Металл | ………………………………………………………….. | |
| Неметалл | ………………………………………………………….. | |
| Термическое разложение | ………………………………………………………….. |
![]()
ВИДЕО ОПЫТ
| 1. В отличие от гидроксида калия гидроксид алюминия реагирует с: | |
| а) хлоридом натрия | б) соляной кислотой |
| в) гидроксидом натрия (р-р) | г) серной кислотой |
| 2. Гидроксид меди (II) можно получить при взаимодействии: | |
| а) оксида меди (II) с водой | б) меди с водой |
| в) водных растворов хлорида меди (II) и гидроксида натрия | г) меди и водного раствора гидроксида натрия |
| 3. В каких группах указаны формулы веществ, все из которых реагируют с разбавленным раствором гидроксида калия: | |
| а) Al, NaCl, NH4Cl | б) P2O5, Al, Cu |
| в) Mn2O7, ZnO, Na2CO3 | г) CO2, FeCl2, Zn(OH)2 |
| 4. Действием каких веществ из гидроксида калия нельзя получить нитрат калия: | |
| а) нитрат натрия | б) азотная кислота |
| в) нитрат меди (II) | г) оксид азота (V) |
| 5. Укажите схемы реакций, в результате протекания которых образуется гидроксид алюминия: | |
| а)Al2O3 + H2O → | б)Al2O3 + KOH (р-р)→ |
| в)AlCl3 + K→ | г) Al2(SO4)3 + 3Ba(OH)2 → |
| 6. В каких парах между веществами при определенных условиях возможно химическое взаимодействие: | |
| а) гидроксид калия и оксид кремния (IV) | б) хлорид калия и гидроксид бария |
| в) железа и гидроксид натрия | г) гидроксид кальция и оксид углерода (IV) |
| 7. Щелочи могут реагировать: | |
| а) только с сильными кислотами | б) все ответы верны |
| в) только с кислотными оксидами | г) как с кислотными, так и с амфотерными оксидами |
| 8. Укажите формулы веществ, с водными растворами которых реагирует Cu(OH)2: | |
| а)NaOH (разб.) | б) HCl |
| в)все ответы верны | г) KCl |
| 9. Основание не образуется при взаимодействии избытка разбавленного раствора щелочи с: | |
| а) сульфатом алюминия | б) хлоридом железа (II) |
| в) нитратом аммония | г) все ответы верны |
| 10. Гидроксид алюминия проявляет кислотные свойства, реагируя с: | |
| а) соляной кислотой | б) гироксидом калия |
| в) серной кислотой | г) нет верного ответа |
Ответы:
| 1 | в |
| 2 | в |
| 3 | г |
| 4 | а |
| 5 | г |
| 6 | а |
| 7 | г |
| 8 | б |
| 9 | а |
| 10 | б |
Источник: http://himiy88.blogspot.com/p/63.html
Основания (гидроксиды). Свойства, получение, применение
 Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты.
Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода.
Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
- 2Na + 2H2O → 2NaOH + H2
- Ca + 2H2O → Ca(OH)2 + H2
- Mg + 2H2O Mg(OH)2 + H2
- Na2O + H2O → 2NaOH,
- CaO + H2O → Ca(OH)2.
- 2NaCI + 4H2O 2NaOH + 2H2 + CI2
- Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
- MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.

Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
- Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
- фенолфталеин – малиновый
- лакмус – синий
- метиловый оранжевый – желтый

Фенолфталеин придаёт раствору щёлочи малиновую окраску
- 2KOH + H2SO4 → K2SO4 + 2H2O,
- растворимое
- Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
- нерастворимое
- 2KOH + SO3 → K2SO4 + H2O
- а) при плавлении:
- 2NaOH + AI2O3 → 2NaAIO2 + H2O,
- NaOH + AI(OH)3 → NaAIO2 + 2H2O.
- б) в растворе:
- 2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
- NaOH + AI(OH)3 → Na[AI(OH)4].
- 2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
- 2NaOH + Si + H2O → Na 2SiO3 + 2H2
- 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
- Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
- Ca(OH)2 → CaO + H2O,
- Cu(OH)2 → CuO + H2O.
Источник: https://in-chemistry.ru/osnovaniya-gidroksidy
Гидроксид натрия
С химическим соединением, называемым каустической содой, человек встречается ежедневно. Гидроксид натрия, химическая формула которого обозначается NaOH, относится к разряду едких и сильных щелочей, опасных для кожи и слизистых человека.
Одновременно с этим она активно используется пищевой промышленностью, косметологией, фармацевтикой. Ни одно средство личной гигиены не обходится без добавления этого соединения.
Химические свойства вещества сделали его самым популярным среди регуляторов кислотности и средств для поддержания консистенции.
Что такое гидроксид натрия
Это соединение – едкая щелочь, которая применяется не только пищевой, фармацевтической и косметической сферами, но и химической промышленностью.
Гидроокись натрия, или каустическая сода, выпускается в виде немного скользких твердых гранул желтоватого или белого цвета. При сильной концентрации NaOH разъедает органические соединения, поэтому способен вызвать ожог.
Используется как пищевая добавка Е524, необходимая для поддержания консистенции продуктов.
Формула
Вещество имеет химическую формулу NaOH. Соединение взаимодействует с различными веществами любых агрегатных состояний, нейтрализуя их, с кислотами, образуя соль и воду.
Реакция с атмосферными оксидами и гидроксидами позволяет получить тетрагидроксоцинкат или алкоголят. Едкий натр применяется для осаждения металлов. Например, при реакции с сульфатом алюминия образуется его гидроксид.
Осадок не растворяется и не наблюдается избыточное получение щелочи. Это актуально при очистке воды от мелких взвесей.

Свойства
Соединение растворяется в воде. Технический Sodium Hydroxide представляет собой водный раствор гидроксида натрия в щелочеустойчивой герметичной таре. При взаимодействии с водой каустик выделяет большое количество тепла. Вещество имеет следующие свойства:
- при предварительном расплавлении разрушает стекло, фарфор;
- взаимодействие с аммиаком вызывает пожароопасную ситуацию;
- кипит при 1390°С, плавится, если температура достигает 318°С;
- не растворяется в эфирах, ацетоне;
- очень гигроскопичен (поглощает пары воды из воздуха), поэтому натриевая щелочь должна храниться в сухом месте и герметичной упаковке;
- растворяется в метаноле, глицерине, этаноле;
- бурно взаимодействует с металлами – оловом, гидроксидом алюминия, свинцом, цинком, образует водород – взрывоопасный горючий яд;
- поглощает углекислый газ из воздуха.
Получение
Каустическая сода встречается в составе минерала брусита. Второе по величине месторождение сконцентрировано на территории России. Гидроокись благодаря исследованиям Николы Леблана, проведенным в 1787 г., получают методом синтеза из хлористого натрия.
Позже востребованным способом добычи стал электролиз. С 1882 г. ученые разработали ферритный метод получения в лаборатории гидроксида с помощью кальцинированной соды.
Электрохимический способ сейчас самый популярный: ионы натрия образуют его раствор едкой ртути – амальгаму, которая растворяется водой.
Применение гидроксида натрия
Нет более распространенной щелочи, чем каустическая сода. Ежегодно потребляется порядка 57 млн т. Едкий натрий используется при получении лекарственных препаратов, фенола, органических красителей, глицерина.
Еще одна сфера применения – дезинфекция помещения из-за способности химического соединения нейтрализовать вредные для человека вещества, находящиеся в воздухе.
Еще гидроокиси широко используются для поддержания формы продуктов (пищевая промышленность).

В промышленности
Гидроокись натрия относится к сильной основе для химических реакций и активно применяется разными отраслями благодаря своим свойствам:
- Целлюлозной отраслью – для устранения сульфата в составе древесных волокон для размягчения (делигнификация). Это нужно при производстве картона, бумаги, искусственных волокон.
- Химической промышленностью – применяется для производства масел, нейтрализации веществ кислотной среды, при травлении алюминия, изготовлении чистых металлов.
- Гидроокись натрия используется для получения биодизельного топлива на основе растительных масел, в результате реакции образуется глицерин.
- Соединением омывают пресс-формы автомобильных покрышек.
- В гражданской обороне он распространен при нейтрализации опасных для здоровья веществ в воздухе, дегазации.
- Применяется средство для нелегального производства наркотиков типа метамфетаминов.
Пищевая добавка
Каустическая сода очищает овощи, фрукты от кожицы. Применяется вещество для придания цвета карамели. Как пищевая добавка E524 (класс регуляторов кислотности, веществ против комкования наряду с карбонатом натрия) используется при изготовлении какао, мороженого, сливочного масла, маргарина, шоколада, безалкогольных напитков. Оливки и маслины размягчаются, приобретают черный цвет.
Пищевые продукты – рогалики и немецкие крендели (брецели) – обрабатывают едким раствором для хрустящей корочки. В скандинавской кухне существует рыбное блюдо – лютефиск.
Технология приготовления включает вымачивание на протяжении 5-6 суток сушеной трески в растворе гидроокиси, пока не будет получена желеобразная консистенция.
В пищевой промышленности сода помогает рафинировать растительное масло.
В производстве моющих средств
Способность взаимодействия жиров у каустика была замечена уже давно. С VII века арабы освоили получение твердого мыла с помощью едкого натра и ароматических масел. Эта технология осталась прежней.
Каустическая сода добавляется в шампуни, моющие вещества, средства личной гигиены. Косметическая промышленность применяет гидроксид Na для получения мыла против жиров, жидкости для снятия лака, кремов.
В быту
Основной способ применения – гелеобразный гидроксид или его гранулы. Входит в состав средств для устранения засоров канализации, систем отопления. Грязь растворяется, дезагрегируется и проходит дальше по трубе.
Изделия из нержавеющей стали очищаются от масляных веществ с помощью каустической соды, разогретой до 50-60°С с добавлением гидроксида калия.
Косметология применяет гель на его основе для размягчения ороговевшей кожи, папиллом, бородавок.
Гидроксид натрия в медицине
Соединение добавляется в лекарственные препараты против повышенной кислотности желудка, для слабительного эффекта сильного действия. Такое средство приводит к повышению перистальтики кишечника.
Использование вещества восстанавливает кислотно-щелочной баланс. Применяется оно в медицине для достижения успокоительного эффекта, пригодно для очистки воды от примесей. Благодаря хлориду натрия остаются постоянными индикаторы осмотического давления плазмы крови.
Не стоит путать его с пищевой содой, поваренной солью.
Вред гидроксида натрия
Вещество относится ко второму классу опасности. Из-за способности гидроокиси разъедать органические соединения применение каустика должно осуществляться с соблюдением всех мер предосторожности.
При попадании щелочи на слизистые и кожу она вызывает сильные ожоги, а взаимодействие с глазами приводит к атрофии зрительного нерва.
Для нейтрализации гидроксида на коже применяется слабый раствор уксуса и большое количество проточной воды.
Видео
909
Была ли эта статья полезной?
- Да
- Нет
- 0 человек ответили
Спасибо, за Ваш отзыв!
человек ответили
Что-то пошло не так и Ваш голос не был учтен.
Нашли в тексте ошибку?
Выделите её, нажмите Ctrl + Enter и мы всё исправим!
Источник: https://sovets24.ru/909-gidroksid-natriya.html
Амфотерные гидроксиды. Видеоурок. Химия 11 Класс
Тема: Основные классы соединений, их свойства и типичные реакции
Урок: Амфотерные гидроксиды
С греческого языка слово «amphoteros» переводится как «тот и другой». Амфотерность – это двойственность кислотно-основных свойств вещества. Амфотерными называют гидроксиды, которые в зависимости от условий могут проявлять как кислотные, так и основные свойства.
Примером амфотерного гидроксида может служить гидроксид цинка. Формула этого гидроксида в основной форме – Zn(OH)2. Но можно записать формулу гидроксида цинка в кислотной форме, поставив на первое место атомы водорода, как в формулах неорганических кислот: H2ZnO2 (Рис. 1). Тогда ZnO22- будет кислотным остатком с зарядом 2-.

Рис. 1. Формулы гидроксида цинка
Особенностью амфотерного гидроксида является то, что в нем мало различаются по прочности связи О-Н и Zn-O. Отсюда и двойственность свойств.
В реакциях с кислотами, готовыми отдать катионы водорода, гидроксиду цинка выгодно разрывать связь Zn-O, отдавая ОН-группу и выступая в роли основания.
В результате таких реакций образуются соли, в которых цинк является катионом, поэтому их называют солями катионного типа:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
(основание)
В реакциях со щелочами гидроксид цинка выступает в роли кислоты, отдавая водород. При этом образуются соли анионного типа (цинк входит в состав кислотного остатка – аниона цинката). Например, при сплавлении гидроксида цинка с твердым гидроксидом натрия образуется Na2ZnO2 – средняя соль анионного типа цинкат натрия:
- H2ZnO2 + 2NaOH(ТВ.) = Na2ZnO2 + 2H2O
- (кислота)
- При взаимодействии с растворами щелочей амфотерные гидроксиды образуют растворимые комплексные соли. Например, при взаимодействии гидроксида цинка с раствором гидроксида натрия образуется тетрагидроксоцинкат натрия:
- Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
- [Zn(OH)4]2- – сложный анион, который принято заключать в квадратные скобки.
Таким образом, амфотерность гидроксида цинка обусловлена возможностью существования ионов цинка в водном растворе в составе как катионов, так и анионов. Состав этих ионов зависит от кислотности среды. В щелочной среде устойчивы анионы ZnO22-, а в кислотной среде устойчивы катионы Zn2+.
- Амфотерные гидроксиды – нерастворимые в воде вещества, и при нагревании они разлагаются на оксид металла и воду:
- Zn(OH)2 = ZnO + H2O
- 2Fe(OH)3 = Fe2O3 + 3H2O
- 2Al(OH)3 = Al2O3 + 3H2O
- Степень окисления металла в гидроксиде и оксиде должна быть одинаковой.
- Амфотерные гидроксиды – нерастворимые в воде соединения, поэтому их можно получить по реакции обмена между раствором соли переходного металла и щелочью. Например, гидроксид алюминия образуется при взаимодействии растворов хлорида алюминия и гидроксида натрия:
- AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
При сливании данных растворов образуется белый желеподобный осадок гидроксида алюминия (Рис. 2).
Но при этом нельзя допустить избытка щелочи, ведь амфотерные гидроксиды растворяются в щелочах. Поэтому вместо щелочи лучше использовать водный раствор аммиака. Это слабое основание, в котором гидроксид алюминия не растворяется. При взаимодействии хлорида алюминия с водным раствором аммиака образуется гидроксид алюминия и хлорид аммония:
AlCl3+ 3NH3• H2O = Al(OH)3↓ + 3NH4Cl

Рис. 2. Образование осадка гидроксида алюминия
Список литературы
- Новошинский И. И., Новошинская Н. С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008. (§54)
- Кузнецова Н. Е., Литвинова Т. Н., Лёвкин А. Н. Химия: 11 класс: Учебник для учащихся общеобраз. учрежд. (профильный уровень): в 2-х ч. Ч. 2. М.: Вентана-Граф, 2008. (с. 110-111)
- Радецкий А .М. Химия. Дидактический материал. 10-11 классы. – М.: Просвещение, 2011.
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
- с. 27-29 №№ 5.1, 5.15, 5.25 из Сборника задач и упражнений по химии для средней школы (Хомченко И. Д.), 2008.
Источник: https://interneturok.ru/lesson/chemistry/11-klass/osnovnye-klassy-soedineniy-ih-svoystva-i-tipichnye-reaktsii/amfoternye-gidroksidy
Гидроксиды
Химия
Гидраты оксидов имеют общее название- гидрооксиды. Основаниями(основными гидрокисдами) называются гидраты основных оксидов.Общая формулы- Me(OH)n.Количество гидроксильных групп(OH) в молекулу определяет ее кислотность.
Большинство оснований нерастворимо в воде, растворимы толькоГидроксиды щелочных и щёлочноземельных металлов(их называют щелочами), а также аммония. В водных растворах основания диссоцируют на катион металла гидроксильную группу, амфотерные гидроксиды диссоцируют одновременно и как кислоты, и как основания. Многокислотные основания диссоцируют ступенчато:
Mex++xOH—⇌Me(OH)x≡Hx MeOx⇌xH++MeOxx— (диссоциация амфотерного гидроксида(общая схема))
*Это интересно
Сейчас существует 3 основных теории кислот и оснований:
1. Протолитическая теория Брёнстеда — Лоури.В ней кислота- молекула или ион, способная быть в данной реакции донорами протонов, соответственно основаниями являются молекулы или ионы, присоединяющие протоны. И кислоты, и основания получили название протолиты.
2. Теория кислот и оснований Льюиса. В ней кислота-любая частица способная принимать пару электронов, а основание- частица, способная отдавать эту пару. Теория Льюиса очень похожа на теорию Брёнстеда — Лоури, но отличается от неё тем, что охватывает более широкий круг соединений.
3. Теория Усановича.В ней кислота — это частица, которая может отщеплять катионы, включая протон, или присоединять анионы, включая электрон. Основание — частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы.
Номенклатура:
Неорганические соединения, содержащие группы -OH, называются гидроксидами. NaOH — гидроксид натрия, Fe(OH)2 — гидроксид железа(II), Ba(OH)2-гидроксид бария. (в скобочках указана валентность элемента (если она переменная))
Для соединений, содержащих кислород, используют названия гидроксидов, с приставкой «мета»: AlO(OH) — метагидроксид алюминия, MnO(OH) — метагидроксид марганца
Для оксидов, гидратированных неопределённым числом молекул воды, Me2On∙ n H2O, недопустимо писать формулы типаMe(OH)n. Называть такие соединениями гидроксидами также не рекомендуется. Примеры названий: Tl2O3∙n H2O — полигидрат оксида таллия(III), MnO2∙n H2O — полигидрат оксида марганца(IV)
Так же существуют гидраты -NH3∙H2O (гидрат аммиака) =NH4OH(гидроксид аммония).
Основания дают соли при взаимодействии с кислотами (реакция нейтрализации), при взаимодействии с кислотным оксидом, амфотерным гидроксидом, амфотерным металлом, амфотерным оксидом, неметаллом.
NaOH+HCl→NaCl+H2O (реакция нейтрализации)
2NaOH+2NO2→NaNO3+NaNO2+H2 O (реакция с смешанным ангидридом)
Cl2+2KOH→KCl+KClO+H2O (реакция идёт без нагреванием)
Cl2+6KOH→5KCl+KClO3+3H2O (реакция идёт с нагреванием)
3S+6NaOH→2Na2 S+Na2SO3+3H2O
2Al+2NaOH+6H2O→2Na[Al(OH) 4]+3H2
Al2O3+ 6NaOH→ 2Na3 AlO3+3H2O↑
NaOH+Al(OH)3→Na[Al(OH)4]
Способы получения оснований:
1. Взаимодействие щелочных и щелочноземельных металлов, и аммиака с водой. Металлы (только щелочные или щелочноземельные), взаимодействуя с водой образуют щелочь и выделяют водород. Аммиак взаимодействуя с водой образует неустойчивое соединение NH4OH:
2Na+2H2O→2NaOH+H2↑
Ba+2H2 O→Ba(OH) 2+H2↑
NH3+H2O↔NH4OH
2. Непосредственное присоединение основными оксидами воды. Большинство основных оксидов воду непосредственно не присоединяют, только оксиды ЩМ(щелочные металлы) и ЩЗМ(щелочноземельные металлы), присоединяя воду, образуют основания:
Li2O+H2O→2LiOH
BaO+H2O→Ba(OH)2
3. Взаимодействие с солями. Это один из наиболее распространённых способов получения солей и оснований. Так как это реакция ионного обмена, то оба реагента должны быть растворимы, а один из продуктов- нет:
NaOH+FeCl3→3NaCl+Fe(OH)3↓
Na3PO4+3LiOH→3NaOH+Li3PO4↓
4. Электролиз растворов солей щелочных и щелочноземельных металлов.При электролизе растворов данных солей металлы никогда не выделяются на катоде(вместо них выделяется водород из воды:и 2H2O-2e-=H2↓+2OH-), а на аноде восстанавливается галоген (все, кроме F-), или в случае кислородосодержащей кислоты идёт следующая реакция:
2H2O-4e—=4H++O2↑,галогены восстанавливаются по схеме: 2X—-2e—=X2 (где X – галоген)
2NaCl+2H2O→2NaOH+Cl2↑+H2↑
В водном растворе скапливается щелочь, которую затем можно выделить, упаривая раствор.
Это интересно:
Пероксиды и надпероксиды щелочных и щелочноземельных металлов реагируют с водой, образуя соответствующий гидроксид и пероксид водорода.
Na2O2+2H2O→2NaOH+H2O2
4NaO2+2H2O→4NaOH+ 3O2↑
Теория Брёнстеда —Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb. Например, для аммиака как основания Брёнстеда можно записать:
NH3+H2O↔NH4++OH—

Для более удобного отображения константы основности используют отрицательный логарифм:pKb=-logKb. Так же логично, что сила оснований возрастает в ряду напряжения металлов справа налево.
NaOH+C2H5Cl→NaCl+C2H4+H2O(метод получения алкенов, этилена (этена) в данном случае), использовался спиртовой раствор гидроксида натрия.
NaOH+C2H5Cl→NaCl+C2H5OH (метод получения спиртов, этанола в данном случае), использовался водный раствор гидроксида натрия.
2NaOH+C2H5Cl→2NaCl+C2H2+H2O(метод получения алкинов, ацетилена (этина) в данном случае), использовался спиртовой раствор гидроксида натрия.
C6 H5OH(фенол)+NaOH→C6H5ONa+H2O
Продуктом замещения одного из водородов аммиака на гидроксильную группу является гидрокисламин(NH2OH). Он образуется при электролизе азотной кислоты (с ртутными или свинцовыми катодами), в результате ее восстановления атомарным водородом, образующимся так как параллельно происходит электролиз воды:
HNO3+6H→NH2OH+2H2O
2H2O→ 2H2↑+O2↑
Амфотерные гидроксиды.
Это соединения дают соли как при взаимодействии с кислотами (средние соли) так и при взаимодействиями с основаниями (комплексные соединения).Все амфотерные гидроксиды мало растворимы. Их диссоциацию можно рассмотреть, как по основному, так и по кислотному типу, но поскольку эти 2 процесса идут одновременно, то процесс можно записать следующим образом (Me-металл):
Mex++xOH—⇌Me(OH)x ≡HxMeOx⇌xH++MeOxx-
Так как амфотерные гидроксиды есть гидраты амфотерных оксидов, их наиболее яркие представители – гидраты следующих оксидов:ZnO,Al2O3,BeO, SnO,PbO,Fe2O3,Cr2O3,MnO2,TiO2.
Примеры реакций:
NaOH+Al(OH) 3↓→Na[Al(OH) 4] — гидроксоаллюминат натрия
Al(OH) 3↓+3HCl→AlCl3+3H2O
Но, зная, что амфотерные гидроксиды диссоциируют и по кислотному типу тоже, можно записать их взаимодействие с щелочами по другому уравнению:
Zn(OH)2↓+2NaOH→Na2 [Zn(OH) 4] (в растворе)
H2ZnO2↓+2NaOH→Na2 ZnO2+H2O (в расплаве)
1)H3AlO3↓+3NaOH→Na3AlO3+3H2O (здесь образовался ортоалюминат натрия (реакция происходила в растворе), но если реакция будет при сплавлении, то будет образовываться метаалюминат натрия)
2) HAlO2+NaOH→NaAlO2+H2O(образовался метааллюминат натрия, значит в реакции 1 и2 вступали ортоалюминевая и металюминевая кислоты соответственно)
Получают амфотерные гидроксиды обычно взаимодействием их солей с щелочами, количество которых точно рассчитывают по уравнению реакции:
3NaOH+ Cr(NO3 ) 3→3NaNO3+Cr(OH)3↓
- 2NaOH+ Pb(CH3COO)2→2CH3COONa+Pb(OH)2↓
- Автор статьи: Каштанов Артём Денисович
- Редактор: Харламова Галина Николаевна
Источник: http://www.teslalab.ru/articles/chemistry/24/
Что такое гидроксиды
Сегодня поговорим об очень большой группе соединений, которые называются гидроксиды. Как говорит учебник химии,
гидроксид – это химическое соединение, в котором есть группа –ОН.
Собственно, именно по этому признаку и можно определить, что перед нами гидроксид: в нём всегда есть одна или несколько гидроксильных групп –ОН.
fb.ru
Также запомните, что есть понятие «щёлочь». К щелочам относят гидроксиды металлов щелочных (то есть стоящих в первой группе таблицы Менделеева в основной подгруппе), щёлочноземельных (то есть стоящих во второй группе таблицы Менделеева в основной подгруппе) и аммония NH4+.
В чём разница между гидроксидами и щелочами
щёлочь – понятие более узкое, гидроксид – более широкое. то есть щёлочь – всегда гидроксид, но гидроксид – не всегда щёлочь.
например, гидроксид натрия naoh. натрий находится в первой группе периодической таблицы, это щелочной металл. поэтому naoh – это щёлочь. но если вы назовёте его гидроксидом, ошибкой это не будет.
другой пример. гидроксид меди (ii) сu(oh)2 – это гидроксид, но никак не щёлочь (посмотрите в таблицу менделеева. медь находится в первой группе, но не в основной, а в побочной! медь – не щелочной металл!). то есть назвать сu(oh)2 щёлочью будет ошибкой, это гидроксид.
как составить формулу гидроксида
первым делом вспоминаем про валентность, без неё в химии никуда. далее нужно понять, что группа он – это цельная структурная единица. составляя формулу, мы всегда заключаем её в скобки (если он группа одна, то скобки не нужны), а индекс, маленькая цифра внизу справа, относится ко всей гидроксильной группе.
также сразу запомните, что
группа –он всегда имеет валентность i.
чтобы этот факт навсегда врезался вам в память, запомните следующее. группа –он образуется из воды. формула воды н2о, это всем известно. выглядит молекула воды так: н-о-н. то есть в ней две части н– и –он. каждая из этих частей имеет валентность i, это видно и из формулы:
нам здесь важно, что гидроксильная группа имеет валентность i. это надо запомнить.
теперь переходим к практике и решению химии.
пример 1.
составьте формулу гидроксида калия.
это очень просто. калий в таблице менделеева находится в первой группе в основной подгруппе, он имеет валентность i. группа –он также имеет валентность i. следовательно, формула гидроксида калия кон.
пример 2
Составьте формулу гидроксида кальция.
Кальций находится в периодической таблице во второй группе в основной подгруппе, его валентность II. Тогда:
Здесь надо припомнить, как составляется формула вещества, если известна валентность. Нужно, чтобы произведение валентности и индекса у каждого элемента совпадало. Поэтому формула гидроксида кальция выглядит так:
Напоминаю, что если гидроксильных групп больше одной, то мы из заключаем в скобки. Обратите внимание, что такое написание (ОН)2 означает, что в формуле не два атома водорода, а две группы ОН!
Итак, формула гидроксида кальция – Ca(ОН)2.
Пример 3
Составьте формулу гидроксида железа (III).
Валентность железа задана условиями, поэтому:
Отсюда следует:
Таким образом, формула гидроксида железа (III) – Fe(OH)3.
Пишите, пожалуйста, в х, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник: https://zen.yandex.ru/media/id/5c56f90c18d56e00ae42d74c/5c62d60784e0ea00aebf9d47
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
- Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
- 1) растворимость исходных соединений;
- 2) наличие осадка или газа среди продуктов реакции
- Например:
Термическая устойчивость оснований
- Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
- Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются.Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
- Нерастворимые гидроксиды имеют намного более низкие температуры разложения.Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с сильными кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
- Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
- А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/harakternye-himicheskie-svojstva-osnovanij-i-amfoternyh-gidroksidov




