![]()
![]()
![]()
![]()
- Сульфат железа – неорганическое вещество, имеет химическую формулу FeSO4.
- Краткая характеристика сульфата железа, железного купороса
- Физические свойства сульфата железа, железного купороса
- Получение сульфата железа
- Химические свойства сульфата железа
- Химические реакции сульфата железа и железного купороса
- Применение и использование сульфата железа и железного купороса
Краткая характеристика сульфата железа:
- Сульфат железа – неорганическое вещество белого или бесцветного цвета.
- Химическая формула сульфата железа FeSO4.
- Сульфат железа – неорганическое химическое соединение, соль серной кислоты и железа.
Хорошо растворяется в воде, глицерине и этиленгликоле.
Растворение сульфата железа проходит со значительным выделением тепла. Сульфат железа гидролизуется и даёт кислую среду.
- С водой сульфат железа образует кристаллогидраты: гептагидрат сульфата железа FeSO4·7H2O, именуемый также железный купорос (прозрачные кристаллы светлого голубовато-зелёного цвета), тетрагидрат сульфата железа FeSO4·4H2O (прозрачные кристаллы зелёного цвета), моногидрат сульфата железа FeSO4·H2O.
- Очень гигроскопичен.
- Сульфат железа негорюч, пожаро- и взрывобезопасен.
- В природе сульфат железа встречается в виде минерала мелантерита (FeSO4·7H2O).
Краткая характеристика железного купороса:
- Железный купорос – неорганическое вещество светлого голубовато-зелёного цвета.
- Химическая формула железного купороса FeSO4·7H2O.
- Железный купорос – гептагидрат сульфата железа.
- Хорошо растворяется в воде.
- На воздухе постепенно выветривается (теряет кристаллизационную воду).
- Железный купорос негорюч, пожаро- и взрывобезопасен.
Железный купорос относится к веществам 3-го класса опасности в соответствии с ГОСТ 12.1.007.
Физические свойства сульфата железа:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4 |
| Синонимы и названия иностранном языке | iron (II) sulfate (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 1898 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 1,898 |
| Температура кипения, °C | — |
| Температура плавления, °C | — |
| Температура разложения, °C | 680 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 151,932 |
| Растворимость в воде (20 oС), г/100 г | 26,3 |
* Примечание:
— нет данных.
Физические свойства железного купороса:
| Наименование параметра: | Значение: |
| Химическая формула | FeSO4·7H2O |
| Синонимы и названия иностранном языке | гептагидрат сульфата железа (II) iron (II) sulfate heptahydrate (англ.) железный купорос (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | голубовато-зелёные моноклинные кристаллы |
| Цвет | голубовато-зелёный цвет |
| Вкус | горьковато-металлический вяжущий |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 18 °C), кг/м3 | 1898 |
| Плотность (состояние вещества – твердое вещество, при 18 °C), г/см3 | 1,898 |
| Температура кипения, °C | —* |
| Температура плавления, °C | 64 |
| Температура разложения, °C | 56,8 |
| Гигроскопичность | гигроскопичен |
| Молярная масса, г/моль | 278,01 |
| Растворимость в воде (25 oС), г/100 г | 26,3 |
* Примечание:
— нет данных.
Получение сульфата железа:
В промышленности сульфат железа получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и пр., а также как побочный продукт производства оксида титана из ильменита.
Сульфат железа в промышленности может быть получен путем окислительного обжига пирита (FeS2).
В лаборатории сульфат железа получают в результате следующих химических реакций:
- 1. взаимодействия сульфида железа (II) и кислорода:
FeS + 2O2 → FeSO4.
- 2. взаимодействия сульфида железа (IV) и кислорода:
FeS2 + 2O2 → FeSO4 + SO2.
- 3. взаимодействия сульфата меди и железа:
Fe + CuSO4 → FeSO4 + Cu.
Химические свойства сульфата железа. Химические реакции сульфата железа и кристаллогидратов меди:
- Химические свойства сульфата железа аналогичны свойствам сульфатов других металлов. Поэтому для него характерны следующие химические реакции:
- 1. реакция сульфата железа и цинка:
- Zn + FeSO4 → ZnSO4 + Fe.
- В результате реакции образуются сульфат цинка и железо.
- 2. реакция сульфата железа и алюминия:
- 6FeSO4 + 4Al = 2Al2(SO4)3 + 6Fe.
- В результате реакции образуются сульфат алюминия и железо.
- 3. реакция сульфата железа и магния:
- FeSO4 + Mg → Fe + MgSO4.
- В результате реакции образуются сульфат алюминия и железо.
- 4. реакция сульфата железа и кальция:
- FeSO4 + Ca → CaSO4 + Fe.
- В результате реакции образуются сульфат кальция и железо.
- 5. реакция взаимодействия сульфата железа и кислорода:
- 12FeSO4 + 3O2 → 4Fe2(SO4)3 + 2Fe2O3.
- В результате реакции образуются сульфат железа (III) и оксид железа (III).
- 6. реакция взаимодействия сульфата железа, кислорода и воды:
- 4FeSO4 + O2 + 2H2O → 4Fe(OH)SO4.
В результате реакции образуется гидроксосульфат железа (III). Реакция протекает медленно.
7. реакция взаимодействия сульфата железа и гидроксида натрия:
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4.
В результате реакции образуются сульфат натрия и гидроксид железа. Реакция протекает в атмосфере азота.
- реакция взаимодействия сульфата железа и сульфида натрия:
- FeSO4 + Na2S → FeS + Na2SO4.
- В результате реакции образуются сульфат натрия и сульфид железа.
- реакция взаимодействия сульфата железа и нитрата свинца:
- FeSO4 + Pb(NO3)2 → Fe(NO3)2 + PbSO4 (t = 10 °C).
В результате реакции образуются нитрат железа и сульфат свинца. Реакция протекает в атмосфере азота.
- реакция взаимодействия сульфата железа и карбоната натрия:
- FeSO4 + Na2CO3 → FeCO3 + Na2SO4 (t = 150 °C).
- В результате реакции образуются сульфат натрия и карбонат железа.
- реакция взаимодействия сульфата железа и фосфата натрия:
- 3FeSO4 + 2Na3PO4 → Fe3(PO4)2 + 3Na2SO4 (t = 60-80°C).
В результате реакции образуются фосфат железа и сульфат натрия. В ходе реакции используется разбавленный раствор фосфата натрия.
реакция взаимодействия сульфата железа (II) и сульфата меди:
2FeSO4 + CuSO4 → Cu + Fe2(SO4)3.
В результате реакции образуются медь и сульфат железа (III). В ходе реакции используется концентрированный раствор фосфата железа.
- реакция термического разложения сульфата железа:
- 2FeSO4 → Fe2O3 + SO2 + SO3 (t > 480 °C),
- 4FeSO4 → 2Fe2O3 + 4SO2 + O2 (t = 700°C).
В результате реакции образуются в первом случае – оксид железа (III), оксид серы (IV) и оксид серы (VI), во втором – оксид железа (III), оксид серы (IV) и кислород. В ходе второй реакции также образуется примесь SO3.
реакция термического разложения гептагидрата сульфата железа:
FeSO4•7H2O → FeSO4 + 7H2O (t < 250 °C).
Гептагидрат сульфата железа FeSO4•7H2O разлагается на сульфат железа и воду. Реакция протекает в атмосфере водорода.
Применение и использование сульфата железа и железного купороса:
- Сульфат железа и железный купорос используется во множестве отраслей промышленности и для бытовых нужд:
- – в медицине в качестве лекарственного средства;
- – в производстве чернил;
- – в красильном деле железный купорос применятся для окраски шерсти в чёрный цвет;
- – для консервирования дерева;
- – в сельском хозяйстве применяется как антисептик, фунгицид для опрыскивания садовых деревьев.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- сульфат железа реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие сульфата железа
реакции
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/sulfat-zheleza-i-zheleznyiy-kuporos-harakteristika-svoystva-i-poluchenie-himicheskie-reaktsii/
Сульфат железа (FeSO4): структура, свойства и применения
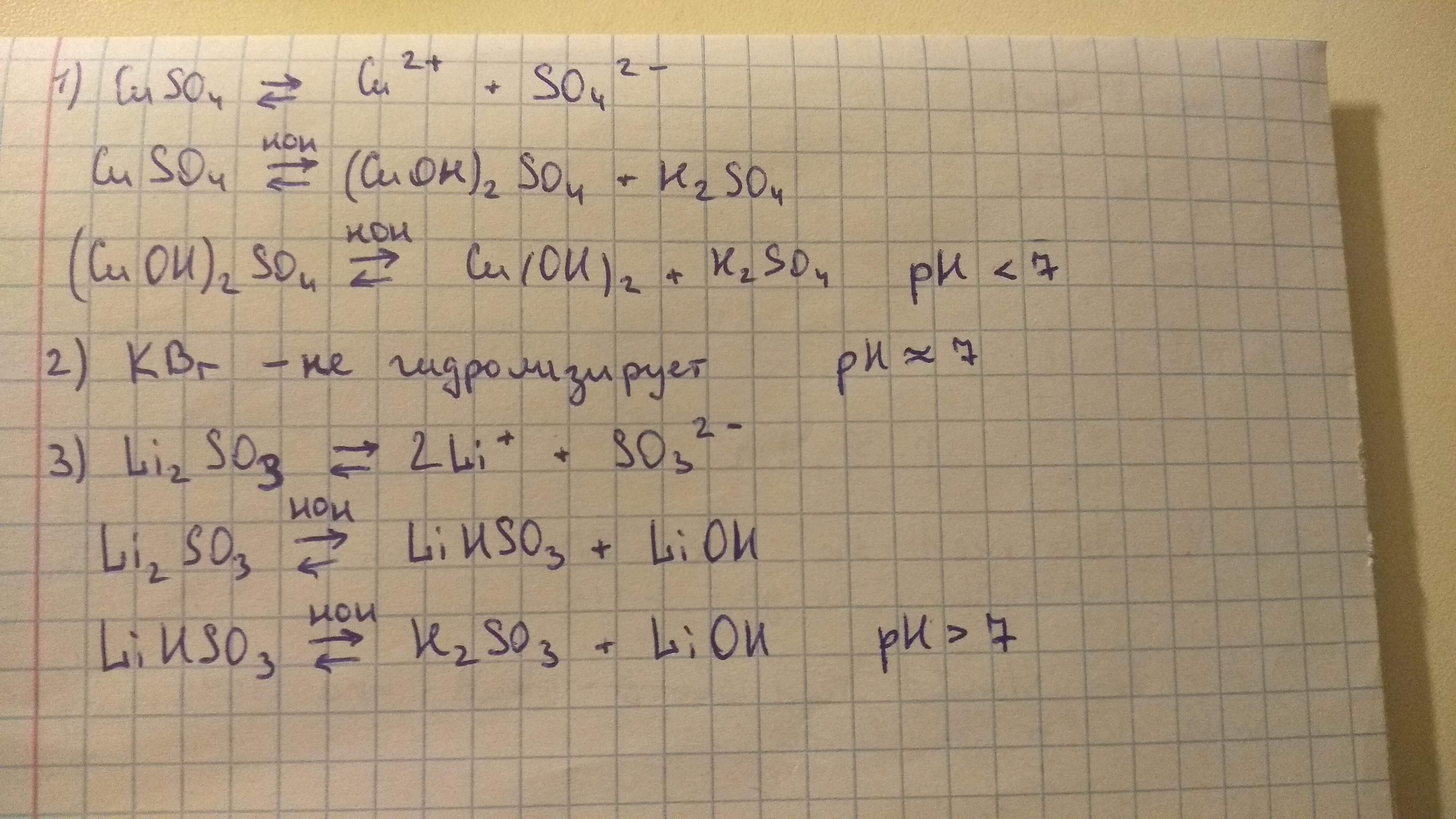
Сульфат железа — это неорганическая соль, химическая формула которой — FeSO4. Состоит из кристаллического твердого вещества переменного цвета. В промышленности получаемый в качестве вторичного продукта обработки стали.
В природе встречается в различных формах, наиболее распространенным из которых является гептагидрат сульфата железа FeSO4·7H2O «зеленый купорос». Этот гидрат легко различить по сине-зеленому цвету его кристаллов (нижнее изображение). Другие гидраты имеют общую формулу FeSO4 · xH2O, где x варьируется от 1 до 7.
 Кристаллы сульфата железа
Кристаллы сульфата железа
Гептагидрат сульфата железа теряет молекулы воды при нагревании и может превращаться в другие формы сульфата железа. Таким образом, при нагревании до 57 ° С он теряет три молекулы воды и превращается в тетрагидрат сульфата железа.
Сульфат железа используется в лечении и профилактике железодефицитной анемии. Тем не менее, он может иметь токсический эффект, поэтому нужно быть осторожным в дозировках.
С другой стороны, этот сульфат имеет множество применений, которые включают окрашивание текстильных материалов и кожи; химический восстановитель; дозиметр излучения; консервант древесины. Он также используется для профилактики хлороза у растений, а также в процессах травления и литографии.
FeSO4 может окисляться в воздухе до сульфата железа (III), Fe2 (SO4) 3, со скоростью, которая может быть увеличена из-за температуры, света или повышения pH.
Многие физические и химические свойства сульфата железа, такие как растворимость в воде, температура плавления, тип кристаллов, которые он образует, и плотность, зависят от количества молекул воды, включенных в кристаллы; то есть их гидраты.
Структура сульфата железа
Химическая формула FeSO4 подчеркивает, что эта соль состоит из ионов Fe2 + и SO42- в соотношении 1:1. Оба иона взаимодействуют под действием электростатических сил таким образом, что они располагаются в ромбической кристаллической системе; что по логике соответствует безводной соли.
 Структура FeSO4·7H2O
Структура FeSO4·7H2O
На верхнем изображении, с другой стороны, показана структура FeSO4 · 7H2O. Оранжевая сфера представляет катион Fe2 +, который, как видно, координируется с шестью молекулами воды, образуя октаэдр. Заряд Fe2 + притягивает анион SO42 и в свою очередь образует водородный мостик с седьмой молекулой воды.
Седьмая молекула воды (та, которая удалена от октаэдра) также образует другой водородный мостик с другой молекулой воды, принадлежащей соседнему октаэдру. Результатом этих взаимодействий является то, что кристалл превращается из ромбического в моноклинный.
По мере гидратации безводных кристаллов FeSO4 анионы SO42 вокруг Fe2 + замещаются молекулами H2O. Эти замещения нарушают электроны d железа, заставляя их проходить через различные уровни энергии; которые, ответственны за изменения окраски.
Кислотность
Некоторые анионы SO42 могут быть протонированы как продукт кислой среды. Как следствие, в кристаллах FeSO4 · 7H2O могут быть молекулы H2SO4, если pH очень кислый; и, следовательно, прикосновение к этим красивым кристаллам в таких условиях может вызвать серьезные ожоги.
Физико-химические свойства
Имена
Сульфат железа или сульфат железа (II)
Молекулярная формула
Безводный сульфат железа (FeSO4)
— Гептагидрат сульфата железа (FeSO4.7H2O)
Молекулярный вес
Это зависит от степени гидратации сульфата. Например, гептагидрат сульфата железа имеет молекулярную массу 278,02 г/моль; в то время как безводный имеет молекулярную массу 151,91 г/моль.
Внешний вид
Это также зависит от степени гидратации. Например, безводная форма имеет ромбические белые кристаллы; в то время как в форме гептагидры, кристаллы являются моноклинными сине-зелеными.
Запах
Унитаза ))
Плотность
Безводный сульфат железа — наиболее плотная форма соли (3,65 г/см3). С другой стороны, гептагидратная форма является наименее плотной (1,895 г/см3).
Точка плавления
Варьируется в зависимости от степени гидратации. Безводная форма имеет температуру плавления 680 ° C (1856 ° F, 973 K) и гептагидратная форма 60-64 ° C (140-147 ° F, 333-337 K).
Растворимость в воде
— Моногидрат формы: 44,69 г / 100 мл воды (77 ?C)
-Форма гептахидрата 51,35 г / 100 мл воды (54 ?C).
Растворимость в спирте
Неразрешимая.
Давление пара
1,95 кПа (гептагидратная форма)
Показатель преломления
1591 (моногидрат) и 1471 (гептагидрата).
Стабильность
В воздухе может быстро окисляться и покрыт желто-коричневым цветом, что указывает на присутствие катиона Fe3 +. Скорость окисления увеличивается за счет добавления щелочи или воздействия света.
Разложение
При нагревании до разложения он выделяет токсичные пары диоксида серы и триоксида серы, оставляя в качестве остатка красноватый оксид железа.
Реакции
Это восстановитель, который действует на азотную кислоту, превращая ее в окись азота. Он также снижает содержание хлора в хлориде и токсичные формы хрома, присутствующие в цементе, до хрома (III) с меньшей токсичностью.
Синтез
Сульфат железа получается путем взаимодействия стали (Fe) с серной кислотой. В описанном методе используется следующая процедура: сталь используется в виде стальной стружки, предварительно обезжиренной ацетоном.
Затем стружку помещают в стеклянный стакан и полностью покрывают 30-40% -ной серной кислотой пока стружка не исчезнет.
Зеленые кристаллы, которые могли образоваться, повторно растворяют, используя подкисленную воду с pH 1-2 с серной кислотой. Этот раствор фильтруют и pH регулируют добавлением карбоната натрия. Раствор хранится, чтобы избежать его контакта с кислородом и таким образом, препятствовать окислению Fe2 + до Fe3 +.
Затем фильтрат подвергают испарению при температуре от 80 до 90 ° С.
Риски
Вдыхание FeSO4 вызывает раздражение носа, горла и легких. При физическом контакте может вызвать раздражение кожи и глаз. Кроме того, длительный контакт с последним может вызвать повреждение глаз.
Среди признаков интоксикации сульфатом железа можно выделить: черный или кровавый стул; синяя кожа и ногти; обмороки; сухость во рту или глазах; грудная боль; кома; затруднение дыхания.
Кроме того, могут наблюдаться учащенное и нерегулярное сердцебиение, усиление жажды и голода, необычная бледность и одышка.
Применение
В сельском хозяйстве
- Используется в качестве пестицида для контроля пшеницы и разложения фруктовых деревьев.
- Используется при лечении хлороза, заболевания, характеризующегося желтоватым цветом листьев, вызванного щелочностью почвы.
- Сульфат железа контролирует щелочность, снижая рН почвы.
- Устраняет мох.
Как реагент и в промышленности
- В рамках использования FeSO4 как реагента в промышленности мы имеем следующее:
- -Аналитический реагент
- -Сырье для получения феррита и магнитного оксида железа
- -Ингредиент для разработки неорганического синего пигмента
- -Восстанавливающий реагент азотной кислоты, хлора и хрома
- -При производстве других сульфатов
- -Используется для гальванизации железа
- -Консервант дерева
- -Для гравюр из алюминия
- -Используется в промышленности в качестве фиксатора красителя
- -При изготовлении краски для метала
- -Для окрашивания шерсти
В медицине и для пищи
Он используется при лечении железодефицитной анемии, используя дозу 150-300 мг сульфата железа, три раза в день, что приводит к заметному увеличению концентрации гемоглобина за неделю лечения.
Также рекомендован для использования у беременных женщин в качестве дополнения к диете. Сульфат железа используется в качестве вяжущего при заживлении ран у животных.
Другое
Используется для очистки сточных вод, а также для удаления фосфатов из них. Гептагидрат сульфата железа используется для идентификации типов грибов.
Поделиться ссылкой:
Источник: https://tagient.com/sulfat-zheleza/
Сульфат железа(III) — это… Что такое Сульфат железа(III)?
Сульфат железа(III) (лат. Ferrum sulfuricum oxydatum, нем. Eisensulfat (oxyd) Ferrisulfat[2]) — неорганическое химическое соединение, соль, химическая формула — .
Физические свойства
Безводный сульфат железа(III) — светло-желтые, парамагнитные, очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм,c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде и ацетоне, не растворяется в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 3.
Наиболее изученный кристаллогидрат — нонагидрат сульфата железа(III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4.
Хорошо растворяется в воде (440 г на 100 г воды) и этаноле, не растворяется в ацетоне. В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минерал, содержащий в себе смешанный сульфат железа-алюминия называется микасаит (англ. mikasaite), с химической формулой (Fe3+, Al3+)2(SO4)3 является минералогической формой сульфата железа(III). Этот минерал несет в себе безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще всего, например:
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее чаще встречающийся среди таковых.
- Паракокимбит (англ. paracoquimbite) — нонагидрат — наоборот — наиболее редко встречающийся минерал в природе.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — так же встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат, малоизученный минерал.
Все перечисленные выше природные гидраты железа являются непрочными соединениями и в открытом состоянии быстро выветриваются.
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: Спирит и Оппортьюнити. Эти вещества являются признаком сильных окислительных условий на поверхности Марса.
В мае 2009 года марсоход Спирит застрял, когда он ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта[3].
Вследствие того, что сульфат железа имеет очень низкую плотность, то марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа(III) получают прокаливанием пирита или марказита с NaCl на воздухе:
или растворяют оксид железа(III) в серной кислоте:
В лабораторной практике сульфат железа(III) можно получить из гидроокиси железа(III):
Препарат той же чистоты можно получить окислением сульфата железа(II) азотной кислотой:
также окисление можно провести кислородом или оксидом серы:
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа(III):
Дисульфид железа можно окислить концентрированной серной кислотой:
Сульфат-аммоний железа(II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа(III), хрома(III), аммиака и калия, и вода:
Сульфат железа(III) можно получить как один из продуктов термического разложения сульфата железа(II):
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа(III):
Нагрев пентагидрат до температуры 70—175 °C получим безводный сульфат железа(III):
Сульфат железа(II) можно окислить таким экзотическим окислителем, как оксид ксенона(III):
Химические свойства
Сульфат железа(III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
Горячая вода или пар разлагают сульфат железа(III):
Безводный сульфат железа(III) при нагревании разлагается:
Растворы щелочей разлагают сульфат железа(III), продукты реакции зависят от концентрации щёлочи:
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа(III) и железа(II), то в результате получится сложный оксид железа:
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа(III):
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа(III):
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа(III) (гетерозит):
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при в окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационый регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химическое промышленности как окислитель и катализатор.
См. также
- Алунит
- Ярозит
- Минерал
- Марс
Примечания
Источник: https://dic.academic.ru/dic.nsf/ruwiki/1353072




