![]()
![]()
![]()
![]()
Al 13 Алюминий
26,9815386(8) 1s2 2s2 2p6 3s2 3p1
Алюминий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 13. Расположен в 13-й группе (по старой классификации — главной подгруппе третьей группы), третьем периоде периодической системы.
Атом и молекула алюминия. Формула алюминия. Строение алюминия
- Изотопы и модификации алюминия
- Свойства алюминия (таблица): температура, плотность, давление и пр.
- Физические свойства алюминия
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием
Получение алюминия
Применение алюминия
Таблица химических элементов Д.И. Менделеева
Атом и молекула алюминия. Формула алюминия. Строение алюминия:
Алюминий (лат. Aluminium, от лат. alumen – «квасцы») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Al и атомным номером 13. Расположен в 13-й группе (по старой классификации – главной подгруппе третьей группы), третьем периоде периодической системы.
Алюминий – амфотерный металл. Относится к группе лёгких металлов.
- Как простое вещество алюминий при нормальных условиях представляет собой лёгкий металл серебристо-белого цвета.
- Молекула алюминия одноатомна.
- Химическая формула алюминия Al.
Электронная конфигурация атома алюминия 1s2 2s2 2p6 3s2 3p1. Потенциал ионизации атома алюминия равен 5,984 эВ (577,5 кДж/моль).
Строение атома алюминия. Атом алюминия состоит из положительно заряженного ядра (+13), вокруг которого по трем оболочкам движутся 13 электронов. При этом 10 электронов находятся на внутреннем уровне, а 3 электрона – на внешнем. Поскольку алюминий расположен в третьем периоде, оболочек всего три.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома алюминия находятся два спаренных – на s-орбитали и один неспаренный – на p-орбитали электроны.
В свою очередь ядро атома алюминия состоит из 13 протонов и 14 нейтронов.
Радиус атома алюминия составляет 143 пм.
Атомная масса атома алюминия составляет 26,9815386(8) а. е. м.
Алюминий – наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния). Концентрация алюминия в земной коре составляет 8,1 %.
Изотопы и модификации алюминия:
Свойства алюминия (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Алюминий/ Aluminium |
| Символ | Al |
| Номер в таблице | 13 |
| Тип | Металл |
| Открыт | Ганс Эрстед, Дания, 1825 г. |
| Внешний вид и пр. | Мягкий, лёгкий и пластичный металл серебристо-белого цвета |
| Содержание в земной коре | 8,1 % |
| Содержание в океане | 5,0×10-7 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 26,9815386(8) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p1 |
| Радиус атома | 143 пм |
| Химические свойства | |
| Степени окисления | 0, +3 |
| Валентность | +3 |
| Ковалентный радиус | 121 ± 4 пм |
| Радиус Ван-дер-Ваальса | 184 пм |
| Радиус иона | 51 (+3e) пм |
| Электроотрицательность | 1,61 (шкала Полинга) |
| Энергия ионизации | 1‑я: 577,5 кДж/моль (5,984 эВ); 2‑я: 1816,7 кДж/моль (18,828 эВ) |
| Электродный потенциал | -1,66 В |
| Физические свойства | |
| Плотность (при нормальных условиях) | 2,6989 г/см3 |
| Температура плавления | 660,32 °C (933,47 К) |
| Температура кипения | 2518,82 °C (2792 K) |
| Уд. теплота плавления | 10,75 кДж/моль |
| Уд. теплота испарения | 284,1 кДж/моль |
| Молярная теплоёмкость | 24,35 Дж/(K·моль) |
| Молярный объём | 10,0 см³/моль |
| Теплопроводность (при 300 K) | 237,0 Вт/(м·К) |
| Электропроводность в твердой фазе | 38х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 2,75 по шкале Мооса, 167 МПа по Виккерсу |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 4,050 Å |
| Температура Дебая | 394 K |
Физические свойства алюминия:
Химические свойства алюминия. Взаимодействие алюминия. Реакции с алюминием:
Получение алюминия:
Применение алюминия:
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- алюминий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле алюминия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/alyuminiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Конфигурация и формула строения атома алюминия
Первое место среди известных металлов, находящихся в земной коре, занимает тринадцатый элемент в периодической таблице Менделеева — алюминий.
Строение атома позволяет элементу обладать высокой электропроводностью и пластичностью. До момента открытия промышленного способа создания вещества оно стоило дороже золота.
Из-за высокой сопротивляемости коррозии и низкого веса металл нашёл широкое применение в строительстве, быту, электрике и даже фармацевтике.

Физические и химические свойства
Процесс получения алюминия несложен. Современный способ разработал американский учёный Чарльз Холл. Что интересно, немного позже этот метод использовал французский химик Поль Эру, незнакомый с исследованиями американца.
Суть создания алюминия заключается в растворении оксидированного алюминия в растворе криолита. Затем в жидкость погружают графические электроды.
Недостаток метода заключается в больших затратах электроэнергии, поэтому активно он начал использоваться только в начале двадцатого века.

К полезным свойствам алюминия относят его небольшую плотность — она втрое меньше, чем у железа и меди. Материал характеризуется довольно хорошей прочностью, имеет коррозийную стойкость и неплохую теплопроводность. Из-за своих характеристик он нашёл широкое применение как технический материал.
- Отсутствие вредных примесей для человеческого организма в веществе, податливость к штамповке и лёгкость позволили применять элемент при изготовлении промышленной и бытовой фольги, кухонной посуды.
- В природе алюминий содержится только в минералах.
- Его можно извлечь из следующих соединений:

- Гидроокисла — Al2O3 * H20. Бокситы представляют собой глиноподобную массу. Это одна из наиболее важных руд алюминия.
- Алюмосиликата калия и натрия — (Na, K) AlSiO4. Породообразующий материал (элеолит) с шестиугольной кристаллической системой.
- Квасцового камня — KAl3 (SO4)2 (OH)6. Алунит образовывается при воздействии сернокислых вод с силикатами, что создаёт окись алюминия.
- Корунда — Al2O3. Кристаллический глинозём с высокой твёрдостью.
- Силиката — Al2O3. Породообразующий материал, содержащий порядка 19% оксида алюминия в своём составе.
Кроме этого, элемент можно извлечь из каолина, известняка, магнезита. В химических реакция вещество проявляет себя как восстановитель.
С галогенами при температуре 20−24 градуса по Цельсию он образовывает галогениды: 2Al + 3Cl2 = 2AlCl3. С другими веществами создаёт бинарные соединения. Например, Al + P = AlP, 4Al + 3C = Al4C3, 2Al+ 3F2 = 2AlF3.
При взаимодействии этих соединений с водой образуются гидроксиды и летучие водородные соединения.
С металлами формирует сплавы с интерметаллическими соединениями.
При взаимодействии с кислотами результатом реакции становятся соли. Очищенный алюминий от оксида вступает в активную реакцию с водой: 2Al + 6 H2O = 2 Al (OH)3 + 3H2.
Характеристики элемента
Алюминий — элемент семейства лёгких металлов, уступающий в распространённости только кислороду и кремнию. В периодической таблице он располагается на тринадцатом месте, имеет серебристо-белый цвет. Общепринятое химическое обозначение — Al (от латинского слова aluminium).
Вещество имеет следующие характеристики:

- Относительная атомная масса — 26,981538. Показывает, во сколько раз атом алюминия превышает вес атомной единицы массы, принятой равной 1,67 * 10-27 килограммов.
- Атомный номер — 13. Обозначает число протонов в ядре вещества равное количеству электронов, вращающихся вокруг атома.
- Радиус атома — 143 пикнометра. Определяется расстоянием между ядром и самой удалённой орбитой элемента.
- Ковалентный радиус — 121 пикнометр. Расстояние между ядрами, формирующими ковалентную связь и делённое на 2.
- Электронная формула атома алюминия — 1s 2 2s 2 2p 6 3s 2 3p 1. Число электронов в оболочках в соответствии с энергетическим состоянием.
- Фазовые температуры — при достижении 660 градусов по Цельсию происходит плавление, а при 2518 °C закипание.
- Способность атомов удерживать электроны (электроотрицательность) — 1,61 по Полингу.
- Степень окисления — 3,0. Находится по числу электронов, смещённых от или к атому.
- Плотность — 2,7 г/см3. Отношение массы алюминия к его объёму.
- Молярный объем = 10,0 см3/моль. Определяется отношением объёма вещества к количеству.
Впервые искусственно алюминий был создан в 1825 году. Получить его сумел датский учёный Эрстед. В ядре вещества содержится 13 протонов и больше на один нейтронов. Всего же массовое число равняется 27. Электроны располагаются на трех энергетических уровнях. На первом размещены 2 электрона, на втором 8 (три пары), а на третьем 3. Такое положение соответствует записи: +13Al)2)8)3.

При этом если атом возбудить, то в этом состоянии все три элемента могут быть отданы, тем самым достигая степени окисления +3 или вызывать образование ковалентных связей. Отсюда следует, что валентность алюминия равняется трём. В природе вещество встречается в глине, слюде, корунде. Взаимодействует со многими элементами, а вот с водородом нет.
При соприкосновении с кислородом образует оксидную плёнку, препятствующую реакциям с водой и азотной и серной кислотой.
Электронная конфигурация
Алюминий можно найти в таблице Менделеева в третьей группе главной подгруппы. Распределение зарядов по орбитали описывается как 1s22s22p63s23p1. Алюминий в периодической таблице имеет тринадцатый номер, так как атом элемента состоит из тринадцати электронов. В электронной конфигурации сумма верхних индексов как раз и составляет это число: 2+2+6+2+1 =13.
Другими словами, верхние индексы показывают количество заряда, распределённого по слоям и орбиталям. Если изобразить схему строения электронной оболочки атома алюминия, можно отметить, что последним заполняемым слоем будет р-орбиталь. А это значит, что вещество принадлежит семейству р-элементов.
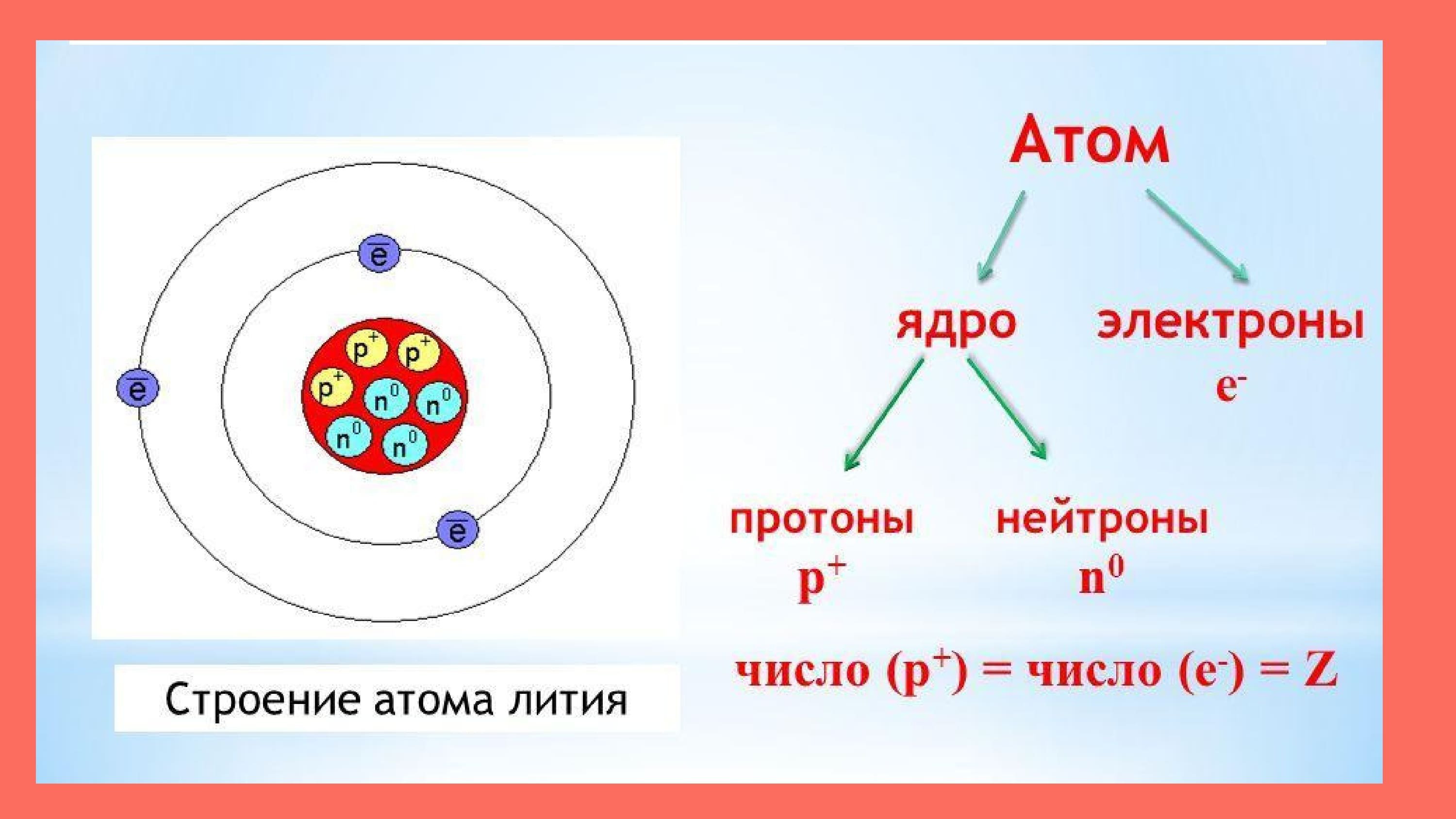
Алюминий расположился в третьем периоде. Это значит, что у него 3 электронных слоя. На первом находится s-орбиталь, 3 орбитали расположились на p-слое, и 5 на d-орбитали. На 3d-орбитали пусто, на неё электронов не хватило.
На каждом слое не может быть более двух электронов. Заполняются же орбиты, начиная со слоев с меньшей энергией. Теоретически существует возможность возбужденного состояния для атома элемента за счет существования свободной 3d-орбитали.
Однако распаривания ионов 3s-подуровня на практике не происходит.
Сначала электроны размещаются в первом слое, потом во втором, а уже затем в третьем. Орбитали каждого слоя заполняются с использованием принципа меньшей энергии. Так, сначала закрывается s-орбиталь, затем каждой орбитали достаётся по одному электрону, а затем по второму. Если их хватает, заполняются оставшиеся внешние р-орбитали.
В атоме алюминия полностью заполняются орбитали первых двух электронных слоев. На первом размещается 2 электрона, а на втором 8 носителей заряда. Два размещаются на s-орбиталь и по 2 на 3 р-орбитали. На третий слой переместятся 3 электрона: 13 — 8 — 2 = 3.
В соответствии с законом сначала до предела зарядами заполняется s-орбиталь третьего слоя, а на три р-орбитали хватает только 4 электрона. Из них 3 элементарные частицы занимают свою орбиталь, а после одна из р-орбиталей приобретает парный электрон.
Составление строения
На уроках химии в седьмом классе ученикам показывают, как графически изображают электронные формулы различных элементов. При составлении конфигураций учитывают правила Паули и Клечковского (Хунда).
Модель записывается для атомов, находящихся в возбуждённом состоянии. При составлении учитывают, что порядковый номер периода элемента определяет количество энергетических оболочек, а порядок — число носителей заряда.
Беря во внимание, что согласно правилу Клечковского, энергетические уровни заполняются в соответствии с порядком возрастания главного и орбитального квантового числа, используют формулу n + 1.
Так, действует следующее правило: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 5 d ≈ 4 f < 6 p. Перемещение атомов происходит согласно запретному принципу. Сформулировал его Паули.
Он утверждал, что на одной орбитали могут разместиться только 2 иона, отличные квантовым числом спина.

Из его утверждения следует, что количество электронов на энергетических уровнях соответствует квадрату главного квантового числа, умноженному на 2.
Форма обозначения подразумевает, что главное квантовое число обозначают арабской цифрой. Затем записывают букву, определяющую энергетический подуровень, характеризующий орбитальное квантовое число.
Верхний индекс указывает на число электронов, формирующих подуровень.
При заполнении энергетических подуровней следует придерживаться правила Хунда. В соответствии с ним, частицы стремятся достигнуть наибольшего суммарного спина. Для валентных ионов алюминия электронно-графическая формула изображается с использованием квадратов и стрелок. Ячейки обозначают орбитали, а стрелки — спины. В одном квадрате не может быть больше двух электронов.
На первом уровне (s) для алюминия рисуют один квадрат с двумя стрелками. На втором (p) нужно изобразить 4 квадрата с заполненными стрелками.
На заполнение третьего уровня остаётся только 3 электрона, поэтому на последнем уровне (d), будет нарисовано только 2 квадрата, при этом во второй помещена только одна стрелка.
Источник: https://1001student.ru/himiya/konfiguratsiya-i-formula-stroeniya-atoma-alyuminiya.html
Алюминий – общая характеристика элемента, химические свойства
 Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Алюми́ний — элемент главной подгруппы III группы, третьего периода, с атомным номером 13. Алюминий – р-элемент. На внешнем энергетическом уровне атома алюминия содержится 3 электрона, которые имеют электронную конфигурацию 3s23p1. Алюминий проявляет степень окисления +3.
Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).
Простое вещество алюминий— лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
 Химические свойства алюминия
Химические свойства алюминия
При нормальных условиях алюминий покрыт тонкой и прочной оксидной плёнкой и потому не реагирует с классическими окислителями: с H2O (t°);O2, HNO3 (без нагревания). Благодаря этому алюминий практически не подвержен коррозии и потому широко востребован современной промышленностью. При разрушении оксидной плёнки алюминий выступает как активный металл-восстановитель.
1. Алюминий легко реагирует с простыми веществами-неметаллами:
- 4Al + 3O2 = 2Al2O3
- 2Al + 3Cl2 = 2AlCl3,
- 2Al + 3 Br2 = 2AlBr3
- 2Al + N2 = 2AlN
- 2Al + 3S = Al2S3
- 4Al + 3С = Al4С3
- Сульфид и карбид алюминия полностью гидролизуются:
- Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
- Al4C3 + 12H2O = 4Al(OH)3+ 3CH4
2. Алюминий реагирует с водой
(после удаления защитной оксидной пленки):
2Al + 6H2O = 2Al(OH)3 + 3H2
3. Алюминий вступает в реакцию со щелочами
- 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 2(NaOH•H2O) + 2Al = 2NaAlO2 + 3H2
- Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
- Затем протекают реакции: 2Al + 6H2O = 2Al(OH)3 + 3H2, NaOH + Al(OH)3 = Na[Al(OH)4],
- или суммарно: 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2,
- и в результате образуются алюминаты: Na[Al(OH)4] — тетрагидроксоалюминат натрия Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительная формула тетрагидроксосоединений следующая: Na[Al(OH)4(Н2О)2]
4. Алюминий легко растворяется в соляной и разбавленной серной кислотах:
- 2Al + 6HCl = 2AlCl3 + 3H2
- 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2
- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
- 8Al + 15H2SO4(конц) = 4Al2(SO4)3 + 3H2S + 12H2O
- Al + 6HNO3(конц) = Al(NO3)3 + 3NO2 + 3H2O
5. Алюминий восстанавливает металлы из их оксидов (алюминотермия):
- 8Al + 3Fe3O4 = 4Al2O3 + 9Fe
- 2Al + Cr2O3 = Al2O3 + 2Cr


Источник: http://himege.ru/alyuminij-xarakteristika-elementa/
Алюминий Al
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь Al: 1s2 2s2 2p6 3s2 3p1 Короткая запись:
Al: [Ne] 3s2 3p1
- Одинаковую электронную конфигурацию имеют атом алюминия и Si+1, P+2, S+3, Cl+4
- Порядок заполнения оболочек атома алюминия (Al) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Алюминий имеет 13 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Квантовые числа определяются последним электроном в конфигурации, для атома Al эти числа имеют значение N = 3, L = 1, Ml = -1, Ms = ½
Видео заполнения электронной конфигурации (gif): 

Источник: https://k-tree.ru/tools/chemistry/periodic.php?element=Al
Общие сведения об алюминии
Алюминий — химический элемент III группы Периодической системы элементов Д.И. Менделеева. Вследствие высокой химической активности алюминий в природе находится только в связанном виде.
По содержанию в земной коре он (в форме его соединений) занимает первое место среди металлов — 8,13% и третье место после кислорода и кремния. По данным акад. А.Е.
Ферсмана, насчитывается более 250 минералов алюминия, которые преимущественно сосредоточены вблизи поверхности земли, и более 40 % из них относится к алюмосиликатам.
Практически единственным методом получения металлического алюминия является электролиз криолитоглиноземного расплава. Основное сырье для этого процесса — глинозем (Al2О3) получают различными гидрохимическими методами путем переработки минералов, содержащих соединения алюминия.
В Периодической системе Д.И. Менделеева порядковый номер алюминия 13, его атомная масса составляет 26,9815 (по углероду 12С) и 26,98974 (по кислороду 16O).
Основным изотопом является 27Al, который устойчив и состоит из 14 нейтронов и 13 протонов. Кроме одного изотопа 26Al, период полураспада которого равен 106 лет, установлено существование еще шести изотопов с массовыми числами 23, 24, 25, 26, 28 и 29 и с малыми периодами полураспада (от 0,13 до 396с), а также пренебрежимо малой распространенностью в природе (от 2×10-5 до 1,5×10-4 %).
Алюминий трехвалентен, и 13 его электронов распределены на электронных оболочках ls2, 2s2, 2р6, 3s2, 3р1.
На внешнем электронном слое М находятся три валентных электрона: два на 3s-орбите с потенциалами ионизации 1800 и 2300 кДж/моль и один на 3p-орбите с потенциалом 574,5 кДж/моль, и поэтому в химических соединениях алюминий обычно трехвалентен (Al3+).
Так как электрон на p-орбите с ядром атома связан слабее, чем два спаренных электрона на s-орбите, то при определенных условиях, теряя р-электрон, атом алюминия становится одновалентным ионом (Al+), образуя соединения низшей валентности (субсоединения), и еще реже — Al2+.
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно.
Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом .
Примеси в алюминии незначительно влияют на величину параметра решетки.
Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В.
В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия Al203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость.
Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
Расплавленный алюминий активно реагирует с оксидом и диоксидом углерода и парами воды. Наибольший интерес представляет растворимость водорода в алюминии, так как присутствие водорода в металле негативно влияет на механические свойства алюминия и его сплавов. Водород в алюминии в количествах, превосходящих растворимость в твердом состоянии, рассматривается как вредная примесь.
Алюминий обладает амфотерными свойствами, т.е. реагируя с кислотами, образует соответствующие соли, а при взаимодействии с щелочами — алюминаты.
Эта особенность существенно расширяет возможности извлечения алюминия из руд различного состава.
Алюминий растворяется в серной и соляной кислотах, а также в щелочах, но концентрированная азотная и органическая кислоты на алюминий не действуют.
Источник: https://www.metmk.com.ua/11spr_alum.php
Алюминий, строение и свойства
- МОБУ СОШ №6 г. Тында
- Предмет: химия
- Класс: девятый
- Тема: «Алюминий, строение и свойства»
- Форма проведения: урок
- ФИО учителя: Гантимурова Надежда Михайловна
- План — конспект урока по теме «Алюминий, строение и свойства».
- Тип урока: урок-сообщение новых знаний
- Структура урока: -организация класса
- -сообщение нового материала
- -закрепление
- -задание на дом
- Цель урока: рассмотреть строение атома алюминия, характер простого вещества алюминия, доказать способность алюминия проявлять амфотерные свойства.
- Учебно-воспитательные задачи:
- 1.Образовательные:
- А) продолжить формирование умений у учащихся характеризовать химический элемент по его положению в Периодической Системе.
- Б) повторить понятие о металлической химической связи на примере алюминия, развивать умения у учащихся предсказывать свойства веществ, зная их строение.
- В) продолжить формирование навыков и умений у учащихся при работе с химическими реактивами и оборудованием.
- 2. Воспитательные:
- А) прививать навыки культуры труда при оформлении тетради
- Б) способствовать осуществлению эстетического воспитания учащихся на примере оформления класса, наглядности
- 3. Развивающие:
- А) включить всех учащихся в активный познавательный процесс
- Б) развивать логику мышления у учащихся при доказательстве амфотерности алюминия.
- Оборудование и реактивы : мультимедийный проектор( или компьютер, экран),документ-камера;
- Учителю: бенгальские огни, спиртовка, гранула алюминия, р-р хлорида меди (II).
- Учащимся: две пробирки с кусочками алюминиевой фольги, штатив для пробирок, держатель, спиртовка, р-р NaOH, р-р HCI.
- Ход урока.
-
Вводная часть (проверка присутствия учащихся в классе).
-
Сообщение нового материала.
План сообщения нового материала:
1.Постановка целей и задач урока
Давайте попытаемся сформулировать тему урока, для этого попробуем отгадать загадку (презентация слайд №2). Итак, сегодня мы рассмотрим строение атома алюминия, характер простого вещества алюминия, попробуем доказать способность алюминия проявлять амфотерные свойства. Записываем в тетради тему урока: алюминий, строение и свойства (презентация слайд №3).
2.Характеристика химического элемента алюминия.
- План характеристики (презентация слайд№4)
- Дети сами устно дают характеристику химическому элементу алюминию, используя Периодическую Систему Химических Элементов, согласно плану на экране.
- 1 . Порядковый номер 13, номер периода 3,III А
- 2. 13p, 13 e, 14 n
- +13AL 1s22s22p63s23p1 степеньокисления +3
- 3. Металл
- Вспоминаем металлическую химическую связь, ее схема(презентация слайд№5).
- Попробуем предсказать свойства алюминия, зная его строение, и как эти свойства мы можем применить? Ответы детей
- Делаем выводы вместе с учащимися, используя презентацию (презентация слайды №6-10)
- 4. AL2O3 , амфотерный
- 5. AL(OH)3
- Запись в тетради характеристика алюминия(презентация слайд№11)
- 3.Химические свойства алюминия
- Теперь, зная строение алюминия, попробуем предсказать его химические свойства!
- Рассуждения учащихся
- Как и все металлы, алюминий, имея малое число электронов на внешнем уровне, будет стремиться отдавать их в химических реакциях, проявляя металлические свойства.
- С какими же веществами будет реагировать алюминий?
- (конечно с неметаллами!)
- Запись в тетрадь
- Химические свойства алюминия.
- 1.Реагирует с простыми веществами- неметаллами
- С кислородом
- Рассказ учителя:
алюминий –активный металл, но покрыт прочной оксидной пленкой, поэтому при комнатной температуре на воздухе не изменяется! Если порошок алюминия или фольгу сильно нагреть, то он сгорает ослепительным пламенем.
- Демонстрация реакции горения алюминия (вспоминаем правила техники безопасности в химической лаборатории)(презентация слайд№12,13,14)
- Реакцию горения алюминия каждый из вас проводил дома- это бенгальские огни (порошок алюминия)
- Учитель демонстрирует горение бенгальского огня и записывает уравнение реакции на доске, один ученик уравнивает у доски методом электронного баланса
- 4AL + 3O2= 2AL2O3
- ALo-3e→AL+3
- Oo2+ 4e→2O-2
- 2.Реагирует со сложными веществами (лабораторный опыт)
Давайте выясним, как повлияет появление третьего электрона на внешнем уровне атома алюминия на его способность проявлять металлические свойства?Будет ли он, как и его соединения, реагировать с кислотами и основаниями???
- Проведем лабораторный эксперимент (вспомнить правила техники безопасности— работа с едкими веществами (презентация слайд№13), работа с нагревательными приборами(спиртовка), правила нагревания веществ.)
- Запись в тетрадь
- А) Опыт №1. Взаимодействие алюминия с кислотами (презентация слайд№15)
В пробирку с алюминиевой фольгой прилить3-4 мл раствора HCI, пробирку нагреть. Что наблюдаете? Выделение газа без цвета и запаха.
Алюминий хорошо растворяется в HCl, металл –активный, хорошо растворяется в разбавленных кислотах, но концентрированные азотная и серная кислоты пассивируют алюминий, т.е.
на его поверхности образуется прочная оксидная пленка, которая препятствует протеканию реакции, поэтому эти кислоты перевозят в алюминиевых цистернах. В алюминиевой посуде не рекомендуется варить кислые супы(борщ), т. к.
в раствор будут выделятся ионы алюминия, оказывающие отрицательное влияние на здоровье человека!
Записываем уравнение реакции 2AI+6HCl=2AlCl3 +3H2↑
Б) Опыт№2. Взаимодействие алюминия с растворами щелочей (презентация слайд№16)
В пробирку с алюминиевой фольгой прилить 3-4 мл раствора NaOH, пробирку нагреть, что наблюдаете??? Выделение газа без цвета и запаха. Записываем уравнение реакции, используя слайд 16 презентации.
Вместе с детьми делаем вывод (презентация слайд№17) и записываем его в тетрадь!
В) Алюминий способен восстанавливать менее активные металлы из растворов их солей. Демонстрация реакции при помощи документ-камеры!
К 1-2 гранулы алюминия прилить раствор хлорида меди(II).
Записываем уравнение реакции 2 Al + 3CuCl2= 2AlCl3 +3Cu
Почему реакция протекает так долго???На поверхности алюминия прочная оксидная пленка, поэтому необходимо время для ее растворения!
Cu+2голубая окраска раствора→Cuoокраска исчезла
Итак, мы рассмотрели строение атома алюминия, характер простого вещества алюминия, доказали способность алюминия проявлять амфотерные свойства.
Попробуем составить синквейн по материалам нашего урока, вспоминаем правила составления синквейна (презентация слайд№18).
Учащиеся самостоятельно составляют синквейны в тетрадях, затем выборочно зачитывают, учитель, в завершение, предлагает свой синквейн (презентация слайд№19).
-
Задание на дом (презентация слайд№20)
Используемые интернет ресурсы в презентации
Слайд №1 http://cyberland.ws/uploads/posts/2012-11/1352706091_himiya.jpg
Слайд №5 http://files.school-collection.edu.ru/dlrstore/bb14c73e-aae7-11db-abbd-0800200c9a66/ch08_12_01.swf
Слайд №8 http://image.zn.ua/media/images/original/Jan2011/23247.jpg
Слайд №9 http://www.shopmania.ru/other/p-mantovarka-kazan-15-0l-msh-018-7234544
Слайд №10 http://donbass.ua/news/world/2011/02/10/v-nebe-nad-kanadoi-stolknulis-dva-samoleta.html
Слайд №13 http://agrafima.ru/wp-content/uploads/2010/11/Image17072-e1289333072642.jpg
Слайд №14 http://img-fotki.yandex.ru/get/5813/43159532.1b/0_98edc_de80068f_L.jpg
Источник: https://infourok.ru/material.html?mid=114351
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий — металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3s23p1.
При химических взаимодействиях в возбужденном состоянии он способен образовывать три ковалентных связи или полностью отдавать свои три электроны, проявляя в своих соединениях степень окисления +3.
Следовательно, Алюминий является активным восстановителем.
Алюминий по распространенности занимает третье место среди других элементов. Массовая доля Алюминия в земной коре составляет 8,5 %. В природе он встречается только в виде соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды, полевые шпаты, в частности каолин.
Промышленно важным алюминиевой рудой являются боксит Al2O3 · nН2О. Алюминий входит в состав минерала корунда, который является кристаллическим алюминий оксидом Al2O3. Различные примеси способны оказывать корундовые разных цветов. зеленого, желтого, оранжевого, фиолетового и других цветов и оттенков.
Его синий разновидность называют сапфиром, а красный — рубином. И рубины, и сапфиры являются драгоценными камнями.
Простое вещество алюминий — блестящий серебристо-белый металл. Он имеет высокую способность отражать световые и тепловые лучи, а также высокие тепло — и электропроводность. Температура плавления алюминия 660 °С. Это достаточно легкий и пластичный металл. С него можно производить тонкую проволоку и фольгу.
Химически алюминий очень активный. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и предопределяет коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:
- 4Al + 3O2
= 2Al2O3. - Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:
- 2Al + 3Сl2
= 2AlСl3. - Реакция алюминия с йодом происходит, если к смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:
- 2Al + 3I2
= 2AlІ3. - При нагревании алюминий реагирует с серой, азотом, углеродом, например:
- 2Al + 3S = Al2S3.
- В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к воздействию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газуватого водорода:
- 2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
- Алюминий реагирует с растворами кислот с образованием солей и водорода, например:
- 2Al + 6НСl= 2AlCl3
+ 3Н2↑.
Концентрированные сульфатная и азотная кислоты пассивируют алюминий, то есть увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.
- Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:
- 2Al + 2NaOH +6Н2O = 2Na[Al(OH)4] + 3Н2↑.
- Алюминий восстанавливает металлы из их оксидов при нагревании (алюмінотермія), например:
- Fe2O3
+ 2Al = 2Fe + Al2O3. - Алюминий добывают путем электролиза глинозема, растворенного в расплавленном криолите Na3[AlF6].
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.п.
Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготавливают зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используют как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
Источник: http://na-uroke.in.ua/lesson40.html
Разработка урока по химии на тему Алюминий ,строение атома , свойства и применение
- План-конспект урока
- «АЛЮМИНИЙ,
- СТРОЕНИЕ АТОМА, СВОЙСТВА И ПРИМЕНЕНИЕ»
- Зуб Татьяна Васильевна
- учитель химии
- Луганской ОШ 1-111ст.
- Тема: Металлы
- 2015 год
- Дата _______________________
- Тема урока – Алюминий, его физические и химические свойства, применение (первый урок темы)
- Тип урока – комбинированный урок с демонстрационными и лабораторными опытами, направлен на объяснение нового материала.
- Вид урока – смешанный
- Цель урока:продолжить знакомство с особенностями научного исследования на основе установления причинно-следственной связи между строением, свойствами и применением на примере алюминия.
- Задачи урока:
- Обучающие:
- Рассмотреть строение атома алюминия.
- Изучить нахождение алюминия в природе, способы получения, физические и химические свойства, применение.
- Развивающие:
- Развивать познавательный интерес, уметь определять цель
- Совершенствовать умения работать с лабораторным оборудованием и реактивами.
- Продолжить формирование умений обрабатывать и анализировать экспериментальные данные, делать выводы о свойствах вещества.
- Воспитывающие:
- Формировать потребности в познавательной деятельности и ценностное отношение к знаниям.
- Формировать умение работать в парах, воспитание культуры умственного труда, сохранения своего здоровья, соблюдения техники безопасности при работе с химическими реактивами.
Оборудование: ПСХЭ Д.И. Менделеева, коллекция «Металлы», электрохимический ряд напряжения металлов, проектор, компьютер, презентация.
Ход учебного занятия
Орг. момент. Приветствие учащихся.
Актуализация опорных знаний об алюминии.
Введение в тему урока, легенда, связанная с историей открытия алюминия
(рассказ учителя).Постановка темы, целей урока.
- Рассмотрение строение атома по следующему плану:
- Порядковый номер алюминия.
- Алюминий — элемент __________группы, __________ подгруппы.
- Заряд ядра атома алюминия.
- В ядре атома алюминия __________протонов.
- В ядре атома алюминия _________нейтронов.
- В атоме алюминия ________ электронов.
- Количество энергетических уровней в атоме алюминия.
- Строение электронной оболочки.
- Количество электронов на внешнем уровне в атоме алюминия.
- (работа в парах, учащиеся обмениваются тетрадями и проверят правильность выполнения задания)
II. Изучение нового материала.
1. История открытия алюминия. (Сообщение учащегося).
В начале нашей эры римский полководец Архелай во время войны римлян с персами велел обмазать боевые башни квасцами. Дерево башен стало огнестойким, поэтому все попытки персов сжечь их оказались бесплодными. Пропитка древесины раствором алюмокалиевых квасцов делало её негорючей. Соединения алюминия были известны человеку с древних времён.
Одними из них являлись вяжущие вещества, к которым относятся алюмо-калиевые квасцы КAl(SO4)2. Они находили широкое применение: в качестве протравы и как средство, останавливающее кровь. Одним из соединений алюминия были природные глины, в состав которых входит оксид алюминия Al2O3. Первые попытки получить алюминий только в середине XIX века.
Попытка предпринятая датским учёным Х.К.Эрстедом увенчалась успехом. Для получения он использовал амальгированный калий в качестве восстановителя алюминия из оксида. Но что за металл был получен тогда выяснить так и не удалось.
Через некоторое время, через два года, алюминий был получен немецким ученым-химиком Велером, который получил алюминий, используя нагревание безводного хлорида алюминия с металлическим калием.
Многие годы труда немецкого ученого не прошли даром. За 20 лет он сумел приготовить гранулированный металл. Он оказался похожим на серебро, но был значительно легче его. Алюминий был очень дорогим металлом, и вплоть до начала XX века, его стоимость была выше стоимости золота.
О коло 1807 г. Дэви попытался провести электролиз глинозема, получил металл, который был назван алюмиумом (Alumium) или алюминумом (Aluminum), что в переводе с латинского — квасцы. Получение алюминия из глин интересовало не только ученых-химиков, но и промышленников. Алюминий очень тяжело было отделить от других веществ, это способствовало тому, что он был дороже золота.
В1886 году химиком Ч.М. Холлом был предложен способ, который позволил получать металл в больших количествах. Проводя исследования, он в расплаве криолита AlF3•nNaF растворил оксид алюминия. Полученную смесь поместил в гранитный сосуд и пропустил через расплав постоянный электрический ток.
Он был очень удивлен, когда через некоторое время на дне сосуда он обнаружил бляшки чистого алюминия. Этот способ и в настоящее время является основным для производства алюминия в промышленных масштабах. Полученный металл всем был хорош, кроме прочности, которая была необходима для промышленности.
И эта проблема была решена. Немецкий химик Альфред Вильм сплавил алюминий с другими металлами: медью, марганцем и магнием. Получился сплав, который был значительно прочнее алюминия. В промышленных масштабах такой сплав был получен в немецком местечке Дюрене, в 1911 году.
Этот сплав был назван дюралюминием.
2. Физические свойства. (Обучающиеся рассматривают коллекцию «Металлы»)
Алюминий – металл серебристо- белого цвета, лёгкий ( q- 2,7 г./ см.3), плавится при температуре 6600С. обладает хорошей ковкостью, пластичностью, электрической проводимостью и теплопроводностью, легко поддаётся обработке, образует лёгкие и прочные сплавы.
Физ. минутка.Упражнение 1.
И.п. – основная стойка.
1-2 – руки дугами вперёд, вверх — наружу, вдох.
3 – и.п.
4-5 – то же самое.
6 – и.п. (4-6 повторений).
Упражнение 2.
И.п. – руки на пояс.
1 – наклон туловища вправо.
2 – и.п.
- 3 – наклон туловища влево.
- 4 – выпрямиться, руки за голову.
- 5 – наклон назад.
6 – и.п.
7 – полуприседание руки вперёд.
8 – и.п.
Упражнение 3.
И.п. – руки к плечам.
1 – правую ногу назад на носок, руки вверх.
2 – и.п.
3 – то же левой ногой.
4 – и.п.
3.Химические свойства. (Обучающиеся на основе своих знаний об общих химических свойствах металлов, высказывают свои предположения о свойствах алюминия).
Алюминий восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой.
- Учащиеся проводят лабораторный опыт в «Виртуальной химической лаборатории» 1 группа – Отношение алюминия к кислороду (горение бенгальского огня)
- 2 группа – Отношение алюминия к воде
- 3 группа – Отношение алюминия к соляной кислоте
- 4 группа – Отношение алюминия к гидроксиду натрия
- Ученики рассказывают о своих наблюдениях, результаты.
- Учителем проводится демонстрационный опыт реакция алюминия по отношению к H2SO4 (конц) и HNO3(конц)
- Нахождение алюминия в природе.
- (рис.1)
- Алюминий и организм человека.
Алюминий — макроэлемент. В зависимости от дозы в организме алюминий оказывает активирующее или ингибирующее воздействие на активность пищеварительных ферментов. Установлено также влияние алюминия на центральную нервную систему повышенное содержание этого элемента в крови вызывает ее возбуждение, а пониженное — торможение.
Отмечено повышенное содержание алюминия в крови у больных алкоголизмом, у больных с ожогами тела. Установлено, что в организм человека избыток алюминия попадает при пользовании алюминиевой посудой.
Есть тревожные данные о том, что накопление алюминия в мозгу может вызвать первичное дегенеративное слабоумие (болезнь Альцгеймера).
III. Закрепление изученного материала.
Составление уравнений реакций. Взаимоконтроль.
- Написать уравнение реакции взаимодействия алюминия с кислородом.
- 4Al + 3O2 → 2Al2O
- 2Al +3Cl2 → 2AlCl3
- 2Al + 3S → Al2S3
- 2Al + N2 → 2AlN
- В уравнениях реакций ученики отмечают степени окисления алюминия до и после реакции и делают вывод, что алюминий в реакциях является восстановителем, как и другие металлы.
- Тест
- Самым распространенным в земной коре металлом является
- а) Caв)Na
- б) Alг)Fe
- Самым активным металлом среди перечисленных является
- a) Naв) Al
- б) Kг)Mg
- Амфoтерные соединения образует
- a) Caв) Al
- б) Naг) Li
- Сплав на основе алюминия называется
- a) бронзав) мельхиор
- б) латуньг) дюралюминий
- В самородном состоянии встречается в природе
- a) Alв) Na
- б) Cuг) Mg
- Не подвержен коррозии
- a) Alв) Na
- б) Feг) Li
- Проверка теста (на сладе презентации).
ІV. Подведение итогов урока. Объявляются оценки
V. Домашнее задание. §13, №1,3
VІ. Рефлексия.
1. Какую тему мы сегодня изучали? 2. Что нового вы узнали об алюминии?
- 3. Оцените свою работу на уроке:
- — материал усвоен (на всех этапах урока “хорошо”, “отлично”) — материал усвоен недостаточно (оценки “удовлетворительно”, “хорошо”)
Источник: https://www.prodlenka.org/metodicheskie-razrabotki/215860-razrabotka-uroka-po-himii-na-temu-aljuminij-s




