Химическая формула NH4+
Ион аммония NH4+ является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра.

Образование иона аммония
В молекуле аммиака NH3 три электронные пары образуют три связи N – H, четвертая, прина длежащая атому азота электронная пара является неподеленной. С помощью этой электронной пары образуется связь с ионом водорода, который имеет свободную орбиталь:

Таким образом, в ионе аммония три ковалентные связи образуются по обменному механизму, а одна – по донорно-акцепторному. Механизм образования не оказывает слияния на характеристики связи, все связи в катионе аммония равноценны.
Соединения аммония
Катион аммония может образовывать с различными противоионами аммонивые соединения, в которых положительно заряженный атом азота, ковалентно связан с ионами водорода и (или) с органическими радикалами, а ионно – с каким-либо анионом.
Неорганические соединения аммония
- Гидрат аммиака (гидроксид аммония, аммиачная вода, едкий аммоний, едкий аммиак). Формула: NH3·H2O
- Образуется при взаимодействии аммиака с водой. Слабое основание, диссоциирует в воде с образованием катионов аммония и гидроксид-ионов:
-

- Реакция обратима, поэтому водные растворы гидроксида аммония всегда имеют характерный резкий запах аммиака.
Соли аммония
- Соли, содержание катион аммония NH4+: нитрат аммония NH4NO3 , хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, карбонат аммония (NH4)2CO3 и др.
- Все соли аммония по своим свойствам похожи на соответствующие соли натрия.
Хорошо растворяются в воде, полностью диссоциируют в водном растворе, при нагревании разлагаются:
-

-

- В растворе гидролизуются по катиону:
-

-

- Органические аммониевые соединения разделяют по количеству органических радикалов, связанных с атомом азота на первичные (R 1NH3)+ X–, вторичные (R 1R2NH2)+ X–, третичные (R1R2R3NH)+ X–, и четвертичные (R1R2R3R4N)+ X–.
- Первичные, вторичные и третичные аммониевые соединения можно рассматривать как соли соответствующих аминов, их можно получить взаимодействием этих аминов с кислотами:
-

- где R1,R2, R3 — органические радикалы или водород, X — анион кислотного остатка.
- Качественная реакция на ионы аммония – взаимодействие со щелочами с выделением аммиака:
-

Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ammoniya/
Соли аммония
Аммоний – одно из многочисленных соединений азота. Его соли обладают рядом интересных свойств и находят практическое применение во многих областях человеческой деятельности. Исследованием свойств этого элемента занимается химия. Соли аммония изучаются в разделе исследования взаимодействий азота с другими химическими элементами.
Что такое аммоний
Чтобы узнать, что такое аммоний, следует более внимательно ознакомиться с принципом соединения азота и атомов углерода. Молекула аммиака записывается в виде NH3. Атом азота связан своими ковалентными связями с тремя протонами. Вследствие внутренней структуры азота одна связь остается нераспределенной.

Поэтому NH3 активно вступает в различные ковалентные связи с другими элементами, задействуя нераспределенную электронную пару. Если в соединение вступает ядро водорода, то образуется ион аммония. Схема реакции приведена ниже:

Как можно видеть, в данной реакции молекула аммиака является акцептором одного протона и тем самым ведет себя как основание. Аммоний в свободном виде не существует, так как практически мгновенно распадается на водород и аммиак.
Соли аммония получаются в результате взаимодействия этого элемента с другими веществами. Как показывают практические опыты, аммоний вступает в различные соединения с кислотами, нейтрализуя их и образовывая соли аммония.
Например, в случае вступления в реакцию с соляной кислотой происходит образование одной из солей этого элемента:
NH3 + HCl = NH4Cl
В результате реакции получается хлорид соли аммония.
Взаимодействие с водой
Аммоний хорошо взаимодействует с водой. В итоге реакции получаются гидраты аммиака усиленной концентрацией ОН-. Химическая запись реакции:
NH3 + H2O → NH4 + OH-
Поскольку количество ионов гидроксогруппы чрезвычайно велико, то водные растворы аммиака обладают щелочной реакцией. Однако по старой химической привычке водный раствор аммиака записывают, как NH4OH. Данное вещество называется гидроксидом аммония, а щелочную реакцию этого соединения рассматривают в виде диссоциации молекул, на которые раскладывается аммиак.
Соли аммония. Свойства и основные характеристики
Большая часть солей NH4 практически бесцветны и довольно хорошо растворяются в воде. Данное соединение обладает многими свойствами металлов, поэтому и соли аммония ведут себя так же, как и соли различных металлов. Вот несколько примеров такого подобия:
— Соли NH4 являются хорошими электролитами. Они подвергаются гидролизу в различных растворах. Эту реакцию можно проследить на примере диссоциации хлорида аммония:
- NH4Cl= NH4++ HCl-
- — Подвержены гидролизу. В результате получается реакция соли слабого основания и сильной кислоты:
- — имеют ионную кристаллическую решетку, обладают электропроводимостью;
- — не выдерживают высоких температур и распадаются на составляющие.
Необратимые и обратимые процессы
Распад солей аммония под воздействием температур может быть необратим, либо же представлять собой обратимый процесс. Если анион соли проявляет несильные свойства окислителя, соли распадается обратимо.
Классическим примером такой реакции является хлорид аммония: при повышении температуры реакции он в конце концов распадается на собственные исходные элементы — хлористый водород, а также аммиак.
Если стенки сосуда не прогревать, на них появляется налет. Так генерируется хлорид аммония.

- Другие соли этого элемента, анион в которых имеет ярко выраженные свойства окислителя, распадаются безвозвратно. Стандартным примером такой реакции может служить распад нитрата аммония, который выглядит следующим образом:
- NH4NO3 = N2O ↑+ H2O
- Поскольку один из продуктов взаимодействия покидает ее поле, реакция прекращается.
Применение аммиака и солей аммония
Весомая доля аммиака, добываемого промышленным путем, идет на применение его в установках для заморозки и охлаждения. Находят соли аммония применение в повседневной жизни и в медицине. Но подавляющая часть аммиака идет на изготовление азотной кислоты и разнообразных азотсодержащих соединений, прежде всего, различных минеральных удобрений.
Азотистые удобрения
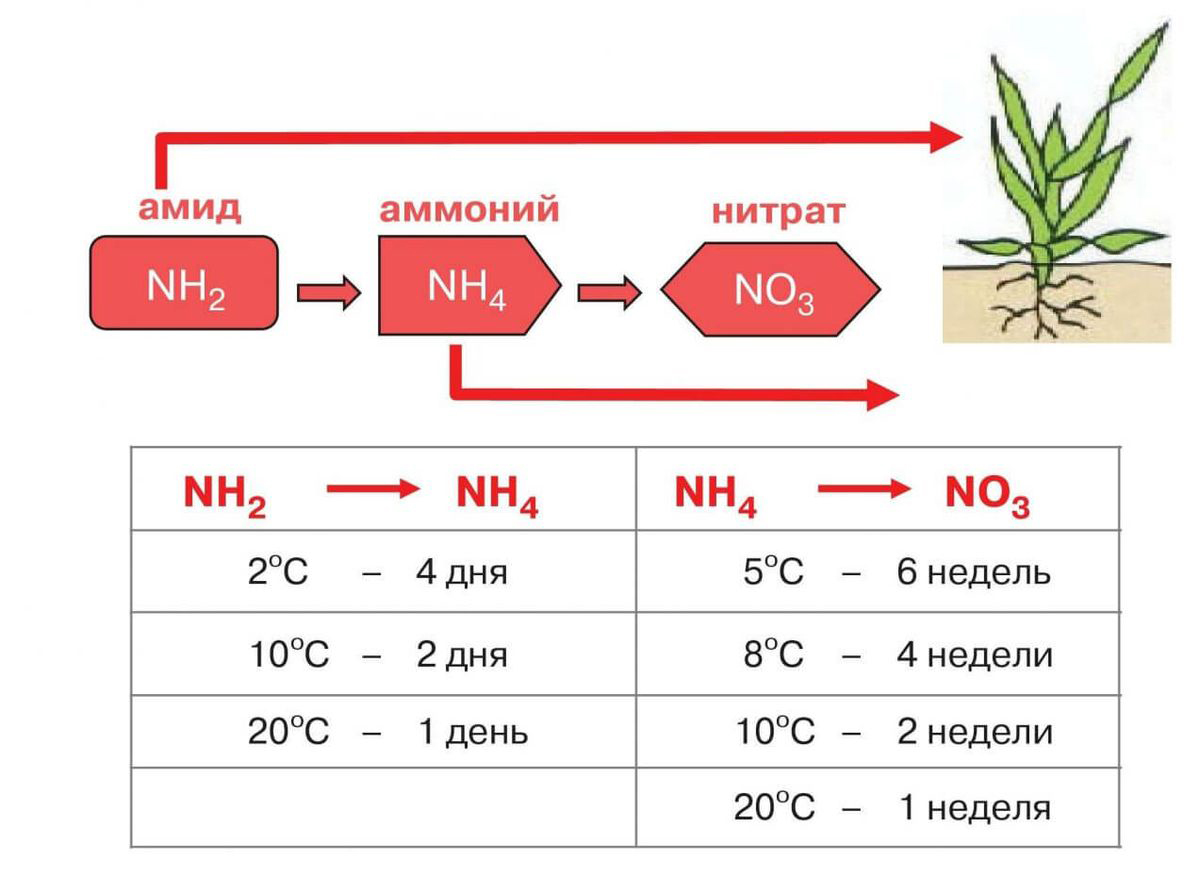
Наиболее известные соли производной азота, применение которых в хозяйственной деятельности крайне важно – это сульфат аммония, нитрат аммония, хлорид аммония. Азот – необходимая составляющая часть белков. Этот элемент является обязательным для существования любого живого организма.
Растения извлекают азот из плодородного грунта, где этот элемент находится преимущественно в связанном виде. Обычно азот встречается, как соли аммония и соединения азотной кислоты.
Растворяясь во влажной почве, эти неорганические соединения попадают в организмы растений и перерабатываются ими в различные белки и аминокислоты. Животные и люди не могут усваивать азот ни в свободном виде, ни в качестве его простых соединений.
Для питания и роста им необходим белок, составной частью которого обязательно является азот. Только при участии растений мы получаем столь необходимый нам элемент для жизни и здоровья.
 Почвы в естественной среде содержат незначительное количество азота. После сбора каждого урожая вместе с растениями уносится и то малое количество азота, которое прежде находилось в земле. Чтобы ускорить процесс регенерации почвы, и применяются азотистые удобрения.
Почвы в естественной среде содержат незначительное количество азота. После сбора каждого урожая вместе с растениями уносится и то малое количество азота, которое прежде находилось в земле. Чтобы ускорить процесс регенерации почвы, и применяются азотистые удобрения.
Сульфат аммония. Формула этого соединения — (NH4)2SO4. Эта соль аммония служит основой для множества удобрений.
Нитрат аммония. Формула этого вещества — NH4NO3. Это также известное удобрение, которое хорошо усваивается растениями. Кроме сельскохозяйственного применения, нитрат аммония используется в военной и горнодобывающей отрасли – на его основе изготавливаются взрывчатые смеси (аммоналы), применяемые для подрывных работ.

Нашатырь
Хлорид аммония. Хорошо известен, как нашатырь. Его химическая формула — NH4Cl. Это соединение хорошо известно в производстве лакокрасочной продукции, в текстильном деле, используется нашатырь и в гальванических элементах. Хорошо известен хлорид аммония пайщикам и лудильщикам. В своей работе они часто задействуют хлористые соли аммония.
Применение этого вещества помогает удалить с поверхности металлов тончайшие оксидные пленки. Прикосновение разогретого металла к нашатырю вызывает соответствующую реакцию оксидов – они либо переходят в хлориды, либо восстанавливаются. Хлориды быстро улетучиваются с поверхности металла.
Процесс реакции для меди может быть записан следующим образом:
4CuO + 2 NH4Cl = 3Cu + 2CuCl2 + N2 +4H2O.
Аммиак в жидком виде и крепкие растворы солей аммония также применяются в качестве азотных удобрений – содержание азота в них выше, чем в твердых удобрениях, и усваивается растениями он лучше.
Источник: https://www.syl.ru/article/225272/new_soli-ammoniya-svoystva-soli-ammoniya-primenenie
Сульфат аммония
Сульфат аммония (аммоний сернокислый, лат. ammonium sulphate), (NH4)2SO4 — неорганическое бинарное соединение, аммонийная соль серной кислоты. Это бесцветные прозрачные кристаллы (или белый порошок) без запаха.
Получают сульфат аммония действием серной кислоты на раствор аммиака и обменными реакциями с другими солями.
Применяется в качестве удобрения, при производстве вискозы, в пищевой промышленности, при очистке белков в биохимии, в качестве добавки при хлорировании водопроводной воды. Токсичность сульфата аммония очень низкая.
Физические свойства
Чистый сульфат аммония — бесцветные прозрачные кристаллы, в измельчённом виде — белый порошок. Запаха не имеет. Гигроскопичность невысокая.
- Образует кристаллы ромбической сингонии, пространственная группа Pnma, параметры ячейки a = 0,7782 нм, b = 0,5993 нм, c = 1,0636 нм, Z = 4.
- Плотность (при 20 °C) — 1,766 г/см3.
- Растворимость в воде (г/100 мл):
- 70,1 (0 °C)
- 72,7 (10 °C)
- 75,4 (20 °C)
- 76,9 (25 °C)
- 78,1 (30 °C)
- 81,2 (40 °C)
- 84,3 (50 °C)
- 87,4 (60 °C)
- 94,1 (80 °C)
- 102 (100 °C).
Растворимость в других растворителях (г/100 г):
Сульфат аммония с солями некоторых других металлов (алюминий, железо и пр.) образует двойные соли, например алюмоаммиачные квасцы, соль Мора.
При нагревании до 147 °С сульфат аммония разлагается на соответствующий гидросульфат NH4HSO4 и аммиак по схеме:
(NH4)2SO4 → NH4HSO4 + NH3↑
При повышении температуры выше 500 °С гидросульфат аммония кипит с разложением на серный ангидрид, аммиак и воду:
NH4HSO4 →>500oC NH3 + SO3 + H2O
Сульфат аммония окисляется до молекулярного азота сильными окислителями, например перманганатом калия.
Получение
В лаборатории получают действием концентрированной серной кислоты на концентрированный раствор аммиака.
2NH3 + H2SO4 → (NH4)2SO4
Эту реакцию, как и все другие реакции взаимодействия аммиака с кислотами, проводят в приборе для получения растворимых веществ в твёрдом виде.
Среди основных способов получения сульфата аммония, которые наиболее часто используются в химической промышленности, имеются следующие: процесс нейтрализации серной кислоты синтетическим аммиаком; использование аммиака из газа коксовых печей для его химической реакции с серной кислотой; получение в результате обработки гипса растворами карбоната аммония; получение при переработке отходов, остающихся после производства капролактама. Вместе с тем имеются и другие способы производства сульфата аммония, например, получение этого вещества из дымовых газов электростанций и сернокислотных заводов. Для этого в горячие газы вводят газообразный аммиак, который связывает имеющиеся в газе окислы серы в различные соли аммония, в том числе и в сульфат аммония.

Технический сульфат аммония часто загрязнен сульфатом железа. Избавиться от него простой перекристаллизацией невозможно, так как соли железа сокристаллизуются с сульфатом аммония, образуя двойную соль Мора.
Согласно Карякину, для очистки препарата 150 г его растворяют в 260 мл дистиллированной воды, нагревают до кипения, прибавляют 1-2 г пероксодисульфата аммония и кипятят до полного окисления железа (II) в железо (III).
Полноту окисления необходимо проверить прибавлением к отфильтрованной пробе раствора гексацианоферрата (III) калия (красной кровяной соли) — синее окрашивание пробы указывает на неполноту окисления железа, в таком случае процесс очистки следует повторить.
После перехода всего железа в трехвалентное к раствору следует прибавить крепкий раствор аммиака до сильно щелочной реакции и отфильтровать. Полученный раствор упарить до консистенции жидкой кристаллической кашицы и дать охладиться до комнатной температуры. Кристаллы отсосать на воронке Бюхнера и промыть несколько раз дистиллированной водой.
В полученном реактиве может содержаться до 0,2 % сульфата кальция, который отделить никак не удастся.
Применение
Сульфат аммония широко применяется как азотное-серное минеральное удобрение (в РФ — по ГОСТ-9097-82) в легкоусвояемой форме, не содержащей NO3—групп и не едкое, его можно применять в любое время года. Содержит 21 % азота и 24 % серы. Подкисляет почву.
- Также используется в производстве вискозного волокна как компонент осадительной ванны.
- В биохимии переосаждение сульфатом аммония является общим методом очистки белков.
- В пищевой промышленности зарегистрирован в качестве пищевой добавки E517.
Сульфат аммония используется в технологии хлорирования воды с аммонизацией — его вводят в обрабатываемую воду за несколько секунд до хлора. С хлором он образует хлорамины, связывая свободный хлор, благодаря чему значительно сокращается образование хлорорганики, вредной для организма человека, сокращается расход хлора, уменьшается коррозия труб водопровода.
Сульфат аммония является компонентом порошковых огнетушителей и огнезащитных средств.
Кроме того, находит применение при получении марганца электролизом, в производстве аммониево-алюминиевых квасцов, корунда. Добавляется к стекольной шихте для улучшения её плавкости.

Сульфат аммония признаётся безопасным для человека и используется в качестве пищевой добавки в России, на Украине и в странах ЕС. Сульфат аммония используется в качестве заменителя соли и носит название пищевой добавки E517.
В пищевой индустрии добавка сульфат аммония выступает в роли улучшителя качества муки и хлебобулочных изделий, увеличивая также их объём, является питанием для дрожжевых культур, применяется как стабилизатор и эмульгатор.
Источник: https://chem.ru/sulfat-ammonija.html
Соли аммония. Нитраты — урок. Химия, 8–9 класс
Соли аммония
Соли аммония — сложные вещества, образованные катионом аммония NH4+ и кислотным остатком.
NH4Cl — хлорид аммония, (NH4)2SO4 — сульфат аммония, NH4NO3 — нитрат аммония.
Соли аммония по свойствам похожи на соли натрия или калия. Они имеют ионное строение и представляют собой твёрдые белые вещества, хорошо растворяющиеся в воде.

- Нитрат аммония
- Образуются соли аммония при взаимодействии аммиака с кислотами:
- NH3+HCl=NH4Cl,
- 2NH3+H2SO4=(NH4)2SO4.
- Солям аммония характерны как общие для всех солей свойства, так и особые.
- К общим свойствам солей можно отнести способность вступать в реакции обмена с кислотами и другими солями, если образуется газ или осадок:
(NH4)2CO3+2HCl=2NH4Cl+H2O+CO2↑,
- (NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl.
- Особые свойства солей обусловлены неустойчивостью иона аммония и его способностью разлагаться с образованием аммиака:
- 1. Соли аммония разлагаются при нагревании:
- NH4Cl=NH3↑+HCl↑.
- 2. Соли аммония при нагревании реагируют со щелочами с выделением аммиака:
- NH4Cl+NaOH=NH3↑+H2O+NaCl.
Применяются соли аммония в качестве удобрений. Карбонат аммония используется кондитерами как разрыхлитель теста. Хлорид аммония находит применение при паянии для очистки поверхности металла.
Нитраты — соли азотной кислоты.
NaNO3 — нитрат натрия, Cu(NO3)2 — нитрат меди((II)), NH4NO3 — нитрат аммония. Нитраты щелочных металлов, кальция и аммония называют ещё селитрами: Ca(NO3)2 — кальциевая селитра, NH4NO3 — аммиачная селитра.

Все соли азотной кислоты хорошо растворяются в воде. При нагревании они разлагаются с выделением кислорода, поэтому взрывоопасны.
2KNO3=2KNO2+O2↑.
Используются нитраты в качестве удобрений, а также для изготовления взрывчатых смесей. Нитрат серебра используется в медицине в качестве прижигающего средства.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/azot-i-ego-soedineniia-161796/re-7be54576-c87d-4017-8977-ef4ce79b605c
Аммоний бикарбонат — важный реактив для пищепрома, химпрома, фармацевтики

Получают соединение химическим синтезом несколькими способами:
- из диоксида углерода CO2, аммиака NH3 и паров воды (для пищевых целей используется только этот метод);
- из углекислого газа CO2 и водного раствора карбоната аммония (NH4)2CO3;
- нагреванием и разложением карбоната аммония.
Свойства
Белый порошок из бесцветных кристалликов. (Пищевой гидроксид аммония может быть только белым. Для технических целей допускается серый и розоватый оттенок.) Запах — легкий, аммиачный. Водорастворим.
Не растворяется в этиловом спирте, ацетоне и других орг. жидкостях. Хорошо пропускает ток, является электролитом. Разлагается на аммиак, воду и углекислый газ уже при нагревании чуть выше 36 градусов Цельсия.
На воздухе постепенно теряет аммиак; чем выше влажность порошка, тем быстрее он разлагается.
Более устойчив, чем карбонат аммония. Раствор имеет щелочную реакцию. Реагирует с аммиаком, кислотами, щелочами, кислородом, хлористым натрием.
| Респиратор «3М 8101″(FFP1) | Аммоний бикарбонат |
Меры предосторожности
Вещество не ядовито, не горит и не взрывается. Относится к 3-му классу опасности для человека (умеренно опасным). Пыль раздражает слизистые оболочки глаз и органов дыхания; вызывает аллергические реакции при контакте с кожей. Реакция с кислородом воздуха уже в нормальных условиях приводит к выделению аммиака. Пары аммиака могут вызвать воспаление слизистой глаз, спазм бронхов.
Надо понимать, что опасность представляет воздействие непосредственно самого реактива. А вот пищевая, фармацевтическая, косметическая продукция, в производстве которой участвовал бикарбонат аммония, совершенно безвредна. В готовом продукте остается лишь вода, а аммиак и углекислый газ улетучиваются. Поэтому вещество считается одной из самых безопасных пищевых добавок.
Помещения, в которых работают с реактивом, должны быть оснащены принудительной вентиляцией. Работникам следует использовать спецодежду, защитные очки и респираторы.
Хранят аммоний бикарбонат на сухих складах, в проветриваемых помещениях с контролем температуры (не выше +20 °С). Пищевой гидрокарбонат аммония упаковывается в тканевые или бумажные мешки и картонные ящики, разрешенные к контакту с пищевыми продуктами. Внутрь мешков и ящиков вставляются герметично закрытые мешки-вкладыши из пищевого полиэтилена.
Применение
- В пищепроме и в домашней кулинарии — в качестве разрешенной во всех странах мира добавки Е503 (ii) (регулятор кислотности; стабилизатор; разрыхлитель для выпечки хлебобулочных бездрожжевых изделий, пирожных, пряников, бубликов, печенья, пирогов и пр). Используется свойство вещества разлагаться при нагревании с выделением газов (аммиака и углекислого газа). Углекислый газ начинает выделяться сразу же после добавления в тесто, способствует быстрому созреванию теста, увеличению объема выпечки, пористости готовых изделий. Входит в состав готовых пекарских порошков для теста. Гидрокарбонат аммония считается более удобным, чем гидрокарбонат натрия (пищевая сода), т. к. не требует точной дозировки, не оставляет характерного содового привкуса. Допускается для производства продукции для детей до одного года. Стабилизатор при изготовлении продуктов из шоколада и какао; мороженого, напитков.
- Используется при производстве вин. Ускоряет брожение сусла, делает более выраженным цвет готового вина.
- В текстильпроме — в процессах окраски тканей.
- В кожевенном деле применяется для хромового дубления кож.
- В фармацевтике — для изготовления витаминов, гомеопатических препаратов, сиропов и средств для растирания при кашле и пневмонии, лекарств от сердечной недостаточности, нашатырного спирта. Используется как противоядие при укусах змей и отравлении грибами.
- В аналитической химии.
- В химпроме востребован при производстве смазочных масел, красителей и пигментов, синтетических волокон (нейлона), катализаторов, средств пожаротушения.
- Используется при изготовлении керамики, в резинотехнической индустрии.

- В косметической индустрии — стабилизатор окраски в красках для волос; регулятор уровня кислотности, средство для получения более однородной консистенции при изготовлении декоративной косметики.
- В сельском хозяйстве — входит в состав кормовых добавок, может использоваться как удобрение вместо аммиачной селитры и мочевины (бикарбонат дешевле, но его сложнее хранить и сложнее вносить в почву).
Источник: https://pcgroup.ru/blog/ammonij-bikarbonat-vazhnyj-reaktiv-dlya-pischeproma-himproma-farmatsevtiki/
Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония
 Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л H2O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства азота: Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Характерная валентность – 3 и 4.
Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. В обычных условиях азот подобен инертному газу.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li3N. При нагревании (то есть активации молекул N2) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
N2 + 3H2 ↔ 2NH3
N2 + 2B → 2BN
3Si + 2N2 → Si3N4
3Ca + N2 → Ca3N2
N2 + O2 → 2NO.
Получение азота. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). Полученный азот содержит примеси благородных газов (аргона).
- В лабораториях обычно используется азот, доставляемый с производства в стальных баллонах под повышенным давлением или жидкий азот в сосудах Дьюара. Можно получать азот разложением некоторых его соединений:
- NH4NO2 → N2 + 2H2O (при to)
- (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O (при to)
- 2N2O → 2N2 + O2 (при to)
- Особо чистый азот получают термическим разложением азида натрия:
- 2NaN3 → 2Na + 3N2 (при to)
Нахождение в природе: в природе азот встречается в основном в свободном состоянии. Содержание азота в воздухе — его объемная доля 78,09 %.
В небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – ДНК и РНК – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цитизила и уридила. Общее содержание азота в земной коре – 0,01 %.
Из минералов промышленное значение имеют чилийская селитра NaNO3 и индийская селитра KNO3.
Источник: http://himege.ru/azot-ximicheskie-svojstva/
Соли аммония. Общая характеристика. Химические свойства. ✎ pangenes.ru
Задания по подготовке к ЕГЭ по химии 29 июля 2019 г., 11:50 
- Соли аммония.
- Аммоний, NH 4+ это положительно — заряженный многоатомный ион, который образуется при протонировании (перенос протона от кислоты к основанию) аммиака (NH3).
- Ион аммония образуется, когда аммиак, слабое основание, реагирует с кислотами Бренстеда (доноры протонов):
H+ + NH3 →NH4+
Однако, будучи слабокислым, реагирует с основаниями Бренстеда, возвращаясь к незаряженной молекуле аммиака:
NH4+ + B- → OB- + NH3
Таким образом, обработка концентрированных растворов солей аммония сильным основанием дает аммиак.
Когда аммиак растворяется в воде, его небольшое количество превращается в ионы аммония:
NH3 + H2O → NH4+ + OH-
- Степень, до которой аммиак образует ион аммония, зависит от рН раствора:
— если pH низкий, равновесие смещается вправо: больше молекул аммиака превращается в ионы аммония.
— если pH высокий, равновесие сдвигается влево: ион гидроксида отнимает протон от иона аммония, образуя аммиак.
Важно! Все соли аммония растворимы в воде, кроме гексахлороплатината аммония (раньше использовалось в качестве теста на NH4+)
Наибольшее значение среди солей аммония в промышленности имеют хлорид аммония (NH4Cl), сульфат аммония ((NH4)2SO4), нитрат аммония (NH4NO3), характеристики которых мы сегодня и пройдем.
Хлорид аммония, NH4Cl (аммиачная соль) — белое кристаллическое твердое вещество. хорошо растворим в воде (37%), образует слегка кислый раствор; испаряется без плавления при 340 ° C с образованием равных объемов аммиака и хлористого водорода.
Уровень опасности: раздражающее средство
- Его основное применение — подача азота в удобрениях и в качестве электролита в сухих элементах
- Также широко используется в качестве компонента флюсов для цинкования, лужения и пайки для удаления оксидных покрытий с металлов и, тем самым, улучшения адгезии припоев.
- Он является компонентом многих патентованных лекарств от простуды и средств от кашля благодаря своей эффективности в качестве отхаркивающего средства,
- В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец.
| NH4Cl | |
| Получение | 1) CO2 + 2NH3 + 2NaCl + H2O → 2NH4Cl + Na2CO3 2) NH3 + HCl → NH4Cl |
| Химические свойства |
|
Сульфат аммония (диаммониевая соль серной кислоты) — белое, твердое вещество, без запаха, хорошо растворяется в воде (103,8 гр в 100 гр воды при 100° С), легко впитывает воду (если подвергается воздействию влажного воздуха, образует «струпья» на влажных поверхностях); температура плавления — выше 280° С; используется в процессе фракционирования (разделения) белков.
Уровень опасности:окислитель, раздражающее средство, экологически опасен
- Сульфат аммония широко распространен в качестве пищевой добавки E517 (регулятор кислотности в хлебе), благодаря активации дрожжей
- (NH4)2SO4 используется в качестве удобрения для щелочных почв (при внесении во влажную почву выделяется NH 4+, что создает небольшое количество кислоты, которая снижает рН баланс почвы, а также способствует выделению азота, который помогает росту растений)
- Наконец, он играет важную роль в разработке вакцин во время процесса очистки. Вакцина DTap, которая защищает детей от дифтерии, столбняка и коклюша, использует для этой цели сульфат аммония.
| (NH4)2SO4 | |
| Получение | 1) 2NH3 + H2SO4 → (NH4)2SO42) (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3 |
| Химические свойства |
|
Нитрат аммония, NH4NO3 (аммиачная селитра, аммониевая соль азотной кислоты) — бесцветное кристаллическое вещество (температура плавления 169,6 ° C); хорошо растворим в воде.
Уровень опасности: окислитель (взрывчатое вещество), раздражающее вещество
- Нагревание водного раствора разлагает соль до закиси азота (веселящий газ):
NH4NO3 = N2O + 2H2O (реакция Пристли, 190-250 С)
Поскольку твердая аммиачная селитра может подвергаться взрывному разложению при нагревании в замкнутом пространстве, на ее транспортировку и хранение были наложены государственные стандарты.
- Товарный сорт содержит около 33,5% азота, причем все они находятся в формах, пригодных для использования растениями; это наиболее распространенный азотный компонент искусственных удобрений.
- Аммиачная селитра также используется для изменения скорости детонации других взрывчатых веществ, таких как нитроглицерин (в так называемых аммиачных динамитах), или в качестве окислителя в аммоналах, которые представляют собой смеси нитрата аммония и порошкообразного алюминия.
- Применяется в качестве питательного вещества при производстве антибиотиков и дрожжей.
| NH4NO3 | |
| Получение | 1) HNO3 + NH3 → NH4NO32) Ca(NO3)2 + 2NH3 + CO2 + H2O → 2NH4NO3 + CaCO3 |
| Химические свойства |
|
pangenes.ru © 2020
Источник: https://pangenes.ru/post/soli-ammoniya-obshchaya-harakteristika-himicheskie-svoystva.html
Что такое аммоний и где его используют
Аммоний – это химический радикал, встречающийся только в составе более сложных соединений. Сфера его применения чрезвычайно широка. Аммоний активно используются в кулинарии в качестве консерванта, некоторые его соединения небезопасны для человеческого здоровья, поэтому запрещены к употреблению в ряде стран.
 Аммоний – химическое вещество, образующееся в результате взаимодействия атомов азота и водорода (формула – NH4), активно использующееся в различных сферах деятельности человека. Аммоний обнаруживается в составе более сложных соединений и никогда в чистом виде. К таким соединениям относятся: хлорид аммония или нашатырь, при взаимодействии с водой образующий нашатырный спирт, сульфат аммония, аммоний ацетат, нитрат аммония.
Аммоний – химическое вещество, образующееся в результате взаимодействия атомов азота и водорода (формула – NH4), активно использующееся в различных сферах деятельности человека. Аммоний обнаруживается в составе более сложных соединений и никогда в чистом виде. К таким соединениям относятся: хлорид аммония или нашатырь, при взаимодействии с водой образующий нашатырный спирт, сульфат аммония, аммоний ацетат, нитрат аммония.
В природе возникновение подобных соединений связано с вулканической активностью планеты, соли хлорида аммония присутствуют в почве и горных породах в местах разломов земной коры, в пещерах, вблизи часто извергающихся вулканов. Незначительное количество нашатыря образуется в процессе разложения продуктов жизнедеятельности животных. В промышленных масштабах аммоний получают в лабораторных условиях.
Сфера применения этого вещества чрезвычайно широка – от производства строительных материалов до пищевой промышленности. Хлорид аммония получил название нашатыря, это вещество представляет собой белый мелкокристаллический порошок, хорошо растворимый в воде и не имеющий запаха, используется при производстве стали, в качестве удобрения в сельском хозяйстве, как лекарственный препарат, обладающий диуретическим действием, в медицине.
Сульфат аммония – это порошок без запаха и цвета, хорошо растворимый в воде и разлагающийся при нагревании до 250°С. Основные сферы применения: пищевая, химическая, горнодобывающая промышленность, производство кормов для животных, строительных материалов. Сульфат аммония обладает легким дезинфицирующим действием, используется в разработке вакцин.
Аммония ацетат – бесцветный или белый кристаллический порошок, получаемый при взаимодействии раствора аммиака с уксусной кислотой. Наиболее часто применяется в химической промышленности, при изготовлении и хранении изделий из кожи, в качестве консерванта при производстве некоторых продуктов питания.
Нитрат аммония, или аммиачная селитра – белый порошок, образующийся при взаимодействии аммиака и азотной кислоты, хорошо растворяется в воде, пиридине и этаноле, взрывоопасен при нагревании выше 270°С. Основная сфера применения: сельское хозяйство (в качестве удобрения).
Различные соединения аммония применяются в пищевой промышленности в качестве консерванта и пищевой добавки:Е510 (хлорид аммония). Используется в основном в хлебобулочном производстве в качестве разрыхлителя теста, в пивоварении для ускорения процесса брожения пива.
В ряде стран пищевая добавка Е510 запрещена, в России добавляется в дрожжи, приправы, соусы, мучные изделия. Е517 (сульфат аммония). Применяется в качестве заменителя соли, эмульгатора, ускоряет процесс поднятия хлеба, улучшает качество муки, вещество разрешено к употреблению в пищу в России и странах ЕС.
Е264 (ацетат аммония).
Способствует увеличению срока годности пищевых продуктов, предотвращает появление плесени, улучшает вкус, запрещен к употреблению в большинстве стран мира, в том числе в России.
- Сульфат аммония
- Аммония нитрат
- Пищевые добавки в продуктах питания и их влияние на человека
- Войти на сайт
- или
Источник: https://www.kakprosto.ru/kak-888973-chto-takoe-ammoniy-i-gde-ego-ispolzuyut
Формула фосфата аммония, свойства и основные применения / химия
фосфат аммония неорганическое вещество, которое образуется при взаимодействии аммиака (NH3) с фосфорной кислотой (H3PO4). В результате получается водорастворимая соль, очень важная для сельскохозяйственного сектора..
Его химическая структура состоит из группы фосфатов (H2PO4) и аммония (NH4). Фосфатная группа состоит из фосфорного ядра (P), которое связывается с кислородом с двойной связью, с двумя гидроксидами (OH) и с кислородом с одинарной связью.

В свою очередь, этот последний кислород связан с аммонием, образуя, таким образом, всю молекулу фосфата аммония. Его формула представлена в виде (NH4) 3PO4.
В природе это происходит в кристаллах. Это продукт, который производится в масштабе довольно экономно.
Основные характеристики
Это происходит в природе в виде белых кристаллов в форме четырехугольных призм или в виде ярко-белых порошков.
В удобрениях он поставляется в гранулированном виде или в виде порошка. Не имеет характерного запаха.
Фосфат аммония обычно является стабильным веществом, поэтому вам не нужно обращать большого внимания на то, будете ли вы реагировать с каким-либо агентом.
В отличие от других веществ, он не представляет опасности для контакта. Однако в случае проглатывания или раздражения важно проконсультироваться с врачом.
свойства
- — Это водорастворимое соединение.
- — Он имеет плотность 1800 кг / м3.
- — Имеет молекулярную массу 115 г / моль.
- — Нерастворим в ацетоне.
— Его pH слегка кислый. Он входит в диапазон от 4 до 4,5.
приложений
Основное применение фосфата аммония — удобрения. Растения нуждаются в минералах и питательных веществах, которые они получают из земли, чтобы развиваться, расти и производить.
К ним относятся азот и фосфор. Поскольку фосфат аммония растворим в воде, растения очень легко поглощают его из земли..
Фосфат аммония также играет фундаментальную роль в фотосинтезе, дыхании и управлении энергией растений..
С другой стороны, было проведено исследование для использования этого соединения в качестве элемента хранения водорода в топливных элементах.
Тенденция к поиску эффективных технологий привела к испытаниям различных материалов, но многие из них слишком дороги. Фосфат аммония очень дешевый, поэтому он может представлять собой отличный вариант.
Некоторые компании используют его как огнетушитель.
ссылки
- Чанг, Р. (2014). химия (International, Eleventh; ed.). Сингапур: Макгроу Хилл.
- Баракат Н., Ахмед Э., Абделькарим М., Фарраг Т., Аль-Меер С., Аль-Деяб С., Нассар М. (2015). Фосфат аммония как обещанный материал для хранения водорода. Международный журнал водородной энергетики, 40 (32), 10103-10110. doi: 10.1016 / j.ijhydene.2015.06.049
- Zhang F., Wang Q., Hong J., Chen, W. Qi C. и Ye L. (2017). Оценка жизненного цикла производства диаммония и моноаммонийфосфатного удобрения в Китае. Журнал чистого производства, 141, 1087-1094. doi: 10.1016 / j.jclepro.2016.09.107
- Dang, Y., Lin, J., Fei, D. & Tang, J. (2010). Факторы влияния процесса кристаллизации моноаммонийфосфата. Huaxue Gongcheng / Химическая инженерия (Китай), 38 (2), 18-21.
- Мубарак Ю.А. (2013). Оптимальные рабочие условия для производства кристаллического моноаммонийфосфата из гранулированного диаммонийфосфата. Арабский журнал для науки и техники, 38 (4), 777-786. doi: 10.1007 / s13369-012-0529-2
- Jančaitienė, K., & Šlinkšienė, R. (2016). Кристаллизация KH2PO4 из хлорида калия и дигидрофосфата аммония. Польский Журнал Химических Технологий, 18 (1), 1-8. doi: 10.1515 / pjct-2016-0001
Источник: https://ru.thpanorama.com/articles/qumica/fosfato-de-amonio-frmula-propiedades-y-usos-principales.html
Сульфат аммония (сернокислый аммоний) | справочник Пестициды.ru
Сульфат аммония (NH4)2SO4 – бесцветные кристаллы, плотность – 1,766 г/см3. При температуре выше +100°C разлагается с выделением аммиака NH3и образованием сначала NH4HSO4, а впоследствии (NH4)2S2O7 и сульфаниловой кислоты.
Растворимость в воде: при 0°C – 70,5 г/100 г, при +25°C – 76,4 г/100 г, при +100°C – 101,7 г/100 г. Окисляется до N2 под действием сильных окислителей, например, марганцевокислого калия KMnO4.[8]
Сульфат аммония содержит:
- азота по массовой доле в пересчете на сухое вещество – не менее 21 %;
- воды – 0,2 %;
- серной кислоты – не более 0,03 %.
Фракционный состав удобрения:
- массовая доля фракции размером более 0,5 мм – не менее 80 %;
- менее 6 мм – 100 %.
Рассыпчатость – 100 %.
Массовая доля остатка, не растворимого в воде, не превышает 0,02 %.[3]
При внесении в почву сульфат аммония быстро растворяется, и значительная часть катионов NH4+ входит в почвенно-поглощающий комплекс. Одновременно в почвенный раствор переходит эквивалентное количество вытесненных катионов. При этом ион аммония теряет подвижность. Это устраняет опасность его вымывания при промывном режиме почв.
Находясь в обменно-поглощенном состоянии, ионы аммония хорошо усваиваются растениями. (Изображение)
Вследствие нитрификации аммонийный азот переходит в нитратную форму. Скорость перехода аммонийного азота в нитратный зависит от необходимых для нитрификации условий: температуры, аэрации, влажности, биологической активности и реакции почвы. Одним из основных факторов, влияющим на скорость нитрификации, является степень окультуренности почв.
Переувлажнение и повышенная кислотность почв тормозят нитрификацию. Известкование кислых почв значительно ускоряет этот процесс. После превращения аммонийного азота в нитратный он приобретает все свойства нитратных удобрений. В результате процесса нитрификации в почве образуется азотная кислота и освобождается серная кислота.
(NH4)2SO4 + 4O2 → 2HNO3 + H2SO4 + 2H2O
В почве эти кислоты нейтрализуются, вступая во взаимодействие с бикарбонатами почвенного раствора и катионами почвенного поглощающего комплекса.
Нейтрализация минеральных кислот сопровождается использованием бикарбонатов почвенного раствора и вытеснением оснований из ППК водородом. Это ослабляет буферную способность почв и повышает их кислотность.
Однократное внесение сульфата аммония может и не повлиять на реакцию почвы. При систематическом использовании данного удобрения почвенная среда может значительно подкислиться. Степень подкисления увеличивается при меньшей буферной способности почв.[9]
| Календарь внесения | |
| Апрель | Основное внесние |
| Сентябрь | Основное внесние |
Сульфат аммония при длительном использовании оказывает на почву окисляющее действие.
На кислых почвах
окисляющее действие этого удобрения проявляется уже через несколько лет. Для регулирования реакции почвы и усиления действия удобрения рекомендуется проводить известкование либо нейтрализовать сульфат аммония до внесения в почву. Для этого на 1 ц удобрения добавляют 1,3 ц извести.[5]
На черноземах
кислотность почв повышается спустя 10–15 лет. Однако на урожайности подкисливание черноземов практически не сказывается, поскольку эти типы почв обладают высоким содержанием гумуса, большой буферностью и емкостью поглощения.[5]
На каштановых почвах
и сероземах оснований опасаться подкисления карбонатных почв нет.[5]
На легких почвах
в районах достаточного увлажнениясульфат аммония наиболее эффективен вследствие слабой миграции аммония.[5]
Сульфат аммония более всего подходит для основного внесения. Но допустимо и применение для поверхностных подкормок озимых зерновых культур, сенокосов и пастбищ,[1] а также фертигации.[7]
Сроки внесения и способы заделки основного удобрения определяются свойствами почвы и климатическими условиями зоны.[6]
Сульфат аммония обеспечивает сельскохозяйственные растения азотом на весь вегетационный период и положительно влияет на их рост, развитие и урожайность.
Овес, озимая рожь, лен
на подкисляющее действие сульфата аммония реагируют слабо.[5]
Свекла, кукуруза, конопля, ячмень, пшеница яровая
на подкисляющее действие удобрения реагируют сильно.[5]
Рапс, капуста, редька масличная и другие крестоцветные
. Применение сульфата аммония особенно эффективно, поскольку они положительно отзываются на серу.[5]
Картофель
– лучшая форма азотных удобрений, посколькупри использовании сульфата аммония в клубнях накапливается гораздо меньше нитратов по сравнению с другими формами азотных удобрений.[1]
Сульфат аммония получают двумя способами:
- путем нейтрализации серной кислоты аммиаком;[6]
H2SO4 + 2NH3 → (NH4)2SO4
- из природных минералов (гипса, мирабилита, фосфогипсом) путем их измельчения и взаимодействия с аммиаком и углекислотой.[5]
При написании статьи, также использовались следующие источники:[4]
Составитель: Григоровская П.И.
Страница внесена: 17.01.14 14:25
Источник: http://www.pesticidy.ru/active_compound/ammonium_sulfate




