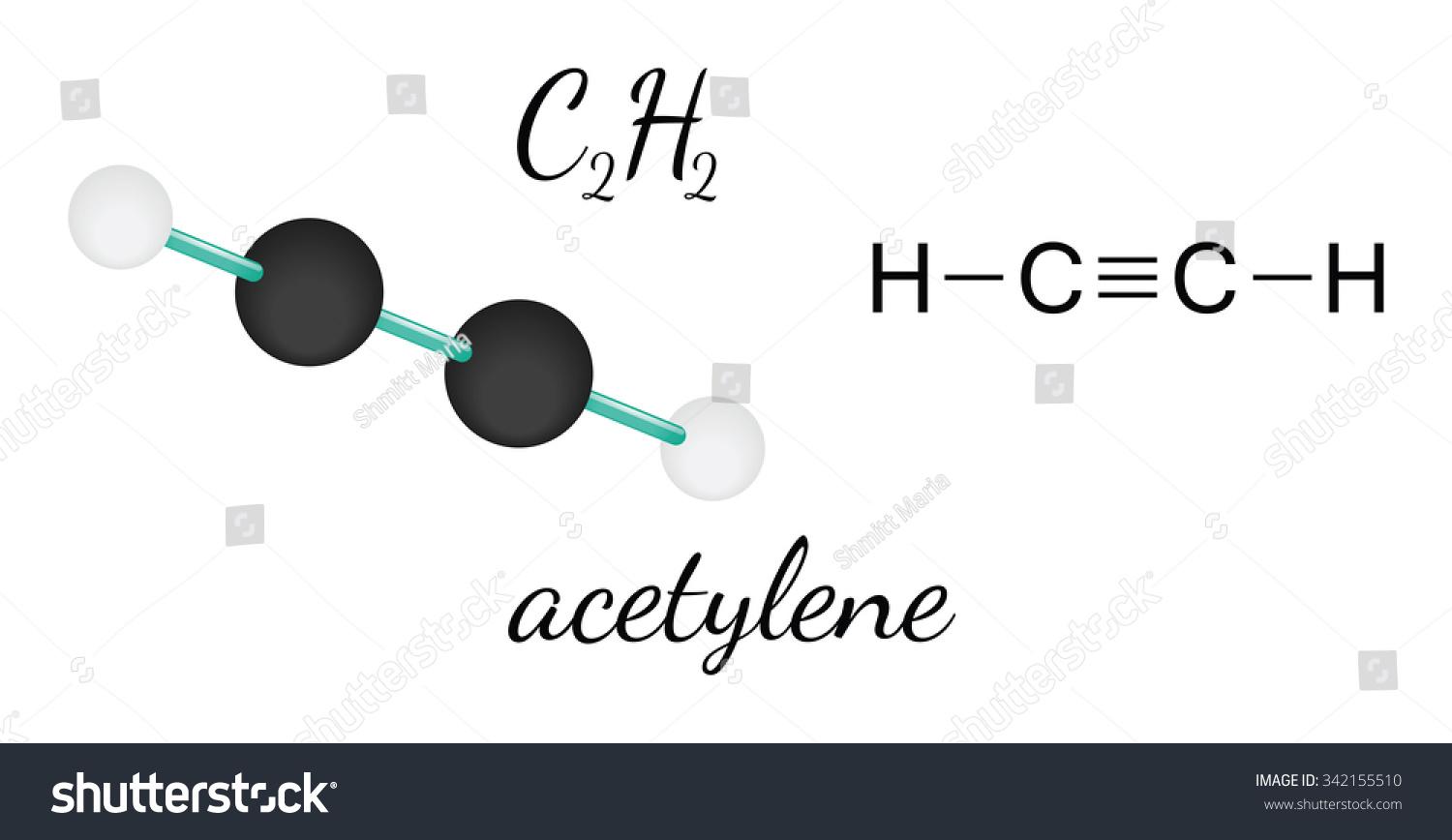
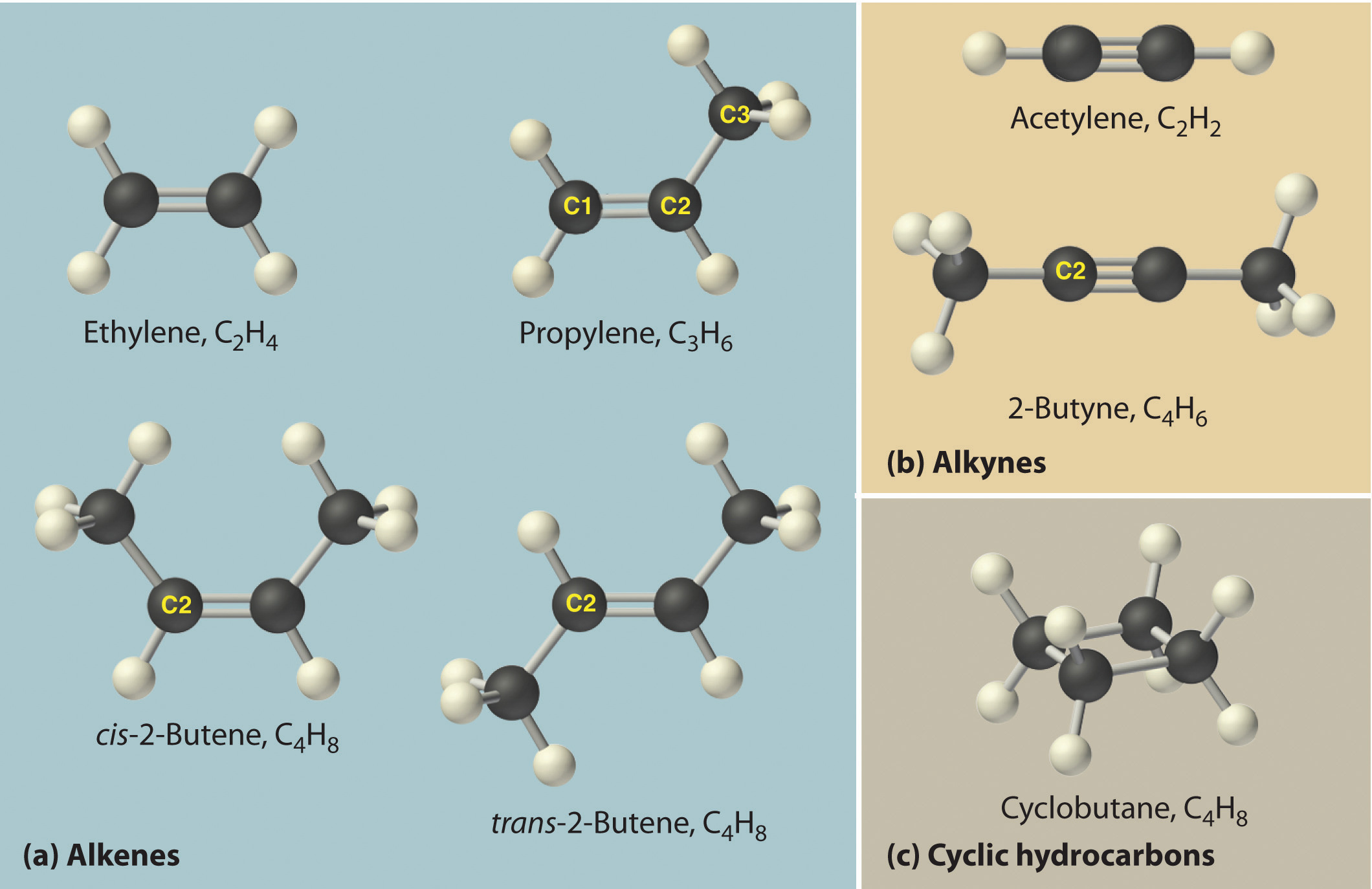
Алкины — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну тройную связь С≡С. Каждая такая связь содержит одну сигма-связь (σ-связь) и две пи-связи (π-связи).
Алкины также называют ацетиленовыми углеводородами. Первый член гомологического ряда — этин — CH≡CH (ацетилен). Общая формула их гомологического ряда — CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов формируются путем добавления суффикса «ин» к названию алкана с соответствующим числом: этин, пропин, бутин и т.д.
При составлении названия алкина важно учесть, что главная цепь атомов углерода должна обязательно содержать тройную связь. Нумерация атомов углерода в ней начинается с того края, к которому ближе тройная связь. В конце названия указывают атом углерода у которых начинается тройная связь.

Для алкинов характерна изомерия углеродного скелета, положения тройной связи, межклассовая изомерия с алкадиенами.
Пространственная геометрическая изомерия для них невозможна, ввиду того, что каждый атом углерода, прилежащий к тройной связи, соединен только с одним единственным заместителем.

Некоторые данные, касающиеся алкинов, надо выучить:
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Получение алкинов
Ацетилен получают несколькими способами:
- Пиролиз метана
- Синтез Бертло
- Разложение карбида кальция
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе чего отщепляется водород. 2CH4 → (t) CH≡CH + 3H2
Осуществляется напрямую, из простых веществ. Протекает на вольтовой (электрической) дуге, в атмосфере водорода. 2C + H2 → (t, вольтова дуга) CH≡CH
В результате разложения карбида кальция образуется ацетилен и гидроксид кальция II. CaC2 + 2H2O → CH≡CH + Ca(OH)2
Получение гомологов ацетилена возможно в реакциях дегидрогалогенирования дигалогеналканов, в которых атомы галогена расположены у одного атома углерода или у двух соседних атомов.

Химические свойства алкины
Алкины — ненасыщенные углеводороды, легко вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции участвует 1 моль водорода)
- CH2=CH-CH3 + H2 → (t, Ni) CH3-CH2-CH3 (в реакции участвует 1 моль водорода)
- CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции участвует 2 моль водорода)
- Галогенирование
- Гидрогалогенирование
- Реакция Кучерова
- Окисление
- При горении алкины, как и все органические соединения, сгорают с образование углекислого газа и воды — полное окисление.
- 2CH≡CH + 5O2 → 4CO2 + 2H2O
- Сильные окислители (особенно в подкисленной среде) способны разрывать молекулы алкинов в самом слабом месте — в месте тройной связи.
- Так, при окислении пропина, образуется уксусная кислота и муравьиная кислота, окисляющаяся до угольной кислоты, которая распадается на углекислый газ и воду.
- Реакция Н.Д. Зелинского (тримеризация ацетилена)
- Димеризация ацетилена
- Образование солей алкинов
Водород присоединяется к атомам углерода, образующим тройную связь. Пи-связи (π-связи) рвутся, остается единичная сигма-связь (σ-связь).
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.

Алкины вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода.

Реакцией Кучерова называют гидратацию ацетиленовых соединений с образованием карбонильных соединений. Открыта русским химиком М.Г. Кучеровым в 1881 году. Катализатор — соли ртути Hg2+.
Только в реакции с ацетиленом образуется уксусный альдегид. Во всех остальных реакциях (с гомологами ацетилена) образуются кетоны.


Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.

Димеризация ацетилена происходит при наличии катализатора — солей меди I. В результате реакции две молекулы ацетилена соединяются, образуя винилацетилен.
В случае если тройная связь прилежит к краевому атому углерода, то имеющийся у данного атома водород может быть замещен атомом металла. Если тройная связь спрятана внутри молекулы, то образование солей невозможно.
Реакция аммиачного раствора серебра и ацетилена — качественная реакция, в ходе которой выпадает осадок ацетиленида серебра.

Источник: https://studarium.ru/article/185
Формула ацетилена в химии
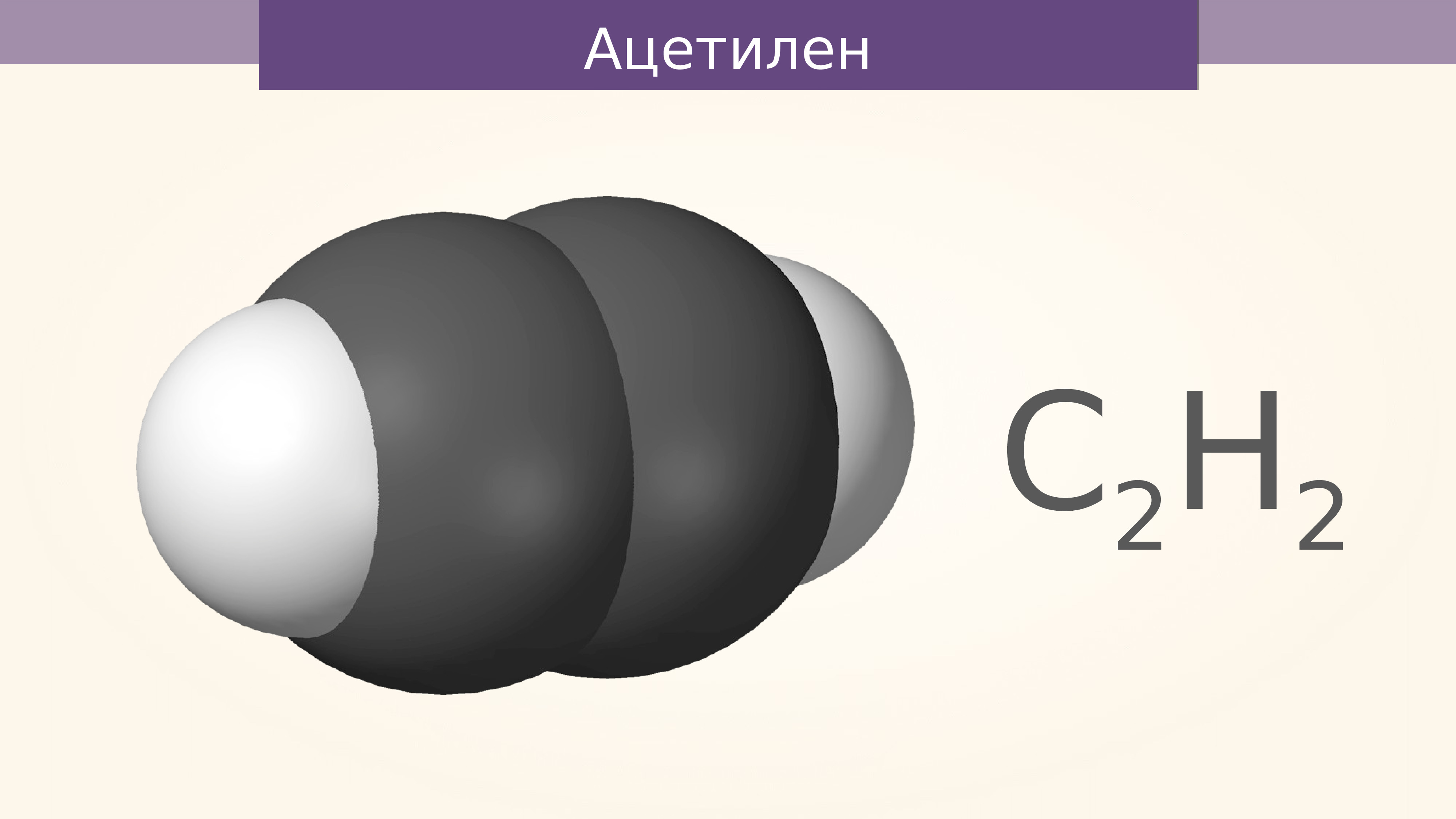
Ацетилен (или по международной номенклатуре — этин) — это непредельный углеводород, принадлежащий к классу алкинов. Химическая формула ацетилена — C2H2. Атомы углерода в молекуле соединены тройной связью. Он является первым в своем гомологическом ряду. Представляет собой бесцветный газ. Очень огнеопасен.
Получение
Все методы промышленного получения ацетилена сходятся к двум типам: гидролиз карбида кальция и пиролиз различных углеводородов. Последний требует меньших энергозатрат, но чистота продукта довольно низкая. У карбидного метода — наоборот.
Суть пиролиза заключается в том, что метан, этан или другой легкий углеводород при нагреве до высоких температур (от 1000 °C) превращается в ацетилен с выделением водорода.
Нагрев может осуществятся электрическим разрядом, плазмой или сжиганием части сырья.
Но проблема состоит в том, что в результате реакции пиролиза может образовываться не только ацетилен, но и еще множество разных продуктов, от которых необходимо впоследствии избавляться.
https://www.youtube.com/watch?v=oiu2HL3Z0yo
Карбидный метод основан на реакции взаимодействия карбида кальция с водой. Карбид кальция получают из его оксида, сплавляя с коксом в электропечах. Отсюда и такой высокий расход энергии. Зато чистота ацетилена, получаемого таким способом, крайне высока (99,9 %).
В лаборатории ацетилен также можно получить дегидрогалогенированием дигалогенпроизводных алканов с помощью спиртового раствора щелочи.
Физические свойства ацетилена
Ацетилен — это газ без цвета и запаха. Хотя примеси могут давать ему чесночный запах. Практически не растворим в воде, немного растворим в ацетоне. При температуре -83,8 °C сжижается.
Химические свойства ацетилена
Исходя из тройной связи ацетилена, для него будут характерны реакции присоединения и реакции полимеризации. Атомы водорода в молекуле ацетилена могут замещаться другими атомами или группами. Поэтому можно сказать, что ацетилен проявляет кислотные свойства. Разберем химические свойства ацетилена на конкретных реакциях.
- Гидрирование. Осуществляется при высокой температуре и в присутствии катализатора (Ni, Pt, Pd). На палладиевом катализаторе возможно неполное гидрирование.
- Галогенирование. Может быть как частичным, так и полным. Идет легко даже без катализаторов или нагревания. На свету хлорирование идет с взрывом. При этом ацетилен полностью распадается до углерода.

- Присоединение к уксусной кислоте и этиловому спирту. Реакции идут только в присутствии катализаторов.

- Присоединение синильной кислоты.
- Взаимодействие ацетилена с металл-органическими соединениями.
- Взаимодействие с металлическим натрием. Необходима температура 150 °C или предварительное растворение натрия в аммиаке.
2CH≡CH + 2Na → 2CH≡CNa + H2
- Взаимодействие с комплексными солями меди и серебра.

- Взаимодействие с амидом натрия.
- Димеризация. При этой реакции две молекулы ацетилена объединяются в одну. Необходим катализатор — соль одновалентной меди.
- Тримеризация. В этой реакции три молекулы ацетилена образуют бензол. Необходим нагрев до 70 °C, давление и катализатор.
- Тетрамеризация. В результате реакции получается восьмичленный цикл — циклооктатетраен. Для этой реакции также требуется небольшой нагрев, давление и соответствующий катализатор. Обычно это комплексные соединения двухвалентного никеля.

Это далеко не все химические свойства ацетилена.
Применение
Структурная формула ацетилена указывает нам на довольно прочную связь между атомами углерода. При ее разрыве, например при горении, выделяется очень много энергии. По этой причине ацетиленовое пламя обладает рекордно высокой температурой — около 4000 °C. Его используют в горелках для сварки и резки металла, а также в ракетных двигателях.
Пламя горения ацетилена имеет также очень высокую яркость, поэтому его часто используют в осветительных приборах. Используется он и во взрывотехнике. Правда, там применяется не сам ацетилен, а его соли.
Пистолет для кровельных гвоздей
Как видно из разнообразных химический свойств, ацетилен может применяться как сырье для синтеза других важных веществ: растворителей, лаков, полимеров, синтетических волокон, пластмасс, органического стекла, взрывчатых веществ и уксусной кислоты.
Безопасность
Как уже говорилось, ацетилен — огнеопасное вещество. С кислородом или воздухом он способен образовывать крайне легковоспламеняющиеся смеси. Чтобы вызвать взрыв, достаточно одной искры от статического электричества, нагрева до 500 °C или небольшого давления. При температуре 335 °C чистый ацетилен самовоспламеняется.
Из-за этого ацетилен хранят в баллонах под давлением, которые наполнены пористым веществом (пемза, активированный уголь, асбест). Таким образом, ацетилен распределяется по порам, уменьшая риск взрыва. Часто эти поры пропитывают ацетоном, из-за чего образуется раствор ацетилена. Иногда ацетилен разбавляют другими, более инертными газами (азот, метан, пропан).
Этот газ обладает и токсичным действием. При его вдыхании начнется интоксикация организма. Признаками отравления являются тошнота, рвота, шум в ушах, головокружение. Большие концентрации могут приводить даже к потере сознания.
Особенности строения ацетилена влияют на его свойства, получение и применение. Условное обозначение состава вещества — С2Н2 — это его простейшая и брутто-формула. Ацетилен образован двумя атомами углерода, между которыми возникает тройная связь. Ее наличие отражают разные виды формул и моделей молекулы этина, позволяющих разобраться в проблеме влияния строения на свойства вещества.
Алкины. Общая формула. Ацетилен
Углеводороды алкины, или ацетиленовые, являются ациклическими, непредельными. Цепочка атомов углерода — не замкнутая, в ней присутствуют простые и кратные связи. Состав алкинов отражает сводная формула CnH2n – 2.
В молекулах веществ этого класса присутствует одна или несколько тройных связей. Ацетиленовые соединения относятся к ненасыщенным. Это означает, что только одна валентность углерода реализуется за счет водорода.
Оставшиеся три связи используются при взаимодействии с другими атомами углерода.
Первый — и наиболее известный представитель алкинов — ацетилен, или этин. Тривиальное название вещества произошло от латинского слова «acetum» — «уксус» и греческого — «hyle» — «дерево».
Родоначальник гомологического ряда был открыт в 1836 году в химических опытах, позже вещество синтезировали из угля и водорода Э. Дэви и М. Бертло (1862 год). При обычной температуре и нормальном атмосферном давлении ацетилен находится в газообразном состоянии.
Это бесцветный газ, без запаха, малорастворимый воде. Этин легче растворяется в этаноле и ацетоне.

Молекулярная формула ацетилена
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г/моль.
- Н:С. С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.

Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических).
Еще в конце XVIII века получили распространение шаростержневые модели — например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен.
Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
Антенна из кабеля для dvb t2
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Гибридные атомные орбитали ацетилена
Углерод в возбужденном состоянии содержит три р-орбитали и одну s с неспаренными электронами. При образовании метана (СН4) они принимают участие в создании равноценных связей с атомами водорода. Известный американский исследователь Л.
Полинг разработал учение о гибридном состоянии атомных орбиталей (АО). Объяснение поведения углерода в химических реакциях заключается в выравнивании АО по форме и энергии, образовании новых облаков.
Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Атомы углерода в молекуле ацетилена, в отличие от метана, подвергаются sp-гибридизации. По форме и энергии смешиваются s- и р электроны. Появляются две sp-орбитали, лежащие под углом 180°, направленные по разные стороны от ядра.

Тройная связь
В ацетилене гибридные электронные облака углерода участвуют в создании σ-связей с такими же соседними атомами и с водородом в парах С—Н. Остаются две перпендикулярные друг другу негибридные p-орбитали. В молекуле этина они участвуют в образовании двух π-связей.
Вместе с σ возникает тройная связь, которую отражает структурная формула. Ацетилен отличается от этана и этилена расстоянием между атомами. Тройная связь короче двойной, но обладает большим запасом энергии, является более прочной.
Максимальная плотность σ- и π-связей расположена в перпендикулярных областях, что приводит к образованию цилиндрического электронного облака.
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Гомологи ацетилена
Ацетилен — простейший представитель алкинов, в молекулах которых также присутствует тройная связь. Пропин СН3С≡СН — гомолог ацетилена. Формула третьего представителя алкинов — бутина-1 — СН3СН2С≡СН. Ацетилен — тривиальное название этина. Систематическая номенклатура алкинов подчиняется правилам ИЮПАК:
- в линейных молекулах указывается название основной цепи, возникшее от греческого числительного, к которому добавляется суффикс -ин и номер атома при тройной связи, например, этин, пропин, бутин-1;
- нумерацию главной цепочки атомов начинают с конца молекулы, ближайшего к тройной связи;
- для разветвленных углеводородов сначала идет наименование бокового ответвления, затем следует название главной цепочки атомов с суффиксом -ин.
- заключительная часть наименования — цифра, указывающая расположение в молекуле тройной связи, например, бутин-2.
Изомерия алкинов. Зависимость свойств от строения
Этин и пропин не имеют изомеров положения тройной связи, они появляются, начиная с бутина. Изомеры углеродного скелета есть у пентина и следующих за ним гомологов. Относительно тройной связи не проявляется пространственная изомерия ацетиленовых углеводородов.
Первые 4 гомолога этина — газы, плохо растворимые в воде. Ацетиленовые углеводороды C5 – C15 — жидкости. Твердыми веществами являются гомологи этина, начиная с углеводорода C17. Химическая природа алкинов испытывает значительное влияние тройной связи.
Углеводороды этого типа активнее, чем этиленовые, присоединяют различные частицы. На этом свойстве основано широкое применение этина в промышленности и технике.
При горении ацетилена выделяется большое количество теплоты, что находит применение в газовой резке и сварке металлов.
Плотность стружки черных металлов
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C.
При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный.
Нельзя выпускать на открытый воздух. C2H2 обнаружен на Уране и Нептуне.
Химические свойства
- Для ацетилена (этина) характерны реакции присоединения:
- HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова).
В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен).
Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
- Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
- Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
- Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В лаборатории ацетилен получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.),
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
Применение
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях(вместе с аммиаком) [2]
Безопасность
Поскольку ацетилен растворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры.
Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м 3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест».
Источник: https://ostwest.su/instrumenty/formula-acetilena-v-himii.php/
Урок-конспект "Ацетилен, его строение, свойства, получение, применение."
Урок « Ацетилен, его строение, свойства, поучение, применение. Гомологический ряд ацетилена. Изомерия.»
Цели урока:
- познакомиться с гомологическим рядом, номенклатурой, и изомерией непредельных углеводородов ряда ацетилена;
- рассмотреть физические и химические свойства на основе ранее полученных знаний о кратной связи и логической цепочки « состав – строение — свойства»;
- выяснить области применения представителей данного класса органических веществ;
- закрепить полученные знания.
Задачи урока:
-
Формирование представлений о химических свойствах ацетилена и его гомологов на основе строения.
-
Формирование информационно-коммуникативных компетенций учащихся при поиске информации, при работе с разными источниками информации.
-
Совершенствование умений и навыков учащихся в написании изомеров непредельных углеводородов, в составлении уравнений химических реакций для ацетилена и его гомологов.
Тип урока: комбинированный
Оборудование:
- Шаростержневая модель молекулы ацетилена
- Раздаточный материал по теме «Углеводороды»
- Интернет-ресурсы;
- презентация
Ход урока
I.Организационный момент: объявление темы, целей и задач урока. II. Изучение темы урока по плану:
-
Состав: общая формула, простейшие представители данного класса, номенклатура соединений.
-
Особенности строения: наличие тройной (кратной) связи, тип гибридизации.
-
Изомерия молекул и ее виды.
-
Свойства веществ: физические и химические.
-
Применение.
Подведение итогов урока, выставление оценок.
Домашнее задание.
II. Изучение новой темы.
1. Алкины – это непредельные (ненасыщенные) углеводороды, с одной тройной углерод — углеродной связью С≡С в цепи и общей формулой СnH2n-2
2. Строение. Состав алкинов.
C2H6 C2H4 C2H2
На доске записаны формулы углеводородов. Чем они отличаются? Числом атомов водорода.
Первая формула принадлежит этану (предельному углеводороду), вторая этилену (непредельному углеводороду), а третья принадлежит еще более ненасыщенному соединению – ацетилену. Давайте составим структурные формулы этих углеводородов.
- Сn H2n+2
- CnH2n
- CnH2n-2
Ацетилен еще более ненасыщенный угеводород, чем этан и этилен..
- Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
- Молекулярная формула ацетилена C2H2
- Структурная формула ацетилена H–C≡C–H
- Электронная формула H : С : : : С : Н

Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s— и p-орбитали.
В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь.
Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются σ -связи.
Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ — и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
![]()
Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π -связи, которые относительно непрочные и в химических реакциях легко разрываются.


Таким образом, в молекуле ацетилена имеются три σ -связи (одна связь C–C и две связи C–H) и две π -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ — и двух π -связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
- Запомните!
- 1. Длина связи 0,12 нм
- 2. Угол 180
- 3. Линейная молекула
- 4. Связи – σ и 2π
- 5. Sp- гибридизация
- 3. Физические свойства
- С2Н2 – Ацетилен – бесцветный газ, легче воздуха, с резким запахом, малорастворим в воде,
- 4. Изомерия и номенклатура
- Структурная изомерия
- 1. Изомерия положения тройной связи (начиная с С4Н6):
![]()
2. Составить все возможные изомеры гексина.
- 3. Построить следующие структурные формулы алкенов:
- а) 3метил пентин-1, б) 4,4диметил пентин-2, в) 2,5диэтилгексин-3
- 5.Химические свойства алкинов
1). Горение. Ацетилен горит светящимся пламенем и образует много копоти. Чем больше в горящем веществе углерода и чем меньше водорода, тем больше коптящего пламени получается. Часть углерода просто не успевает перевариться в углекислый газ и дает частицы сажи от которых пламя становиться светящимся.
- 2 С2Н2 + 5 О2 = 4СО2 + 2 Н2О
- Реакции присоединения
- 2). Галогенирование
- (как и алкены обесцвечивают бромную воду!)
- СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
- CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан)
- 3). Гидрогалогенирование
- * CH3-C≡CH + HBr AlBr3→ CH3-CBr=CH2
- 2-бромпропен
- * — используется пр. Морковникова
- 4). Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):

- Получение ацетилена.
- Ацетилен химически активен, поэтому в природе не встречается. Его получают:
- 1. Из метана, тo есть основного компонента природного газа: 2СН4 → С2Н2+ 3H2
2.Ацетилен в лаборатории получают карбидным способом. В карбид кальция наливают дистиллированную воду и опускают газоотводную трубку в перманганат калия. Раствор обесцвечивается. CaC2 + 2H2O → Ca(OH)2 + C2H2↑
Применение ацетилене.
-
Для сварки и резки металлов.
-
Из ацетилена поучают полихлорвинил из которого изготавливают новогодние искусственные елочки, искусственные кожи , клеенки, линолиум.
-
Ацетилен дешевое химическое сырье, из которого получают пластмассы, каучуки, резину, химические волокна.
-
Переработав ацетилен можно получить этиловый спирт, уксусную кислоту, растворители, ароматические углеводороды.
- Обобщение и закрепление знаний: Закончите следующие фразы:
- 1 Алкины — это…
- 2. Общая формула алкинов…
- 3 Простейший алкин…
- 4. Связь в молекуле ацетилена между углеродными атомами…
- 5. Физические свойства ацетилена…
- 6. Характерные химические реакции алкинов…
- 7. Ацетилен применяется для…
- Осуществить превращения:
- Метан → Ацетилен → Этилен → Этан → Хлорэтан
- Задание на дом: § 16, Составить кроссворд по теме « Алкины», ацетилен.
Источник: https://infourok.ru/urokkonspekt-acetilen-ego-stroenie-svoystva-poluchenie-primenenie-808171.html
Разница между Ацетиленом и Этиленом
Ключевое различие между Ацетиленом и Этиленом состоит в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.

Содержание
- Обзор и основные отличия
- Что такое Ацетилен
- Что такое Этилен
- Сходство между Ацетиленом и Этиленом
- В чем разница между Ацетиленом и Этиленом
- Заключение
Что такое Ацетилен?
Ацетилен представляет собой органическое соединение, имеющее химическую формулу C2H2. Это самый простой алкин среди углеводородов. Алкин это соединение, имеющее тройную связь между двумя атомами углерода и соответственно ацетилен, также имеет тройную связь между двумя атомами углерода. Между этими атомами углерода есть две пи-связи и одна сигма-связь.
 Химическая и молекулярная структура Ацетилена
Химическая и молекулярная структура Ацетилена
Молекула ацетилена имеет линейную геометрию, так как один атом углерода может образовывать только четыре ковалентные связи (ацетилен имеет тройную связь и одинарную связь СН, что делает молекулу линейной). Следовательно, атомы углерода молекулы ацетилена sp-гибридизованы.
Химические свойства Ацетилена:
- Химическая формула: C2H2
- Молярная масса: 26,04 г/моль
- Физическое состояние при комнатной температуре: бесцветный газ
- Наличие запаха: без запаха
- Температура плавления: -80,8 °С
- Температура кипения: -84 °C
- Растворимость в воде: слаборастворимый
- Химическое название: Этин
Ацетилен не может существовать в виде жидкости при атмосферном давлении. Таким образом, он не имеет фактической температуры плавления. Приведенная выше температура плавления фактически является тройной точкой ацетилена. Поэтому твердая форма ацетилена подвергается сублимации, а не плавлению. при этом твердый ацетилен превращается в пар.
 Резка металла на кислородно-ацетиленовой смеси
Резка металла на кислородно-ацетиленовой смеси
Основное применение ацетилена в резке металла, а также в сварочных процессах. Кислородно-ацетиленовое пламя — это высокотемпературное пламя, которое нагревается до 3150 °С и используется для резки металла и его сварки.
Что такое Этилен?
Этилен является органическим соединением, имеющим химическую формулу C2H4. У этилена два атома углерода, связанные друг с другом через двойную связь (пи-связь и сигма-связь). Следовательно, молекула этилена имеет два sp2-гибридизованных атома углерода. Молекула этилена имеет плоскую структуру.
 Химическая и молекулярная структура Этилена
Химическая и молекулярная структура Этилена
Химические свойства Ацетилена Этилена:
- Химическая формула: C2H4
- Молярная масса: 28,05 г/моль
- Физическое состояние при комнатной температуре: бесцветный, легковоспламеняющийся газ
- Запах: сладковатый запах
- Температура плавления: −169,2 °C
- Точка кипения: −103,7 °C
- Растворимость в воде: слаборастворимый
- Химическое название: Этен
 Получение Этилена Лабораторным путём
Получение Этилена Лабораторным путём
Лабораторным путём Этилен получают при нагревании этилового спирта с серной кислотой (концентрированной)
Основным источником промышленного этилена является сырая нефть и природные газы. Существует три основных способа производства этилена:
- Паровой крекинг этана и пропана
- Паровой крекинг нафты
- Каталитический крекинг газойля
Этилен применяется в качестве мономеров для производства полимеров, таких как полиэтилен, который производится путем аддитивной полимеризации. Полиэтилен является распространенным упаковочным материалом.
Кроме того, в биологических системах этилен выполняет функции растительного гормона. Кроме того он стимулирует процесс созревания плодов, что имеет практическое применение в растениеводстве.
Например при перевозке бананов применяется их газация этиленон для дозревания в процессе доставки и тем самым потребителю они приходят зрелые и в свежем виде.
Каковы сходства между Ацетиленом и Этиленом?
- Оба являются простейшими углеводородами.
- Ацетилен и этилен состоят только из атомов углерода и атомов водорода.
- Оба бесцветные газы.
- И ацетилен, и этилен являются легковоспламеняющимися газами.
- Ацетилен и этилен имеют плоскую структуру.
В чем разница между ацетиленом и этиленом?
| Ацетилен против Этилена |
|
| Ацетилен представляет собой органическое соединение, имеющее химическую формулу C2H2 | Этилен является органическим соединением, имеющим химическую формулу C2H4 |
| Количество атомов водорода |
|
| Ацетилен имеет два атома водорода в одной молекуле ацетилена | Этилен имеет четыре атома водорода в одной молекуле этилена |
| Молярная масса |
|
| Молярная масса ацетилена составляет 26,04 г/моль | Молярная масса этилена составляет 28,05 г/моль |
| Химическая связь |
|
| Ацетилен имеет тройную связь между двумя атомами углерода и двумя одинарными связями СН | Этилен имеет двойную связь между двумя атомами углерода и четырьмя одинарными связями СН |
| Гибридизация атомов углерода |
|
| Атомы углерода молекулы ацетилена sp-гибридизованы | Атомы углерода молекулы этилена sp2-гибридизованы |
Разница между Пропанол-1 и Пропанол-2
Ацетилен и Этилен являются углеводородными соединениями с широким спектром применения. Разница между Ацетиленом и Этиленом заключается в том, что Ацетилен имеет тройную связь между двумя атомами углерода, тогда как Этилен имеет двойную связь между двумя атомами углерода.
Источник: https://raznisa.ru/raznica-mezhdu-acetilenom-i-etilenom/
Ацетилен
Продажа
Производство
Доставкамарка «А» 2.6марка «Б» II сорттехнический чистый марка «А» 2.5марка «А»марка «Б», I сорт
Ацетилен — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C.
При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.
Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2H2 есть на Уране и Нептуне.
Химические свойства
- Ацетилено-кислородное пламя(температура «ядра» 3300 °C)
- Для ацетилена (этина) характерны реакции присоединения:
- HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова).
В силу наличия тройной связи, молекулавысокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен можетполимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен).
Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метаниз эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра иодновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидка),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
Безопасность
Источник: https://tgko.ru/spravka/gaz/acetilen
Ацетилен
Взрывоопасность ацетилена
При использовании ацетилена необходимо учитывать его взрывоопасные свойства. Это единственный широко применяемый в промышленности газ, горение и взрыв которого возможны даже при отсутствии кислорода или других окислителей.
Температура самовоспламенения ацетилена зависит от давления (таблица 5).
Таблица 5 — Зависимость температуры самовоспламенения ацетилена от давления
| Абсолютное давление, кгс/см3 (МПа) | 2 (0,2) | 3 (0,3) | 4 (0,4) | 22 (2,2) |
| Температура самовоспламенения, °С (К) | 630 (903) | 530 (803) | 475 (748) | 350 (623) |
Повышение давления существенно уменьшает температуру самовоспламенения ацетилена.
Частицы других веществ, присутствующие в ацетилене, увеличивают поверхность его контакта и тем самым снижают температуру самовоспламенения при атмосферном давлении до следующих значений, °С (К): железная стружка – 520 (793); латунная стружка – 500–520 (773–793); карбид кальция – 500 (773); оксид алюминия – 490 (763); медная стружка – 460 (733); активированный уголь – 400 (673); гидрат оксида железа (ржавчина) – 280–300 (553–573); оксид железа – 280 (553);
оксид меди – 250 (523).
Если ацетилен медленно нагревать до температуры 700–800 °С (973–1073 К) при атмосферном давлении, то происходит его полимеризация, при которой молекулы уплотняются и образуют более сложные соединения: бензол C6H6, стирол C8H8, нафталин C10H8, толуол C7H8 и др. Полимеризация всегда сопровождается выделением теплоты и при быстром нагреве ацетилена может перейти в его самовоспламенение или взрывчатый распад.
Если при сжатии ацетилена в компрессоре до давления 29 кгс/м3 (2,9 МПа) те5мпература при завершении этого процесса не превышает 275 °С (548 К), то воспламенения не происходит, что позволяет наполнять баллоны ацетоном с целью его длительного хранения и транспортирования. С повышением давления температура, при которой начинается процесс полимеризации, понижается (рис.1).
| Рис.1. Области полимеризации (I) и взрывчатого распада (II) ацетилена |
При практическом использовании ацетилена допустим его нагрев до следующих значений температуры, °С (К): 300 (573) – при давлении 1 кгс/см2 (0,1 МПа); 150–180 (423–453) – при 2,5 кгс/см2 (0,25 МПа);
100 (373) – при более высоких давлениях.
Одним из важных показателей взрывоопасности горючих газов и паров является энергия зажигания. Чем меньше эта величина, тем взрывоопаснее данной вещество. Значения энергии зажигания ацетилена (при нормальных условиях): с воздухом – 19 кДж; в кислородом – 0,3 кДж.
Водяной пар служит флегматизатором для ацетилена, т.е. его присутствие существенно снижает способность ацетилена к самовоспламенению при наличии случайных источников теплоты и взрывчатому распаду. Согласно действующим нормам для ацетиленовых генераторов, в которых ацетилен всегда насыщен парами воды, предельное избыточное давление составляет 150 кПа, а абсолютное – 250 кПа.
При атмосферном давлении смесь ацетилена с воздухом взрывоопасна, если в ней содержатся 2,2 % ацетилена и более, смесь с кислородом – 2,8 % ацетилена и более (верхних пределов концентрации ацетилена для его смесей с воздухом и кислородом не существует, так как при достаточной энергии зажигания способен взрываться и чистый ацетилен).
Источник: http://bst29.ru/info/articles/detail.php?ELEMENT_ID=12
АЦЕТИЛЕН
АЦЕТИЛЕН (этин) – углеводород состава С2Н2, содержащий тройную углерод-углеродную связь. Название этого соединения уже более ста лет знакомо не только химикам. С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (СаС2 + 2Н2О ® С2Н2 + Са(ОН)2), этот газ стали использовать для освещения.
В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода.
Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени – от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы.
Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Впервые ацетилен получил в 1836 Эдмунд Дэви, двоюродный брат знаменитого Гемфри Дэви. Он подействовал водой на карбид калия: К2С2 + Н2О ® С2Н2 + 2КОН и получил новый газ, который назвал двууглеродистым водородом. Он был, в основном, интересен химикам с точки зрения теории строения органических соединений.
Один из создателей так называемой теории радикалов Юстус Либих назвал группу атомов (т.е. радикал) С2Н3 ацетилом. На латыни acetum – уксус; молекула уксусной кислоты (С2Н3О+О+Н, как записывали тогда ее формулу) рассматривалась как производное ацетила.
Когда французский химик Марселен Бертло в 1855 сумел получить «двууглеродистый водород» сразу несколькими способами, он назвал его ацетиленом. Бертло считал ацетилен производным ацетила, от которого отняли один атом водорода: С2Н3 – Н ® С2Н2.
(Сейчас ацетилом называют группировку СН3СО; она входит в состав солей уксусной кислоты – ацетатов, а также ацетона СН3СО–СН3, ацетальдегида СН3СО–Н, ацетилхлорида СН3СО–Cl и многих других соединений.)
Сначала Бертло получал ацетилен, пропуская пары этилена, метилового и этилового спирта через раскаленную докрасна трубку.
В 1862 он сумел синтезировать ацетилен из элементов, пропуская водород через пламя вольтовой дуги между двумя угольными электродами, а в 1867 сделал очень важное для химической теории открытие: показал, что из трех молекул ацетилена можно получить молекулу бензола: 3С2Н2 ® С6Н6.
Все упомянутые методы синтеза имели только теоретическое значение, и ацетилен был редким и дорогим газом, пока не был разработан дешевый способ получения карбида кальция прокаливанием смеси угля и негашеной извести: СаО + 3С ® СаС2 + СО.
В течение длительного времени ацетилен для технических нужд (например, на стройках) получали «гашением» карбида водой. Полученный из технического карбида кальция ацетилен имеет неприятный запах из-за примесей аммиака, сероводорода, фосфина РН3, арсина AsH3.
Сейчас широко применяются методы получения ацетилена из природного газа – метана: электрокрекинг 2СН4 ® С2Н2 + 3Н2 (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена); термоокислительный крекинг (неполное окисление) 6СН4 + 4О2 ® С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О (в реакции используют теплоту частичного сгорания ацетилена).
Чистый ацетилен при охлаждении сжижается при –83,8° С, а при дальнейшем понижении температуры быстро затвердевает.
Он умеренно растворим в воде (1150 мл в 1 л воды при 15° С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением 12 атм).
Термодинамически ацетилен неустойчив; он взрывается при нагревании до 500° С, а при обычной температуре – при повышении давления до 2 атм. Поэтому его хранят в баллонах, наполненных пористым инертным материалом, который пропитан ацетоном.
Ацетилен используют для так называемой автогенной сварки и резки металлов. Для этого нужны два баллона с газами – с кислородом (он окрашен в голубой цвет) и с ацетиленом (белого цвета). Газы из баллонов поступают в специальную горелку.
Еще в 1895 году было обнаружено, что при сгорании ацетилена в кислороде получается очень горячее пламя; максимальная его температура (3150° С) достигается при содержании ацетилена 45% по объему.
В таком пламени очень быстро расплавляются даже толстые куски стали.
Химия ацетилена впервые была детально изучена в работах академика А.Е.Фаворского (1860–1945). Оказалось, что ацетилен может служить исходным продуктом для синтеза многих более сложных органических соединений. Эта область применения ацетилена в настоящее время является самой обширной.
Ацетилен – реакционноспособное соединение, вступающее в многочисленные реакции. В 1881 М.Г.Кучеров открыл реакцию присоединения к ацетилену воды в присутствии катализатора – солей ртути, при этом образуется ацетальдегид: С2Н2 + Н2О ® СН3СНО.
Из ацетальдегида далее получают уксусную кислоту, ацетон, спирт.
В 1949 немецкий химик В.Ю.Реппе открыл важную реакцию карбонилирования (присоединения СО) ацетилена в присутствии никелевого катализатора: С2Н2 + СО + Н2О ® СН2=СН–СООН.
Образующаяся в этой реакции непредельная акриловая кислота используется для получения разнообразных полимеров – акрилатов (к ним относится и органическое стекло – полиметилметакрилат).
А присоединение к ацетилену синильной кислоты дает другой важнейший продукт – нитрил акриловой кислоты (акрилонитрил): C2H2 + HCN ® CH2=CH–CN. Его полимеризацией получают очень важные полиакрилонитрильные полимеры, из которых делают искусственные волокна, пластики, каучуки.
Галогены и гидрогалогены (последние – в присутствии катализаторов) легко присоединяются к ацетилену с образованием сначала замещенных этилена, затем – этана, например: HCєCH + Cl2 ® ClCH=CHCl, ClCH=CHCl + Cl2 ® CHCl2–CHCl2; HCєCH + HCl ® CH2=CHCl, CH2=CHCl + HCl ® CH3–CHCl2 (последние две реакции идут по правилу Марковникова). Образующиеся хлорпроизводные широко используются в качестве полупродуктов для дальнейших синтезов, а также как растворители (например, в химчистке).
Ацетилен является слабой кислотой, в присутствии сильных оснований возможна ионизация этой связи с образованием ацетиленид-иона НєС–С–.
Возможна ионизация и второй связи С–Н, поэтому при пропускании ацетилена в аммиачные растворы солей серебра и меди(I) образуются белый ацетиленид серебра C2Ag2 и красно-бурый ацетиленид меди C2Cu2. Оба соединения нерастворимы и выпадают в осадок; в сухом виде они они являются взрывчатыми веществами.
Карбид кальция СаС2 также можно рассматривать как ацетиленид. Эти солеобразные соединения имеют ионную кристаллическую решетку, в узлах которой находятся катионы металла и анионы С22–.
В кислой среде в присутствии ионов Cu+ ацетилен димеризуется с образованием винилацетилена НСєС–СН=СН2.
При его полимеризации образуются продукты, которые используются в производстве лакокрасочных материаловю – винил- и дидивинилацетиленовых лаков.
Приведенные примеры далеко не исчерпывают богатую химию ацетилена, из которого можно получить сотни разнообразных соединений. Недаром его годовое производство превышает 5 млн тонн. Из них примерно 70% используют для промышленного органического синтеза, а 30% – для сварки и резки металлов.
Илья Леенсон
Источник: https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/ATSETILEN.html
Метан, этилен, ацетилен: химическое строение, горение. Реакция полимеризации
Химическим строением называют последовательность соединения атомов в молекуле и их расположение в пространстве. Химическое строение изображают с помощью структурных формул. Черточка изображает ковалентную химическую связь. Если связь кратная: двойная, тройная, — то ставят две (не путать со знаком «равно») или три черточки. Углы между связями изображают по возможности.
Чтобы правильно составлять структурные формулы органических веществ, нужно помнить, что атомы углерода образуют по 4 связи
(т. е. валентность углерода по числу связей равна четырем. В органической химии преимущественно используется именно валентность по числу связей).
Метан (его также называют болотный, рудничный газ) состоит из одного атома углерода, связанного ковалентными связями с четырьмя атомами водорода. Молекулярная формула CH4. Структурная формула:
H
l
H – C – H l
H
Угол между связями в молекуле метана составляет около 109° — электронные пары, образующие ковалентные связи атома углерода (в центре) с атомами водорода, располагаются в пространстве на максимальном удалении друг от друга.
В 10–11 классах изучается, что молекула метана имеет форму треугольной пирамиды — тетраэдра, подобно знаменитым египетским пирамидам.
Этилен C2H4 содержит два атома углерода, соединенных двойной связью:
Угол между связями составляет 120° (электронные пары отталкиваются и располагаются на максимальном расстоянии друг от друга). Атомы располагаются в одной плоскости.
Если не изображать отдельно каждый атом водорода, то получаем сокращенную структурную формулу:
CH2 = CH2
Ацетилен C2H2 содержит тройную связь:
H – C ≡ C – H
Угол между связями 180°, молекула имеет линейную форму.
При горении углеводородов образуются оксиды углерода (IV) и водорода, т. е. углекислый газ и вода, при этом выделяется много тепла:
- CH4 + 2O2 → CO2 + 2H2O
- C2H4 + 3O2 → 2CO2 + 2H2O
- 2C2H2 + 5O2 → 4CO2 + 2H2O (в уравнении с ацетиленом перед формулой ацетилена ставим коэффициент 2, чтобы число атомов кислорода в правой части было чётным)
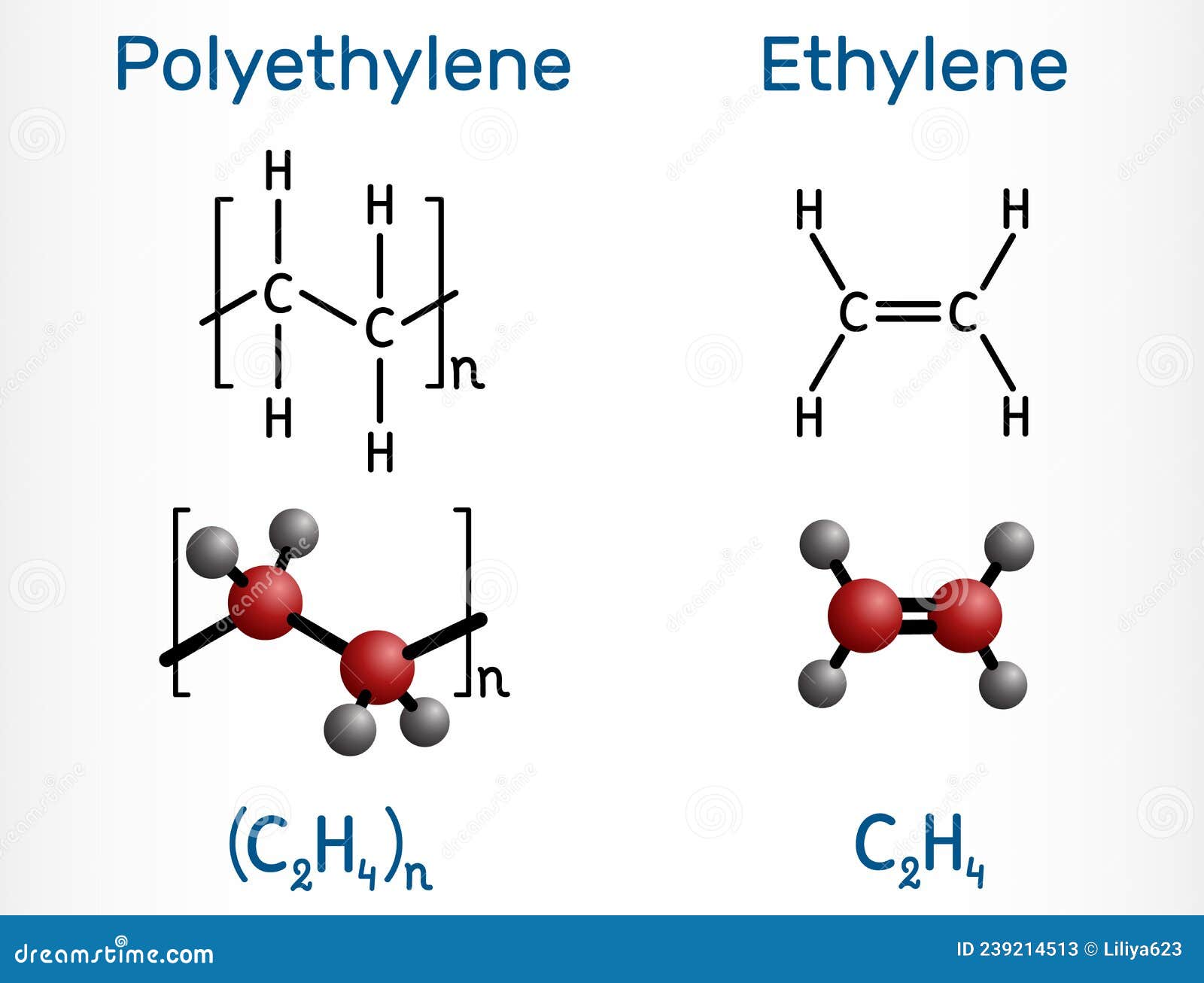
Большое практическое значение имеет реакция полимеризации этилена — соединение большого числа молекул с образованием макромолекул полимера — полиэтилена. Связи между молекулами образуются за счет разрыва одной из связей двойной связи. В общем виде это можно записать так:
nCH2 = CH2 → (- CH2 – CH2 -)n
где n — число соединившихся молекул, называемое степенью полимеризации. Реакция происходит при повышенном давлении и температуре, в присутствии катализатора.
Из полиэтилена изготавливают пленку для парников, покрышки для банок и пр.
Образование бензола из ацетилена тоже относят к реакциям полимеризации:
3C2H2 → C6H6
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-33.htm




