Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.

Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.

Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.

- Получение
- В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
- H2S + O2 = S + H2O (недостаток кислорода)
- SO2 + C = (t) S + CO2
- Серу можно получить разложением пирита
- FeS2 = (t) FeS + S
- В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
- H2S + H2SO4 = S + H2O
- Химические свойства
- Реакции с неметаллами
- S + O2 = (t) SO2
- S + F2 = SF6
- S + Cl2 = (t) SCl2
- S + C = (t) CS2
- Реакции с металлами
- При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
- K + S = (t) K2S
- Al + S = Al2S3
- Fe + S = (t) FeS
- Реакции с кислотами
- При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
- S + H2SO4 = (t) SO2 + H2O
- S + HNO3 = (t) H2SO4 + NO2 + H2O
- Реакции с щелочами
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.

Сера вступает в реакции диспропорционирования с щелочами.
S + KOH = (t) K2S + K2SO3 + H2O

Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).

- Получение
- Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
- Al2S3 + H2O = (t) Al(OH)3↓ + H2S↑
- FeS + HCl = FeCl2 + H2S↑

Химические свойства
- Кислотные свойства
- MgO + H2S = (t) MgS + H2O
- KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
- 2KOH + H2S = K2S + 2H2O
- Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
- Ca + H2S = (t) CaS + H2
- Восстановительные свойства
- H2S + O2 = H2O + S (недостаток кислорода)
- H2S + O2 = H2O + SO2 (избыток кислорода)
- H2S + HClO3 = H2SO4 + HCl
- Качественная реакция
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
Сероводород — сильный восстановитель (сера в минимальной степени окисления S2-). Горит в кислороде синим пламенем, реагирует с кислотами.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
H2S + Pb(NO3)2 = PbS↓ + HNO3
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).

- Получение
- В промышленных условиях сернистый газ получают обжигом пирита.
- FeS2 + O2 = (t) FeO + SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
- K2SO3 + H2SO4 = (t) K2SO4 + H2O + SO2↑
- Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
- Cu + H2SO4(конц.) = (t) CuSO4 + SO2 + H2O
- Кислотные свойства
- С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
- K2O + SO2 = K2SO3
- NaOH + SO2 = NaHSO3
- 2NaOH + SO2 = Na2SO3 + H2O
- Восстановительные свойства
- Как окислитель
- В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
- CO + SO2 = CO2 + S
- H2S + SO2 = S + H2O

Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже. Fe2(SO4)3 + SO2 + H2O = FeSO4 + H2SO4 SO2 + O2 = (t, кат. — Pt) SO3
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
- Получение
- SO2 + H2O ⇄ H2SO3
- Химические свойства
- Диссоциация
- Диссоциирует в водном растворе ступенчато.
- H2SO3 = H+ + HSO3-
- HSO3- = H+ + SO32-
- Кислотные свойства
- В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
- CaO + H2SO3 = CaSO3 + H2O
- H2SO3 + 2KOH = 2H2O + K2SO3 (соотношение кислота — основание, 1:2)
- H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
- Окислительные свойства
- Восстановительные свойства
С сильными восстановителями сернистая кислота принимает роль окислителя.
H2SO3 + H2S = S↓ + H 2O
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
H2SO3 + Br2 = H2SO4 + HBr
Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
- Получение
- В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
- SO2 + O2 = (кат) SO3
- В лабораторных условиях разложением солей серной кислоты — сульфатов.
- Fe2(SO4)3 = (t) SO3 + Fe2O3
- Химические свойства
- Кислотные свойства
- SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
- SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
- SO3 + Ca(OH)2 = CaSO4 + H2O
- Окислительные свойства
- SO3 + P = SO2 + P2O5
- SO3 + H2S = SO2 + H2O
- SO3 + KI = SO2 + I2 + K2SO4
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + Li2O = Li2SO4 SO3 + H2O = H2SO4
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
Источник: https://studarium.ru/article/173
Сера. Сероводород
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII – XIV вв., после появления пороха и огнестрельного оружия. Главным поставщиком серы была Италия.
 Кристаллы природной серы
Кристаллы природной серы
В наши дни сера используется как сырьё для производства серной кислоты, пороха, при вулканизации каучука, в органическом синтезе, а также для борьбы с вредителями сельского хозяйства. Порошок серы применяют в медицине в качестве наружного дезинфицирующего средства.
Сера образует несколько аллотропных модификаций. Устойчивая при комнатной температуре ромбическая сера представляет собой жёлтый порошок, нерастворимый в воде. При кристаллизации из хлороформа CHCl3 или из сероуглерода CS2 она выделяется в виде прозрачных кристаллов октаэдрической формы.
ромбическая сера состоит из циклических молекул S8, имеющих форму короны. При 113 оС она плавится, превращаясь в жёлтую легкоподвижную жидкость. При дальнейшем нагревании расплав загустевает, так как в нем образуются цепочки. А если нагреть серу до 445 оС, она закипает.
Выливая кипящую серу струйкой в холодную воду, можно получить пластическую серу – резиноподобную модификацию, состоящую из полимерных цепочек. При медленном охлаждении расплава образуются игольчатые кристаллы моноклинной серы (tпл = 119 оС). Подобно ромбической сере, эта модификация состоит из молекул S8.
При комнатной температуре пластическая и моноклинная сера неустойчивы и самопроизвольно превращаются в порошок ромбической серы.
Нахождение в природе
 Минерал пирит
Минерал пирит
В природе сера находится как в свободном состоянии, так и в виде соединений. Важнейшие из них следующие: FeS2 – пирит; или железный (серный) колчедан, CuS – медный блеск, Ag2S – серебряный блеск, PbS – свинцовый блеск. Сера часто встречается в виде сульфатов: гипса – CaSO4 ∙2H2O; мирабилита, или глауберовой соли Na2SO4∙10H2O; горькой (английской) соли MgSO4 ∙ 7H2O и др. Сера входит в состав нефти, каменного угля, содержится в растительных и животных организмах (в составе белков).
Получение
 Кристаллизация серы в вулканическом озере
Кристаллизация серы в вулканическом озере
- Серу, содержащуюся в свободном состоянии (в виде включений) в горных породах, выплавляют из них в специальных аппаратах – автоклавах.
- В лабораторных условиях свободную серу можно получить, например, при сливании растворов сероводородной и сернистой кислот, при неполном сгорании сероводорода:
- H2SO3 + 2H2S = 3S + 3H2O
- 2H2S + O2 = 2H2O + 2S
Химические свойства серы
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует.
Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами имеющими меньшую ЭО).
Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам и кислотам – окислителям).
Взаимодействие серы с простыми веществами
Взаимодействие серы с цинком
- Сера реагирует как окислитель:
- а) с металлами:
- 2Na + S = Na2S
- Mg + S = MgS
- 2Al + 3S = Al2S3
- б) с углеродом:
- C + 2S = CS2
- в) с фосфором:
- 2P + 3S = P2S3
- г) с водородом:
- H2 + S = H2S
- как восстановитель:
- а) с кислородом:
- S + O2 = SO2
- б) с хлором:
- S + Cl2 = SCl2
- в) с фтором:
- S + 3F2 = SF6
- Взаимодействие серы со сложными веществами
 Реакция серы с хлоратом натрия и хлоридом меди (II)
Реакция серы с хлоратом натрия и хлоридом меди (II)
- а) в воде сера не растворяется и даже не смачивается водой;
- б) как восстановитель сера взаимодействует с кислотами-окислителями (HNO3, H2SO4) при нагревании:
- S + 2H2SO4 = 3SO2↑ + 2H2O
- S + 2HNO3 = H2SO4 + 2NO↑
- S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O
- в) проявляя свойства и окислителя, и восстановителя, сера вступает в реакции диспропорционирования (самоокисления-самовосстановления) с растворами щелочей при нагревании:
- 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Сероводород и сероводородная кислота
Сера с водородом образует летучее соединение – сероводород H2S. Сероводород – это бесцветный газ с неприятным запахом тухлых яиц, ядовит. В природе сероводород образуется при гниении белковых веществ, содержится в воде минеральных источников. При комнатной температуре в одном объеме воды растворяется 2,5 объёма сероводорода.
Кислотно – основные свойства
Раствор сероводорода в воде – сероводородная вода – является слабой двухосновной кислотой. Сероводородная вода имеет все общие свойства кислот. Она реагирует с: а) основными оксидами, б) основаниями, в) солями, г) металлами:
- а) H2S + CaO = CaS + H2O
- б) H2S + NaOH = NaHS + H2O
- в) CuSO4 + H2S = CuS↓ + H2SO4
- г) Ca + H2S = CaS + H2↑
Качественной реакцией на сероводородную кислоту и ее растворимые соли (т.е. на сульфид-ион S2-) является взаимодействие их с растворимыми солями свинца. При этом выделяется осадок сульфида свинца (II) PbS черного цвета:
- Na2S + Pb(NO3)2 = PbS↓ + 2NaNO3
- Окислительно – восстановительные свойства
- В окислительно – восстановительных реакциях как газообразный сероводород, так и сероводородная кислота проявляют сильные восстановительные свойства, так как атом серы в H2S имеет низшую степень окисления – 2, а поэтому может только окисляться. Он легко окисляется:
 Горение сероводорода
Горение сероводорода
- а) кислородом воздуха:
- 2H2S + O2 = 2H2O + 2S (при недостатке О2)
- 2H2S + 3O2 = 2SO2 + 2H2O ( в избытке О2)
- б) бромной водой Br2:
- H2S + Br2 = 2HBr + S↓
- Бромная вода, имеющая желто-оранжевый цвет, при пропускании через нее сероводорода обесцвечивается;
- в) раствором перманганата калия KMnO4:
- 5H2S + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5S↓ + 8H2O
- При пропускании сероводорода через раствор перманганата калия происходит его обесцвечивание.
Сероводородная кислота окисляется не только сильными окислителями, такими как кислород, галогены, перманганат калия, но и более слабыми, например солями железа (III), сернистой кислотой и т.д.:
- 2FeCl3 + H2S = 2FeCl2 + S↓ + 2HCl
- H2SO3 + 2H2S = 3S↓ + 3H2O
- Применение
Сероводородная вода издавна применялся в медицине для лечения ревматизма и кожных заболеваний. Сероводород является одним из компонентов минеральных вод.
Скачать:
Скачать бесплатно реферат на тему: «Сера» Сера.docx (44 Загрузки)
Скачать рефераты по другим темам можно здесь
Источник: https://al-himik.ru/sera-serovodorod/
Сероводород. Свойства, опасность для человека, ПДК, токсикология, как образуется
Свойства, опасность для человека, ПДК, токсикология, как образуется.
 Сероводород H2S — наиболее активное из серосодержащих соединений. В нормальных условиях бесцветный газ с неприятным запахом тухлых яиц. Очень ядовит: острое отравление человека наступает уже при концентрациях 0,2–0,3 мг/л, концентрация выше 1 мг/л — смертельна. Сероводород хорошо растворим в воде. Диапазон взрывоопасных концентраций его смеси с воздухом достаточно широк и составляет от 4 до 45% об. При контакте с металлами (особенно если в газе содержится влага) вызывает сильную коррозию. Самый нежелательный компонент в газах нефтепереработки.
Сероводород H2S — наиболее активное из серосодержащих соединений. В нормальных условиях бесцветный газ с неприятным запахом тухлых яиц. Очень ядовит: острое отравление человека наступает уже при концентрациях 0,2–0,3 мг/л, концентрация выше 1 мг/л — смертельна. Сероводород хорошо растворим в воде. Диапазон взрывоопасных концентраций его смеси с воздухом достаточно широк и составляет от 4 до 45% об. При контакте с металлами (особенно если в газе содержится влага) вызывает сильную коррозию. Самый нежелательный компонент в газах нефтепереработки.
Опасность сероводорода для человека.
Сероводород – очень токсичный газ, действующий непосредственно на нервную систему. По шкале опасности он отнесён к 3 классу.
Обязательно учитывайте этот факт всякий раз, когда чувствуете его отчётливый запах.
Но что особенно опасно – так это свойство сероводорода притуплять обонятельный нерв, из-за чего человек просто перестаёт различать окружающие его ядовитые пары, и интоксикация может произойти внезапно.
Смертельная концентрация этого газа в воздухе очень мала – всего 0,1%. Такое количество сероводорода может привести человека к летальному исходу за 10 минут. Стоит лишь немного увеличить концентрацию – и смерть наступает мгновенно, после первого же вдоха. Для примера: в канализационной системе концентрация сероводорода иногда достигает 16%.
Наиболее заметные признаки сильного отравления сероводородом: отёк лёгких, судороги, паралич нервов, последующая кома. Если в атмосфере сероводород содержится в меньших количествах (от 0,02%), симптомы не столь фатальны, но очень неприятны: головокружение и головная боль, тошнота и быстрое привыкание к запаху «тухлых яиц».

Отравление сероводородом вылечить можно, если быстро принять необходимые меры: вывести пострадавшего на свежий воздух, обогатить его лёгкие кислородом, ввести сердечные и дыхательные аналептики, препараты железа, глюкозу, витамины.
ПДК (Предельно-допустимая концентрация)
ПДК сероводорода (H2S) в воздухе в рабочей зоне—10 мг/м3 (ГН 2.2.5.1313-03 Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны), в смеси с углеводородами —3 мг/м3.
Источник: https://vozdyx.ru/article/serovodorod/
Сероводородная кислота. Свойства, получение, применение и цена сероводородной кислоты
Если о человеке говорят, что он слаб, значит, пришла болезнь, или голод, в общем, невзгоды. В химии все иначе. Рассмотрим слабую сероводородную кислоту. Слаба она не потому, что готова распасться, погибнуть а, напротив, из-за нежелания диссоциировать.
Так именуют процесс растворения в воде, разделения на ион гидроксония и анион кислоты. Сероводородная диссоциирует всего на 0,011%, причем, в две стадии. На первой из них степень распада не превышает 0,005%.
Так что, кислота является вполне стойкой, «держит удар». Однако, это по человеческим меркам. В химии все иначе. Погрузимся в ее мир, продолжив изучение свойств сероводородной кислоты.
Свойства сероводородной кислоты
Стойкость героини статьи относительна. Не желая до конца растворяться в воде, соединение распадается под действием кислорода. Он окисляет сероводородную кислоту. Формула ее выглядит так: — Н2S. Н в ней – водород, S – сера. Так вот, последний элемент при окислении «вырывается» из формулы. Соединение распадается.
По сути, сероводородная кислота является водным раствором газа. Сероводород известен запахом тухлых яиц и ядовитостью. Цвета у вещества нет. Нет цвета и у индикаторных бумажек, побывавших в сероводородной кислоте. Свойство это – еще один указатель на слабость соединения. Сильные кислоты окрашивают лакмус в красные тона.
Характеристика сероводородной кислоты сводится не только к медленному растворению в воде. Прочие реакции с героиней статьи тоже проходят неторопливо. Применительно к человеческому характеру, это, скорее, лень, чем слабость.
С металлами, к примеру, сероводородный раствор реагирует нехотя. Объяснение тому – малая концентрация положительных ионов водорода. Их дефицит связан с малой степенью диссоциации кислоты.
Из металлов героиня статьи взаимодействует лишь с теми, которые в ряду напряжения стоят до Н2. Такие элементы способны вытеснять водород из раствора. Взаимодействие может привести к образованию соли сероводородной кислоты.
Она полностью нерастворима в воде. Реплика касается сульфидов. Это один из типов солей, образуемых при участии сероводородного соединения. Второй тип – гидросульфиды. Они образуются в ходе реакции с щелочными и щелочноземельными металлами, растворимы.
Вступая во взаимодействие со щелочноземельными металлами, сероводородная кислота реагирует и со щелочами. Героиня статьи выступает восстановителем, то есть, отдает электроны. Получается, свойства соединения типичны для кислот слабого типа.
Неоднозначно другое. Являясь раствором ядовитого сероводорода, героиня статьи опасна лишь относительно. За счет малой концентрации исходного вещества, кислота становится лекарством. Где и как его применяют, расскажем в следующей главе.
Применение сероводородной кислоты
Диссоциация сероводородной кислоты до раствора насыщенностью в тысячные процента позволяет использовать соединение для лечебных ванн. Их, как правило, организуют на местах выхода подземных вод, содержащих сероводород. Запах тухлых яиц терпят ради избавления от кожных недугов, реабилитации нервной системы, лечения бессонницы.
Ванны с сероводородной кислотой улучшают кровоток, а значит, благотворно влияют на весь организм. Быстрее передвигаясь по сосудам, кровь не застаивается, оперативнее снабжает органы необходимыми им элементами. Ускоряется обмен веществ, приводя к очищению от шлаков. На лицо общий эффект омоложения.
«На лицо» употреблено в прямом значении. Косметологи применяют раствор сероводорода для лифтинг-процедур. Кроме подтяжки кожи, можно избавиться от целлюлита и угревой сыпи. Локальное нанесение раствора имеет меньше противопоказаний, чем ванны.
Последние не рекомендованы при атеросклерозе, развитии опухолей, пороке сердца. Больным туберкулезом купания в сероводородной кислоте тоже лишь навредят, как и людям с заболеваниями почек и печени.
Медики замечают, что ванны с сероводородом не принимают в домашних условиях и, вообще, закрытых помещениях. Концентрация паров, исходящих от воды, может превысить допустимые нормы.
В санаториях бассейны стараются расположить под открытым небом. Источники горячие. Поэтому, купаться в них приятно даже зимой. Ряд сероводородных курортов есть, к примеру, вблизи города Северобайкальск.
Врачи, курирующие постояльцев, рекомендуют героиню статьи еще и в качестве лекарства от недугов мочеполовой системы. Правда, беременным и кормящим процедуры противопоказаны. Зато, тем, кто хочет стать родителем, ванны с сероводородом не повредят.

На западе страны сероводород образуется вдоль шельфа Черного моря. Правда, там соединение образуется на глубине около 150-ти метров, выходя пузырьками газа на мелководье.
Если временные процедуры в атмосфере газа приемлемы, то длительное вдыхание сероводорода ведет к угасанию способности чувствовать запахи. Это итог паралича обонятельного нерва.
Как распознать сероводородную кислоту в воздухе при малой концентрации, в отсутствии явного запаха? Поможет лишь соль свинца. Она тоже ядовита, но, иначе никак. В реактиве смачивают бумагу. В атмосфере с содержанием сероводорода хотя бы в 0,0000001% лист покроется черным налетом.
Получение сероводородной кислоты
Раз кислота является раствором сероводорода, стоит задаться вопросом его получения. Популярен способ использования соляной кислоты и сульфида железа. В качестве последнего берут природные минералы. Сульфидов железа в недрах планеты несколько. Самый известный, пожалуй, пирит. Его формула: — FeS2.
Реакция между сульфидом и кислотой бурная, с активным выделением газа. Соответственно, взаимодействие проводят в изолированных помещениях, используя защитные маски и одежды.
Промышленники чаще идут другим путем. Сероводород – побочный продукт многих производств. Остается лишь вытянуть вещество из промышленных газов, очистка которых, все равно, прямая обязанность предприятий.
Потом, сероводород растворяют в воде. Жидкость нагревают. Так диссоциация проходит успешнее. Героиня статьи готова к использованию, или продаже. Узнаем ценники.
Цена сероводородной кислоты
Поскольку в быту героиня статьи нужна лишь для водных процедур, форма продажи соединения сводится к наборам для сероводородных ванн. Пример: — средство «Мацеста». Продается в аптеках, как и прочие препараты группы.

«Мацеста» реализуется в пакетах, добавляется в ванну с водой температурой в 37-38 градусов Цельсия. Препарат тщательно размешивают и погружаются на 5-15 минут. Стоит удовольствие около 300-от рублей за пакет, то есть, одну процедуру.
Замечание об опасности принятия сероводородных ванн в домашних условиях никто не отменял. Но, производители перестраховываются, подбирая оптимальную, безопасную концентрацию. При ней, за 15 минут вред здоровью не нанести.
Для лабораторных нужд и промышленных производств нет смысла платить за воду с минимальной долей сероводорода. Удобнее организовать поставки сжиженного газа в баллонах и самим сделать кислоту. Товар специфический, спрос ограничен. Поэтому, предложений немного, а цена на баллоны с газом, как правило, договорная.
Источник: https://tvoi-uvelirr.ru/serovodorodnaya-kislota-svojstva-poluchenie-primenenie-i-cena-serovodorodnoj-kisloty/
Сероводород
При нагревании сера реагирует с водородом. Образуется ядовитый газ с резким запахом – сероводород. По-другому называется сернистым водородом, сульфидом водорода, дигидросульфидом.

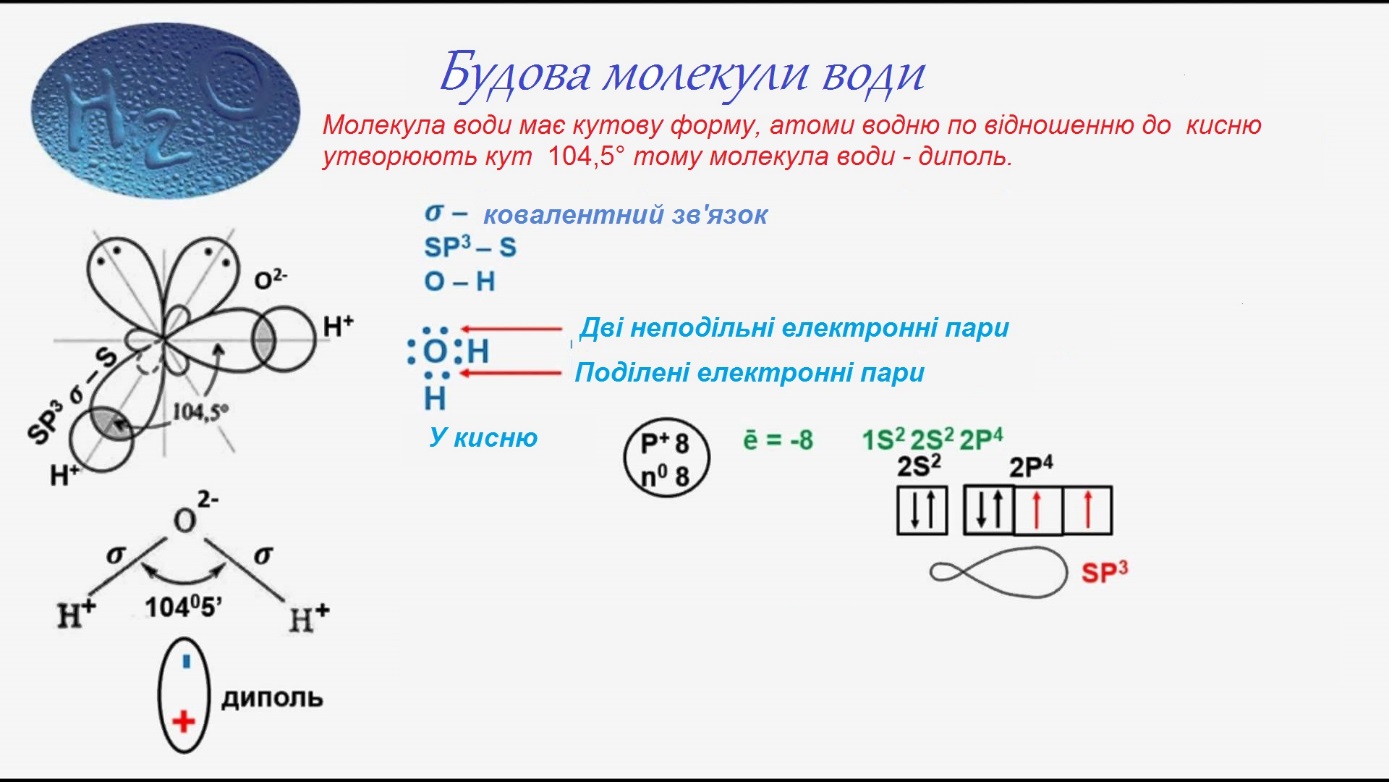
Сернистый водород – это бинарное соединение серы и водорода. Формула сероводорода – H2S. Строение молекулы аналогично строению молекулы воды. Однако сера образует с водородом не водородную, а ковалентную полярную связь. Это связано с тем, что в отличие от атома кислорода атом серы больше по объёму, имеет меньшую электроотрицательность и меньшую плотность заряда.
Рис. 1. Строение сероводорода.
Сульфид водорода встречается в природе редко. В небольших концентрациях входит в состав попутных, природных, вулканических газов. Моря и океаны содержат сероводород на больших глубинах. Например, сернистый водород находится на глубине 200 метров в Чёрном море. Кроме того, сероводород выделяется при гниении белков, содержащих серу.
В промышленности получают несколькими способами:
- реакцией кислот с сульфидами:
FeS + 2HCl → FeCl2 + H2S; - воздействием воды на сульфид алюминия:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S; - сплавлением серы с парафином:
С18Н38 + 18S → 18H2S + 18С.
Наиболее чистый газ получается при прямом взаимодействии водорода и серы. Реакция протекает при 600°С.
Дигидросульфид – бесцветный газ с запахом протухших яиц и сладковатым вкусом. Это ядовитое вещество, опасное в больших концентрациях. Благодаря молекулярному строению в обычных условиях сернистый водород не сжижается.
Общие физические свойства сернистого водорода:
- плохо растворяется в воде;
- проявляет свойства сверхпроводника при температуре -70°С и давлении 150ГПа;
- огнеопасен;
- растворяется в этаноле;
- сжижается при -60,3°С;
- превращается в твёрдое вещество при -85,6°С;
- плавится при -86°С;
- кипит при -60°С;
- разлагается на простые вещества (серу и водород) при 400°С.
При обычных условиях можно приготовить раствор сероводорода (сероводородную воду). Однако сернистый водород не вступает в реакцию с водой. На воздухе раствор быстро окисляется и мутнеет из-за выделения серы. Сероводородная вода проявляет слабые свойства кислоты.
Рис. 2. Сероводородная вода.
Сернистый водород – мощный восстановитель. Основные химические свойства вещества описаны в таблице.
| Реакция | Описание | Уравнение |
| С кислородом | Горит на воздухе голубым пламенем с образованием диоксида серы. При недостатке кислорода образуется сера и вода | – 2H2S + 4O2 → 2H2O + 2SO2; – 2H2S + O2 → 2S + 2H2O |
| С окислителями | Окисляется до диоксида серы или серы |
|
| Со щелочами | При избытке щёлочи образуются средние соли, при отношении 1:1 – кислые | – H2S + 2NaOH → Na2S + 2H2O; – H2S + NaOH → NaHS + H2O |
| Диссоциации | Ступенчато диссоциирует в растворе | – H2S ⇆ H+ + HS–; – HS– ⇆ H+ + S2- |
| Качественная | Образование чёрного осадка – сульфида свинца | H2S + Pb(NO3)2 → PbS↓ + 2HNO3 |
Рис. 3. Горение сероводорода.
Сернистый водород – токсичный газ, поэтому его применение ограниченно. Большая часть производимого сероводорода используется в промышленной химии для производства серы, сульфида, серной кислоты.
Из темы урока узнали о строении, получении и свойствах сероводорода или сернистого водорода. Это бесцветный газ с неприятным запахом. Является токсичным веществом. Образует сероводородную воду, не вступая во взаимодействие с водой.
В реакциях проявляет свойства восстановителя. Реагирует с кислородом воздуха, сильными окислителями (оксидами, кислородными кислотами), со щелочами. Диссоциирует в растворе в два этапа.
Сернистый водород используется в химической промышленности для изготовления производных веществ.
Средняя оценка: 4.4. Всего получено оценок: 85.
Источник: https://obrazovaka.ru/himiya/serovodorod.html
Сероводород
Сероводород (H₂S) представляет собой бесцветный газ c запахом тухлых яиц. По плотности он тяжелее водорода. Сероводород смертельно ядовит для человека и животных.
Даже незначительное его содержание в воздухе вызывает головокружение и тошноту, но самым страшным является то, что при длительном его вдыхании этот запах уже не ощущается.
Однако при отравлении сероводородом существует простое противоядие: следует завернуть в платок кусок хлорной извести, затем смочить, и какое-то время нюхать этот сверток.
Сероводород получают путем взаимодействия серы с водородом при температуре 350 °С:
H₂ + S → H₂S↑
Это окислительно-восстановительная реакция: в ходе нее изменяются степени окисления участвующих в ней элементов.
В лабораторных условиях сероводород получают воздействием на сульфид железа серной или соляной кислоты:
FeS + 2HCl → FeCl₂ + H₂S
Это реакция обмена: в ней взаимодействующие вещества обмениваются своими ионами. Данный процесс обычно проводят с помощью аппарата Киппа.
- При горении сероводорода образуется оксид серы 4 и водяной пар:
- 2H₂S + 3О₂ → 2Н₂О + 2SO₂
- H₂S горит голубоватым пламенем, а если над ним подержать перевернутый химический стакан, то на его стенках появится прозрачный конденсат (вода).
- Однако при незначительном понижении температуры данная реакция проходит несколько иначе: на стенках предварительно охлажденного стакана появится уже желтоватый налет свободной серы:
- 2H₂S + О₂ → 2Н₂О + 2S
- На этой реакции основан промышленный способ получения серы.
- При поджигании предварительно подготовленной газообразной смеси сероводорода и кислорода происходит взрыв.
- Реакция сероводорода и оксида серы(IV) также позволяет получить свободную серу:
- 2H₂S + SО₂ → 2Н₂О + 3S
Сероводород растворим в воде, причем три объема этого газа могут раствориться в одном объеме воды, образуя слабую и нестойкую сероводородную кислоту (Н₂S). Эту кислоту также называют сероводородной водой. Как видите, формулы газа-сероводорода и сероводородной кислоты записываются одинаково.
Если к сероводородной кислоте прилить раствор соли свинца, выпадет черный осадок сульфида свинца:
H₂S + Pb(NO₃)₂ → PbS + 2HNO₃
Это качественная реакция для обнаружения сероводорода. Она же демонстрирует способность сероводородной кислоты вступать в реакции обмена с растворами солей.
Таким образом, любая растворимая соль свинца является реактивом на сероводород.
Некоторые другие сульфиды металлов также имеют характерную окраску, например: сульфид цинка ZnS — белую, сульфид кадмия CdS — желтую, сульфид меди CuS — черную, сульфид сурьмы Sb₂S₃ — красную.
- Кстати, сероводород является нестойким газом и при нагревании практически полностью разлагается на водород и свободную серу:
- H₂S → Н₂ + S
- Сероводород интенсивно взаимодействует с водными растворами галогенов:
- H₂S + 4Cl₂ + 4H₂O→ H₂SO₄ + 8HCl
Сероводород в природе и жизнедеятельности человека
Сероводород входит в состав вулканических газов, природного газа и газов, сопутствующих месторождениям нефти. Много его и в природных минеральных водах, например, в Черном море он залегает на глубине от 150 метров и ниже.
Сероводород применяют:
- в медицине (лечение сероводородными ваннами и минеральными водами);
- в промышленности (получение серы, серной кислоты и сульфидов);
- в аналитической химии (для осаждения сульфидов тяжелых металлов, которые обычно нерастворимы);
- в органическом синтезе (для получения сернистых аналогов органических спиртов (меркаптанов) и тиофена (серосодержащего ароматического углеводорода).
Еще одно из недавно появившихся направлений в науке — сероводородная энергетика. Всерьез изучается получение энергии из залежей сероводорода со дна Черного моря.
Природа окислительно-восстановительных реакций серы и водорода
Реакция образования сероводорода является окислительно-восстановительной:
Н₂⁰ + S⁰→ H₂⁺S²⁻
Процесс взаимодействия серы с водородом легко объясняется строением их атомов. Водород занимает первое место в периодической системе, следовательно, заряд его атомного ядра равен (+1), а вокруг ядра атома кружится 1 электрон. Водород с легкостью отдает свой электрон атомам других элементов, превращаясь в положительно заряженный ион водорода — протон:
Н⁰ -1е⁻= Н⁺
Сера находится на шестнадцатой позиции в таблице Менделеева. Значит, заряд ядра ее атома равен (+16), и количество электронов в каждом атоме также 16е⁻.
Расположение серы в третьем периоде говорит о том, что ее шестнадцать электронов кружатся вокруг атомного ядра, образуя 3 слоя, на последнем из которых находится 6 валентных электронов.
Количество валентных электронов серы соответствует номеру группы VI, в которой она находится в периодической системе.
- Итак, сера может отдать все шесть валентных электронов, как в случае образования оксида серы(VI):
- 2S⁰ + 3O2⁰ → 2S⁺⁶O₃⁻²
- Кроме того, в результате окисления серы, 4е⁻могут быть отданы ее атомом другому элементу с образованием оксида серы(IV):
- S⁰ + О2⁰ → S⁺4 O2⁻²
- Сера может отдать также два электрона c образованием хлорида серы(II) :
- S⁰ + Cl2⁰ → S⁺² Cl2⁻
Во всех трех вышеуказанных реакциях сера отдает электроны. Следовательно, она окисляется, но при этом выступает в роли восстановителя для атомов кислорода О и хлора Cl.
Однако в случае образования H2S окисление — удел атомов водорода, поскольку именно они теряют электроны, восстанавливая внешний энергетический уровень серы с шести электронов до восьми.
В результате этого каждый атом водорода в его молекуле становится протоном:
- Н2⁰-2е⁻ → 2Н⁺,
- а молекула серы, наоборот, восстанавливаясь, превращается в отрицательно заряженный анион (S⁻²):
S⁰ + 2е⁻ → S⁻² - Таким образом, в химической реакции образования сероводорода окислителем выступает именно сера.
- С точки зрения проявления серой различных степеней окисления, интересно и еще одно взаимодействие оксида серы(IV) и сероводорода — реакция получения свободной серы:
- 2H₂⁺S-²+ S⁺⁴О₂-²→ 2H₂⁺O-²+ 3S⁰
Как видно из уравнения реакции, и окислителем, и восстановителем в ней являются ионы серы. Два аниона серы (2-) отдают по два своих электрона атому серы в молекуле оксида серы(II), в результате чего все три атома серы восстанавливаются до свободной серы.
2S-² — 4е⁻→ 2S⁰ — восстановитель, окисляется;
S⁺⁴ + 4е⁻→ S⁰ — окислитель, восстанавливается.
Источник: https://melscience.com/RU-ru/articles/serovodorod/
Соединения серы (II). Сероводород и сульфиды
Все водородные соединения подгруппы серы имеют молекулярную структуру и ковалентную полярную связь.
Химическое строение молекул H2S аналогично строению молекул Н2O: (угловая форма)
Но, в отличие от воды, молекулы H2S малополярны; водородные связи между ними не образуются; прочность молекул значительно ниже.
Физические свойства
При обычной температуре H2S — бесцветный газ с чрезвычайно неприятным удушливым запахом тухлых яиц, очень ядовитый (при концентрации > 3 г/м3 вызывает смертельное отравление). Сероводород тяжелее воздуха, легко конденсируется в бесцветную жидкость.H2S растворим в воде (при обычной температуре в 1 л H2O растворяется — 2,5 л газа).
Сероводород в природе
H2S присутствует в вулканических и подземных газах, в воде серных источников. Он образуется при гниении белков, содержащих серу, а также выделяется в процессе жизнедеятельности многочисленных микроорганизмов.
Способы получения
- 1. Синтез из простых веществ:
- S + Н2 = H2S
- 2. Действие неокисляющих кислот на сульфиды металлов:
- FeS + 2HCI = H2S↑ + FeCl2
3.Действие конц. H2SO4 (без избытка) на щелочные и щелочно-земельные Me:
- 5H2SO4(конц.) + 8Na = H2S↑ + 4Na2SO4 + 4H2О
- 4. Образуется при необратимом гидролизе некоторых сульфидов:
- AI2S3 + 6Н2О = 3H2S↑ + 2Аl(ОН)3↓
Химические свойства H2S
H2S — сильный восстановитель
Взаимодействие H2S с окислителями приводит к образованию различных веществ (S, SО2, H2SO4),
Реакции с простыми веществами окислителями
- Окисление кислородом воздуха
- 2H2S + 3О2(избыток) = 2SО2↑ + 2Н2О
- 2H2S + О2(недостаток) = 2S↓ + 2Н2О
- Окисление галогенами:
- H2S + Br2 = S↓ + 2НВr
Реакции с окисляющими кислотами (HNО3, H2SO4(конц.)
- 3H2S + 8HNО3(разб.) = 3H2SO4 + 8NO + 4Н2О
- H2S + 8HNО3(конц.) = H2SO4 + 8NО2↑ + 4Н2О
- H2S + H2SO4(конц.) = S↓ + SО2↑ + 2Н2О
Реакции с солями — окислителями
- 5H2S + 2KMnO4 + 3H2SO4 = 5S↓ + 2MnSO4 + K2SO4 + 8Н2О
- 5H2S + 6KMnO4 + 9H2SO4 = 5SО2 + 6MnSO4 + 3K2SO4 + 14Н2О
- H2S + 2FeCl3 = S↓ + 2FeCl2 + 2HCl
Водный раствор H2S проявляет свойства слабой кислоты
- Сероводородная кислота H2S 2-основная кислота диссоциирует ступенчато
- 1-я ступень: H2S → Н+ + HS-
- 2-я ступень: HS- → Н+ + S2-
- Для H2S в водном растворе характерны реакции, общие для класса кислот, в которых она ведет себя как слабая кислота.
Взаимодействует:
- а) с активными металлами
- H2S + Mg = Н2↑ + MgS
- б) с малоактивными металлами (Аg, Си, Нg) в присутствии окислителей
- 2H2S + 4Аg + O2 = 2Ag2S↓ + 2Н2O
- в) с основными оксидами
- H2S + ВаО = BaS + Н2O
- г) со щелочами
- H2S + NaOH(недостаток) = NaHS + Н2O
- д) с аммиаком
- H2S + 2NH3(избыток) = (NH4)2S
Особенности реакций H2S с солями сильных кислот
- Несмотря на то, что сероводородная кислота — очень слабая, она реагирует с некоторыми солями сильных кислот, например:
- CuSO4 + H2S = CuS↓ + H2SO4
- Реакции протекают в тех случаях, если образующийся сульфид Me нерастворим не только в воде, но и в сильных кислотах.
Качественная реакция на сульфид-анион
- Одна из таких реакций используется для обнаружения анионов S2- и сероводорода:
- H2S + Pb(NO3)2 = 2HNO3 + PbS↓ черный осадок.
- Газообразный H2S обнаруживают с помощью влажной бумаги, смоченной раствором Pb(NO3)2, которая чернеет в присутствии H2S.
Сульфиды
Сульфидами называют бинарные соединения серы с менее ЭО элементами, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
Наибольшее значение имеют сульфиды металлов, поскольку многие из них представляют собой природные соединения и используются как сырье для получения свободных металлов, серы, диоксида серы.
Обратимый гидролиз растворимых сульфидов
- Сульфиды щелочных Me и аммония хорошо растворимы в воде, но в водном растворе они подвергаются гидролизу в очень значительной степени:
- S2- + H2O → HS- + ОН-
- Поэтому растворы сульфидов имеют сильнощелочную реакцию
- Сульфиды щелочно-земельных Me и Mg, взаимодействуя с водой, подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
- 2CaS + 2НОН = Ca(HS)2 + Са(ОН)2
- При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
- HS- + H2O → H2S↑ + ОН-
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов подвергаются необратимому гидролизу и полностью разлагаются в водных растворах, например:
- Al2S3 + 6H2O = 3H2S↑ + 2AI(OH)3↓
- Аналогичным образом разлагаются Cr2S3, Fe2S3
Нерастворимые сульфиды
- Большинство сульфидов тяжелых металлов в воде практически не растворяются и поэтому гид
ролизу не подвергаются. Некоторые из них растворяются под действием сильных кислот, например: - FeS + 2HCI = FeCl2 + H2S↑
- ZnS + 2HCI = ZnCl2 + H2S↑
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
Окислительный обжиг сульфидов
- Окисление сульфидов кислородом воздуха при высокой температуре является важной стадией переработки
сульфидного сырья. Примеры: - 2ZnS + 3O2 = 2ZnO + 2SO2
- 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
Способы получения сульфидов
- 1. Непосредственное соединение простых веществ:
- Fe + S = FeS
- 2.Взаимодействие H2S с растворами щелочей:
- H2S + 2NaOH = 2H2O + Na2S сульфид натрия
- H2S + NaOH = H2O + NaHS гидросульфид натрия
- 3.Взаимодействие H2S или (NH4)2S с растворами солей:
- H2S + CuSO4 = CuS↓ + H2SO4
- H2S + 2AgNO3 = Ag2S↓ + 2HNO3
- 4. Восстановление сульфатов прокаливанием с углем:
- Na2SO4 + 4С = Na2S + 4СО
- Этот процесс используют для получения сульфидов щелочных и щелочно-земельных металлов.
Источник: http://examchemistry.com/content/lesson/neorgveshestva/serovodorod.html




