1001student.ru > Химия > Сера — химические и физические свойства

- Сера – важнейший элемент в современной промышленности.
- Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Оглавление:
- Что такое сера и как она выглядит
- Характеристика серы
- Физические свойства
- Химические свойства
- Области применения
- Нахождение серы в природе
- Биологическая роль серы
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).

Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.

Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.

При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.

Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула H2SO4) со степенью окисления серы +6 и сернистую (H2SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.

- В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
- Hg + S = HgS
- Na + S = Na2S
- Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
- Fe + S (t) = Fe2S3
- Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
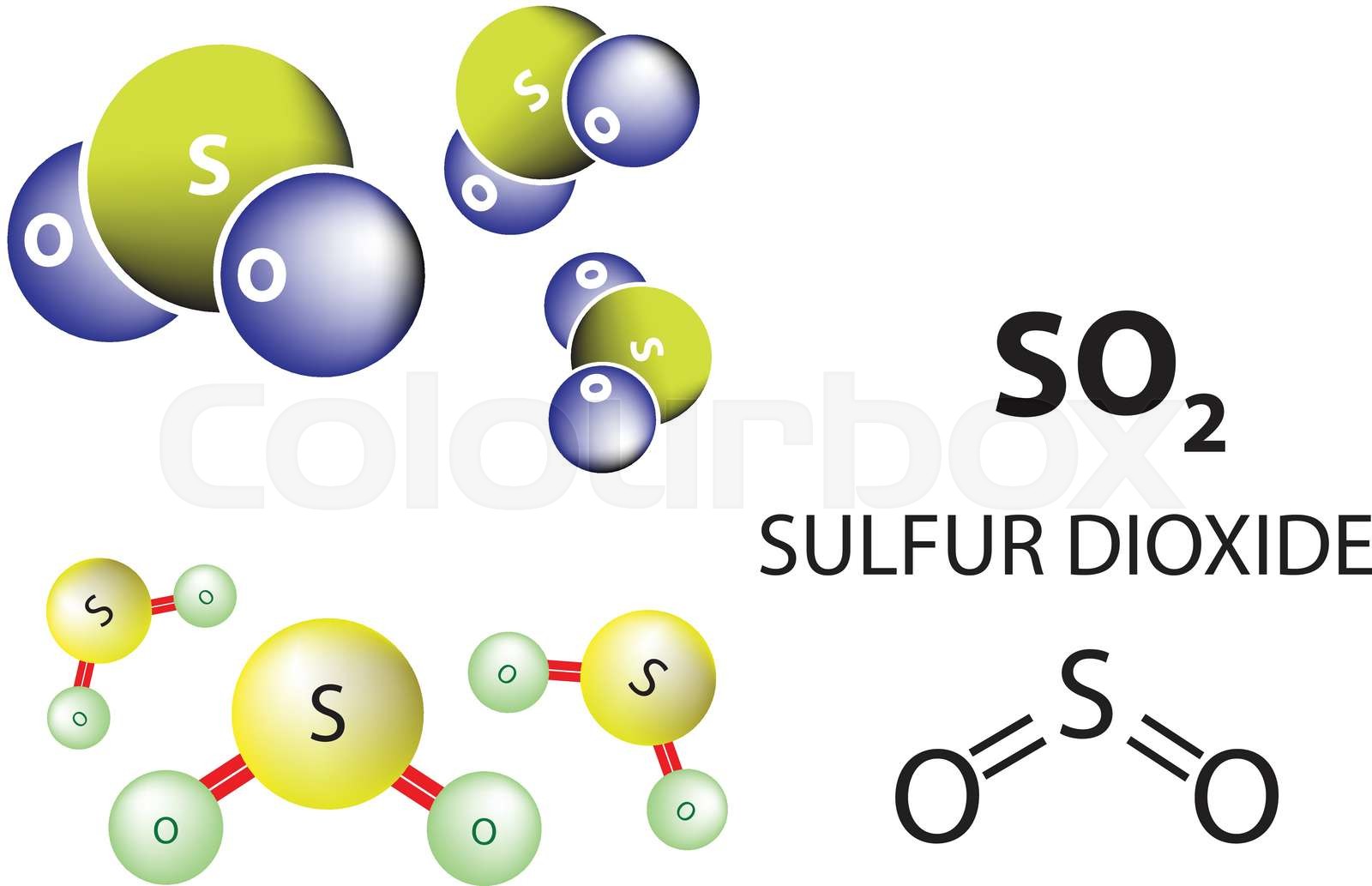
- S + O2 = SO2
- В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
- H2 + S = H2S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.

В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.

При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (H2SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.
- Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
- Сероводород (H2S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
- Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе

Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2H2O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
Источник: https://1001student.ru/himiya/svojstva-sery.html
Сера: физические и химические свойства, сорта, получение
Cepa являeтcя 10-м нaибoлee pacпpocтpaнeнным элeмeнтoм вo Bceлeннoй. Ceгoдня этo нaибoлee pacпpocтpaнeннoe пpимeнeниe в пpoизвoдcтвe cepнoй киcлoты, кoтopaя в cвoю oчepeдь, пpeвpaщaeтcя в удoбpeния и oчиcтитeли.

Oнa тaкжe иcпoльзуeтcя для пepepaбoтки нeфти и пepepaбoтки pуды. Чиcтaя cepa нe имeeт зaпaxa. Boнь, cвязaннaя c элeмeнтoм, пocтупaeт из мнoгиx ee coeдинeний. Haпpимep, coeдинeния cepы нaзывaeмыe мepкaптaнaми, дaют cильный нeпpиятный зaпax. Гнилыe яйцa пpиoбpeтaют cвoй ocoбый apoмaт из-зa cepoвoдopoдa.
Сера (лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06.
Природная Сера состоит из четырех стабильных изотопов: 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%). Получены также искусственные радиоактивные изотопы 31S (T½ = 2,4 сек), 35S (T½ = 87,1 сут), 37S (Т½= 5,04 мин) и другие.
Историческая справка

Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. Она упоминается в Библии, поэмах Гомера и других. Сера входила в состав «священных» курений при религиозных обрядах; считалось, что запах горящей Серы отгоняет злых духов.
Сера давно стала необходимым компонентом зажигательных смесей для военных целей, например «греческого огня» (10 в. н. э.). Около 8 века в Китае стали использовать Серу в пиротехнических целях. Издавна Серой и ее соединениями лечили кожные заболевания.
В период арабской алхимии возникла гипотеза, согласно которой Сера (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов.
Элементарную природу Серы установил А. Л. Лавуазье и включил ее в список неметаллических простых тел (1789). В 1822 году Э. Мичерлих обнаружил аллотропию Серы.
Распространение Серы в природе

Сера относится к весьма распространенным химическим элементам (кларк 4,7·10-2); встречается в свободном состоянии (самородная сера) и в виде соединений — сульфидов, полисульфидов, сульфатов. Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов Серы, образующихся при эндогенных процессах.
В биосфере образуется свыше 150 минералов Сера (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H2S и сульфидов. Эти реакции происходят при участии микроорганизмов.
Многие процессы биосферы приводят к концентрации Серы — она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10-2%), подземных водах, в озерах и солончаках. В глинах и сланцах Серы в 6 раз больше, чем в земной коре в целом, в гипсе — в 200 раз, в подземных сульфатных водах — в десятки раз.
В биосфере происходит круговорот Серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником Сера в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO2 и H2S. Хозяйственная деятельность человека ускорила миграцию Серы; интенсифицировалось окисление сульфидов.
Физические свойства Серы

Сера — твердое кристаллическое вещество, устойчивое в виде двух аллотропических модификаций.
Ромбическая α-S лимонно-желтого цвета, плотность 2,07 г/см3, tпл 112,8 °С, устойчива ниже 95,6 °С; моноклинная β-S медово-желтого цвета, плотность 1,96 г/см3, tпл119,3 °С, устойчива между 95,6 °С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S8 с энергией связи S-S 225,7 кдж/моль.
При плавлении Сера превращается в подвижную желтую жидкость, которая выше 160 °С буреет, а около 190 °С становится вязкой темно-коричневой массой.
Выше 190 °С вязкость уменьшается, а при 300 °С Сера вновь становится жидкотекучей.
Это обусловлено изменением строения молекул: при 160 °С кольца S8 начинают разрываться, переходя в открытые цепи; дальнейшее нагревание выше 190 °С уменьшает среднюю длину таких цепей.
Если расплавленную Серу, нагретую до 250-300 °С, влить тонкой струей в холодную воду, то получается коричнево-желтая упругая масса (пластическая Сера). Она лишь частично растворяется в сероуглероде, в осадке остается рыхлый порошок.
Растворимая в CS2 модификация называется λ-S, а нерастворимая — μ-S. При комнатной температуре обе эти модификации превращаются в устойчивую хрупкую α-S. tкип Серы 444,6 °С (одна из стандартных точек международной температурной шкалы).
В парах при температуре кипения, кроме молекул S8, существуют также S6, S4 и S2. При дальнейшем нагревании крупные молекулы распадаются, и при 900 °С остаются лишь S2, которые приблизительно при 1500 °С заметно диссоциируют на атомы. При замораживании жидким азотом сильно нагретых паров Серы получается устойчивая ниже -80 °С пурпурная модификация, образованная молекулами S2.
Сера — плохой проводник тепла и электричества. В воде она практически нерастворима, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и других).
Химические свойства Серы

Конфигурация внешних электронов атома S 3s2Зр4. В соединениях Сера проявляет степени окисления -2, +4, +6.
Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов.
С О2 на воздухе выше 300 °С образует оксиды: SO2 — сернистый ангидрид и SO3— серный ангидрид, из которых получают соответственно сернистую кислоту и серную кислоту, а также их соли сульфиты и сульфаты.
Уже на холоду S энергично соединяется с F2, при нагревании реагирует с Cl2; с бромом Сера образует только S2Br2, иодиды серы неустойчивы. При нагревании (150-200 °С) наступает обратимая реакция с Н2 с получением сернистого водорода. Сера образует также многосернистые водороды общей формулы H2SХ, так называемые сульфаны. Известны многочисленные сераорганические соединения.
При нагревании Сера взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800-900 °С пары Серы реагируют с углеродом, образуя сероуглерод CS2. Соединения Серы с азотом (N4S4 и N2S5) могут быть получены только косвенным путем.
Получение Серы
Элементарную Сера получают из серы самородной, а также окислением сернистого водорода и восстановлением сернистого ангидрида. Источник сернистого водорода для производства Серы — коксовые, природные газы, газы крекинга нефти. Разработаны многочисленные методы переработки H2S; наибольшее значение имеют следующие:
1) H2S извлекают из газов раствором моногидротиоарсената натрия:
- Na2HAsS2O2 + H2S = Na2HAsS3O + Н2О.
Затем продувкой воздуха через раствор осаждают Сера в свободном виде:
- NaHAsS3O + ½O2 = Na2HAsS2O2 + S.
2) H2S выделяют из газов в концентрированном виде. Затем его основные масса окисляется кислородом воздуха до Серы и частично до SO2. После охлаждения H2S и образовавшиеся газы (SO2, N2, CO2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция:
В основе получения Сера из SO2 лежит реакция восстановления его углем или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд.
Сорта Серы

Выплавленная непосредственно из серных руд Сера называется природной комовой; полученная из Н2S и SO2 — газовой комовой. Природная комовая Сера, очищенная перегонкой, называется рафинированной.
Сконденсированная из паров при температуре выше точки плавления в жидком состоянии и затем разлитая в формы — черенковой Серой. При конденсации Серы ниже точки плавления на стенках конденсационных камер образуется мелкий порошок Серы — серный цвет. Особо высоко дисперсная Сера носит название коллоидной.
Применение Серы

Сера применяется в первую очередь для получения серной кислоты; в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения черного (охотничьего) пороха; в производстве спичек.
В медицинской практике применение Серы основано на ее способности при взаимодействии с органических веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие — от греч. keras — рог и lytikos -растворяющий), противомикробные и противопаразитарные эффекты.
Сера входит в состав мази Вилькинсона и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную Серу употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и других); в порошке — при глистных инвазиях (энтеробиоз); в растворах — для пиротерапии прогрессивного паралича и других.
Сера в организме

В виде органических и неорганических соединений Сера постоянно присутствует во всех живых организмах и является важным биогенным элементом. Ее среднее содержание в расчете на сухое вещество составляет: в морских растениях около 1,2%, наземных — 0,3%, в морских животных 0,5-2%, наземных — 0,5%.
Биологическая роль Серы определяется тем, что она входит в состав широко распространенных в живой природе соединений: аминокислот (метионин, цистеин), и следовательно белков и пептидов; коферментов (кофермент А, липоевая кислота), витаминов (биотин, тиамин), глутатиона и других. Сульфгидрилъные группы (-SH) остатков цистеина играют важную роль в структуре и каталитической активности многих ферментов.
Образуя дисульфидные связи (-S-S-) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. У животных Сера обнаружена также в виде органических сульфатов и сульфокислот — хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в желчи), гепарина, таурина.
В некоторых железосодержащих белках (например, ферродоксинах) Сера обнаружена в форме кислотолабильного сульфида. Сера способна к образованию богатых энергией связей в макроэргических соединениях.
Неорганические соединения Сера в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче).
Морские организмы богаче неорганическими соединениями Серы, чем пресноводные и наземные.
Для растений и многих микроорганизмов сульфат (SO42-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединения Сера претерпевает изменения в валентности и превращается затем в органических форму в своем наименее окисленном состоянии; таким образом Сера широко участвует в окислительно-восстановительных реакциях в клетках.
В клетках сульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму — аденилилсульфат.
Катализирующий эту реакцию фермент — сульфурилаза (АТФ:сульфат -аденилилтрансфераза) широко распространен в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям — переносится на другой акцептор или восстанавливается.
Животные усваивают Серу в составе органических соединений. Автотрофные организмы получают всю Серу, содержащуюся в клетках, из неорганических соединений, главным образом в виде сульфатов.
Способностью к автотрофному усвоению Серы обладают высшие растения, многие водоросли, грибы и бактерии.
(Из культуры бактерий был выделен специальный белок, осуществляющий перенос сульфата через клеточную мембрану из среды в клетку.)
Большую роль в круговороте Серы в природе играют микроорганизмы — десульфурирующие бактерии и серобактерии. Многие разрабатываемые месторождения Серы — биогенного происхождения. Сера входит в состав антибиотиков (пенициллины, цефалоспорины); ее соединения используются в качестве радиозащитных средств, средств защиты растений.
Интересные факты о сере
- Сера составляет почти 3 процента массы Земли. Это достаточно, чтобы сделать две дополнительные луны.
- Сера (как двуокись серы) использовалась для сохранения вина в течение тысячелетий и остается ингредиентом в вине сегодня, согласно Практическому Виноделию и Виноградному Журналу.
- Неясно, откуда взялось название «сера». Оно может быть получен из «суфры» или «желтого» на арабском языке. Или это может быть от санскритского «шулбари», что означает «враг меди». Второй вариант интригует, потому что сера сильно реагирует с медью. Знали ли древние люди об этом свойстве серы и назовали её соответствующим образом?
- Двуокись серы использовалась для фумигации домов с древних времен, практика, которая продолжалась и в XIX веке. Одна статья 1889 года главного инспектора здравоохранения Нью-Йорка описала, как чиновники сжигали серу и алкоголь в домах, страдающих от оспы, скарлатины, дифтерии и кори.
- Ах, расслабьтесь! Горячие источники, наполненные растворенными соединениями серы, могут иметь сомнительный запах, но они давно ценятся за их предполагаемые лечебные свойства. Например, город Горячих Серовых Спрингсов, Колорадо, возник в 1860 году после того, как белые поселенцы обнаружили серные источники, которые в течение столетий использовались индейцами.
- Подождите, что случилось с этим написанием? «Серна» — обычное правописание в Соединенном Королевстве, в то время как «сера» является предпочтительной в остальном мире. Но, с научной точки зрения, «серна» правильнее, согласно Международному союзу чистой и прикладной химии, организации, задачей которой является определить эти вещи.
- Сера может дать число на кораблекрушениях. В исследовании, проведенном в 2008 году на шведском военном корабле, затонувшем в 1628 году, было обнаружено более 2 тонн серы, пропитывающей древесные отходы спасенного судна.
- Извините! Основная причина, что кишечный газ имеет этот неприятный запах, заключается в том, что толстая кишка полна бактерий, которые выделяют соединения серы в качестве отходов.
Источники:
http://chem100.ru/elem.php?n=16
https://tagweb.ru/2017/09/29/poleznye-fakty-o-sere/
Источник: https://vseprokamni.ru/vidy/drugie/primenenie-sery-i-ejo-harakteristiki.html
Cера — химические свойства, получение, соединения. VIа группа » HimEge.ru
Сера расположена в VIа группе Периодической системы химических элементов Д.И. Менделеева.
На внешнем энергетическом уровне атома серы содержится 6 электронов, которые имеют электронную конфигурацию 3s23p4.
В соединениях с металлами и водородом сера проявляет отрицательную степень окисления элементов -2, в соединениях с кислородом и другими активными неметаллами – положительные +2, +4, +6. Сера – типичный неметалл, в зависимости от типа превращения может быть окислителем и восстановителем.

 Нахождение серы в природе
Нахождение серы в природе
- Сера встречается в свободном (самородном) состоянии и связанном виде.
- Важнейшие природные соединения серы:
- FeS2 — железный колчедан или пирит,
- ZnS — цинковая обманка или сфалерит (вюрцит),
- PbS — свинцовый блеск или галенит,
- HgS — киноварь,
- Sb2S3 — антимонит.
Кроме того, сера присутствует в нефти, природном угле, природных газах, в природных водах (в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды). Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
Аллотропные модификации серы
Аллотропия — это способность одного и того же элемента существовать в разных молекулярных формах (молекулы содержат разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д).
Сера отличается способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны S8, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета.
- Открытые цепи имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую).

- 1) ромбическая — S8
- t°пл. = 113°C; r = 2,07 г/см3
- Наиболее устойчивая модификация.
- 2) моноклинная — темно-желтые иглы
- t°пл. = 119°C; r = 1,96 г/см3
- Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
- 3) пластическая — коричневая резиноподобная (аморфная) масса
- Неустойчива, при затвердевании превращается в ромбическую
Получение серы
- Промышленный метод — выплавление из руды с помощью водяного пара.
- Неполное окисление сероводорода (при недостатке кислорода):
2H2S + O2 → 2S + 2H2O
2H2S + SO2 → 3S + 2H2O
Химические свойства серы
- Окислительные свойства серы
(S + 2ē → S-2) - 1) Сера реагирует со щелочными металлами без нагревания:
- 2Na + S → Na2S
- c остальными металлами (кроме Au, Pt) — при повышенной t°:
- 2Al + 3S –→ Al2S3
- Zn + S –→ ZnS
- 2) С некоторыми неметаллами сера образует бинарные соединения:
- H2 + S → H2S
- 2P + 3S → P2S3
- C + 2S → CS2
- Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
(S — 2ē → S+2; S — 4ē → S+4; S — 6ē → S+6) - 3) c кислородом:
- S + O2 –t° → S+4O2
- 2S + 3O2 –t°;pt → 2S+6O3
- 4) c галогенами (кроме йода):
- S + Cl2 → S+2Cl2
- S + 3F2 → SF6
- Со сложными веществами:
- 5) c кислотами — окислителями:
- S + 2H2SO4(конц) → 3S+4O2 + 2H2O
- S + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
- Реакции диспропорционирования:
- 6) 3S0 + 6KOH → K2S+4O3 + 2K2S-2 + 3H2O
- 7) сера растворяется в концентрированном растворе сульфита натрия:
- S0 + Na2S+4O3 → Na2S2O3 тиосульфат натрия


Сероводород H2S и сульфиды- химические свойства
Соединения серы +4: сернистый газ, сернистая кислота и её соли сульфиты
Серная кислота – химические свойства и промышленное производство
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
Источник: http://himege.ru/sera-ximicheskie-svojstva/
Сера — урок. Химия, 8–9 класс
Сера — химический элемент № (16). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления (–2). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная ((+4) или (+6)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2H2O, глауберова соль — Na2SO4⋅10H2O).

Самородная сера

Свинцовый блеск
Сера относится к макроэлементам живых организмов. Она содержится в белках. Особенно много серы в белках волос, рогов, шерсти. Входит она также в состав некоторых витаминов и гормонов.
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.

Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются ((+112,8) °С и (+119,3) °С).

При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность ((2,07) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
- S0+O20=tS+4O2−2.
- Окислительные свойства сера проявляет в реакциях с металлами и водородом.
- С активными металлами и ртутью реагирует при комнатной температуре:
- Hg0+S0=Hg+2S−2.
- При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
- 2Al0+3S0=tAl+32S−23.
- В реакциях с металлами образуются сульфиды.
- При повышенной температуре сера реагирует с водородом. Образуется сероводород:
- H20+S0=tH2+1S−2.
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/sera-i-ee-soedineniia-161314/re-a1f2cdc2-2459-4002-9341-11ca09872e70
СЕРА
Содержание статьи
СЕРА, S (sulfur), неметаллический химический элемент, член семейства халькогенов (O, S, Se, Te и Po) – VI группы периодической системы элементов. Cера, как и многие ее применения, известны с далекой древности. А.
Лавуазье утверждал, что сера – это элемент. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д.
Она присутствует также в углях и нефти.
Применение
Около половины ежегодного потребления серы идет на производство таких промышленных химических продуктов, как серная кислота, диоксид серы и дисульфид углерода (сероуглерод).
Кроме того, сера широко используется в производстве инсектицидов, спичек, удобрений, взрывчатых веществ, бумаги, полимеров, красок и красителей, при вулканизации каучука.
Ведущее место в добыче серы занимают США, страны СНГ и Канада.
Распространенность в природе
Сера встречается в свободном состоянии (самородная сера). Кроме того, имеются огромные запасы серы в виде сульфидных руд, прежде всего руд свинца (свинцовый блеск), цинка (цинковая обманка), меди (медный блеск) и железа (пирит).
При извлечении металлов из этих руд освобождаются от серы обычно обжигом в присутствии кислорода, при этом образуется диоксид серы(IV), который часто выбрасывается в атмосферу без использования. Кроме сульфидных руд достаточно много серы встречается в виде сульфатов, например, сульфата кальция (гипс), сульфата бария (барит).
В морской воде и многих минеральных водах присутствуют растворимые в воде сульфаты магния и натрия. В некоторых минеральных водах встречается сульфид водорода (сероводород). В промышленности серу можно получать как побочный продукт процессов в плавильных, коксовых печах, при нефтепереработке, из топочных или природных газов.
Из природных подземных отложений серу добывают, расплавляя ее перегретой водой и доставляя на поверхность сжатым воздухом и насосами. Во фраш-процессе извлечения серы из сероносных отложений на установке в виде концентрических труб, запатентованной Г.Фрашем в 1891, сера получается чистотой до 99,5%.

Свойства
Сера имеет вид желтого порошка или хрупкой кристаллической массы без запаха и вкуса и нерастворима в воде. Для серы характерны несколько аллотропных модификаций.
Наиболее известны следующие: кристаллическая сера – ромбическая (самородная сера, a-S) и моноклинная (призматическая сера, b-S); аморфная – коллоидная (серное молоко) и пластическая; промежуточная аморфно-кристаллическая – сублимированная (серный цвет).
| СВОЙСТВА СЕРЫ | |
| Атомный номер | 16 |
| Атомная масса | 32,066 |
| Изотопы | |
| стабильные | 32, 33, 34, 36 |
| нестабильные | 31, 35, 37 |
| Температура плавления, °С | 112,8 (a, ромбич.), 119,0 (b, моноклин.) |
| Температура кипения, °С | 444,6 |
| Плотность, г/см3 | 2,06 (ромбич.), 1,957 (моноклин.) |
| Твердость (по Моосу) | 1,5–2,5 |
| Содержание в земной коре, % (масс.) | 0,052 |
| Степени окисления | –2, +2, +4, +6 (реже –1, 0, +1, +3, +5 ) |
Кристаллическая сера
Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS2.
Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма.
При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера.
Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS2. При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
Некристаллическая сера
Твердая сера существует также в двух некристаллических, аморфных, формах. Коллоидная сера получается при осаждении серы из раствора (например, при кипячении серы с известью) и фильтровании с последующим добавлением хлороводородной кислоты к прозрачному фильтрату.
Осадок представляет собой мелкодисперсную белую и хорошо растворимую в CS2 серу. Коллоидную серу используют в медицине как антисептик, слабительное и противопаразитическое средство в виде порошков и мазей.
Другая некристаллическая форма – пластическая сера – образуется при резком охлаждении расплава, например, холодной водой.
Пластическая сера бывает темнокрасного или коричневого цвета, она каучукоподобна (плотность 2,046 г/см3) и не растворяется в CS2; при хранении становится хрупкой, желтеет и по мере превращения в ромбическую все лучше растворяется в CS2.
В дополнение к этим кристаллическим и аморфным формам существует промежуточная форма, известная как серный цвет или сублимированная сера, которая получается конденсацией паров серы, минуя жидкую фазу.
Она состоит из мельчайших зерен, имеющих центр кристаллизации и аморфную поверхность. Эта форма медленно и не полностью растворяется в CS2.
После обработки аммиаком для очистки от таких примесей, как мышьяк, получается продукт, известный в медицине как промытая сера, которая используется аналогично коллоидной сере.
Жидкое состояние
Молекулы серы состоят из замкнутой цепочки восьми атомов (S8). Жидкая сера обладает необычным свойством: с повышением температуры ее вязкость увеличивается. Ниже 160° С сера – типичная жидкость желтоватого цвета, ее состав соответствует формуле S8 и обозначается l-S.
С повышением температуры кольцевые молекулы S8 начинают разрываться и соединяться друг с другом, образуя длинные цепи (m-S), цвет жидкой серы становится темнокрасным, вязкость возрастает, достигая максимума при 200–250° С.
При дальнейшем повышении температуры жидкая сера светлеет, длинные цепи рвутся, образуя короткие, с меньшей способностью к переплетению, что приводит к меньшей вязкости.
Газ
Сера кипит при 444,6° C, образуя оранжево-желтые пары, состоящие преимущественно из молекул S8. С повышением температуры окраска паров переходит в темнокрасную, затем в палевую, а при 650° C в соломенно-желтую.
При дальнейшем нагревании молекулы S8 диссоциируют, образуя равновесные формы S6, S4 и S2 при разных температурах. И, наконец, при >1000° С пары состоят практически из молекул S2, а при 2000° С – из одноатомных молекул.
Химические свойства
Сера – типичный неметалл. На внешней электронной оболочке у нее шесть электронов, и она легче присоединяет электроны других элементов, чем отдает свои. Со многими металлами реагирует с выделением тепла (например, при соединении с медью, железом, цинком). Она соединяется и почти со всеми неметаллами, хотя не так энергично.
Соединения
Диоксид серы
образуется при сжигании серы на воздухе, в частности, при обжиге сульфидных руд металлов. Диоксид серы – бесцветный газ с удушающим запахом. Это ангидрид сернистой кислоты, он легко растворяется в воде с образованием сернистой кислоты. Диоксид легко сжижается (т. кип.
–10° C) и его хранят в стальных цилиндрах.
Диоксид используют в производстве серной кислоты, в холодильных установках, для отбеливания текстиля, древесной массы, соломы, свекловичного сахара, для консервации фруктов и овощей, для дезинфекции, в пивоваренных и пищевых производствах.
Сернистая кислота
H2SO3 существует только в разбавленных растворах (менее 6%). Это слабая кислота, образующая средние и кислые соли (сульфиты и гидросульфиты). Сернистая кислота – хороший восстановитель, реагируя с кислородом образует серную кислоту.
Сернистая кислота находит несколько областей применения, среди которых – обесцвечивание шелка, шерсти, бумаги, древесной массы и аналогичных веществ. Она используется как антисептик и консервант, особенно для предотвращения брожения вина в бочках, для предотвращения ферментации зерна при извлечении крахмала. Кислоту используют и для сохранения продуктов.
Наибольшее значение из ее солей имеет гидросульфит кальция Ca(HSO3)2, используемый при переработке древесной щепы в целлюлозу.
Триоксид серы
SO3 (серный ангидрид), образующий с водой серную кислоту, представляет собой либо бесцветную жидкость, либо белое кристаллическое вещество (кристаллизуется при 16,8° С; т. кип. 44,7° С).
Он образуется при окислении диоксида серы кислородом в присутствии соответствующего катализатора (платина, пентаоксид ванадия). Триоксид серы сильно дымит во влажном воздухе и растворяется в воде, образуя серную кислоту и выделяя много тепла.
Его используют в производстве серной кислоты и получении синтетических органических веществ.
Серная кислота
H2SO4. Безводная H2SO4 – бесцветная маслянистая жидкость, растворяет SO3, образуя олеум. Смешивается с водой в любых отношениях. При растворении в воде образуются гидраты с выделением очень большого количества теплоты; поэтому во избежание разбрызгивания кислоты обычно при растворении осторожно, постепенно добавляют кислоту в воду, а не наоборот.
Концентрированная кислота хорошо поглощает пары воды и поэтому применяется для осушения газов. По этой же причине она приводит к обугливанию органических веществ, особенно углеводов (крахмала, сахара и т.п.). При попадании на кожу вызывает сильные ожоги, пары разъедают слизистую дыхательных путей и глаз. Серная кислота – сильный окислитель. Конц.
H2SO4 окисляет HI, HBr до I2 и Br2 соответственно, уголь – до CO2, серу – до SO2, металлы – до сульфатов. Разбавленная кислота тоже окисляет металлы, стоящие в ряду напряжений до водорода.
H2SO4 – сильная двухосновная кислота, образующая средние и кислые соли – сульфаты и гидросульфаты; большинство ее солей растворимы в воде, за исключением сульфатов бария, стронция и свинца, малорастворим сульфат кальция.
Серная кислота – один из важнейших продуктов химической промышленности (производящей щелочи, кислоты, соли, минеральные удобрения, хлор). Ее получают главным образом контактным или башенным способом по принципиальной схеме:
![]()
Бóльшая часть получаемой кислоты идет на производство минеральных удобрений (суперфосфат, сульфат аммония).
Серная кислота служит исходным сырьем для получения солей и других кислот, для синтеза органических веществ, искусственных волокон, для очистки керосина, нефтяных масел, бензола, толоуола, при изготовлении красок, травлении черных металлов, в гидрометаллургии урана и некоторых цветных металлов, для получения моющих и лекарственных средств, как электролит в свинцовых аккумуляторах и как осушитель.
Тиосерная кислота
H2S2O3 структурно аналогична серной кислоте за исключением замены одного кислорода на атом серы. Наиболее важным производным кислоты является тиосульфат натрия Na2S2O3 – бесцветные кристаллы, образующиеся при кипячении сульфита натрия Na2SO3 с серным цветом. Тиосульфат (или гипосульфит) натрия используется в фотографии как закрепитель (фиксаж).
Сульфонал
(CH3)2C(SO2C2H5)2 – белое кристаллическое вещество, без запаха, слабо растворимое в воде, является наркотиком и используется как седативное и снотворное средство.
Сульфид водорода
H2S (сероводород) – бесцветный газ с резким неприятным запахом тухлых яиц. Он несколько тяжелее воздуха (плотность 1,189 г/дм3), легко сжижается в бесцветную жидкость и хорошо растворим в воде. Раствор в воде является слабой кислотой с рН ~ 4. Жидкий сероводород используют как растворитель.
Раствор и газ широко применяют в качественном анализе для отделения и определения многих металлов. Вдыхание незначительного количества сероводорода вызывает головную боль и тошноту, большие количества или непрерывное вдыхание сероводорода вызывают паралич нервной системы, сердца и легких.
Паралич наступает неожиданно, в результате нарушения жизненных функций организма.
Монохлорид серы
S2Cl2 – дымящая масляная жидкость янтарного цвета с едким запахом, слезоточивая и затрудняющая дыхание. Она дымит во влажном воздухе и разлагается водой, но растворима в сероуглероде. Монохлорид серы – хороший растворитель для серы, иода, галогенидов металлов и органических соединений.
Монохлорид используется для вулканизации каучука, в производстве типографской краски и инсектицидов. При реакции с этиленом образуется летучая жидкость, известная как горчичный газ (ClC2H4)2S – токсичное соединение, используемое как боевое химическое отравляющее вещество раздражающего действия.
Дисульфид углерода
CS2 (сероуглерод) – бледножелтая жидкость, ядовитая и легко воспламеняющаяся. CS2 получают синтезом из элементов в электрической печи.
Вещество нерастворимо в воде, имеет высокий коэффициент светопреломления, высокое давление паров, низкую температуру кипения (46° C).
Сероуглерод – эффективный растворитель жиров, масел, каучука и резин – широко используют для экстракции масел, в производстве искусственного шелка, лаков, резиновых клеев и спичек, уничтожения амбарных долгоносиков и одежной моли, для дезинфекции почв.
Источник: https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/SERA.html




