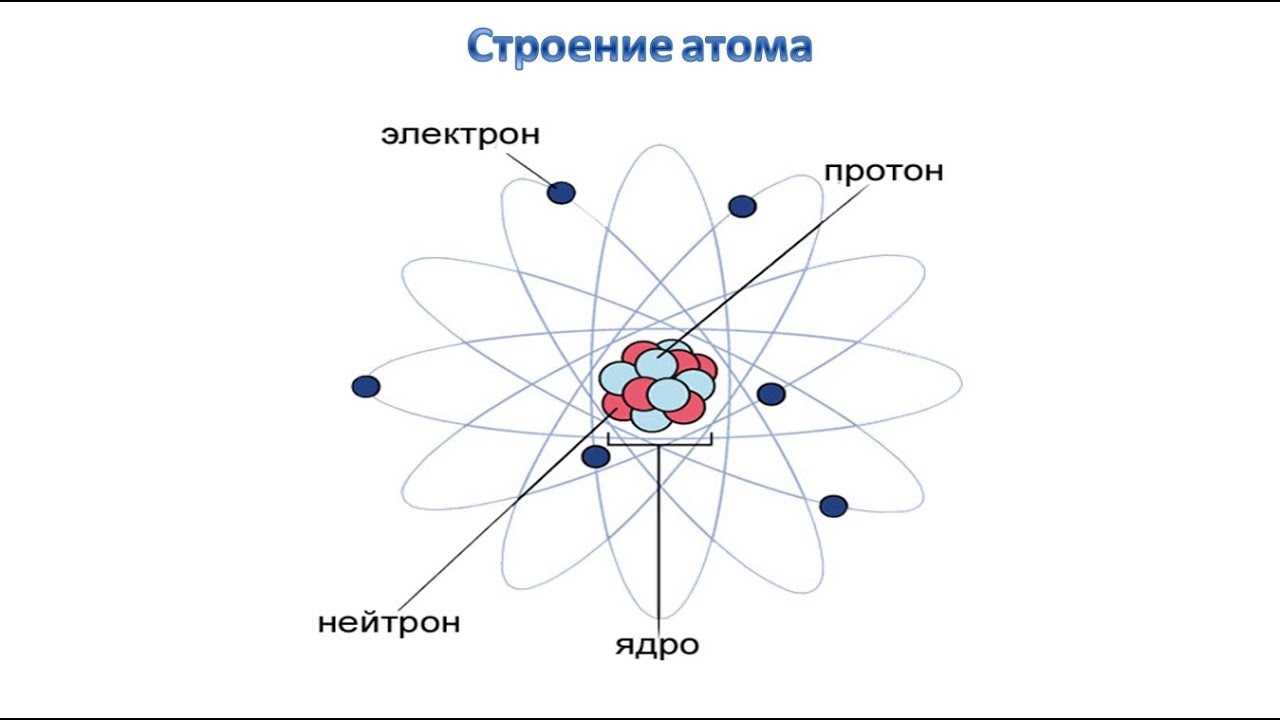
 Состав ядра атома
Состав ядра атома
В 1932г. после открытия протона и нейтрона учеными Д.Д. Иваненко (СССР) и В. Гейзенберг (Германия) предложили протонно-нейтронную модель атомного ядра.
Согласно этой модели ядро состоит из протонов и нейтронов. Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A: A = Z + N.
Ядра химических элементов обозначают символом :
X – химический символ элемента.
Например, – водород, – кислород, – уран.
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N.
Ядерные силы
Для того, чтобы атомные ядра были устойчивыми, протоны и нейтроны должны удерживаться внутри ядер огромными силами, во много раз превосходящими силы кулоновского отталкивания протонов. Силы, удерживающие нуклоны в ядре, называются ядерными.
Они представляют собой проявление самого интенсивного из всех известных в физике видов взаимодействия – так называемого сильного взаимодействия.
Ядерные силы примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов.
Ядерные силы обладают следующими свойствами:
- обладают силами притяжения;
- является силами короткодействующими (проявляются на малых расстояниях между нуклонами);
- ядерные силы не зависят от наличия или отсутствия у частиц электрического заряда.
Дефект массы и энергия связи ядра атома
Важнейшую роль в ядерной физике играет понятие энергии связи ядра.
Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы. Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц.
Энергию связи любого ядра можно определить с помощью точного измерения его массы. В настоящее время физики научились измерять массы частиц – электронов, протонов, нейтронов, ядер и др. – с очень высокой точностью.
Эти измерения показывают, что масса любого ядра Mя всегда меньше суммы масс входящих в его состав протонов и нейтронов: 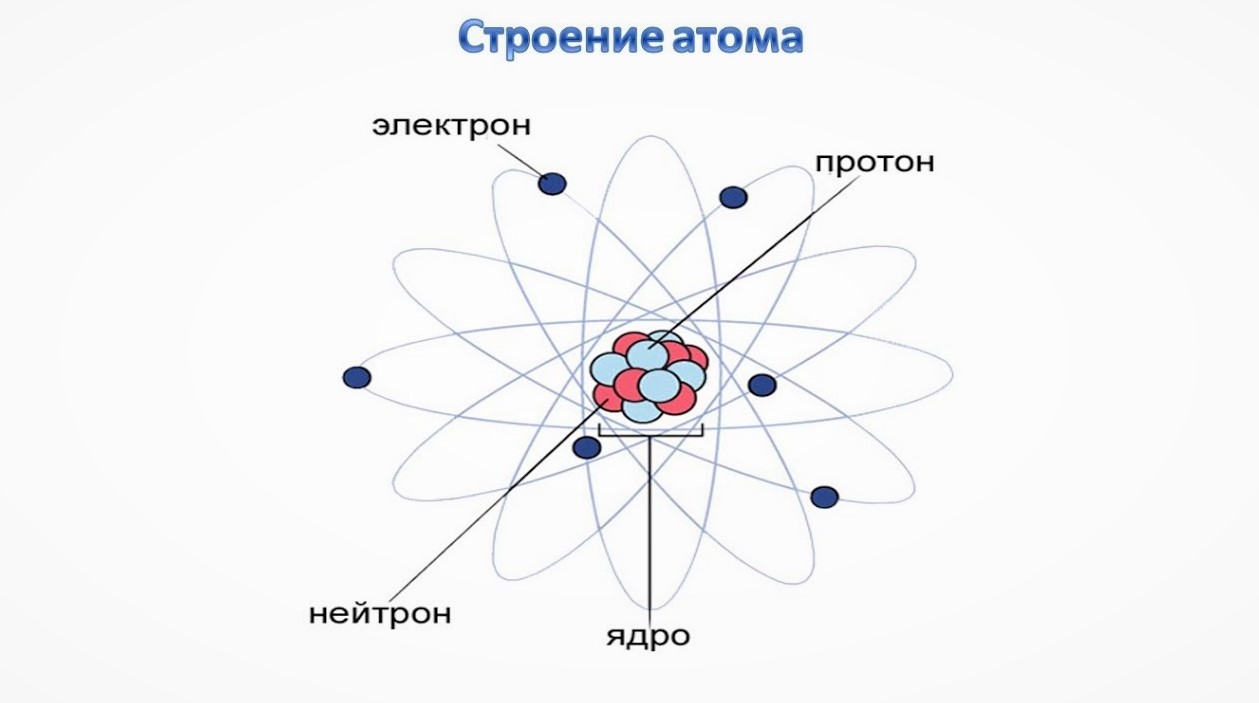
Разность масс ![]() называется дефектом масс. По дефекту массы с помощью формулы Эйнштейна E = mc2 можно определить энергию, выделившуюся при образовании данного ядра, т. е. энергию связи ядра Eсв:
называется дефектом масс. По дефекту массы с помощью формулы Эйнштейна E = mc2 можно определить энергию, выделившуюся при образовании данного ядра, т. е. энергию связи ядра Eсв: ![]()
Эта энергия выделяется при образовании ядра в виде излучения γ-квантов.
Ядерная энергетика
В нашей стране была построена первая в мире атомная электростанция и запущена в 1954 году в СССР, в городе Обнинске. Развивается строительство мощных атомных электростанций. В настоящее время в России 10 действующих АЭС. После аварии на Чернобыльской АЭС приняты дополнительные меры по безопасности атомных реакторов.
Преимущества АЭС:
- практическая независимость от источников топлива из-за небольшого объёма используемого топлива;
- экологическая чистота при правильной эксплуатации.
Проблемы ядерной энергетики:
- тяжелые последствия аварий;
- радиоактивные отходы;
- тепловое загрязнение;
- содействие распространению ядерного оружия.
 Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
Схема работы атомной электростанции на двухконтурном водо-водяном энергетическом реакторе (ВВЭР)
 атомная электроэнергетика
атомная электроэнергетика
Источник: http://kaplio.ru/sostav-yadra-atoma-yadernye-sily-defekt-massy-i-energiya-svyazi-yadra-atoma-yadernye-reaktsii-yadernaya-energetika/
Строение ядра атома. Атомная физика :: Класс!ная физика

СТРОЕНИЕ ЯДРА АТОМА
В 1932г. после открытия протона и нейтрона учеными Д.Д. Иваненко (СССР) и В. Гейзенберг (Германия) была выдвинута протонно-нейтронная модель ядра атома.
 Согласно этой модели:
Согласно этой модели:
- — ядра всех химических элементов состоят из нуклонов: протонов и нейтронов
- Условное обозначение ядра атома химического элемента:
- X – символ химического элемента
- А – массовое число, которое показывает :
- Z – зарядовое число, которое показывает:
- Масса ядра всегда меньше суммы масс покоя свободных протонов и нейтронов, его составляющих.
- Разность между массой ядра и суммой масс протонов и нейтронов называется дефектом масс.

— заряд ядра обусловлен только протонами — число протонов в ядре равно порядковому номеру элемента — число нейтронов равно разности между массовым числом и числом протонов (N=A-Z) — массу ядра в целых атомных единицах массы (а.е.м.) (1а.е.м. = 1/12 массы атома углерода) — число нуклонов в ядре — (A = N + Z) , где N – число нейтронов в ядре атома — заряд ядра в элементарных электрических зарядах (э.э.з.) ( 1э.э.з. = заряду электрона = 1,6 х 10 -19 Кл) — число протонов — число электронов в атоме — порядковый номер в таблице Менделеева Это объясняется тем, что протоны и нейтроны в ядре очень сильно притягиваются друг к другу. Чтобы разъединить их требуется затратить большую работу. Поэтому полная энергия покоя ядра не равна энергии покоя составляющих его частиц. Она меньше на величину работы по преодолению ядерных сил притяжения.
Вспомни тему «Атомная физика» за 9 класс:
Радиоактивность.
Радиоактивные превращения.
Состав атомного ядра. Ядерные силы.
Энергия связи. Дефект масс.
Деление ядер урана.
Ядерная цепная реакция.
Ядерный реактор.
Термоядерная реакция.
Другие страницы по теме «Атомная физика» за 10-11 класс:
Строение атома
Квантовые постулаты Бора Методы регистрации частиц Естественная радиоактивность Радиоактивный распад Закон радиоактаивного распада Ядерные силы Открытие электрона Открытие протона Открытие нейтрона Строение ядра атома Изотопы Энергия связи ядра Ядерные реакции Деление ядер урана. Цепная реакция Ядерный реактор. Атомная бомба Термоядерная реакцияВодородная бомба Топливные ресурсы. Ядерная энергетика
КАК ИЗУЧАЛИ АТОМ
Атом – это ядро из протонов и нейтронов, вокруг которого вращаются электроны. Размеры атомов составляют тысячные доли микрона. Но существуют и сверх гигантские «атомы» диаметром около 10 километров.
Впервые подобный «атом» был открыт в 1967 году, а сейчас их известно более тысячи.
Это нейтронные звезды – остатки сверхновых, которые являются фактически огромными атомными ядрами, состоящими на 90% из нейтронов и на 10% из протонов, и окружены «атмосферой» из электронов. ___
В 20-е годы один молодой физик проходил стажировку у Э. Резерфорда. Через два месяца Резерфорд пригласил его к себе и сообщил, что ничего не получится. «Почему? Ведь я работаю по 20 часов в сутки!?» — возразил молодой. «Это и плохо! У вас не остается времени на то, чтобы думать!» — ответил Резерфорд.
___
В 1908 году знаменитый физик Эрнест Резерфорд сказал, что он имел дело со многими превращениями в природе, но такое сиюминутное превращение ему вряд ли удалось бы предвидеть. – Из физиков в химики! В 1908 году Э. Резерфорд получил Нобелевскую премию по химии за свои работы в области изучения атома. В те годы исследования по строению атома и радиоактивности относили к химии.
Источник: http://class-fizika.narod.ru/at9.htm
Строение атома и атомного ядра
В 1911 году Э. Резерфорд на основе проделанных им экспериментов обосновал наличие в атоме положительно заряженного ядра. Схему опыта Резерфорда вы видите на рисунке.
В цилиндре 1 находилось радиоактивное вещество, испускавшее поток α-частиц 2. Они попадали на тонкую золотую фольгу 3 и, взаимодействуя с ней, ударялись об экран 4.
В местах ударов частиц на экране возникали вспышки света 5.

То, что некоторые α-частицы значительно меняли направление полёта, противоречило «рыхлой» модели атома Томсона (см. § 15-б). Резерфорд рассуждал так.
Если некоторые α-частицы отлетают назад, значит, сильный положительный заряд есть и в атомах фольги.
Но поскольку большая часть α-частиц пролетает сквозь фольгу, почти не отклоняясь, этот положительный заряд занимает малую часть атома. Её назвали ядром атома.
Подсчитывая α-частицы, отклоняющиеся на разные углы, определили размеры ядра атома: около 10-14 м. Это приблизительно в 10 000 раз меньше самого атома.
Поэтому Резерфорду пришлось в своей ядерной модели атома всё незанятое ядром пространство в атоме «заполнить» электронами.
Он писал так: «Атом состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины».
Резерфорд не указывал, как именно в атоме расположены электроны и движутся ли они. Его эксперимент и не мог дать ответ на этот вопрос, но родилось предположение, что электроны движутся вокруг ядра подобно планетам вокруг Солнца.
Однако тогда электроны имели бы центростремительное ускорение (см. § 12-л). И, как и любые движущиеся с ускорением заряды, они излучали бы электромагнитные волны (см. § 11-з). С течением времени, теряя энергию, все электроны неизбежно «упали» бы на ядро.
Но размеры никаких атомов не уменьшаются. Значит, гипотеза о движении электронов неверна?
Первый шаг на пути снятия противоречия между планетарной моделью атома и его долговечностью был сделан в 1913 году датчанином Н. Бором. Он развил идеи Планка о квантовании энергии (см.
§ 15-а) и предположил, что кванты испускаются атомами, а не электронами.
Согласно Бору, атомная система (ядро и электроны) может находиться в энергетически устойчивых состояниях, при переходах между которыми испускаются или поглощаются кванты излучения, переносящие энергию.

Бору удалось вывести формулу, описывающую положения линий в спектрах водорода и других одновалентных атомов (см. § 14-й). Сделанные расчёты положений спектральных линий совпадали с наблюдаемыми спектрами. Их происхождение теория Бора легко объясняла прерывистым характером допустимых значений энергии атома.
Следующие шаги для понимания причин устойчивости атомов привели к отказу от понятия орбиты электрона в пользу понятий электронных уровней и подуровней. Поэтому с середины XX века планетарная модель в физике не используется. Несмотря на это, квантование энергии атомной системы является одним из главных принципов физики по сей день.
Перейдём к рассмотрению строения ядра атома. В 1919 году Э. Резерфорд, бомбардируя атомы азота ядрами атомов гелия, обнаружил появление ядер атомов водорода.
Аналогичная бомбардировка натрия, алюминия, неона и других элементов тоже порождала ядра атомов водорода. Их назвали протонами и сделали вывод, что они входят в состав ядер всех атомов. В 1932 году английский физик Д.
Чедвик открыл нейтрон – частицу ядра с массой, равной массе протона, и без электрического заряда.
В настоящее время считается, что атомное ядро состоит из протонов и нейтронов, вместе именуемых нуклонами (лат. «нуклеус» – ядро). Ядра прочны благодаря наличию особых ядерных сил, действующих между всеми нуклонами. Эти силы примерно в 100 раз интенсивнее электрических, но действуют только на расстояниях до 10-15 м, то есть в пределах ядра.
Источник: https://questions-physics.ru/uchebniki/9_klass/stroenie_atoma_i_atomnogo_yadra.html
Строение ядра атома. Опыт Резерфорда
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома.
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом. Количество протонов в ядре называется его зарядовым числом — это число равно порядковому номеру элемента, к которому относится атом, в таблице (Периодической системе элементов) Менделеева. Количество протонов в ядре определяет структуру электронной оболочки нейтрального атома и, таким образом, химические свойства соответствующего элемента. Количество нейтронов в ядре называется его изотопическим числом . Ядра с одинаковым числом протонов и разным числом нейтронов называются изотопами.
В 1911 году Резерфорд в своём докладе «Рассеяние α- и β-лучей и строение атома» в философском обществе Манчестера заявил[4]:
Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала.
Таким образом Резерфорд открыл атомное ядро, с этого момента и ведёт начало ядерная физика, изучающая строение и свойства атомных ядер.
После обнаружения стабильных изотопов элементов, ядру самого лёгкого атома была отведена роль структурной частицы всех ядер. С 1920 года ядро атома водорода имеет официальный термин —протон.
После промежуточной протон-электронной теории строения ядра, имевшей немало явных недостатков, в первую очередь она противоречила экспериментальным результатам измерений спинов и магнитных моментов ядер, в 1932 году Джеймсом Чедвиком была открыта новая электрически нейтральная частица, названная нейтроном.
В том же году Иваненко и, независимо, Гейзенберг выдвинули гипотезу о протон-нейтронной структуре ядра. В дальнейшем, с развитием ядерной физики и её приложений, эта гипотеза была полностью подтверждена.
Радиоактивность
Радиоакти́вный распа́д (от лат.
radius «луч» и āctīvus «действенный») — спонтанное изменение состава (заряда Z, массового числа A) или внутреннего строения нестабильных атомных ядер путём испускания элементарных частиц, гамма-квантов и/или ядерных фрагментов.
Процесс радиоактивного распада также называют радиоактивностью, а соответствующие ядра (нуклиды, изотопы и химические элементы) радиоактивными. Радиоактивными называют также вещества, содержащие радиоактивные ядра.
Закон радиоактивного распада — закон, открытый Фредериком Содди и Эрнестом Резерфордом экспериментальным путём и сформулированный в 1903 году. Современная формулировка закона:
что означает, что число распадов за интервал времени t в произвольном веществе пропорционально числу N имеющихся в образце радиоактивных атомов данного типа.
В этом математическом выражении λ — постоянная распада, которая характеризует вероятность радиоактивного распада за единицу времени и имеет размерность с−1. Знак минус указывает на убыль числа радиоактивных ядер со временем.
Закон выражает независимость распада радиоактивных ядер друг от друга и от времени: вероятность распада данного ядра в каждую следующую единицу времени не зависит от времени, прошедшего с начала эксперимента, и от количества ядер, оставшихся в образце.
Решение этого дифференциального уравнения имеет вид:
, или , где Т — период полураспада равный времени, в течение которого число радиоактивных атомов или активность образца уменьшаются в 2 раза.
12. Ядерные реакции.
Ядерная реакция — это процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, сопровождающийся изменением состава и структуры ядра.
Последствием взаимодействия может стать деление ядра, испускание элементарных частиц или фотонов.
Кинетическая энергия вновь образованных частиц может быть гораздо выше первоначальной, при этом говорят о выделении энергии ядерной реакцией.
Виды ядерных реакций
Ядерная реакция деления — процесс расщепления атомного ядра на два (реже три) ядра с близкими массами, называемых осколками деления. В результате деления могут возникать и другие продукты реакции: лёгкие ядра (в основном, альфа-частицы), нейтроны и гамма-кванты.
Деление бывает спонтанным (самопроизвольным) и вынужденным (в результате взаимодействия с другими частицами, прежде всего, с нейтронами).
Деление тяжёлых ядер — экзоэнергетический процесс, в результате которого высвобождается большое количество энергии в виде кинетической энергии продуктов реакции, а также излучения.
- Деление ядер служит источником энергии в ядерных реакторах и ядерном оружии.
- Ядерная реакция синтеза — процесс слияния двух атомных ядер с образованием нового, более тяжелого ядра.
- Кроме нового ядра, в ходе реакции синтеза, как правило, образуются также различные элементарные частицы и (или) кванты электромагнитного излучения.
Без подвода внешней энергии слияние ядер невозможно, так как положительно заряженные ядра испытывают силы электростатического отталкивания — это так называемый «кулоновский барьер».
Для синтеза ядер необходимо сблизить их на расстояние порядка 10−15 м, на котором действие сильного взаимодействия будет превышать силы электростатического отталкивания.
Это возможно в случае, если кинетическая энергия сближающихся ядер превышает кулоновский барьер.
Фотоядерная реакция
При поглощении гамма-кванта ядро получает избыток энергии без изменения своего нуклонного состава, а ядро с избытком энергии является составным ядром.
Как и другие ядерные реакции, поглощение ядром гамма-кванта возможно только при выполнении необходимых энергетических и спиновых соотношений.
Если переданная ядру энергия превосходит энергию связи нуклона в ядре, то распад образовавшегося составного ядра происходит чаще всего с испусканием нуклонов, в основном, нейтронов.
- Запись ядерных реакций
- способ написания формул ядерных реакций аналогичен записи формул реакций химических, то есть слева записывается сумма исходных частиц, справа — сумма получившихся частиц (продуктов реакции), а между ними ставится стрелка.
- Так, реакция радиационного захвата нейтрона ядром кадмия-113 записывается так:
![]()
Мы видим, что число протонов и нейтронов справа и слева остаётся одинаковым (барионное число сохраняется). Это же относится к электрическим зарядам, лептонным числам и другим величинам (энергия, импульс, момент импульса, …). В некоторых реакциях, где участвует слабое взаимодействие, протоны могут превращаться в нейтроны и наоборот, однако их суммарное число не меняется.
Источник: https://megaobuchalka.ru/8/5586.html
Строение атома и атомного ядра. Изотопы
Слово» атом» переводится с древнегреческого языка как «неделимый».
Атомы — мельчайшие частицы вещества.
В конце XIX — начале XX века физики доказали, что атом является сложной частицей и состоит из более простых (элементарных) частиц. Были обнаружены:
· катодные лучи (английский физик Дж. Дж. Томсон ,1897 г.),частицы которых получили название электроны e- (несут единичный отрицательный заряд);
· естественная радиоактивность элементов (французские ученые — радиохимики А. Беккерель и М. Склодовская-Кюри, физик Пьер Кюри, 1896 г.) и существование α-частиц ( ядер гелия 4He2+);
· наличие в центре атома положительно заряженного ядра (английский физик и радиохимик Э. Резерфорд , 1911 г.);
· искусственное превращение одного элемента в другой , например азота в кислород (Э. Резерфорд , 1919 г.). Из ядра атома одного элемента (азота — в опыте Резерфорда) при соударении с α-частицей образовывалось ядро атома другого элемента (кислорода) и новая частица, несущая единичный положительный заряд и названная протоном (p+, ядро 1H)
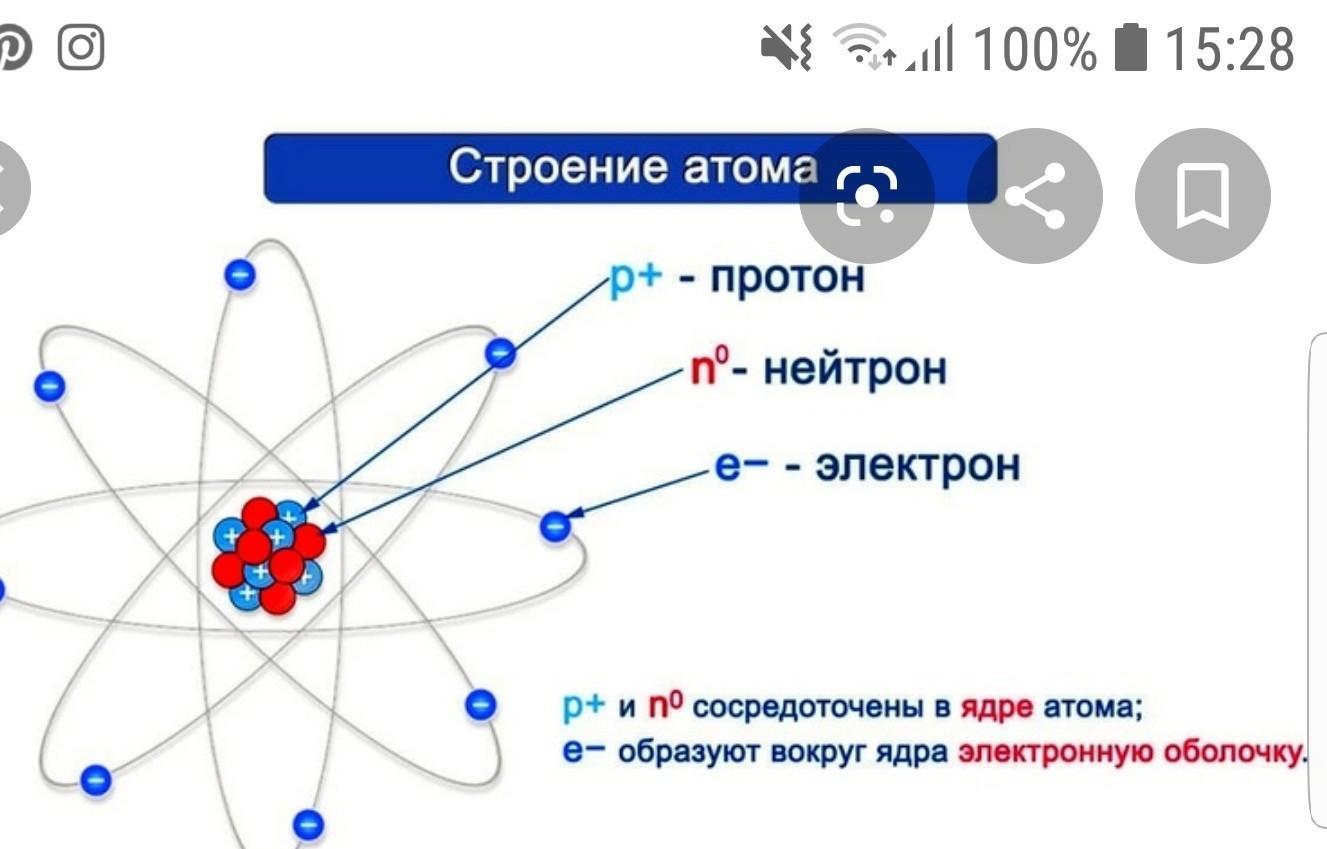
· наличие в ядре атома электронейтральных частиц — нейтронов n0 (английский физик Дж. Чедвик , 1932 г.). В результате проведенных исследований было установлено, что в атоме каждого элемента (кроме 1H) присутствуют протоны , нейтроны и электроны , причем протоны и нейтроны сосредоточены в ядре атома, а электроны — на его периферии (в электронной оболочке).
Электроны принято обозначать так : e−.
Электроны e−очень легкие, почти невесомые, но зато имеют отрицательный электрический заряд. Он равен -1. Электрический ток, которым все мы пользуемся — это поток электронов, бегущий в проводах.
- Нейтроны обозначают так : n0 , а протоны так : p+ .
- По массе нейтроны и протоны почти одинаковы.
- Число протонов в ядре равно числу электронов в оболочке атома и отвечает порядковому номеру этого элемента в Периодической системе.
Атомное ядро
— центральная часть атома, в которой сосредоточена основная его масса и структура которого определяет химический элемент, к которому относится атом.
Атомное ядро состоит из нуклонов — положительно заряженных протонов p+ и нейтральных нейтронов n0 , которые связаны между собой при помощи сильного взаимодействия. Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, часто называется нуклидом.
- Количество протонов в ядре называется его зарядовым числом Z — это число равно порядковому номеру элемента, к которому относится атом в таблице Менделеева .
- Число нейтронов в ядре обозначается буквой N , а число протонов
— буквой Z. Эти числа связаны между собой простым соотношением: - A = Z + N
- Полное количество нуклонов в ядре называется его массовым числом A = N + Z и приблизительно равно средней массе атома, указанной в таблице Менделеева.
- Ядра атомов с одинаковым числом протонов и разным числом нейтронов называются изотопами.
Многие элементы имеют по одному природному изотопу, например, Be, F, Nа, Al, P, Mn,Co, I, Au и некоторые другие. Но большинство элементов имеют по два, по три иболее устойчивых изотопа.
Например:

Ядра атомов с одинаковым числом нейтронов, но разным числом протонов — называются изотонами .
Атомы различных элементов с одинаковой атомной массой-А называются изобарами.
Источник: http://examchemistry.com/content/lesson/himelement/stroenieatoma.html
Строение атомного ядра. Ядерные силы. Изотопы — Класс!ная физика
«Физика — 11 класс»
Строение атомного ядра. Ядерные силы
Сразу же после того, как в опытах Чедвика был открыт нейтрон, советский физик Д. Д. Иваненко и немецкий ученый В. Гейзенберг в 1932 г. предложили протонно-нейтронную модель ядра. Она была подтверждена последующими исследованиями ядерных превращений и в настоящее время является общепризнанной.
Протонно-нейтронная модель ядра
Согласно протоннонейтронной модели ядра состоят из элементарных частиц двух видов — протонов и нейтронов.
Так как в целом атом электрически нейтрален, а заряд протона равен модулю заряда электрона, то число протонов в ядре равно числу электронов в атомной оболочке. Следовательно, число протонов в ядре равно атомному номеру элемента Z в периодической системе элементов Д. И. Менделеева.
Сумму числа протонов Z и числа нейтронов N в ядре называют массовым числом и обозначают буквой А:
A = Z + N
Массы протона и нейтрона близки друг к другу, и каждая из них примерно равна атомной единице массы. Масса электронов в атоме много меньше массы его ядра. Поэтому массовое число ядра равно округленной до целого числа относительной атомной массе элемента.
Массовые числа могут быть определены путем приближенного измерения массы ядер приборами, не обладающими высокой точностью.
Изотопы представляют собой ядра с одним и тем же значением Z, но с различными массовыми числами А, т. е. с различными числами нейтронов N.
Ядерные силы
Так как ядра весьма устойчивы, то протоны и нейтроны должны удерживаться внутри ядра какими-то силами, причем очень большими. Это не гравитационные силы, которые слишком слабые. Устойчивость ядра не может быть объяснена также электромагнитными силами, так как между одноименно заряженными протонами действует электрическое отталкивание.
- А нейтроны не имеют электрического заряда.
- Значит, между ядерными частицами — протонами и нейтронами, их называют нуклонами — действуют особые силы, называемые ядерными силами.
Каковы основные свойства ядерных сил? Ядерные силы примерно в 100 раз превышают электрические (кулоновские) силы. Это самые мощные силы из всех существующих в природе.
Поэтому взаимодействия ядерных частиц часто называют сильными взаимодействиями.
Сильные взаимодействия проявляются не только во взаимодействиях нуклонов в ядре. Это особый тип взаимодействий, присущий большинству элементарных частиц наряду с электромагнитными взаимодействиями.
Другая важная особенность ядерных сил — их коротко- действие. Электромагнитные силы сравнительно медленно ослабевают с увеличением расстояния.
- Ядерные силы заметно проявляются лишь на расстояниях, равных размерам ядра (10-12—10-13 см), что показали уже опыты Резерфорда по рассеянию α-частиц атомными ядрами.
- Значительные успехи в ее разработке были достигнуты совсем недавно — в последние 10—15 лет.
Законченная количественная теория ядерных сил пока еще не разработана.
Ядра атомов состоят из протонов и нейтронов. Эти частицы удерживаются в ядре ядерными силами.
Изучение явления радиоактивности привело к важному открытию: была выяснена природа атомных ядер.
В результате наблюдения огромного числа радиоактивных превращений постепенно обнаружилось, что существуют вещества, тождественные по своим химическим свойствам, но имеющие совершенно различные радиоактивные свойства (т. е. распадающиеся по-разному). Их никак не удавалось разделить ни одним из известных химических способов.
На этом основании Содди в 1911 г. высказал предположение о возможности существования элементов с одинаковыми химическими свойствами, но различающихся, в частности, своей радиоактивностью.
Эти элементы нужно помещать в одну и ту же клетку периодической системы Д. И. Менделеева.
Содди назвал их изотопами (т. е. занимающими одинаковые места).
Предположение Содди получило блестящее подтверждение и глубокое толкование год спустя, когда Дж. Дж. Томсон провел точные измерения массы ионов неона методом отклонения их в электрическом и магнитном полях.
Он обнаружил, что неон представляет собой смесь двух видов атомов. Бо́льшая часть их имеет относительную массу, равную 20. Но существует незначительная часть атомов с относительной атомной массой 22.
В результате относительная атомная масса смеси была принята равной 20,2.
Атомы, обладающие одними и теми же химическими свойствами, различались массой.
Оба вида атомов неона, естественно, занимают одно и то же место в таблице Д. И. Менделеева и, следовательно, являются изотопами. Таким образом, изотопы могут различаться не только своими радиоактивными свойствами, но и массой.
Именно поэтому у изотопов заряды атомных ядер одинаковы, а значит, число электронов в оболочках атомов и, следовательно, химические свойства изотопов одинаковы. Но массы ядер различны.
Причем ядра могут быть как радиоактивными, так и стабильными.
Различие свойств радиоактивных изотопов связано с тем, что их ядра имеют различную массу.
В настоящее время установлено существование изотопов у большинства химических элементов. Некоторые элементы имеют только нестабильные (т. е. радиоактивные) изотопы.
Изотопы есть у самого тяжелого из существующих в природе элементов — урана (относительные атомные массы 238, 235 и др.) и у самого легкого — водорода (относительные атомные массы 1, 2, 3).
Особенно интересны изотопы водорода, так как они различаются по массе в 2 и 3 раза. Изотоп с относительной атомной массой 2 называется дейтерием. Он стабилен (т. е.
не радиоактивен) и входит в качестве небольшой примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется так называемая тяжелая вода.
Ее физические свойства заметно отличаются от свойств обычной воды.
При нормальном атмосферном давлении она кипит при 101,2 °С и замерзает при 3,8 °С.
Изотоп водорода с атомной массой 3 называется тритием. Он β-радиоактивен, и его период полураспада около 12 лет.
Существование изотопов доказывает, что заряд атомного ядра определяет не все свойства атома, а лишь его химические свойства и те физические свойства, которые зависят от периферии электронной оболочки, например размеры атома. Масса же атома и его радиоактивные свойства не определяются порядковым номером в таблице Д. И. Менделеева.
Примечательно, что при точном измерении относительных атомных масс изотопов выяснилось, что они близки к целым числам. А вот атомные массы химических элементов иногда сильно отличаются от целых чисел. Так, относительная атомная масса хлора равна 35,5. Это значит, что в естественном состоянии химически чистое вещество представляет собой смесь изотопов в различных пропорциях.
Целочисленность (приближенная) относительных атомных масс изотопов очень важна для выяснения строения атомного ядра.
Большинство химических элементов имеют изотопы. Заряды атомных ядер изотопов одинаковы, но массы ядер различны.
Источник: «Физика — 11 класс», учебник Мякишев, Буховцев, Чаругин
Следующая страница «Энергия связи атомных ядер» Назад в раздел «Физика — 11 класс, учебник Мякишев, Буховцев, Чаругин»
Физика атомного ядра. Физика, учебник для 11 класса — Класс!ная физика
Методы наблюдения и регистрации элементарных частиц — Открытие радиоактивности. Альфа-, бета- и гамма-излучения — Радиоактивные превращения — Закон радиоактивного распада. Период полураспада — Открытие нейтрона — Строение атомного ядра. Ядерные силы.
Изотопы — Энергия связи атомных ядер — Ядерные реакции — Деление ядер урана — Цепные ядерные реакции — Ядерный реактор — Термоядерные реакции.
Применение ядерной энергии — Получение радиоактивных изотопов и их применение — Биологическое действие радиоактивных излучений — Краткие итоги главы — Три этапа в развитии физики элементарных частиц — Открытие позитрона. Античастицы
Источник: http://class-fizika.ru/11_77.html




