Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
- В молекулах, имеющих только σ-связи, взаимное влияние атомов осуществляется через индуктивный эффект.
- В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
- Влияние заместителей, передающееся по сопряженной системе π -связей, называется мезомерным (М) эффектом.
В молекуле бензола p -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
1. Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе.
К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с p -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:

Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение p -электронной плотности.
2. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе.
К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в мета-положениях:

- Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
- Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
- I. Заместители, обладающие +I—эффектом или +М—эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называются заместителями (ориентантами) первого рода:
![]()
II. Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
![]()
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:

Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:

- Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-го рода (и галогены) затрудняют его.
- Все заместители 2-го рода, уменьшая электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
- Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
- толуол С6H5CH3 > бензол C6H6 > нитробензол C6H5NO2.
- Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода вих молекулах.
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
| Название | Формула | t°.пл., °C |
t°.кип., °C |
| Бензол | C6H6 | +5,5 | 80,1 |
| Толуол (метилбензол) | С6Н5СH3 | -95,0 | 110,6 |
| Этилбензол | С6Н5С2H5 | -95,0 | 136,2 |
| Ксилол (диметилбензол) | С6Н4(СH3)2 | ||
| орто- | -25,18 | 144,41 | |
| мета- | -47,87 | 139,10 | |
| пара- | 13,26 | 138,35 | |
| Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 |
| Кумол (изопропилбензол) | C6H5CH(CH3)2 | -96,0 | 152,39 |
| Стирол (винилбензол) | С6Н5CH=СН2 | -30,6 | 145,2 |
Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
- Большинство ароматических углеводородов опасны для жизни, токсичны.
- Химические свойства аренов
- I. РЕАКЦИИ ОКИСЛЕНИЯ
- 1. Горение (коптящее пламя):
- 2C6H6 + 15O2 t → 12CO2 + 6H2O + Q
- 2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
- 3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
- А) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:

- 5C6H5-C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4+28H2O
- 5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 +14H2O
- Упрощённо:
- C6H5-CH3 + 3O KMnO4 → C6H5COOH + H2O
- Б) в нейтральной и слабощелочной до солей бензойной кислоты
- C6H5-CH3 + 2KMnO4 → C6H5COOК + KОН + 2MnO2 + H2O
- II. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
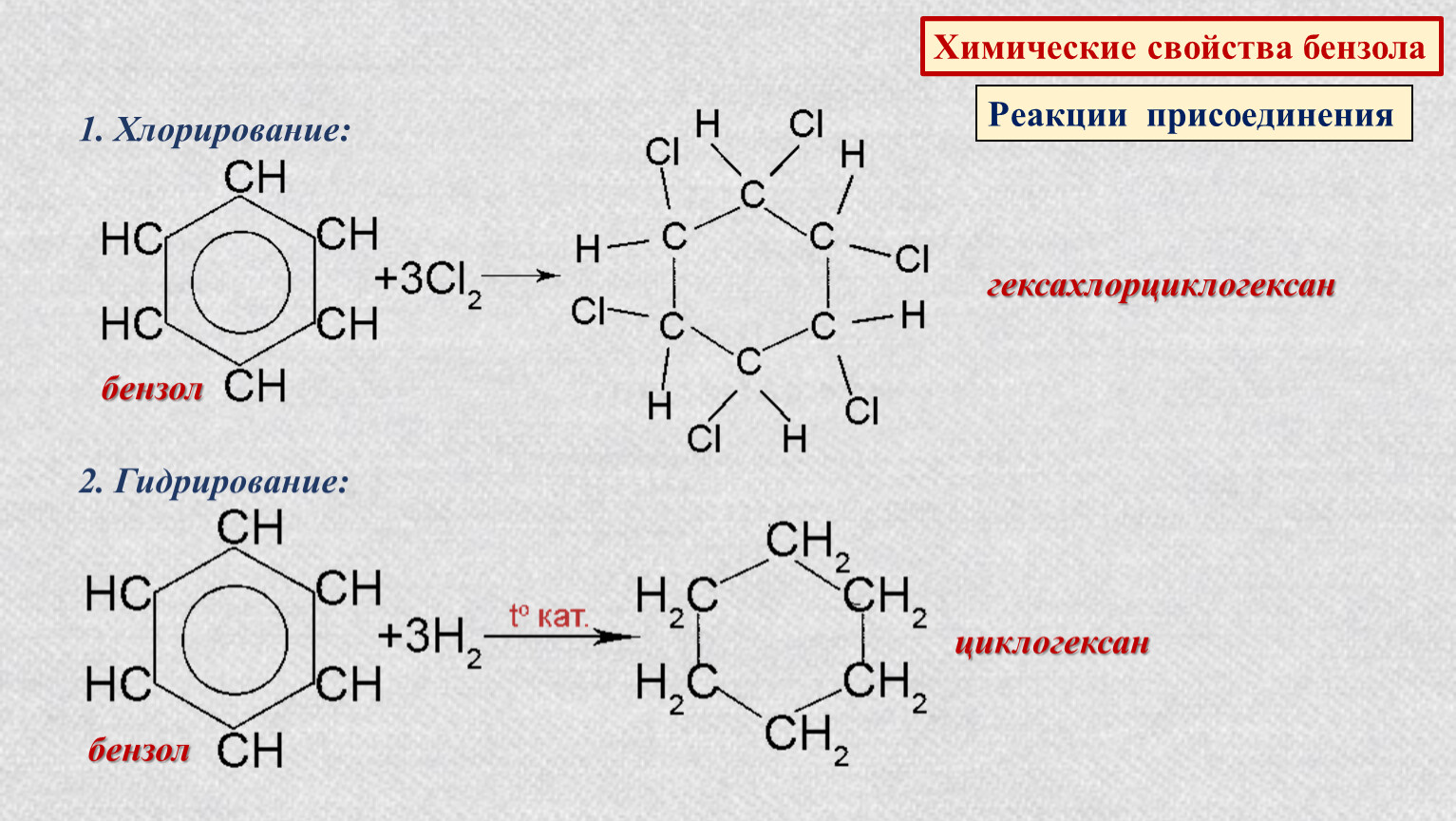
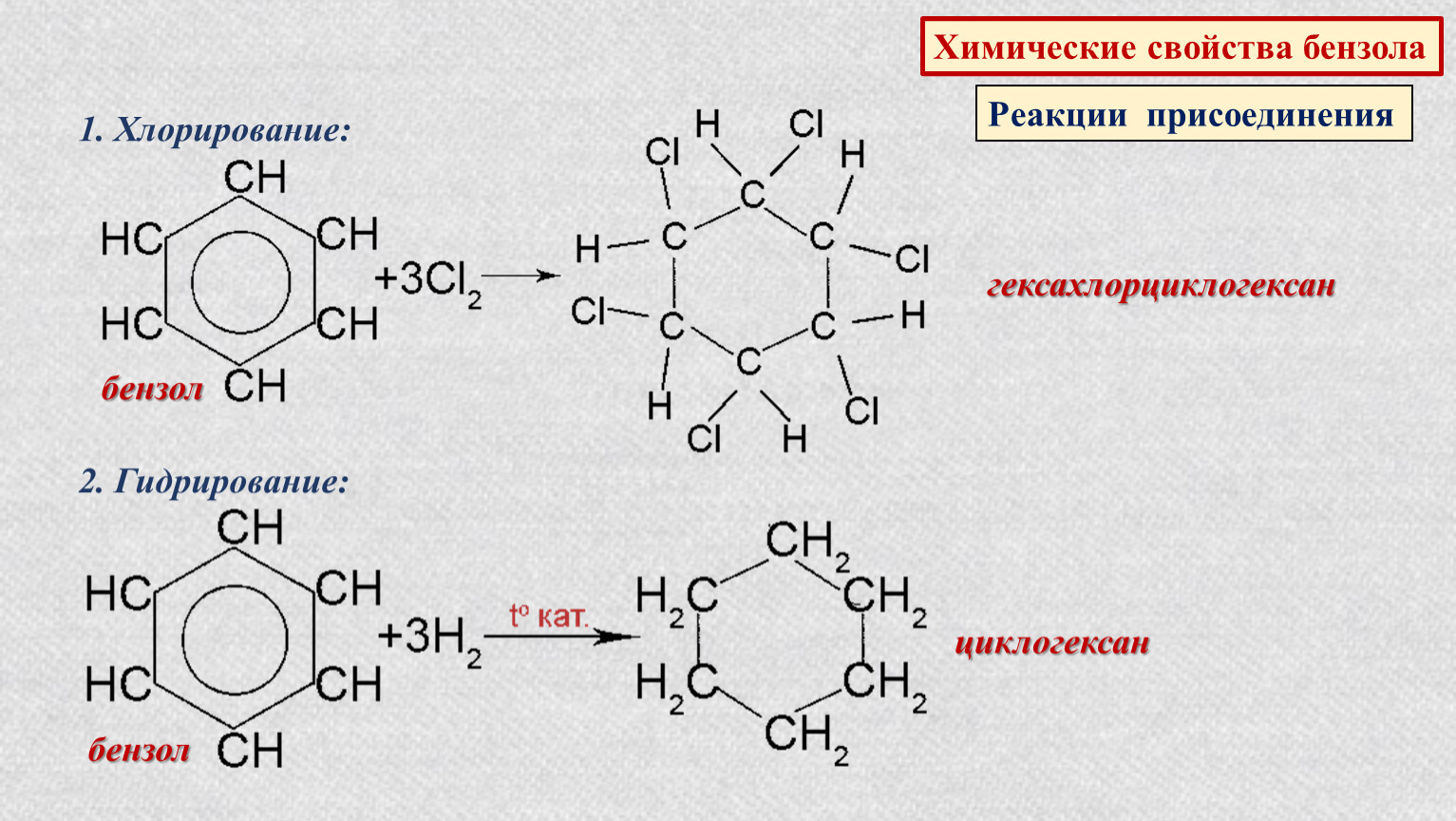
- 1. Галогенирование
- C6H6 +3Cl2 hν → C6H6Cl6 (гексахлорциклогексан — гексахлоран)

2. Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)

3. Полимеризация
- III. РЕАКЦИИ ЗАМЕЩЕНИЯ – ионный механизм(легче, чем у алканов)
- 1. Галогенирование —
- a) бензола
- C6H6 + Cl2 AlCl3→ C6H5—Cl + HCl (хлорбензол)
C6H6 + 6Cl2 t ,AlCl3→ C6Cl6 + 6HCl (гексахлорбензол)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr (бромбензол)
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму.
Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи.
Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
1) C6H5-CH3 + Cl2 hν→ C6H5-CH2-Cl + HCl
2)
- в) гомологов бензола в присутствии катализатора
- C6H5—CH3 + Cl2 AlCl3→ (смесь орта, пара производных) + HCl
- 2. Нитрование (с азотной кислотой)
- C6H6 + HO-NO2 t, H2SO4→ C6H5-NO2 + H2O
- нитробензол — запахминдаля!
- C6H5-CH3 + 3HO-NO2 t, H2SO4→ СH3-C6H2(NO2)3 + 3H2O
- 2,4,6-тринитротолуол (тол, тротил)
Источник: http://www.yoursystemeducation.com/elektronnye-effekty-fizicheskie-i-ximicheskie-svojstva-arenov/
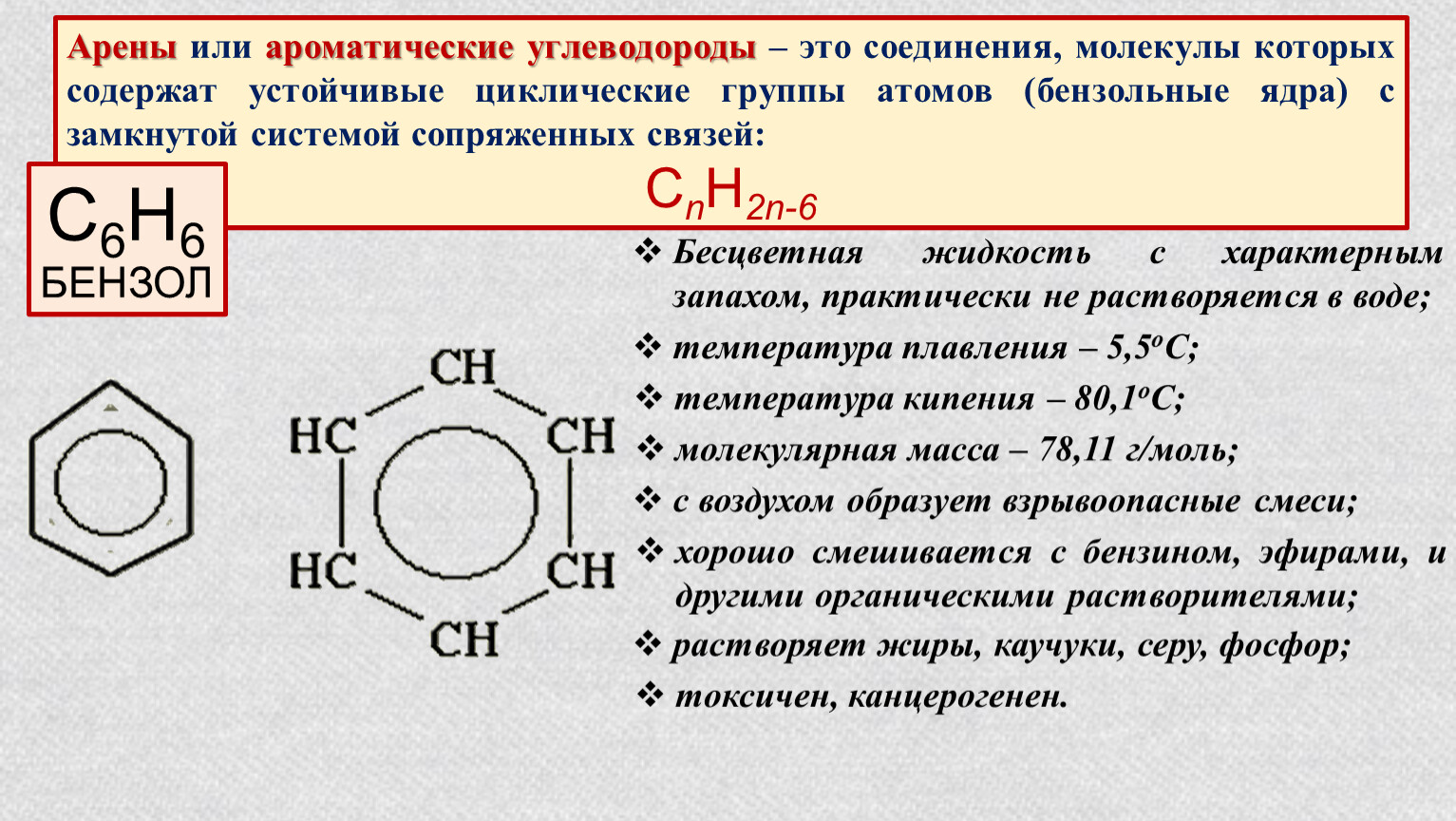
Ароматические углеводороды (Арены)
АРЕНЫ (АрУ)– карбоциклические соединения, содержащие в молекуле специфическую систему чередующихся двойных и одинарных связей (сопряженных π-связей).
Общая формула CnH2n-6
Ароматические углеводороды (Арены) являются ненасыщенными циклическими соединениями и представлены в нефтях следующими углеводородами:
- моноциклическими (бензольными) – СnНn;
- бициклическими (нафталиновыми) – СnНn-2;
- трициклическими (антраценовыми) – СnНn-4
- тетрациклическими (пиреновыми) – СnНn-6.
В основном все они представлены алкилпроизводными изомерами и содержатся во фракциях нефти в соответствии с их температурами кипения.
В среднем для нефтей характерно следующее соотношение этих групп углеводородов:
- бензольные – 67%,
- нафталиновые – 18%,
- фенантреновые – 8%,
- пиреновые – 5%,
- прочие – 2%.
Строение
Основой названия ароматического углеводорода с небольшим заместителем является бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему по кратчайшему пути.

- Строение аренонов представлено бензолом и его гомологами – продуктами замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
- Гомологи – вещества, относящиеся к одному классу соединений, имеющие сходные химические свойства и отличающиеся на одну или несколько СН2 групп.
 Арены: бензол и его гомологи
Арены: бензол и его гомологи
Существуют также соединения, молекулы которых содержат несколько циклических структур:
 Циклические молекулы
Циклические молекулы
Изомеры
Для гомологов бензола характерна изомерия положения нескольких заместителей.
 Изомеры
Изомеры
Свойства
Физические
К характерным свойствам следует отнести:
- высокую плотность (880 – 900 кг/м3),
- большой показатель преломления (1,5 – 1,55)
- минимальное соотношение Н:С (5 – 8 %), т.е. низкие энергетические свойства.
Кстати, прочтите эту статью тоже: Фракционный состав нефти
Физические свойства ароматических углеводородов существенно зависят от числа, места и молекулярной массы боковых заместителей и числа циклов. Такое резкое отличие их свойств часто используют для разделения этих углеводородов физическими методами.
Бензол и его простейшие гомологи в обычных условиях – токсичные жидкости с характерным запахом. Они плохо растворяются в воде, но хорошо в органических растворителях.
Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) – бесцветные жидкости со специфическим запахом. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ.
Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Химические
Для аренов наиболее характерны реакции электрофильного замещения –
- галогенирование,
- нитрование,
- сульфирование,
- алкилирование (получение хлорбензола, нитробензола, этилбензола др. соединений).
При высоких парциальных давлениях водорода в присутствии катализаторов арены насыщаются до нафтенов.





Получение
Ароматические углеводороды нефтяного происхождения (содержащиеся в природной нефти и образующиеся во вторичных процессах термокаталитической переработки фракций нефти) являются основным исходным сырьем для огромного числа нефтехимических производств получения ценных продуктов.
Из общего производства аренов в мире 29 млн. т/г. (2005-е годы) 87-92% вырабатывалось из нефти.
Применение
- Бензол в основном идет на производство этилбензола, из которого каталитическим дегидрированием при 600 °С получают стирол – исходный мономер для производства каучуков и ценных полимеров:
- Для производства других ценных продуктов – фенола и ацетона пользуют кумол (изопропилбензол), который окисляют в пероксид, разложением которого кислотой получают фенол и ацетон.
- Из кумола каталитическим дегидрированием получают такой ценный мономер для производства каучуков, как α-метилстирол.
Кстати, прочтите эту статью тоже: Асфальт
Значение АрУ в нефтепродуктах различно. Так, в бензинах присутствие (до 30% масс.) желательно и необходимо, так как придает бензинам хорошие моторные свойства – повышает детонационную стойкость. С этой целью в товарные бензины часто добавляют толуол или ксилолы.
В авиационных керосинах содержание АрУ ограничивают (в зависимости от марки топлива) 10-20% масс. из-за их низкой теплоты сгорания и способности давать нагар в двигателе сгорании. Допустимое количество АрУ обусловлено необходимостью иметь авиакеросины с повышенной плотностью.
В дизельных топливах содержание АрУ ограничивают из-за их нагарообразующих свойств и плохой воспламеняемости является очень важной характеристикой этих топлив.
В маслах высокомолекулярные и алкилсодержащие АрУ с боковыми цепями изомерного строения – нежелательный компонент, так как они ухудшают вязкостно-температурную характеристику масел (индекс вязкости) и обусловливают образование лаково-смолистых отложений на трущихся поверхностях. АрУ удаляют из масел в процессе очистки масляных дистиллятов и деасфальтизатов.
Остаются в маслах лишь АрУ с длинными боковыми цепями и “гибридные” полициклические углеводороды, в которых преобладают насыщенные циклы, поскольку свойства углеводородов приближаются соответственно к свойствам алканов и цикланов.
Распределение по фракциям нефти
Распределение АрУ по фракциям нефтей зависит от степени ароматизированности нефти, выражающейся в ее плотности.
- В легких нефтях, богатых алканами, АрУ представлены в основном легкими моно- и бициклическими, и их общее содержание максимально в начальных фракциях и снижается к более высококипящим.
- В нефтях средней плотности, богатых нафтеновыми углеводородами, распределение АрУ более равномерно, а в тяжелых смолистых нефтях картина обратная: содержание АрУ в низкокипящих фракциях невелико и нарастает в высококипящих.
- В бензиновых фракциях нефти (30-200 °С) содержатся в основном бензольные АрУ (С6-C9).
- В керосиновых фракциях (150-300 °С) кроме бензольных присутствуют нафталиновые АрУ (С10-С16), а в тяжелых дистиллятных фракциях (350-500 °С) – главным образом нафталиновые и антраценовые.
- В остатках нефти (выше 500 °С) концентрируются полициклические АрУ с числом циклов от трех до семи, причем “чистые” АрУ здесь уступают место “гибридным”, сочетающим в себе насыщенные и ненасыщенные циклы.
Кстати, прочтите эту статью тоже: Твердые горючие ископаемые
Простейшие из них (индан, тетралин, флуорен и другие би- и трициклические соединения) содержатся в керосино-газойлевых фракциях нефти (150 – 350оС).
Гибридные соединения
В «гибридных» соединениях ароматические циклы имеют обычно метильные заместители, а нафтеновые – более длинные боковые цепи.
В остальных фракциях нефти (выше 500оС) и особенно в составе смол и асфальтенов концентрируются полициклические АрУ с числом циклов 4 и более, такие как пирен, хризен, бенз-α-пирен и другие, являющиеся канцерогенными веществами.
Cодержание аренов в нефтях России
Общее содержание аренов в нефтях России (с учетом «гибридных») составляет 35 – 40 % – для тяжелых нафтено – ароматических нефтей и около 20 % – для высокопарафинистых.
Источник: https://pronpz.ru/neft/areny.html
Бензол и его гомологи
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.

Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям, двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.

Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ?

Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.  В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола. 
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.  При дегидроциклизации гептана получается толуол.
При дегидроциклизации гептана получается толуол. 
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана. 
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов. 
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан. 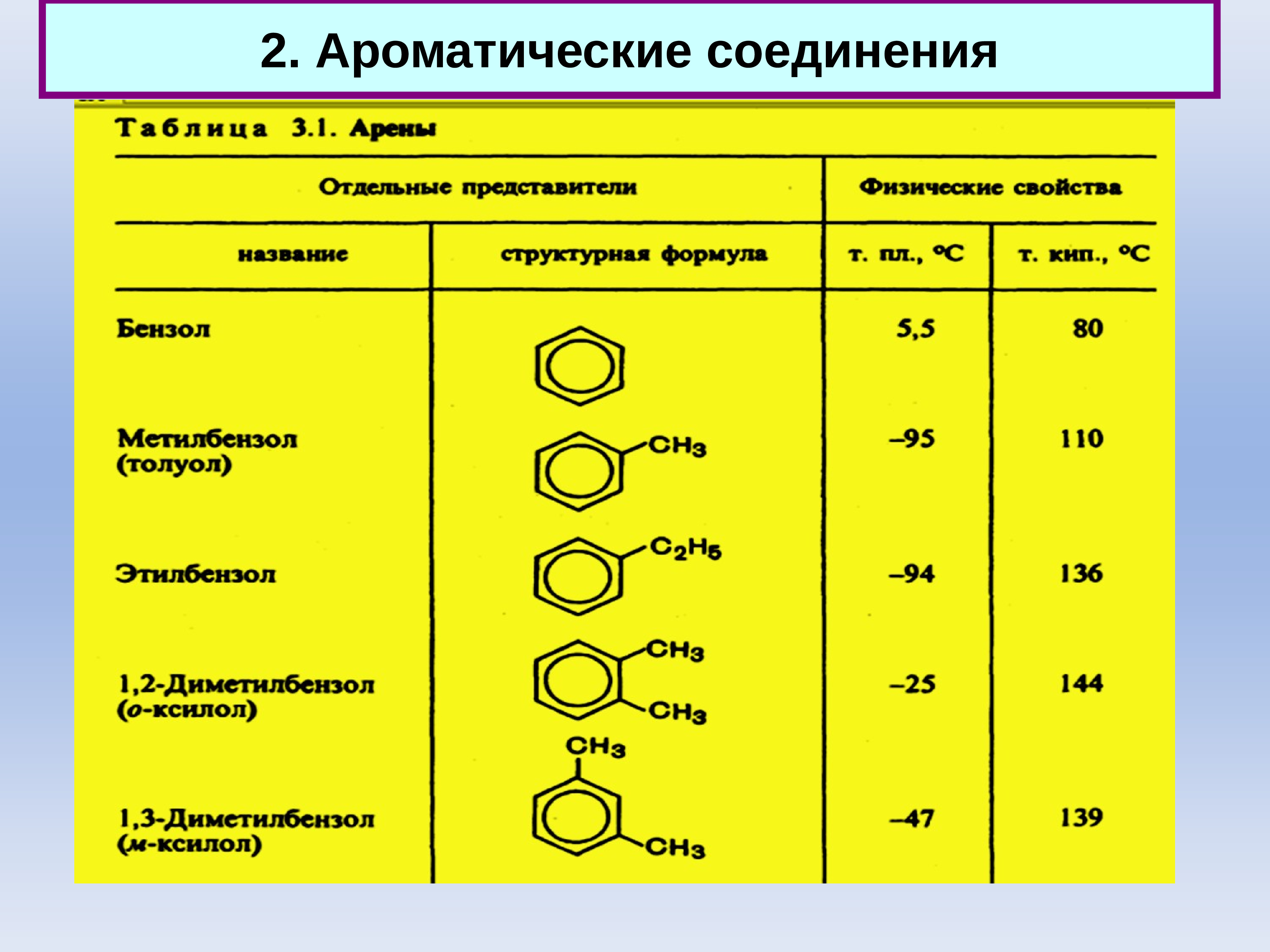
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол. Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении). Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты). К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR. Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды. 2C6H6 + 15O2 → 12CO2 + 6H2O При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Источник: https://studarium.ru/article/186
Арены. Номенклатура, изомерия, получение и физические свойства. Видеоурок. Химия 10 Класс
На данном уроке будет рассмотрена тема «Арены. Номенклатура, изомерия, получение и физические свойства». В ходе этого занятия вы сможете узнать, что представляют собой арены. Узнаете о номенклатуре, физических свойствах, изомерии, а также методе получения аренов.
Согласно номенклатуре ИЮПАК, арены с одним бензольным кольцом рассматривают как производные бензола. В качестве главной цепи выбирают бензольное кольцо. Многие арены имеют свои исторические названия.
Например:
 |
||
| Метилбензол (толуол) | Мзопропилбензол (кумол) | Винилбензол (стирол) |
Нумерацию начинают с одного из заместителей так, чтобы сумма номеров заместителей была минимальна.
Если соединение содержит два заместителя у бензольного кольца, то располагаться они могут тремя разными способами друг относительно друга. Часто вместо нумерации для 1,2-дизамещенных бензолов используют обозначение орто-, для 1,3-замещенных – мета-, а для 1,4-замещенных – пара-.
 |
 |
 |
| 1,2-диметилбензол (о-ксилол) |
|
|
Диметилбензолы изомерны друг другу. Изомерные триметилбензолы:
 |
||
| 1,2,3-триметилбензол | 1,2,4-триметилбензол | 1,3,5-триметилбензол |
Им изомерны также метилэтилбензолы (приведем в пример один из них), а также пропил- и изопропилбензолы:
 |
||
| м-метилэтилбензол | пропилбензол | изопропилбензол |
У аренов есть и межклассовые изомеры – соединения с несколькими двойными и тройными связями, циклы и т.п.
Арены похожи на остальные углеводороды – они нерастворимы в воде и легче ее. Бензол при комнатной температуре – бесцветная прозрачная жидкость со своеобразным запахом. Тпл = 5,5оС, Ткип = 80оС.
Бензол токсичен и легко воспламеняется.
1. Переработка каменного угля
Каменный уголь нагревают без доступа воздуха до 1000°С. При этом получают смесь летучих веществ и твердый остаток – кокс. Часть летучих веществ при охлаждении конденсируется с образованием аммиачной воды и каменноугольной смолы – жидкой смеси органических веществ, из которой выделяют многие ценные соединения, в том числе и арены.
2. Риформинг (ароматизация нефти)

3. Тримеризация алкинов.
Подведение итога урока
На этом уроке вы изучили тему «Арены. Номенклатура, изомерия, получение и физические свойства». В ходе этого занятия вы смогли узнать, что представляют собой арены. Узнали о номенклатуре, физических свойствах, изомерии, а также методе получения аренов.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 10 класс: учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2008. – 463 с.
3. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений/ В.В. Еремин, Н.Е. Кузьменко, В.В. Лунин и др. – М.: Дрофа, 2010. – 462 с.
4. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в вузы. – 4-е изд. – М.: РИА «Новая волна»: Издатель Умеренков, 2012. – 278 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Органическая химия (Источник).
2. Химик (Источник).
Домашнее задание
1. №№ 5, 6 (с. 62) Рудзитис Г.Е., Фельдман Ф.Г. Химия: Органическая химия. 10 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
2. Какой вид изомерии характерен для ароматических углеводородов?
3. Что такое тримеризация?
Источник: https://interneturok.ru/lesson/chemistry/10-klass/aromaticheskie-uglevodorody/areny-nomenklatura-izomeriya-poluchenie-i-fizicheskie-svoystva
Химические свойства аренов | CHEMEGE.RU
- Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
- Общая формула: CnH2n–6 при n ≥ 6.
- Строение, номенклатура и изомерия ароматических углеводородов
- Способы получения ароматических углеводородов
- Химические свойства ароматических углеводородов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл.
Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
- При гидрировании бензола образуется циклогексан:
- При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
- Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
- При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
| Например, при хлорировании толуола на свету образуется бензилхлорид |
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
| Например, этилбензол реагирует с хлором на свету |
2. Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
- Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
- При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
| Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду. На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
- Мета-хлортолуол образуется в незначительном количестве.
- При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
- Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
- При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
- Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
- В продуктах реакции мы указываем либо о-нитротолуол:
- либо п-нитротолуол:
- Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
- 2C6H6 + 15O2 → 12CO2 + 6H2O + Q
- Уравнение сгорания аренов в общем виде:
- CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
- При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
- Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
- При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
- Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
- Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
- Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
| При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты. |
| Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ |
| Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат |
- Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
- При окислении пропилбензола образуются бензойная и уксусная кислоты:
- Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
| Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода). |
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
| Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода. |
- В уравнении реакции в качестве продукта записывается либо орто-толуол, либо пара-толуол.
| Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-хлортолуол. Нитро-группа — заместитель второго рода |
5. Особенности свойств стирола
- Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
- Общая формула гомологического ряда стирола: CnH2n-8.
| Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации. |
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
| Например, при гидратации стирола образуется спирт: |
| Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду |
- При полимеризации стирола образуется полистирол:
- Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
- При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
- При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Источник: https://chemege.ru/ximicheskie-svojstva-areny/




