Циклоалканы (циклопарафины) – органические насыщенные соединения, атомы углерода в молекулах которых, соединяясь образуют циклы. Общая формула – CnH2n . Строение, получение и свойства циклоалканов отличаются от свойств нормальных алканов с тем же числом углеродных атомов.
В молекулах циклоалканов углеродные атомы связаны между собой σ – связями. Устойчивость циклопарафинов, т.е. прочность С-С связей возрастает с увеличением количества атомов углерода, образующих цикл. Циклы делят на малые (С3, С4) и обычные (C5 – С7).
В качестве представителя малого цикла рассмотрим циклопропан:
- Молекула циклопропана представляет собой плоский цикл, образованный тремя атомами углерода; атомы водорода при этом расположены вне его плоскости и занимают энергетически невыгодное («заслоненное») положение, что способствует увеличению «напряженности» цикла и его неустойчивости.
- Валентные углы в плоском равностороннем треугольнике принимают значение равное 60°. А для sp3-гибридизованного атома углерода это значение соответствует 109,5°. В случае молекулы циклопропана, sp3-гибридизованные орбитали атомов углерода перекрываются между собой вне прямой, соединяющей ядра атомов. Образующиеся σ-связи с подобным способом перекрывания называют «банановыми». Их свойства обладают сходными чертами с π-связями, например, вступают в реакции присоединения.

- В отличие от трехчленных циклов, устойчивость пяти- и шестичленных циклических алканов на столько высока, что они не способны к разрыву.
- В качестве представителя обычного цикла рассмотрим циклогексан.
Для молекулы циклогексана не характерно плоское строение, напротив — ей присуще несколько форм — конформаций.
Наиболее выгодной с энергетической точки зрения являются конформации кресла (более устойчива) и ванны.
Валентные углы образованные гибридными орбиталями атомов углерода в цикле равны 109,5°, атомы водорода у соседних атомов углерода расположены относительно друг друга в положении энергетически выгодном.
Тетраэдрическое расположение связей вокруг каждого атома углерода способствует большей устойчивости обычных циклов по сравнению с малыми. Для них возможны реакции замещения и невозможны реакции присоединения.

Физические свойства циклоалканов
При обычных условиях циклоалканы закипают и плавятся при более высоких температурах, по сравнению с соответствующими алканами. С увеличением размера цикла, температуры кипения и плавления растут. Циклоалканы С3 — С4 представляют собой газы, С5 — С16 — жидкости, C17 и более — твердые вещества. Растворимость циклических алканов в воде очень низка.
Получение циклоалканов
- Переработка нефти (получают циклогексан и его производные)
- Реакция отщепления.
При отщеплении от дигалогенпроизводных алканов двух атомов галогена получают трех- и четырехчленные циклоалканы:

- Реакция пиролиза солей дикарбоновых кислот.
Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур без доступа воздуха на соли дикарбоновых кислот.

- Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
При нагревании бензола или его гомологов и водорода в присутствии никелиевого катализатора получают циклогексан или его производные:

Химические свойства циклоалканов
Устойчивость, а, следовательно, и реакционная активность малых и обычных циклов сильно различаются.
Малые циклы, такие как циклопропан и циклобутан проявляют склонность к реакциям присоединения, тогда как для обычных циклов (циклопентан и циклогексан) более характерны реакции замещения.
1. Реакции присоединения
- Расщепление серной кислотой:

- Взаимодействие с сильными карбоновыми кислотами:

2. Реакции замещения (радикальный механизм)
- Галогенирование при действии ультрафиолета:
3. Реакция дегидрирования
В присутствии катализатора ведет к образованию бензола:
4. Реакция окисления
Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:
5. Перегруппировка (сужение или расширение цикла)
Применение циклоалканов
Источник: http://zadachi-po-khimii.ru/obshaya-himiya/stroenie-i-svojstva-cikloalkanov.html
Циклоалканы
Циклоалканы (циклопарафины, нафтены) — циклические насыщенные углеводороды, по химическому строению близкие к алканам. Содержат только простые одинарные сигма связи (σ-связи), не содержат ароматических связей.
Циклоалканы имеют большую плотность и более высокие температуры плавления, кипения, чем соответствующие алканы. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия циклоалканов
Названия циклоалканов формируются путем добавления приставки «цикло-» к названию алкана с соответствующим числом: циклопропан, циклобутан и т.д.

Как и у алканов, атомы углерода циклоалканов находятся в sp3 гибридизации.
Помимо изомерии углеродного скелета, для циклоалканов характерна межклассовая изомерия с алкенами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Получение циклоалканов
В промышленности циклоалканы получают несколькими способами:
- Из ароматических углеводородов
- Циклизация алканов
Циклоалканы можно получить гидрированием (присоединением водорода) бензола и его гомологов. 
При наличии катализатора и повышенной температуры алканы способны образовывать цикл, отщепляя при этом водород. 
В лабораторных условиях циклоалканы можно получить реакцией дегалогенирования дигалогеналканов.
- Дегалогенирование дигалогеналканов (внутримолекулярная реакция Вюрца)
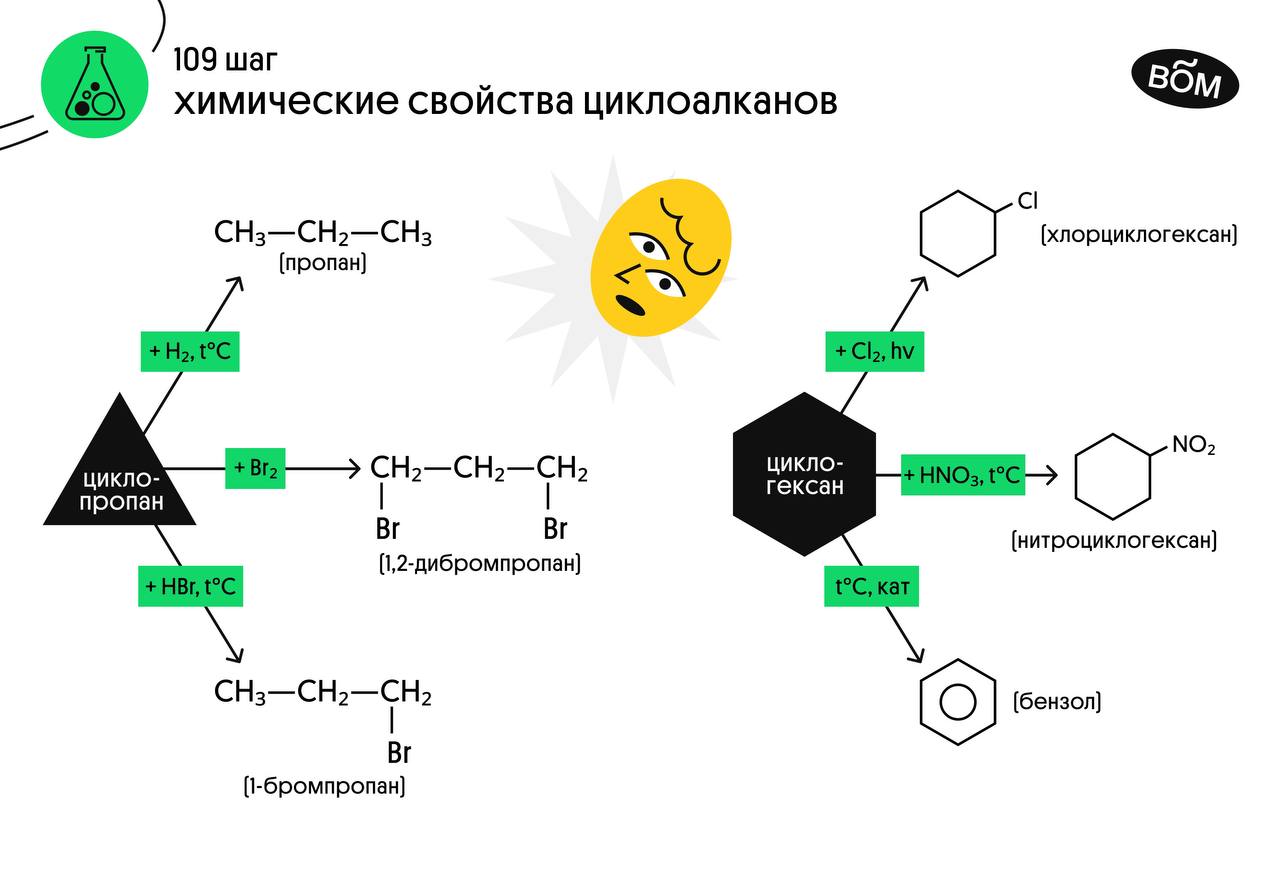
Химические свойства циклоалканов
Важно заметить, что циклопропан и циклобутан вступают в реакции присоединения, проявляя свойства ненасыщенных соединений. Для циклопентана и циклогексана реакции присоединения не характерны, они преимущественно вступают в реакции замещения.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Дегидрирование
- Изомеризация
Наиболее легко в реакции гидрирования вступают циклопропан и циклобутан. Циклопентан и циклогексан не вступают в реакции гидрирования. 
Без освещения реакция циклопропана и циклобутана с хлором идет по типу присоединения. При освещении хлор образует свободные радикалы, реакция идет, как и у алканов, по механизму замещения. У циклопентана и циклогексана реакция идет только путем замещения. 
В реакции гидрогалогенирования, протекающие по типу присоединения, вступают циклопропан и циклобутан. 
При отщеплении водорода от циклогексана образуется бензол, при наличии радикалов — гомологи бензола. 
В ходе нагревания с катализатором — AlCl3 циклоалканы образуют изомеры. 
Источник: https://studarium.ru/article/182
Циклоалканы
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами).
По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n.
Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
 |
 |
||
| Циклопропан | Циклобутан | Циклопентан | Циклогексан |
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
![]()
Физические свойства
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице.
Таблица. Физические свойства некоторых циклоалканов
| Соединение | t°пл., °С |
t°кип., °С |
| Циклопропан | -126,9 | -33 |
| Метилциклопропан | -177,2 | 0,7 |
| Циклобутан | — 80 | 13 |
| Метилциклобутан | -149,3 | 36,8 |
| Циклопентан | — 94,4 | 49,3 |
| Метилциклопентан | -142,2 | 71,9 |
| Циклогексан | 6,5 | 80,7 |
- Изомерия циклоалканов
- Для циклоалканов характерны как структурная, так и пространственная изомерия.
- Структурная изомеpия
- 1. Изомерия углеродного скелета:
- а) кольца

б) боковых цепей

2. Изомерия положения заместителей в кольце:

3. Межклассовая изомерия с алкенами:

Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные:

2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение:
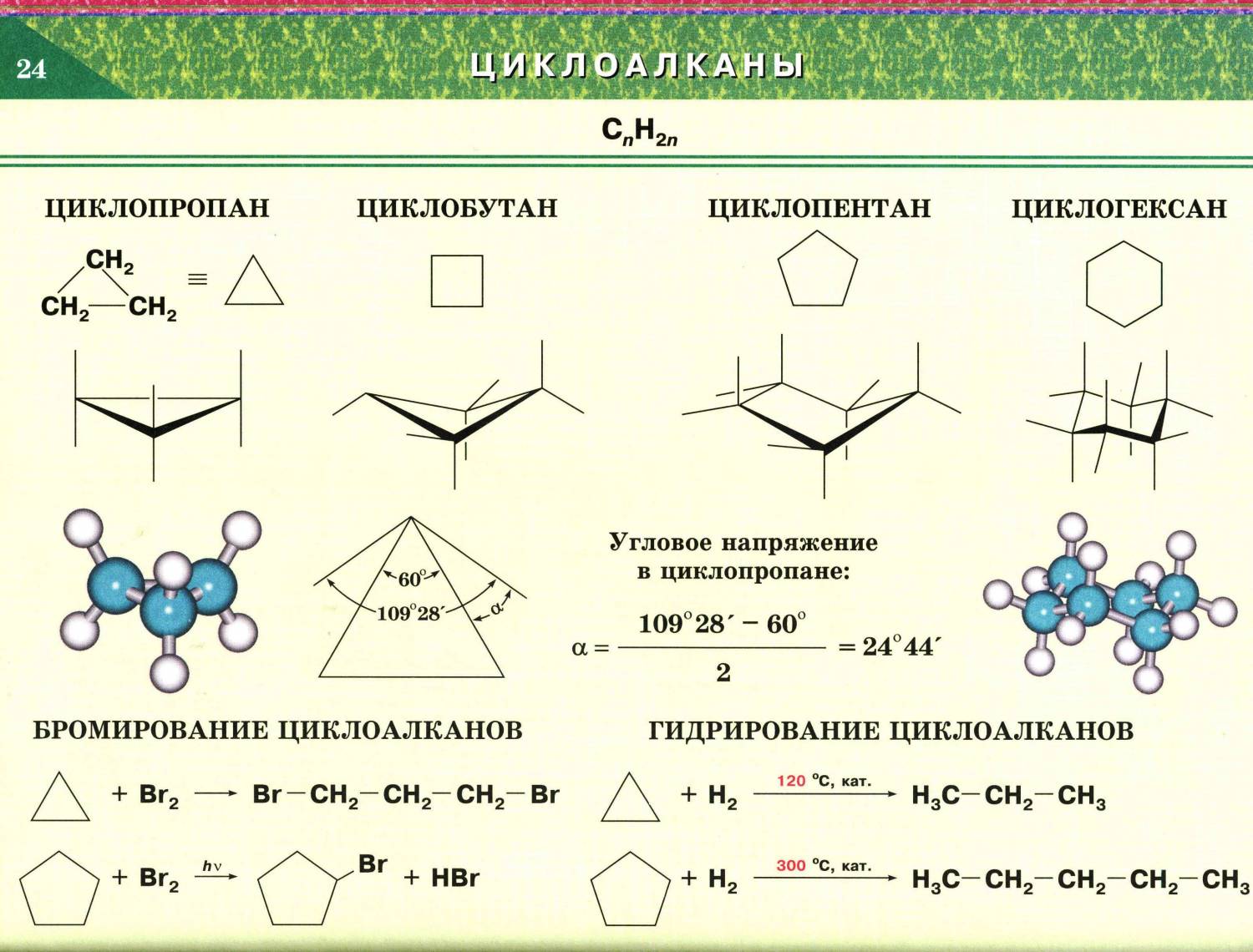
3. Конформационная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями.
Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые.
Например, в циклогексане наиболее устойчивой является конформация «кресла».
Химические свойства
Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
Реакции горения:
CnH2n + 3n/2O2 — t→ nCO2 + nH2O +Q
| Малые циклы (n=3,4) |
Реакции присоединения – сходство с алкенами.
|
| Обычные циклы (n=5-7) |
Реакции замещения – сходство с алканами.
|
Получение циклоалканов
| В промышленности |
| 1) Из нефти (пяти- и шестичленных) Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий — нафтены). При переработке нефти выделяют главным образом циклоалканы С5 — С7. 2) Из ароматических углеводородов – каталитическое гидрирование: C6H6 + H2 —t,p,Ni→ C6H12  |
| В лаборатории |
Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца):
|
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
Источник: http://www.yoursystemeducation.com/cikloalkany/
Циклоалканы: химические свойства, применение :
Рассмотрим циклоалканы. Химические свойства данного класса характеризуются особенностями строения, наличием замкнутой структуры.
Характеристика состава
Общая формула циклоалканов — CnH2n. Атомы углерода в этих соединениях находятся в sp3-гибридном состоянии. Именно общая формула циклоалканов объясняет межклассовую изомерию с алкенами.
Несмотря на сходство с предельными углеводородами по типу гибридизации углеродного атома, между классами есть и существенные отличия. Циклопарафины имеют замкнутую структуру. Первым представителем данного ряда является циклопропан.

Номенклатура
Существуют виды циклоалканов, имеющие простой цикл, боковые заместители. В зависимости от особенностей строения, существует алгоритм наименования циклопарафинов. Например, С3Н6 — это циклопропан. В структуре не содержится дополнительных радикалов, поэтому при формировании названия к пропану добавляют приставку цикло-.
С4Н8 может существовать в виде двух структурных формул: циклобутана и метилциклопропана. Учитывая, что структура углеводорода является замкнутой, нет смысла указывать цифрой положение одного радикала. Если в молекуле несколько разных заместителей, то нумерация начинается с того, который будет старшим из них.
Особенности строения
Какое еще строение могут иметь циклоалканы? Химические свойства соединений, имеющих несколько циклов, имеют некоторые отличия от моноциклов. В названиях таких соединений сначала указывают меньший цикл, затем называют большее кольцо. Если в молекуле повторяется несколько одинаковых циклов, добавляют приставки бицикло-, тетрацикло-.
Получение
Циклоалканы входят в состав нефти, поэтому имеют второе название – нафтены. Именно поэтому для получения представителей данного класса, в составе которого есть от пяти до семи углеродных атомов, осуществляют переработку нефти.
В лабораторных условиях циклопарафины получают реакцией Вюрца. Суть ее во взаимодействии активных металлов с дигалогенозамещенными алканов.

Изомерия и свойства
Какие виды изомерии имеют циклоалканы? Химические свойства данного класса аналогичны характерным для предельных углеводородов. Для всех нафтенов, начиная с С4Н8, свойственна структурная изомерия. Межклассовыми изомерами для представителей этого класса углеводородов являются алкены. Для нафтенов от С5Н10 выделяют и оптическую изомерию.
Что собой представляют циклоалканы? Химические свойства этих соединений основаны на особенностях строения. На прочность связей зависит количество углеродных атомов, имеющихся в молекуле. По мере увеличения относительной молекулярной массы молекулы, происходит снижение прочности, ускоряются реакции разрыва циклической конфигурации.
При нормальных условиях первые представители нафтенов являются газообразными веществами. Циклоалканы с количеством углеродов в цепи от пяти до шестнадцати это жидкости, а остальные представители этого класса имеют твердое агрегатное состояние.

На химические свойства влияет размер цикла, именно он характеризует устойчивость соединения. Например, для представителей нафтенов характерно гидрирование (взаимодействие с молекулой водорода), которое приводит к образованию соответствующего насыщенного соединения CnH2n+2.
Среди химических свойств, характеризующих класс нафтенов, также можно отметить и способность к реакциям замещения. Например, при взаимодействии с молекулой галогена (хлора, брома) циклическая структура не меняется, происходит замена водорода в боковой цепи на атом соответствующего галогена.
Как и для всех других веществ, имеющих органическое происхождение, для циклоалканов характерно взаимодействие с кислородом воздуха. Среди продуктов реакции будет не только углекислый газ, водяной пар, но и тепловая энергия.
Каково применение циклоалканов? В первую очередь нужно отметить использование этилциклогексана и циклогексана. Эти вещества являются основой для промышленного производства капролактана, адапиновой кислоты. Все нафтены являются отличными растворителями. Кроме того, циклопропан применяют в качестве анестезирующего ингаляционного средства в современной медицине.
Источник: https://www.syl.ru/article/298037/tsikloalkanyi-himicheskie-svoystva-primenenie
Циклоалканы
В отличии от остальных предельных углеводородов, в молекулах которых все углеродные атомы образуют открытые цепи, имеются углеводороды с замкнутыми цепями (циклами). Так, например, при действии на 1,5-дихлорпентан активным металлом цепь углеродных атомов замыкается и образуется циклический углеводород циклопентан:

Известны циклопарафины, молекулы которых состоят из трех, четырех и шести атомов углерода:

У циклопарафинов возможна изомерия. Например, молекулярной формуле C6H12 соответствует насколько веществ-изомеров; изомерия этих соединений связана с наличием боковых углеводородных цепей.
Общая формула циклопарафинов CnH2n.
Нахождение в природе
Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены профессором Московского университета В. В. Морковниковым.
Получение
Как уже было сказано, в лаборатории циклопарафины получают из дигалогенопроизводных предельных углеводородов, действуя на них активными металлами. Циклопарафины можно выделить из нефти.
Физические свойства
Циклопропан и циклобутан при нормальных условиях — газы, а циклопентан и циклогексан — жидкости. Циклопарафины в воде практически не растворяются.
Химические свойства
У циклопарафинов, как и у предельных углеводородов, все связи насыщены, однако, в отличие от последних, они способны к реакциям присоединения. Это объясняется тем, что связи между атомами углерода в цикле могут разорваться. В результате образуются свободные связи, способные присоединять атомы водорода и других элементов.
Соединения с малыми циклами легче вступают в реакции присоединения, что их аналоги с большими циклами. Так, например, реакция гидрирования (присоединение водорода) происходит при различной температуре у разных циклопарафинов.
Для соединений с большими циклами характерны реакции замещения. В этом отношении они сходны с парафинами.
Циклопарафины подвергаются и реакциям дегидрирования(отщепления водорода).
Применение
Из циклопарафинов практическое значение имеют циклогексан, митилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используют для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза.
Другие заметки по химии
Источник: http://edu.glavsprav.ru/info/cikloalkany
Циклоалканы
Насыщенные углеводороды с замкнутым, циклическим углеродным скелетом называются циклоалканами. Другие названия – нафтены, циклопарафины, цикланы. Общая формула циклоалканов – CnH2n.

Циклопарафины имеют схожее строение с алканами. Вещества находятся в состоянии sp3-гибридизации. Все атомы углерода заняты атомами водорода.
Простейшим веществом является циклопропан с тремя атомами углерода, образующими треугольный цикл. С увеличением атомов углерода форма цикла меняется и усложняется.
Например, молекула, содержащая пять атомов углерода, имеет вид пятиугольника, а молекула с десятью атомами – форму сдвоенных пятиугольников.
Молекулу веществ зарисовывают в виде фигуры, в углах которой по умолчанию находятся группы СН2.
Рис. 1. Строение циклоалканов
По номенклатуре ИЮПАК названия цикланов составляются из приставки «цикло-» и названия алкана. Циклопропан образует гомологический ряд циклоалканов:
- C3H6 – циклопропан;
- C4H8 – циклобутан;
- C5H10 – циклопентан;
- C6H12 – циклогексан;
- C7H14 – циклогептан;
- C8H16 – циклооктан;
- C9H18 – циклононан;
- C10H20 – циклодекан;
- C11H22 – циклоундекан;
- C12H24 – циклододекан.
Циклоалканы отличаются от алканов двумя атомами водорода. Например, пентан – C5H12, а циклопентан – C5H10.
Нафтены выделяют из полезных ископаемых – нефти и газа. Также получают путём гидрирования ароматических углеводородов (аренов) и дегидрирования алканов:
- C6H6 + 3H2 → C6H12;
- С6Н14 ↔ C6H12 + Н2.
Циклоалканы образуют три вида изомерии: пространственную, углеродную (присоединение дополнительных групп СН2) и межклассовую с алкенами.
Рис. 2. Изомерия циклоалканов
Циклоалканы по физическим и химическим свойствам близки алканам. В обычных условиях первые три гомолога – газы. Соединения, содержащие от пяти до 11 атомов углерода – жидкости. Высшие нафтены с 12 и более атомами углерода – твёрдые вещества.
Рис. 3. Циклододекан
Температуры плавления и кипения увеличиваются с увеличением молекулярной массы. Однако нафтены плавятся и кипят при более высоких температурах, чем соответствующие алканы.
Низшие цикланы – циклопропан и циклобутан – сходны с алкенами и способны вступать в реакции присоединения. Циклоалканы выше циклопентана схожи с алканами и вступают в реакцию замещения. Основные химические свойства циклопарафинов описаны в таблице.
| Реакция | Описание | Уравнения реакций |
| Галогенирование | Циклопропан и циклобутан присоединяют галогены. Начиная с циклопентана, нафтены вступают в реакцию замещения с галогенами |
|
| Гидрирование | Циклопропан и циклобутан присоединяют водород при нагревании в присутствии никеля | C4H8 + H2 → CH3-CH2-CH2-CH3 |
| Присоединение галогеноводородов | Циклопропан и циклобутан присоединяют галогеноводороды | C3H6 + HI → CH3-CH2-CH2I |
| Дегидрирование | Нафтены от циклопентана и выше дегидрируются в присутствии катализатора | C6H12 ↔ C6H6 + 3H2 |
| Окисление | Окисление в присутствии катализатора | C6H12 + 2O2 ↔ C6H10O4 |
Нафтены применяются для синтеза спиртов, кетонов, кислот, полимеров, используются в качестве растворителей.
Циклоалканы или нафтены – циклические предельные углеводороды, схожие свойствами с алканами. Имеют циклическую структуру разной формы. Могут образовывать межклассовые, углеродные и структурные изомеры. Малоактивные вещества в обычных условиях.
В присутствии катализатора циклопропан и циклобутан вступают в реакции присоединения с галогенами, галогеноводородами, водородом. Начиная с циклопентана, циклоалканы вступают в реакцию замещения с галогенами, а также окисляются и дегидрируются.
Средняя оценка: 4.7. Всего получено оценок: 129.
Источник: https://obrazovaka.ru/himiya/cikloalkany-obschaya-formula.html
ПОИСК
Физические и химические свойства циклоалканов. Физические свойства циклоалканов приведены в табл. 5. Первые два члена этого ряда — газы, С5—Сю — жидкости, высшие — твердые [c.61]
Физические и химические свойства циклоалканов с большими циклами аналогичны свойствам высших алканов. [c.251]
Углеводороды алканы, алкены, алкины, диеновые углеводороды, ароматические углеводороды (физические и химические свойства, способы получения). Представление о строении циклоалканов.
Кислородсодержащие соединения спирты одноатомные и многоатомные, фенол, альдегиды, карбоновые кислоты, сложные эфиры (физические и химические свойства, способы получения и области применения, медико-биологическое значение).
Азотсодержащие соединения амины алифатические и ароматические, аминокислоты (физические и химические свойства, способы получения, медико-биологическое значение). Строение отдельных представителей аминокислот глицина, аланина, цистеина, серина, глутаминовой кислоты, лизина, фенилаланина и тирозина.
Строение и химические свойства гетероциклических соединений (пиридин, пиррол, пиримидин, пурин). Строение пиримидиновых и пуриновых оснований цитозина, урацила, тимина, аденина, гуанина. [c.758]
Физические и химические свойства циклоалканов. Физические свойства циклопарафинов приведены в табл. 5. Первые два члена этого ряда — газы, Сз—Сю — жидкости, высшие — твердые вещества. Температуры кипения и плавления циклопарафинов, как и их плотности, несколько выше, чем у парафинов с равным числом атомов углерода. Как и парафины, циклопарафины практически нерастворимы в воде. [c.66]
Небольшие примеси изоалканов и циклоалканов резко меняют физические свойства смеси углеводородов (способность фильтроваться, потеть) и, особенно, форму их кристаллов [83]. Систематическое исследование влияния нормальных алканов на общие физико-химические свойства смеси углеводородов, образовавших комплекс с тиокарбамидом, проведено автором на искусственных смесях.
В состав смесей входили следующие алкано-циклоалкановые фракции 1) извлеченная из нефти карбамидом (соотношение нефть карбамид = 1 0,3, содержание нормальных алканов 97,5%) 2) выделенная из нефти тиокарбамидом (содержание нормальных алканов 76,1%) 3) извлеченная тиокарбамидом из фракции твердых углеводородов (содержание нормальных алканов 60,5%). [c.
46]
На основе различия физических свойств н-, изо- и циклоалканов разработан метод [49, 50], позволяющий по плотности, температуре плавления, молекулярному весу и показателю преломления составить определенное представление о химическом составе парафина. При разработке этого метода была использована зависимость температуры плавления н-алканов от молекулярного веса [51] [c.35]
Характерной особенностью циклоалканов является то, что их химические свойства (и многие физические свойства) не изменяются постепенно на протяжении всего гомологического ряда, как в случае гомологического ряда алканов и многих других гомологических рядов они обладают некоторыми характерными свойствами, зависящими от величины цикла. Поэтому принято разделять циклоалканы на четыре группы в зависимости от величины циклов циклоалканы с малыми циклами (Се. С4), с обычными циклами (С5. С,, Су), со средними циклами (Са—Си) и с большими циклами (>С1г). [c.243]
Превращения различных циклопарафинов и относительная прочность колец — это различные стороны одной и той же проблемы строения и взаимного влияния заместителей па физические и химические свойства кольчатой системы. В так называемой теории напряжения (Spannugtheorie) Байера (1885), являющейся логическим развитием идеи о тетраэдрическом строении углеродного атома, делалась попытка механистического объяснения относительной прочности колец [110]. Согласно этой теории различная прочность кольчатых и непредельных систем обусловливается отклонением от своего нормального значения (=109° 28 ) угла между валентными силами углеродного атома, причем непрочность системы пропорциональна величине отклонения. Если для трех первых циклопарафинов байеровские взгляды достаточно удовлетворительно, хотя и качественно, согласуются с фактами, то начиная с циклогексана, наблюдаются резкие расхождения свойств циклоалканов спредсказаниями теории напряжения. Это расхождение привело к дополнительным соображениям о нахождении углеродных атомов циклогексана и высших циклов в различных плоскостях (Заксе [c.120]
Дегидрогенизация шестичленных циклоалканов изучалась Зелинским, как известно (см. гл. III), не только на катализаторах— благородных металлах, но и на никеле, отложенном на разных носителях, в том числе на окиси алюминия. Никелевые катализаторы в дальнейшем изучались Рубинштейном, Шуйкиным, Новиковым и другими [49—52].
Причем Рубинштейн показал, что активность катализаторов зависит не только от их химической природы, но и от их физической структуры (от деформации и фазового состояния кристаллической решетки, от дисперсности).
На этой основе Рубинштейн [53] объяснил различную активность одного и того же катализатора в реакциях гидрогенизации, где требуется активация прежде всего молекулярного водорода, и в реакциях дегидрогенизации, где требуется соответствующая активация органической молекулы.
Рубинштейн, Фрейдлин и Бо-рунова [54] нашли, что при приготовлении никель-глиноземных катализаторов возможны случаи образования аморфного никеля, который из-за отсутствия структурного соответствия между катализатором и реагирующей молекулой лишается каталитических свойств и не вызывает дегидрогенизации циклот-ексана. [c.226]
Смотреть страницы где упоминается термин Физические и химические свойства циклоалканов: [c.204] Смотреть главы в:
Органическая химия Издание 2 -> Физические и химические свойства циклоалканов
Органическая химия Издание 3 -> Физические и химические свойства циклоалканов
- Физические н химические свойства
- Циклоалканы
- Циклоалканы свойства
- Циклоалканы физические свойства
- Циклоалканы химические свойства
© 2019 chem21.info Реклама на сайте
Источник: https://www.chem21.info/info/1790850/







