Алкены — непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда — этилену — CH2=CH2. Общая формула их гомологического ряда — CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса «ен» к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) — sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
- Дегидрирование алканов
- Дегидрогалогенирование галогеналканов
- Дегалогенирование дигалогеналканов
- Внутримолекулярная дегидратация спиртов
В результате крекинга нефти образуется один алкан и один алкен. C12H26 → C6H12 + C6H14
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее — вторичный и заметно труднее — первичный. CH3-CH3 → (t, кат) CH2=CH2 + H2 
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода. 
В подобных реакциях применяется цинк (цинковая пыль) — двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь. 
При нагревании спиртов c серной кислотой — H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен. Внутримолекулярная дегидратация спиртов происходит при t > 140 °C. 
Химические свойства алкенов
Алкены — ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
- Галогенирование
- Гидрогалогенирование
- Гидратация
- Окисление
- Полимеризация
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь). 
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу. Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы. 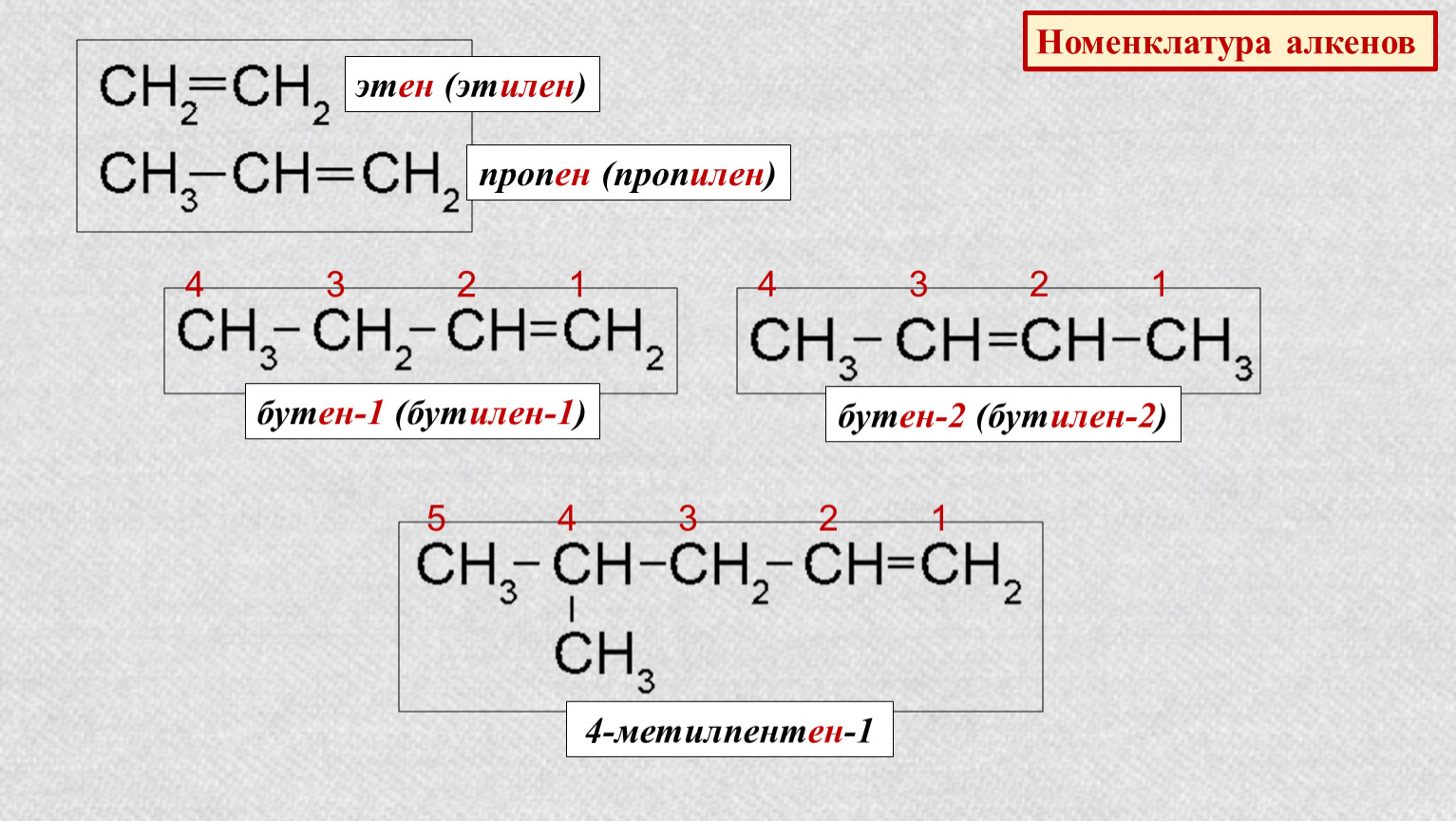
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения. Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена — к наименее гидрированному атому углерода. 
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа — к наименее гидрированному. 
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды — полное окисление. При неполном окислении образуются окиси. Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета — MnO2. В более жестких условиях — при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы — двойной связи.
Полимеризация — цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров. Индекс «n», степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
Источник: https://studarium.ru/article/183
Химические свойства алкенов | Химия онлайн
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов.
Наличие подвижной, легко поляризуемой π–связи приводит к тому, что алкены легко вступают в реакции присоединения.
В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
Реакции присоединения

- 1. Гидрирование или гидрогенизация (присоединение водорода)
- Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при нагревании и повышенном давлении.

- При гидрогенизации олефины превращаются в предельные углеводороды.
- 2. Галогенирование (присоединение галогенов)
- Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы:


Реакция с бромной водой (р-р Br2 в Н2О) является качественной реакцией на наличие двойной связи. Происходит обесцвечивание красно-бурой окраски бромной воды.
- Видеоопыт «Взаимодействие этилена с бромной водой»
- 3. Гидрогалогенирование (присоединение галогеноводородов)
- При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.
-

Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X — галоген).
Присоединение галогеноводородов к алкенам несимметричного строения происходит по правилу В.В. Марковникова.

Гидрохлорирование этилена
Присоединение против правила Марковникова происходит в том случае, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е проявляет электроноакцепторные свойства (–I и/или –М-эффект).
В молекуле трихлопропена Сl3C-CH=CH2 группа СCl3 проявляет отрицательный индуктивный эффект и π -электронная плотность связи С=С смещается к менее гидрогенизированному атому углерода.
В результате на атоме С(2) возникает частичный отрицательный заряд δ- , а на атоме С(1) – частичный положительный заряд δ+.
При взаимодействии с галогеноводородом водород присоединяется к менее гидрогенизированному атому углерода, а галоген – к более гидрогенизированному:

- Также в присутствии какого-либо органического пероксида полярные молекулы галогеноводородов реагируют с алкенами не по правилу Марковникова.
-

- Это связано с тем, что в присутствии перекиси реакция присоединения идет не по электрофильному, а по радикальному механизму.
 4. Гидратация (присоединение воды)
4. Гидратация (присоединение воды)
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
-

- Присоединение воды к несимметричным алкенам идет по правилу Марковникова.
- Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, содержащихся в газах крекинга нефти (попутных газов), а также в коксовых газах.
- 5. Реакции полимеризации
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и др.
Реакции окисления
- 1. Горение
- А) Полное (избыток О2).
- Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
- Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду:
- Видеоопыт «Горение этилена»
- Б) Неполное (недостаток О2).
- 2. Неполное каталитическое окисление
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 2000С серебряным катализатором, то образуется оксид алкена (эпоксид). Циклические оксиды широко используются в органическом синтезе.
- 3. Окисление перманганатом калия в нейтральной или щелочной среде (реакция Вагнера)
- Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов.
- В результате этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4 и выпадает коричневый осадок оксида марганца (IV).
- Видеоопыт «Взаимодействие этилена с раствором перманганата калия»
- Эта реакция используется как качественная реакция на алкены и другие непредельные углеводорода.
- 4. Окисление перманганатом калия в кислой среде
- При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи с образование а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
Изомеризация алкенов
- Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
- Изомеризация алкенов приводит или к перемещению π–связи:
- или к перестройке углеродного скелета:
- Алкены (непредельные углеводороды)
Источник: https://himija-online.ru/organicheskaya-ximiya/alkeny/ximicheskie-svojstva-alkenov.html
Урок 19. Алкены – HIMI4KA
Самоучитель по химии › Органическая химия
Алкены — это нециклические углеводороды, в молекулах которых есть одна двойная связь.
Алкены относятся к группе непредельных углеводородов. Непредельными углеводородами являются вещества, в состав молекул которых входит меньшее, чем у алканов, число атомов водорода. Поэтому они способны к реакциям присоединения, т. е. являются ненасыщенными.
Вопрос. Может ли существовать алкен, в состав которого входит один атом углерода?
Поскольку двойная связь связывает два атома углерода, минимальное число атомов углерода в молекуле алкена равно двум. Сравним состав алкана и алкена:
![]()
Общая формула:
![]()
Таким образом, алкены образует гомологический ряд, общая формула которого
Вопрос. Почему в названиях алкенов появился суффикс ЕН? (См. урок 17.7.)
Упражнение 19.1. Составьте графические формулы алкенов для n = 4.
Решение. Состав этого углеводорода С4Н8. Он содержит двойную связь. Для него возможны три углеродные цепочки:

Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры.
Вывод. Начиная с бутена (n = 4) у алкенов возможна структурная изомерия, которая связана
- со строением углеродной цепи: (а) и (в);
- с положением двойной связи: (а) и (б).
Кроме того, для некоторых алкенов возможна пространственная (цис-транс-) изомерия. Цис-транс-изомеры отличаются друг от друга расположением одинаковых атомов или групп атомов по отношению к двойной связи.
Такие изомеры есть у алкенов, в молекулах которых около двойной связи имеются разные радикалы (атомы, группы).
Например, у бутена-2 [это формула (б)] второй и третий атомы углерода связаны с двумя разными группами: –СН3 и –Н:

Задание 19.1. Назовите оставшиеся два изомера бутена (а) и (в).
Таким образом, в названиях алкенов присутствие двойной связи обозначают при помощи суффикса ЕН, а положение двойной связи показывают цифрой, которую записывают после суффикса. Эта цифра указывает на меньший номер атома углерода при двойной связи. Нумерация атомов углерода основной, главной цепи начинается с того конца, к которому ближе двойная связь.
Упражнение 19.2. Назвать углеводород:

Решение. Основная цепь содержит 4 атома углерода, причём двойная связь соединяет атомы углерода № 1 и № 2 (нумеруем справа налево, так как к правому концу ближе двойная связь). Получаем: бутен-1.
У второго и третьего атомов углерода имеются радикалы «метил», всего их два (обозначение — ДИ); получаем: 2,3-диметилбутен-1.
Задание 19.2. Составьте графические формулы изомеров алкена с n = 5; назовите полученные соединения.
Кроме рассмотренных выше названий по международной номенклатуре IUPAC, на практике применяются и так называемые тривиальные названия. Например, этен обычно называют этилен, пропен — пропилен и т. д. Поэтому алкены называются «этиленовые углеводороды», тем более что по свойствам похожи на этилен.

Строение молекул
Молекулы алкенов отличаются по строению от молекул алканов тем, что они содержат двойную связь. Рассмотрим строение этой связи. Эта связь ковалентная, но неоднородная.
Одна из двух связей имеет ту же природу, что и связь в молекулах алканов, т. е. это прочная σ-связь. Другая связь двойной связи образуется иначе, она менее прочная и обозначается буквой π(пи). Это π-связь.
Таким образом, в молекуле этена (этилена) имеется:

Вопрос. Какая связь будет легче разрушаться в химических реакциях: σ- или π-связь?
В результате алкены (и любые другие углеводороды), имеющие π-связь, легко, иногда даже при обычных условиях, вступают в химические реакции, причём эти реакции происходят за счёт разрыва π-связи.
Свойства алкенов
Физические свойства
По физическим свойствам алкены почти не отличаются от алканов: низшие алкены (этилен, пропилен и др.) — газы, а с увеличением молекулярной массы увеличиваются и температуры кипения и температуры плавления. Это неполярные вещества, поэтому они практически нерастворимы в воде, но хорошо растворяются в бензине, маслах.
Химические свойства
Наиболее характерной реакцией для алкенов является реакция присоединения. В ходе этой реакции разрывается непрочная π-связь, в результате у обоих атомов углерода, которые соединялись этой связью, появляются «свободные» валентности, за счёт чего и происходит присоединение:

Эта реакция бромирования этилена (и других алкенов) происходит при нормальных условиях под действием раствора брома в воде (бромной воды). В результате цвет бромной воды изменяется: был жёлтым, становится бесцветным.
Поэтому реакция обесцвечивания бромной воды является качественной* на двойную связь.
* Качественной называется химическая реакция, при помощи которой можно обнаружить вещество в смеси или в растворе. В результате качественной реакции изменяется цвет, выделяется газ, осадок.
Упражнение 19.3. В двух пробирках находятся бесцветные жидкости: н-пентан и пентен-1. Как при помощи химической реакции определить, где какая жидкость находится?
Решение. В обе пробирки добавляем жёлтую бромную воду и сильно встряхиваем: в пробирке, где был пентен-1, смесь обесцветится, а в другой пробирке цвет бромной воды не изменится.
Задание 19.3. Составьте уравнения реакций этих процессов.
Аналогично происходят и другие реакции присоединения: с Н2 (гидрирование), с Н2O (гидратация), с НСl и т. д. При этом в результате реакции присоединения двойная связь всегда разрушается (разрывается π-связь). Изменяется характер химической связи: вместо двойной связи появляется простая связь. Образуется одно вещество:
Задание 19.4. Составьте уравнения реакций:
- пропен + водород;
- бутен-2 + вода.
Во всех случаях, которые рассматривались ранее, в результате реакции присоединения могло получиться только одно вещество (один изомер). Но так бывает не всегда. Попробуем составить уравнение реакции пропена с хлороводородом:
Какой изомер получится: (1)? или (2)? или оба? Эта задача решается при помощи правила Марковникова (1869 год)*.
* Марковников Владимир Васильевич (25.12.1837–11.02.1904) — русский химик-органик. Ввёл понятие о взаимном влиянии атомов как главном содержании теории химического строения.
Соединения типа Н-Х присоединяются по месту разрыва двойной связи так, что при этом атом водорода (вещества Н-Х) присоединяется к атому углерода, у которого было больше атомов водорода (наиболее гидрогенизированный атом углерода).
Вопрос. Какой изомер получился при гидрировании бутена-2: (1) или (2)?
При составлении уравнений таких реакций, конечно, нужно «считать» атомы водорода только у тех атомов углерода, которые связаны двойной связью:
Задание 19.5. Составьте уравнения реакций:
- пропен + бром;
- бутен-1 + хлороводород;
- 2-метилпропен + вода.
В отличие от алканов, алкены вступают в реакции окисления* и при обычных условиях. Так, если этилен пропустить через розовый раствор перманганата калия (КМnО4), то раствор станет бесцветным:
* Реакции мягкого окисления, в которых не разрушается углеродная цепь атомов, обозначается [O], а формула вещества-окислителя записывается под стрелочкой.
Вопрос. Является ли эта реакция качественной на двойную связь?
Таким образом, для обнаружения двойной связи в углеводороде, можно воспользоваться любой из качественных реакций:
- обесцвечивание бромной воды;
- обесцвечивание раствора перманганата калия.
Алкены горят, но, в отличие от газообразных алканов, пламя которых бесцветно, газообразные алкены горят светящимся (ярким) пламенем.
Задание 19.6. Составьте уравнение реакции горения этилена.
Алкены легко вступают в реакцию полимеризации. Это процесс, при котором из большого числа молекул (мономеров) образуется ОДНА большая молекула (полимер):
Вопрос. Является ли полиэтилен химически активным веществом? Почему?
Полиэтилен, в отличие от этилена, уже не содержит двойной связи, поэтому он химически инертен, т. е. практически не вступает в химические реакции. Поэтому из него делают плёнки, различные изделия, которые широко применяются в быту (полиэтиленовые пакеты*) и в химической промышленности (трубы, ёмкости и др.).
* Полиэтиленовые пакеты часто неправильно называют «целлофановыми», хотя целлофан — совсем другой материал (см. урок 26).
Получение и применение алкенов
- Главный промышленный источник алкенов — природный газ, нефть и продукты их переработки (например, продукты крекинга).
- Основным способом получения алкенов является реакция отщепления. В этом случае от двух соседних атомов углерода отщепляется по одному атому или группе:
- В лаборатории алкены можно получить реакцией дегидратации (отщепления воды) спиртов. Эта реакция происходит при нагревании в присутствии концентрированной серной кислоты:
Упражнение 19.4. Какую молекулу нужно отщепить от хлорэтана, чтобы получить алкен?
- Решение. Сравним состав хлорэтана и этилена:
- Эта реакция происходит под действием спиртового раствора щёлочи. Уравнение этого процесса записывается так:
Вопрос. Какую молекулу нужно отщепить от 1,2-дихлорэтана для получения этилена?
Алкены легко вступают в химические реакции, поэтому они применяются для получения различных веществ: спиртов, растворителей, полимеров. Например, из этилена получают этиловый спирт, растворители (хлорэтан и дихлорэтан), полиэтилен.
Задание 19.7. Составьте уравнения реакций получения перечисленных веществ.
Плёнки полиэтилена находят большое применение не только для хранения пищевых продуктов: ими устилают дно каналов, чтобы уменьшить потери влаги; полиэтиленовую пленку используют для устройства парников; ею оборачивают трубы, чтобы уменьшить потери от коррозии и т. д.
Понятие об алкадиенах (диены)
- Алкадиены — это углеводороды, в молекулах которых есть две двойные связи.
- Алкадиены относят к группе непредельных ненасыщенных углеводородов.
- Для того чтобы вывести общую формулу гомологического ряда алкадиенов, сравним состав алканов и алкадиенов:
- Таким образом, алкадиены образуют гомологический ряд, общая формула которого
Первый член гомологического ряда алкадиенов С3Н4 называется пропадиен.
Таким образом, названия составляют, используя те же принципы номенклатуры IUPAC, с использованием суффикса диен.
Вопрос. На что указывает этот суффикс?
- Некоторые диены (так кратко обозначают представителей этого гомологического ряда) имеют тривиальные названия. Например, бутадиен-1,3 известен под названием дивинил, поскольку каждая его половинка является непредельным радикалом, который называется «винил»:
- Его гомолог — 2-метилбутадиен-1,3 называется изопрен.
Задание 19.8. Составьте графическую формулу этого соединения.
Начиная с n = 4, возникает изомерия, которая связана не только со строением углеродной цепи, но и положением кратных связей. По этому признаку различают:
- диены с кумулированными связями С–С–С=С=С;
- диены с сопряжёнными связями С–С=С–С=С;
- диены с изолированными связями С=С–С–С=С.
Наибольшее значение и применение имеют диены с сопряжёнными связями. Рассмотрим их свойства.
- Для алкадиенов, как и для алкенов, характерны реакции присоединения, которые идут в две стадии. Но диены с сопряжёнными связями вначале присоединяют бром (или другое вещество) в положение 1,4:
- Образовавшиеся «свободные валентности» замыкаются, образуя двойную связь.
Вопрос. Возможна ли для полученного соединения реакция присоединения?
- Поскольку полученное вещество содержит двойную связь, возможна вторая стадия этого процесса:
- Установлено, что на первой стадии присоединения образуется 2 изомера: 80 % указанного вещества (1,4-дибромбутен-2) и 20 % 3,4-дибромбутена-1*.
* Здесь нумерация цепи идёт по двойной связи, так как галогены не являются функциональной группой.
Задание 19.9. Составьте формулы обоих соединений.
Большое практическое значение имеет процесс полимеризации сопряжённых диенов. Вначале, как в случае бромирования, возникает двойная связь в положении 2,3:
Поскольку в полученном полимере имеется двойная связь, такие полимеры имеют два изомера: цис- и транс- (см. урок 19.1). Цис-изомеры таких полимеров являются эластичными и называются каучуки.
Каучуки — это эластичные полимеры, из которых получают резину. Резина образуется из каучука в результате вулканизации. Дело в том, что чистый каучук имеет крайне низкие эксплуатационные качества. Он становится твёрдым и хрупким на морозе, липким на жаре, быстро окисляется, крайне непрочен.
Бутадиен получают синтезом Лебедева**, который заключается в том, что этиловый спирт в присутствии определённых катализаторов подвергают одновременно дегидрированию и дегидратации:
** Лебедев Сергей Васильевич (25.07.1874–02.05.1934) — советский химик. Впервые получил (1910) образец синтетического бутадиенового каучука, разработал (1930) методы получения резины и резинотехнических изделий из синтетического каучука. По способу Лебедева впервые получен (1932) промышленный синтетический каучук.
Для алкадиенов, так же как и для алкенов, характерна реакция окисления. Например, они обесцвечивают раствор перманганата калия. При этом образуются многоатомные спирты.
Производные изопрена широко распространены в природе. К ним относятся многие душистые вещества (мяты, лимона), витамины (каротин, витамин А), а также холестерин.
Выводы
Алкены и алкадиены — это непредельные углеводороды, содержащие двойные связи. Для таких веществ характерны реакции
- присоединения;
- окисления;
- полимеризации.
Все они происходят за счёт разрыва π-связи, которая входит в состав двойной связи.
Алкадиены с сопряжёнными связями образуют полимеры с особыми свойствами — каучуки.
Источник: https://himi4ka.ru/samouchitel-po-himii/urok-19-alkeny.html
Свойства алкенов | Дистанционные уроки
Когда мы говорили об алканах, упоминалась насыщенная связь. У алкенов эта связь ненасыщенная, двойная связь — этим определяются все свойства алкенов. Эта связь видоизмененных (= гибридизированных) орбиталей:
Sp² — гибридизация

Получается, что по двойной связи молекула имеет плоскость. Радикалы при двойной связи будут располагаться по обе стороны от этой плоскости.
- Общая формула алкенов:
- CnH2n
- n = числу атомов углерода.
- Номенклатура алкенов строится из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о связи -С=С-. У алкенов вторая часть всегда имеет окончание -ен.
По правилам номенклатуры ИЮПАК:
- в качестве основной цепи выбирается та, в которой находится двойная связь, не зависимо от ее размера,
- нумерация идет с того конца, к которому ближе двойная связь
- после окончания -ен ставится номер атома, после которого идет двойная связь.
Соответственно, существует 3 вида изомерии алкенов:
- Структурная
- Пространственная
- Межклассовая
- Структурная изомерия алкенов: ну, во первых, можно по цепи двигать двойную связь — изомерия положения двойной связи:

- во-вторых, изомерия положения радикалов:

- Пространственная изомерия: это положение одинаковых радикалов при двойной связи либо по одну, либо по разные стороны от плоскости двойной связи: цис- транс-изомерия:

- Межклассовая изомерия алкенов: по общей формуле — СnH2n алкены изомерны циклоалканам.

- Химические свойства алкенов:

- Двойная ненасыщенная связь обуславливает такие свойства алкенов, как реакции присоединения — π- связь разрывается и образуется одинарная — алкены превращаются в алканы.
- Реакции присоединения:
- СH2=CH-CH3 + H2 → CH3-CH2-CH3
- CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 — качественная реакция на алкены — обесцвечивание бромной воды.
- Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
СH2=CH-CH3 + HCl = CH3-CHCl-CH3
- Окисление алкенов:
- В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение - В кислой среде — идет разрыв двойной связи:
R-СH=CH-R → 2R-COOH — схематичное уравнение - полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
- В нейтральной (или слабощелочной среде:
- Реакция полимеризации:
n СH2=CH2 → n(-CH2-CH2-)
Получение алкенов:
Алкены получают двумя способами:
- Гидрирование алкинов: C2H2 + H2 = C2H4
- из производных алканов: дегидрирование, дегалогенирование, дегидрогалогенирование и т.д.
- в ЕГЭ это вопрос А13 и А14 — Строение и свойства углеводородов
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах
Обсуждение: «Свойства алкенов»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximiya/alkeny
Алкены
Ациклические непредельные углеводороды с одной двойной связью между атомами углерода называются алкенами. Простейший алкен – этилен (C2H4), образующий гомологический ряд.

Алкены – класс веществ органической химии. Второе название класса – олефины. Общая формула алкенов – CnH2n.
Алкены обязательно содержат одну двойную связь, которая может располагаться в любом месте молекулы. Атомы, связанные двойной связью, находятся в состоянии sp2-гибридизации, т.е. в соединении атомов участвуют одна s- и две р-орбитали. При этом одна р-орбиталь остаётся свободной.
Рис. 1. Строение алкенов.
Алкены, в зависимости от нахождения в гомологическом ряду, отличаются физическими свойствами. Первые три алкена в гомологическом ряду – газы. Вещества, содержащие от пяти до 17 атомов углерода, относятся к жидкостям. Высшие алкены, содержащие более 17 атомов углерода, являются твёрдыми веществами.
Названия алкенов в гомологическом ряду соответствуют названиям алканов, но суффикс «-ан» заменён на «-ен». Названия и формулы веществ приведены в таблице алкенов.
| Название | Формула |
| Этен (этилен) | C2H4 |
| Пропен (пропилен) | C3H6 |
| Бутен (бутилен) | C4H8 |
| Пентен | C5H10 |
| Гексен | C6H12 |
| Гептен | C7H14 |
| Октен | C8H16 |
| Нонен | C9H18 |
| Децен | C10H20 |
Название может содержать две цифры. В начале названия цифра указывает на расположение заместителей (в формуле записывается в скобках). Вторая цифра, стоящая в конце названия, указывает положение двойной связи.
Нумерация атомов начинается с конца, к которому ближе расположена двойная связь.
Например, название «5-метилгексен-2» указывает, что к пятому атому гексена присоединён метил, а двойная связь находится между вторым и третьим атомом.
Рис. 2. Примеры записи структурных формул алкенов.
Алкены, кроме этилена, имеют изомеры. Пропилену свойственна межклассовая изомерия. Его единственным изомером является циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны веществам, начиная с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Алкены в отличие от алканов практически не встречаются в природе. Небольшое количество этилена содержат растения. Некоторые феромоны насекомых относятся к классу алкенов.
Олефины синтезируют промышленным и лабораторным путём. В промышленности применяется крекинг – высокотемпературная переработка нефти, а также дегидратация (обезвоживание) спиртов.
В лабораториях используются:
- дегидратация спиртов в присутствии сильных кислот;
- дегидрогалогенирование – отщепление галогенводорода при нагревании;
- дегалогенирование дигалогеналканов – отщепление галогенов в присутствии цинка;
- синтез Гофмана – разложение аммониевых оснований;
- реакция Чугаева – взаимодействие спиртов с сероуглеродом и гидроксидом натрия;
- метод Виттига – взаимодействие карбонильных соединений и алкилиденфосфоранов;
- метод Коупа – разложение N-окисей третичных аминов.
Используются и другие методы. Например, реакция Бурда, Кнёвенагеля, Перкина, Кори-Винтера.
Алкены – активные вещества. Они реагируют:
- с водородом:
CH3-СН2-СН=СН2 + Н2 → CH3-CH2-СН2-СН3; - с галогенами:
СН2=СН2 + Cl2 → Cl-CH2-CH2-Cl; - с галогеноводородами:
СН2=СН2 + HCl → CH3-CH2-Cl; - с водой:
СН2=СН2 + H2O → CH3-CH2OH; - с кислородом:
СН2=СН2 + 3O2 → 2CO2↑ + 2H2O.
Рис. 3. Горение этилена.
Алкены способны образовывать полимеры. Реакция полимеризации протекает в присутствии катализатора под действием давления и высокой температуры. Полимеризация помогает получить прочные материалы: полиэтилен, полипропилен, поливинилхлорид.
Из темы урока узнали, что такое алкены. Это класс органических веществ, содержащий одну двойную связь между атомами углерода. Названия алкенов образуются путём присоединения суффикса «-ен».
В зависимости от количества атомов углерода алкены могут находиться в газообразном, жидком или твёрдом состоянии. Алкены получают искусственными путями, т.к. в природе вещества практически не встречаются.
Это активные соединения, вступающие в реакции с неорганическими веществами.
Средняя оценка: 4.5. Всего получено оценок: 389.
Источник: https://obrazovaka.ru/himiya/alkeny.html
Урок №13-14. Физические и химические свойства алкенов — ХиМуЛя.com
Физические свойства некоторых
алкенов показаны в табл. 1. Первые три представителя гомологического ряда
алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10 (амилен,
или пентен-1) — жидкости, а с С18Н36 — твердые вещества.
С увеличением молекулярной массы повышаются температуры плавления и кипения.
Алкены нормального строения кипят при более высокой температуре, чем их
изомеры, имеющие изостроение.
Температуры кипения цис-изомеров выше, чем
транс-изомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако
лучше, чем соответствующие алканы), но хорошо — в органических растворителях.
Этилен и пропилен горят коптящим пламенем.
Таблица
1. Физические свойства некоторых алкенов
| Название | Формула | t пл,°С |
t кип,°С |
| Этилен (этен) | С2Н4 | -169,1 | -103,7 |
| Пропилен (пропен) | С3Н6 | -187,6 | -47,7 |
| Бутилен (бутен-1) | C4H8 | -185,3 | -6,3 |
| Цис-бутен-2 | С4Н8 | -138,9 | 3,7 |
| Транс-бутен-2 | С4Н8 | -105,5 | 0,9 |
| Изобутилен (2-метилпропен) | С4Н8 | -140,4 | -7,0 |
| Амилен (пентен-1) | C5H10 | -165,2 | +30,1 |
| Гексилен (гексен-1) | С6Н12 | -139,8 | 63,5 |
| Гептилен (гептен-1) | C7H14 | -119 | 93,6 |
| Октилен (октен-1) | C8H16 | -101,7 | 121,3 |
| Нонилен (нонен-1) | C9H18 | -81,4 | 146,8 |
| Децилен (децен-1) | С10Н20 | -66,3 | 170,6 |
Химические
свойства алкенов
Для алкенов наиболее типичными являются
реакции присоединения. В реакциях присоединения двойная связь выступает как
донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
- Реакции
присоединения - 1. Гидрирование
(гидрогенизация – взаимодействие с водородом): - CnH2n +
H2 t, Ni → CnH2n+2 - 2. Галогенирование (взаимодействие
с галогенами): - CnH2n + Г2 →
СnH2nГ2
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/10-klass—tretij-god-obucenia/urok-no13-fiziceskie-i-himiceskie-svojstva-alkenov
Алкены
Алкены — класс органических соединений, имеющий двойную связь между атомами углерода, структурная формула — CnH2n. Двойная связь в молекулах олефинов — это одна σ- и одна π-связь.
Таким образом, если мы представим два атома углерода и разместим их на плоскости, σ-связь будет расположена на плоскости, а π-связь будет распологаться выше и ниже плоскости (если Вы плохо представляете себе, о чём идёт речь, обратитесь к разделу химические связи).
Гибридизация
В алкенах имеет место sp2-гибридизация, для которой угол H-C-H составляет 120 градусов, а длина связи C=C равна 0,134 нм.
Строение
Из наличия π-связи следует, и подтверждается экспериментально, что:
- По своему строению, двойная связь в молекулах алкенов более восприимчива к внешнему воздействию, нежели обычная σ-связь
- Двойная связь делает невозможным вращение вокруг σ-связи, откуда следует наличие изомеров, данные изомеры называются цис- и транс-
- π-связь менее прочна, чем σ-связь, поскольку электроны находятся дальше от центров атомов
Физические свойства
Физические свойства алкенов схожи с физическими свойствами алканов. Алкены, имеющие до пяти атомов углерода, находятся в газообразном состоянии при нормальных условиях. Молекулы с содержанием от шести до 16 атомов углерода находятся в жидком состоянии и от 17 атомов углерода — алкены находятся в твёрдом состоянии при нормальных условиях.
Температура кипения алкенов в среднем увеличивается на 30 градусов на каждую CH2-группу, как и у алканов, ответвления снижают температуру кипения вещества.
Наличие π-связи делает олефины слаборастворимыми в воде, что обуславливает их небольшую полярность. Алкены — неполярные вещества и растворяются в неполярных растворителях и слабо полярных растворителях.
Плотность алкенов выше, чем у алканов, но ниже чем у воды
Изомерия
- Изомерия углеродного скелета: 1-бутен и 2-метилпропен
- Изомерия положения двойной связи: 1-бутен и 2-бутен
- Межклассовая изомерия: 1-бутен и циклобутан
Реакции
Характерные реакции алкенов — реакции присоединения, π-связь разрывается и образовавшиеся электроны охотно принимают новый элемент. Наличие π-связи означает большее количество энергии, поэтому, как правило, реакции присоединения носят экзотермический характер, т.е. протекают с выделением тепла.
Реакции присоединения
Присоединение галогенводородов
Галогенводороды легко присоединяются к двойной связи алкенов, формируя галогеналкилы. Галогенводороды смешивают с уксусной кислотой, либо напрямую, в газообразном состоянии, смешивают с алкеном. Для рассмотрения механизма реакции, необходимо знать правило Марковникова.
Правило Марковникова
При взаимодествии гомологов этилена с кислотами, водород присоединяется к более гидрогенизированному атому углерода. Исключение из правила, гидроборирование алкинов, будет рассмотрено в статье об алкинах.
Механизм реакции присоединения галогенводородов к алкенам следующий: происходит гомолитический разрыв связи в молекуле галогенводорода, образовывается протон и анион галогена. Протон присоединяется к алкену образуя карбкатион, такая реакция является эндотермической и имеет высокий уровень энергии активации, поэтому реакция происходит медленно.
Образованный карбкатион очень реактивен, поэтому легко связывается с галогеном, энергия активации низкая, поэтому этот этап не тормозит реакцию.
Галогенирование
При комнатной температуре алкены реагируют с хлором и бромом в присутствии тетрахлорметана. Механизм реакции присоединения галогенов выглядит следующим образом: электроны с π-связи воздействуют на молекулу галогена X2.
По мере приближения галогена к олефину, электроны в молекуле галогена смещаются к более отдалённому атому, таким образом молекула галогена поляризуется, ближайший атом имеет положительный заряд, более удалённый — отрицательный.
Происходит гетеролитический разрыв связи в молекуле галогена, образуется катион и анион. Катион галогена присоединяется к двум атомам углерода посредством электронной пары π-связи и свободной электронной пары катиона.
Оставшийся анион галогена воздействует на один из атомов углерода в молекуле галогеналкена разрывая цикл C-C-X и образовывая дигалогеналкен.
Реакции присоединения алкенов находят два основных применения, первое — количественный анализ, определение количества двойных связей количеством поглощенных молекул X2. Второе — в промышленности. Производство пластика основано на винилхлориде. Трихлорэтилен и тетрахлорэтилен — отличные растворители ацетиленовых жиров и резин.
Гидрирование
Присоединение газообразного водорода к алкену происходит с катализаторами Pt, Pd или Ni. В результате реакции образуются алканы. Основное применение реакции каталитического присоединения водорода — это, во-первых, количественный анализ.
По остатку молекул H2 можно определить количество двойных связей в веществе. Во-вторых, растительные жиры и жиры рыб являются непредельными углеродами и такое гидрирование приводит к увеличению температуры плавления, преобразуя в твёрдые жиры.
На данном процессе основано производство маргарина.
Гидратация
При смешивании алкенов с серной кислотой образуются алкил-гидросульфаты. При разбавлении алкил-гидросульфатов водой и сопутствующем нагревании, образуется спирт. Пример реакции — смешивание этена (этилен) с серной кислотой, последующее смешивание с водой и нагревание, результат — этанол.
Окисление
Алкены легко окисляются различными веществами, такими как, например, KMnO4, O3, OsO4 и т.д. Существует два вида окисления алкенов: разрыв π-связи без разрыва σ-связи и разрыв σ- и π-связи. Окисление без разрыва сигма-связи называется мягким окислением, с разрывом сигма-связи — жёстким окислением.
Окисление этена без разрыва σ-связи образует эпоксиды (эпоксиды — это циклические соединения C-C-O) или двухатомные спирты. Окисление с разрывом σ-связи образует ацетоны, альдегиды и карбоновые кислоты.
Окисление перманганатом калия
Реакции окисления алкенов под воздействием перманганата калия называются были открыты Егором Вагнером и носит его имя. В реакции Вагнера, окисление происходит в органическом растворителе (ацетон или этанол) при температуре 0-10°C, в слабом растворе перманганата калия. В результате реакции образуются двуатомные спирты и обесцвечивается перманганат калия.
Полимеризация
Большинство простых алкенов могут испытывать реакции самоприсоединения, формируя таким образом большие молекулы из структурных единиц. Такие большие молекулы называются полимерами, реакция, которая позволяет получить полимер называется полимеризацией.
Простые структурные единицы, образующие полимеры, называются мономерами. Полимер обозначается заключением повторяющейся группы в скобках с указанием индекса «n», что означает большое количество повторений, например: «-(CH2-CH2)n-» — полиэтилен.
Процессы полимеризации — основа производства пластика и волокон.
Радикальная полимеризация
Радикальная полимеризация инициируется при помощи катализатора — кислорода или пероксида. Реакция состоит из трёх этапов:
Инициация ROOR → 2RO• CH2=CH-C6H5 → RO—CH2C•H-C6H5 Рост цепи RO—CH2C•H-C6H5 + CH2=CH-C6H5 → RO-CH2-CH(C6H5)-CH2-C•-C5H6 Обрыв цепи рекомбинацией CH2-C•H-C6H5 + CH2-C•H-C6H5 → CH2-CH-C6H5-CH2-CH-C6H5 Обрыв цепи диспропорционированием CH2-C•H-C6H5 + CH2-C•H-C6H5 → CH=CH-C6H5 + CH2-CH2-C6H5
Ионная полимеризация
Другой способ полимеризации алкенов — это ионная полимеризация. Реакция протекает с образованием промежуточных продуктов — карбкатионов и карбанионов. Образование первого карбкатиона, как правило, осуществляется при помощи кислоты Льюиса, образование карбаниона происходит, соответственно, при реакции с основанием Льюиса.
A + CH2=CH-X → A-CH2-C+H-X → … → A-CH2-CHX-CH2-CHX-CH2C+HX … B + CH2=CH-X → B-CH2-C-H-X → … → B-CH2-CHX-CH2-CHX-CH2C-HX …
Распространённые полимеры
Наиболее распространёнными полимерами являются:
| Этен | H2C=CH2 | Полиэтилен |
| Хлороэтилен (винилхлорид) | H2C=CHCl | Поливинилхлорид (ПВХ) |
| Фенилэтен | F2C=CF2 | Тефлон |
| Пропеннитрил (полиакрилонитрил) | H2C=CH-C≡N | Нитрон |
| Метилметакрилат | CH2=C(CH3)-COOCH3 | Оргстекло |
| Таблица 1. Распространённые полимеры |
Номенклатура
Название алкенов, аналогично алканам, состоит из первой части — префикса, обозначающего количество атомов углерода в главной цепи, и суффикса -ен. Алкен — соединение с двойной связью, поэтому молекулы алкена начинаются с двух атомов углерода. Первый в списке — этен, эт- — два атома углерода, -ен — наличие двойной связи.
Этен: CH2—CH2
Если в молекуле более трёх атомов углерода, то необходимо указывать позицию двойной связи, например, бутен может быть двух видов:
CH2=CH—CH2—CH3 CH3—CH=CH—CH3
Для обозначения позиции двойной связи, необходимо добавить цифру, для примера выше это будут 1-бутен и 2-бутен соответственно (также применяются названия 1-бутен и 2-бутен, но они не являются систематическими).
Наличие двойной связи влечёт за собой изомерию, когда молекулы могут находится по разные стороны от двойной связи, например:
Cl/=Cl и Cl/=/Cl
Данная изомерия именуется цис- (Z-zusammen, с немецкого вместе) и транс- (E-entgegen, с немецкого напротив), в первом случае цис-1,2-дихлорэтен (или (Z)-1,2-дихлорэтен), во втором — транс-1,2-дихлорэтен (или (E)-1,2-дихлорэтен).
Источник: https://k-tree.ru/articles/himiya/organicheskaya_himiya/alkeny




