Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

- В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
- NH4NO2 → (t) N2 + H2O
- Также азот можно получить путем восстановления азотной кислоты активными металлами.
- HNO3(разб.) + Zn → Zn(NO3)3 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- N2 + Li → Li3N (нитрид лития)
- N2 + Mg → (t) Mg3N2
- N2 + Al → (t) AlN
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств. N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.

- Получение
- В промышленности аммиак получают прямым взаимодействием азота и водорода.
- N2 + H2 ⇄ (t, p) NH3
- В лабораторных условиях сильными щелочами действуют на соли аммония.
- NH4Cl + NaOH → NH3 + NaCl + H2O
- Химические свойства
- Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Как основание аммиак способен реагировать с кислотами с образованием солей.
- NH3 + HCl → NH4Cl (хлорид аммония)
- NH3 + HNO3 → NH4NO3 (нитрат аммония)
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак. NH3 + H2O ⇄ NH4OH

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов. NH3 + FeO → N2↑ + Fe + H2O NH3 + CuO → N2↑ + Cu + H2O Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO. NH3 + O2 → (t) N2 + H2O NH3 + O2 → (t, кат) NO + H2O
Соли аммония
- Получение
- NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
- 3NH3 + H3PO4 → (NH4)3PO4
- Химические свойства
- Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
- NH4+ + H2O ⇄ NH4OH + H+
- NH4OH ⇄ NH3 + H2O
- Реакции разложения
- NH4Cl → (t) NH3↑ + HCl↑
- (NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
- NH4NO2 → (t) N2↑ + H2O
- NH4NO3 → (t) N2O↑ + H2O
- (NH4)3PO4 → (t) NH3↑ + H3PO4
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак. NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
- Получают N2O разложением нитрата аммония при нагревании:
- NH4NO3 → N2O + H2O
- Оксид азота I разлагается на азот и кислород:
- N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
- Получение
- В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
- NH3 + O2 → (t, кат) NO + H2O
- В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- Химические свойства
- На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
- NO + O2 → NO2
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
- Получение
- Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем охлаждением полученной смеси газов до температуры — 36 °C.
- As2O3 + HNO3 → H3AsO 3 + NO↑ + NO2↑
- При охлаждении газов образуется оксид азота III.
- NO + NO2 → N2O3
- Химические свойства
Является кислотным оксидом. соответствует азотистой кислота — HNO2, соли которой называются нитриты (NO2-). Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O
- Cu(NO3)2 → (t) CuO + NO2 + O2
- Pb(NO3)2 → (t) PbO + NO2 + O2
- Химические свойства
- Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
- NO2 + C → CO2 + N2
- NO2 + P → P2O5 + N2
- Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
- SO2 + NO2 → SO3 + NO
- Реакции с водой и щелочами
- NO2 + H2O → HNO3 + HNO2
- NO2 + LiOH → LiNO3 + LiNO2 + H2O
- Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
- NO2 + H2O + O2 → HNO3
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Источник: https://studarium.ru/article/168
Аммиак — это нашатырный спирт. Формула, свойства и применение аммиака :
Аммиак – это летучее водородное соединение (нитрид водорода), которое играет ведущую роль в современной промышленности.
Хоть его и открыли лишь в восемнадцатом веке, но он был известен человеку с незапамятных времен. Водный раствор аммиака – это нашатырный спирт. Данное вещество содержится в продуктах разложения живых организмов и моче. Поэтому при распаде органики (останков растений, животных) выделяется аммиак, и от этого появляется резкий запах гниения (нашатыря).
История аммиака

- Аммиак был открыт в конце восемнадцатого века британским химиком Джозефом Пристли – одним из основоположников современной химии, который совершил также множество важных открытий в других сферах науки (физике, биологии, оптике).
- Например, в списках его изобретений есть: газированная вода, за которую он получил медаль Лондонского Королевского общества, и всем известный ластик (раньше для стирания графита все пользовались хлебом).
- Нельзя отрицать того, что Джозеф Пристли сделал огромный вклад в химию, особенно в области газов, однако многие свои достижения он совершил случайно.
- Джозеф Пристли получил аммиак методом нагревания хлорида аммония (нашатырь) с гидроксидом кальция (гашеная известь) и затем собрал выделившийся газ в ртутной ванной.
Ртутная ванная – это специальный прибор, созданный Пристли для концентрирования газов. При комнатной температуре ртуть является жидкостью с высокой плотностью, что не позволяет ей абсорбировать газы. Их ученый легко выделял из веществ, нагревая над поверхностью ртути.
- Уравнение аммиака:
- 2NH4Cl + Ca(OH)2 = NH3 + CaCl2.
- После открытия Джозефом Пристли аммиака, его изучение не стояло на месте.
- В 1784 был установлен состав этого вещества химиком Луи Бертолле, который разложил его на исходные элементы электрическим разрядом.
- Именование «нашатырь» он получил уже в 1787 году от латинского названия нашатырной щелочи, а само наименование «аммиак», которым мы привыкли пользоваться, ввел Яков Дмитриевич Захаров в 1801 году.
Но вот что интересно. За сто лет до Джозефа Пристли и его открытия аммиака, ученый Роберт Бойль наблюдал некое явление, при котором палочка, предварительно смоченная в соляной кислоте, начинала дымить, когда ее подносили к газу, выделяющемуся при сжигании навоза.
Это объясняется тем, что кислота и аммиак вступали в реакцию, и в ее продуктах содержался хлорид аммония, частицы которого и создавали дым. Получается, что экспериментальными методами аммиак был выявлен давно, но его нахождение в мире было доказано намного позже.
Состав молекулы
Молекула аммиака (NH3) имеет форму тетраэдра с атомом азота в вершине. В ней находятся четыре электронных облака, которые перекрываются вдоль линии связи, следовательно, в молекуле содержатся исключительно сигма-связи.
По сравнению с водородом азот имеет большую электроотрицательность, поэтому общие электронные пары в молекуле смещены в его сторону.
И так как в аммиаке везде одинарные связи, то тип гибридизации – sp3, а угол между электронными облаками равен 109 градусам.
Способы получения

В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
N2 + 3H2 ⇄ 2NH3 + Q
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
- 3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
- 4. Или нагреванием хлорида аммония с концентрированной щелочью:
- NH4Cl + NaOH = NaCl + NH3↑ + H2O
Применение

Аммиак – это незаменимое и действительно нужное вещество, без которого мировая промышленность замедлила бы свое движение. Область его применения широка: он задействован во всех производственных процессах человека, начиная от заводов и лабораторий, заканчивая медициной. Его преимущества в том, что он экологически чист и является довольно дешевым продуктом.
Области применения аммиака:
- Химическая промышленность. Его используют в производстве удобрений, полимеров, азотной кислоты, взрывчатых веществ, в качестве растворителя (жидкий аммиак).
- Холодильные установки. Аммиак испаряется с поглощением большого количества тепла из окружающей среды, так как обладает определенными термодинамическими свойствами. Холодильные системы, основанные на его применении более чем эффективны, поэтому он является главным хладагентом в промышленности.
- Медицина. Нашатырный спирт или 10 % раствор аммиака используют при выведении из обморочного состояния (раздражение рецепторов слизистой оболочки носа способствует стимуляции дыхания), обработке рук хирурга, возбуждении рвоты и так далее.
- Текстильная промышленность. С его помощью получают синтетические волокна. Также аммиак используют при очистке или окрашивании различных тканей.
Физические свойства
Вот какие физические свойства присущи аммиаку:
- При нормальных условиях является газом.
- Бесцветный.
- Имеет резкий запах.
- Ядовит и очень токсичен.
- Очень хорошо растворим в воде (один объем воды на семьсот объемов аммиака) и ряде органических веществ.
- Температура плавления составляет -80 °С.
- Температура кипения – около -36 °С.
- Является взрывоопасным и горючим веществом.
- Примерно вдвое легче воздуха.
- Имеет молекулярную кристаллическую решетку, соответственно, он легкоплавкий и непрочный.
- Молярная масса аммиака равна 17 грамм/моль.
- При нагревании в кислородной среде разлагается на воду и азот.
Химические свойства аммиака

Аммиак является сильным восстановителем, так как степень окисления азота в молекуле минимальная. Он способен также к окислительным свойствам, что случается намного реже.
Реакции с аммиаком:
- С кислотами аммиак образует соли аммония, разлагающиеся при нагревании. С соляной кислотой аммиак составляет хлорид аммония, а с серной — сульфат аммония.
NH3 + HCL = NH4CL
NH3 + H2SO4 = (NH4)2SO4
- С кислородом при нагревании образуется азот, а при участии катализатора (Pt) получается оксид азота.
4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 3O2 = 2N2 + 6H2O
- С водой образуется неустойчивый гидрат аммиака.
NH3 + H2O = NH3 × H2O
Аммиак способен проявлять щелочные свойства, поэтому при взаимодействии с водой он образует слабое основание – NH4OH. Но на самом деле такого соединения не существует, поэтому формулу следует записывать так: NH3 × H2O.
- 2NH3 + 3CuO = 3Cu + N2 + 3H2O
- 8NH3 + 3Cl2 =N2 + 6NH4Cl
- 3NH3 + ЗН2О + AlCl3 = Al(OH)3↓ + 3NH4Cl
Соединения аммиака
Есть несколько типов сложных веществ, образующихся при взаимодействии с аммиаком:
- Соли аммония. Они образуются в результате реакций аммиака с кислотами и разлагаются при нагревании.
- Амиды. Это соли, которые получают, действуя на щелочные металлы аммиаком.
- Гидразин. Это вещество, которое получают в результате окисления аммиака гипохлоритом натрия в присутствии желатина.
- Амины. Аммиак взаимодействует с галогеноалканами в качестве реакции присоединения, образуя соли.
- Аммиакаты. С серебром и солями меди аммиак образует комплексные соли.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Агрегатные состояния

Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
Отравление аммиаком

Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Симптомы отравления
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Последствия отравления

После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.
Источник: https://www.syl.ru/article/430916/ammiak—eto-nashatyirnyiy-spirt-formula-svoystva-i-primenenie-ammiaka
Аммиак, получение, свойства, химические реакции
![]()
![]()
![]()
![]()
- Аммиак, NH3 – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
- Аммиак, формула, газ, характеристики
- Аммиак, жидкость, твердое тело, характеристики
- Физические свойства аммиака
- Химические свойства аммиака
- Получение аммиака в промышленности и лаборатории
- Химические реакции – уравнения получения аммиака
- Применение и использование аммиака
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:

Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота.
Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/ammiak-poluchenie-svoystva-himicheskie-reaktsii/
Аммиак — урок. Химия, 8–9 класс
Формула аммиака — NH3. Степень окисления азота равна (–3). В молекуле три ковалентные полярные связи. У атома азота одна электронная пара остаётся неподелённой и играет важную роль в способности аммиака вступать в химические реакции.
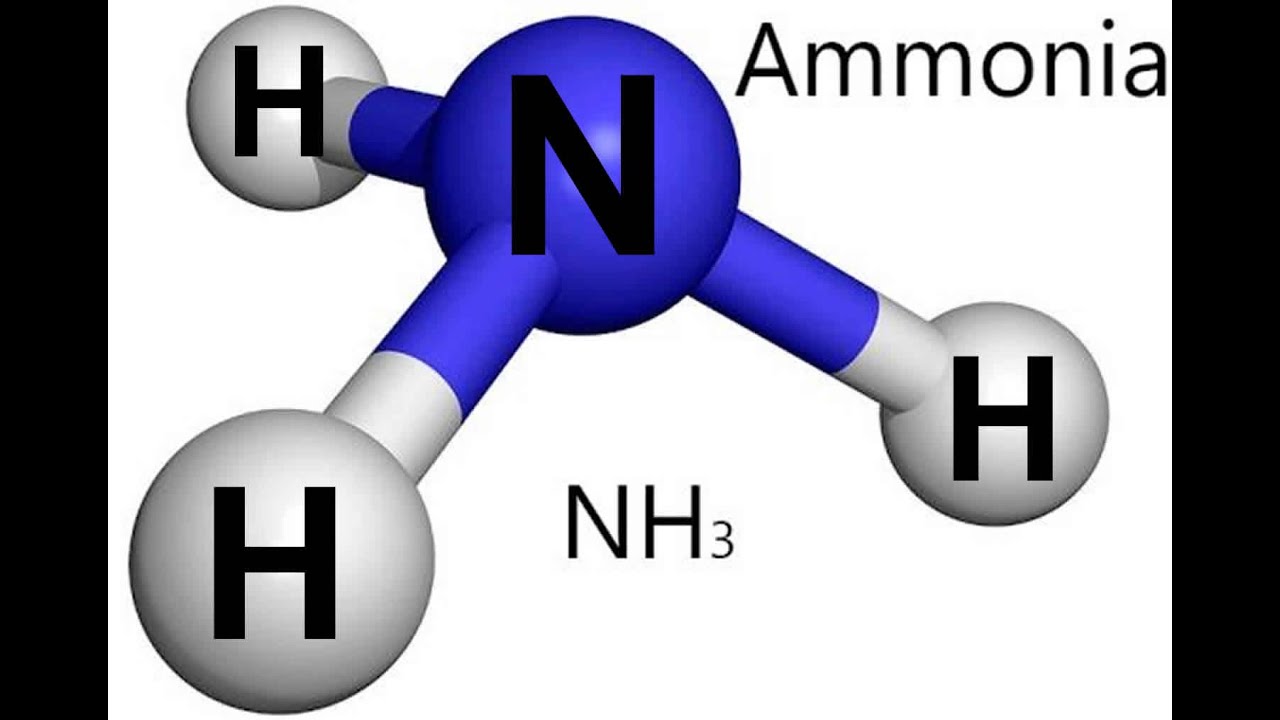
Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а в основании — три атома водорода.
Общие электронные пары в молекуле смещены к более электроотрицательному атому азота. Он заряжен отрицательно, а атомы водорода — положительно. Поэтому молекула полярна и представляет собой диполь. Благодаря высокой полярности молекулы аммиака способны образовывать водородные связи между собой и с молекулами воды. Образование водородных связей влияет на физические свойства вещества.
При обычных условиях аммиак представляет собой бесцветный газ с резким неприятным запахом. Он легче воздуха. Ядовит.
Аммиак очень хорошо растворяется в воде — при (20) °С в одном объёме воды может раствориться до (700) объёмов аммиака. Раствор с содержанием газа (25) % называется аммиачной водой, а (10)%-ный раствор используется в медицине как нашатырный спирт.

Аммиак легко сжижается при пониженной температуре или при повышенном давления. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать его в холодильных установках.
1. Восстановительные свойства.
Степень окисления азота в аммиаке — (–3), поэтому в окислительно-восстановительных реакциях он выступает в роли сильного восстановителя.
Аммиак окисляется кислородом с образованием азота или оксида азота((II)). Результат реакции зависит от условий её протекания.
- При горении аммиака в чистом кислороде образуется азот:
- 4N−3H3+3O20=2N20+6H2O−2.
- Если реакция проводится с катализатором, то образуется оксид азота((II)):
- 4N−3H3+5O20=k4NO+2+6H2O−2.
2. Основные свойства.
Если в водный раствор аммиака добавить несколько капель фенолфталеина, то его окраска станет малиновой. Значит, раствор содержит гидроксид-ионы. Образование этих ионов происходит в результате реакции между водой и молекулами аммиака:
NH3+H2O⇄NH3⋅H2O⇄NH4++OH−.
Образующийся в реакции неустойчивый гидрат аммония частично диссоциирует на ионы аммония и гидроксид-ионы.
Аммиак реагирует с кислотами. При этом образуются соли аммония. Так, с соляной кислотой образуется хлорид аммония, а с серной — сульфат аммония:
- NH3+HCl=NH4Cl,
- 2NH3+H2SO4=(NH4)2SO4.
- В промышленности аммиак синтезируют из азота и водорода:
- N2+3H2⇄t,p,k2NH3.

- Производство аммиака
- Лабораторный способ получения — реакция между солью аммония и гидроксидом кальция:
- 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O.
В больших количествах аммиак применяется для производства азотной кислоты и минеральных удобрений, а также красителей и взрывчатых веществ. Используется в холодильных установках. Нашатырный спирт находит применение в медицине и в быту.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/azot-i-ego-soedineniia-161796/re-38361faf-ef50-48c1-81b8-a678e93fd08f
Азот. Аммиак. Соли аммония
Селитра – природные нитраты натрия и калия – была известна в Китае в первые века нашей эры; ее использовали для приготовления пороха и проведения фейерверков.
Позже она упоминается в трудах европейских алхимиков (латинские названия – nitro или sal nitri).
Нагревая селитру с железным купоросом, алхимики получали азотную кислоту, которая длительное время называлась по-латыни aqua fortis («крепкая вода»; в русских текстах обычно встречается термин «крепкая водка»).
Чистую азотную кислоту впервые получил немецкий химик Иоганн Рудольф Глаубер действуя на селитру купоросным маслом (концентрированной серной кислотой):
KNO3 + H2SO4 = KHSO4 + HNO3↑
 Пустыня Атакама. Место добычи чилийской селитры
Пустыня Атакама. Место добычи чилийской селитры
Он же обнаружил, что при взаимодействии азотной кислоты с поташом K2CO3 образуется чистая калийная селитра.
Это открытие имело большое практическое значение, ведь раньше селитру, необходимую для производства пороха, ввозили в Европу из стран Востока, а также выделяли из соляного налёта на стенах конюшен или из селитряных ям, где она образовывалась под действием микроорганизмов как конечный продукт окисления азотсодержащих органических соединений.
При прокаливании смеси селитры NaNO3,железного купороса FeSO4∙7H2O, алюмокалиевых квасцов KAl(SO4)2∙12H2O и нашатыря NH4Cl алхимикам удалось получить жидкость, растворявшую даже «царя металлов» — золото.
Поэтому ее и назвали aqua regia, что значит «царская вода» или «царская водка». Царская водка – жидкость жёлтого цвета, образующаяся при смешении трёх объёмов соляной и одного объёма азотной кислот.
В царской водке без труда растворяется даже платина.
Азот независимо друг от друга открыли в конце XVIII в. несколько учёных. Английский исследователь Генри Кавендиш получил «мефитический воздух» (так он назвал азот), многократно пропуская воздух над раскаленным углем (тем самым удаляя кислород), а потом через раствор щелочи для поглощения образовавшегося углекислого газа СО2.
 Генри Кавендиш
Генри Кавендиш
Соотечественник Кавендиша Джозеф Пристли описал образование газа, не поддерживающего горение и дыхание, — «флогистированного воздуха», — наблюдая за горением свечи в закрытом сосуде.
Наконец, ещё один английский учёный, Даниэль Резерфорд, также получил азот из воздуха. В отличие от Кавендиша и Пристли, он сразу же, 1772 г., опубликовал работу, где описал получение и свойства выделенного им «удушливого воздуха». Поэтому именно Резерфорд считается первооткрывателем азота.
В природе наибольшее количество азота находится в несвязанном виде в воздухе. Основной состав атмосферного воздуха определил А.Л.Лавуазье, по предложению которого новый элемент и назвали азотом.
Название это составлено из греческого слова «зое» («жизнь») и приставки «а»- («не-») и означает «безжизненный», «не дающий жизнь».
Латинское низвание азота – Nitrogenium – переводится как «образующий селитру».
Редко встречаются минералы, которые содержат азот, например чилийская селитра NaNO3, залежи которой тянутся вдоль побережья Чили и Перу на расстояние свыше 3600 км. В конце XIX в.
добыча ее составляла примерно 0,5 тонн в год. Не случайно у предпринимателей и ученых возникали опасения в том, что скоро ее запасы иссякнут.
Это и подтолкнуло химиков к разработке технологий по связыванию азота воздуха.
В промышленности азот получают из жидкого воздуха. Для этого воздух переводят в жидкое состояние, и при температуре – 196 0С азот испаряется.
В лаборатории азот получают разложением нитрита аммония NH4NO2 при нагревании:
NH4NO2 = N2↑ + H2O
Физические свойства
 Жидкий азот
Жидкий азот
Азот – газ без цвета, вкуса и запаха (tпл = -210 0С, tкип = -196 0С), мало растворимый в воде. Свободный азот химически инертен из-за высокой прочности молекулы N2, в которой атомы связаны тройной связью. Поэтому азот с трудом вступает в химические реакции, не поддерживает горение и дыхание.
- Характерные степени окисления:
- — 3 0 +1 +2 +3 +4 +5
- NH3 N2 N2O NO N2O3 NO2 N2O5
Химические свойства
- В химических реакциях азот может быть как окислителем, так и восстановителем.
- Азот взаимодействует как окислитель:
- а) с водородом:
- N2 + 3H2 = 2NH3
- б) с металлами:
- N2 + 3Ca = Ca3N2
- Азот взаимодействует как восстановитель:
- а) с кислородом:
- N2 + O2 = 2NO
- б) с фтором:
- N2 + F2 = 2NF3
Применение
Азот является исходным сырьем для получения аммиака, азотной кислоты и азотных удобрений.
Аммиак
Аммиак – бесцветный газ с резким запахом, хорошо растворимый в воде. В одном литре воды при температуре 20 0С растворяется 700 л аммиака. Этот раствор называется аммиачной водой или нашатырным спиртом.
Химические свойства
Кислотно-основные свойства
Атом азота в молекуле аммиака имеет неподеленную электронную пару, которая может участвовать в образовании донорно-акцепторной связи. В частности, атом азота в NH3 способен присоединять ион водорода Н+. Вещества, молекулы которых способны присоединять ионы водорода, обладают основными свойствами. Следовательно, аммиак обладает основными свойствами:
- взаимодействие аммиака с водой:
NH3 + HOH ⇄ NH4OH ⇄ NH4+ + OH—
- взаимодействие с галогеноводородами:
NH3 + HCl ⇄ NH4Cl
- взаимодействие с кислотами (в результате образуются средние и кислые соли):
NH3 + H3PO4 = (NH4)3PO4; (NH4)2HPO4; (NH4)H2PO4
- аммиак взаимодействует с солями некоторых металлов с образованием комплексных соединений – аммиакатов:
- CuSO4 + 4NH3 = [Cu(NH3)4]SO4 Сульфат тетрааммин меди (II)
- AgCl + 2NH3 = [Ag(NH3)2]Cl Хлорид диамин серебра (I)
- Окислительно – восстановительные свойства
- В молекуле аммиака азот имеет степень окисления – 3, поэтому в окислительно – восстановительных реакциях он может только отдавать электроны и является только восстановителем.
- аммиак восстанавливает некоторые металлы из их оксидов:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
- аммиак окисляется кислородом без катализатора до азота:
4NH3 + 3O2 = 2N2 + 6H2O
- аммиак в присутствии катализатора окисляется до монооксида азота NO:
4NH3 + 5O2 = 4NO + 6H2O
Соли аммония
 Хлорид аммония
Хлорид аммония
При взаимодействии аммиака или гидроксида аммония с кислотами образуются соли аммония:
Все соли аммония хорошо растворимы в воде. Соли аммония имеют общие свойства солей. К особым свойствам солей аммония относятся реакции их термического разложения, которые протекают по-разному, в зависимости от характера аниона, например:
- (NH4)2SO4 = NH3↑ + NH4HSO4
- NH4NO3 = N2O↑ + 2H2O
- NH4Cl = NH3↑ + HCl↑
- Реакция взаимодействия солей аммония со щелочью является качественной реакцией на катион аммония NH4+:
- NH4Cl + NaOH = NaCl + NH3↑ + H2O
- NH4+ + OH— = NH3↑ + H2O
- Выделяющийся аммиак определяют по запаху или по посинению влажной лакмусовой бумаги.
- Применение аммиака и солей аммония
Из аммиака получают азотную кислоту, гидроксид аммония (нашатырный спирт), соли аммония и т.д. Нашатырный спирт NH4OH и нашатырь NH4Cl широко применяется в медицине. Нитрат аммония, фосфат аммония и другие аммонийные соли используются в сельском хозяйстве в качестве удобрений.
Скачать:
- Скачать бесплатно реферат на тему: «Азот» Azot.doc (49 Загрузок)
- Скачать бесплатно реферат на тему: «Азот и фосфор» Азот-и-фосфор.docx (37 Загрузок)
- Скачать бесплатно реферат на тему: «Соединения азота» Соединения-азота.docx (33 Загрузки)
- Скачать бесплатно реферат на тему: «Производство азотных удобрений» ПРОИЗВОДСТВО-АЗОТНЫХ-УДОБРЕНИЙ.docx (30 Загрузок)
- Скачать бесплатно реферат на тему: «Аммиак» Аммиак.docx (47 Загрузок)
- Скачать бесплатно реферат на тему: «Аммиачная селитра» Аммиачная-селитра.docx (36 Загрузок)
- Скачать рефераты по другим темам можно здесь
Источник: https://al-himik.ru/azot-ammiak-soli-ammonija/
Аммиака раствор
10% водный раствор аммиака. Концентрация активного вещества в литре раствора — 440 мл.
В качестве вспомогательного компонента в состав препарата входит вода очищенная (в объеме до 1 л).
Форма выпуска
Раствор для ингаляций и наружного применения 10%. Выпускается в флаконах-капельницах 10 мл, флаконах 40 и 100 мл.
Представляет собой прозрачную, летучую жидкость, без цвета и с резким запахом.
Фармакологическое действие
Раздражающее, антисептическое, аналептическое, рвотное.
Фармакодинамика и фармакокинетика
Средство оказывает раздражающее действие на экстерорецепторы кожи и провоцирует местное высвобождение простагландинов, кининов и гистамина. В спинном мозге выполняет функцию либератора энкефалинов и эндорфинов, которые блокируют поток болевых импульсов из патологических очагов.
При попадании в верхние дыхательные пути вступает во взаимодействие с окончаниями тройничного нерва и рефлекторно возбуждает дыхательный центр. Концентрированный раствор вызывает колликвацию (размягчение и растворение) белков микробной клетки.
При любом способе введения быстро элиминируется из организма (преимущественно бронхиальными железами и легкими). Рефлекторно влияет на тонус сосудистых стенок и деятельность сердца.
- На месте аппликации при наружном применении расширяет сосуды, улучшает регенерацию тканей и их трофику, а также стимулирует отток метаболитов.
- При раздражении кожи аналогичные рефлексы вызывает и в расположенных сегментарно мышцах и внутренних органах, способствуя восстановлению нарушенных функций и структур.
- Подавляет очаг возбуждения, который поддерживает патологический процесс, снижает напряжение мышц, гипералгезию, снимает спазм сосудов, оказывая, таким образом, отвлекающее действие.
- При продолжительном контакте прижигает слизистые и кожу, что сопровождается гиперемией тканей, развитием отечности и болезненности.
- Прием per os в малых концентрациях стимулирует секрецию желез, воздействуя на рвотный центр, рефлекторно повышает его возбудимость и вызывает рвоту.
- В кровяное русло препарат не поступает.
Показания к применению
- Ингаляционно применяется для возбуждения дыхания при обмороке.
- Прием внутрь показан для стимуляции рвоты (в разведенном виде).
- Наружно используется для обеззараживания рук врача перед хирургической операцией, в виде примочек при невралгии, укусах насекомых, миозитах.
Противопоказания
Непереносимость.
Местное применение противопоказано при кожных заболеваниях.
Побочные действия: влияние на организм человека паров и раствора аммиака
В случае приема раствора в неразведенном виде возможны ожоги пищеварительного канала (пищевода и желудка). Вдыхание препарата в высокой концентрации может спровоцировать рефлекторную остановку дыхания.
Раствор аммиака: инструкция по применению
В инструкции по применению Нашатырного спирта указывается, что доза препарата подбирается индивидуально в зависимости от показаний.
В хирургической практике в качестве средства для мытья рук раствор используется по методу Спасокукоцкого-Кочергина, разводя 50 мл раствора в 1 л кипяченой воды (теплой).
При использовании для возбуждения дыхания раствор наносится на марлю или вату. При укусах насекомых используется в виде примочек.
Применение Нашатырного спирта в садоводстве
Применение для растений Нашатырного спирта достаточно разнообразно: его используют от тли, для обработки лука от луковой мухи, для подкормки растений.
Нашатырный спирт от тли используется из расчета 2 ст. ложки на 10 л воды. В ведро также следует добавить немного стирального порошка — это обеспечит лучшее прилипание. Раствор используют для опрыскивания растений.
Нашатырный спирт как удобрение: в этом случае на 4 л воды следует взять 50 мл раствора. Средство является не только хорошей подкормкой для комнатных и огородных растений, но также позволяет избавиться от мошек и комаров.
Для полива лука следует развести в ведре воды 1-2 ст. ложки нашатырного спирта. Поливать растения таким средством рекомендуется с момента посадки и до конца июня.
Как почистить золото?
Существует несколько способов чистки золота Нашатырным спиртом.
Можно смешать 1 ч. ложку спирта со стаканом воды и 1 ст. ложкой любого моющего средства, а можно добавить в воду (200 мл), нашатырный спирт (1 ч. ложку), перекись водорода (30 мл), половинку чайной ложки жидкого моющего средства.
В первом случае украшения кладут в чистящий раствор на час-два, во втором — на 15 минут. После чистки золото следует промыть в воде и насухо вытереть салфеткой.
Как почистить серебро?
Чтобы провести чистку серебра, Нашатырный спирт разводят водой в пропорции 1:10 (1 часть спирта на 10 частей воды). Изделия из серебра оставляют в растворе в течение нескольких часов, затем прополаскивают их в воде и протирают мягкой салфеткой.
Для регулярной чистки серебра используют мыльный раствор, в который добавляют небольшое количество нашатырного спирта.
Нашатырный спирт от тараканов и муравьев
Для борьбы с муравьями 100 мл раствора разводят в литре воды и промывают этим средством мебель на кухне. Чтобы избавиться от тараканов с нашатырным спиртом моют пол.
Нашатырный спирт для пяток
В качестве средства для смягчения огрубевшей кожи стоп нашатырный спирт смешивают с глицерином (1:1). Средство наносят на ступни перед сном, а сверху надевают носки.
Передозировка. Воздействие на организм человека паров аммиака
Передозировка вызывает усиление проявлений побочных реакций. Так, действие на организм человека высокой дозы Раствора аммиака при пероральном приеме проявляется:
- рвотой с характерным запахом аммиака;
- поносом с тенезмами (ложными болезненными позывами к дефекации);
- отеком гортани;
- насморком;
- кашлем;
- возбуждением;
- судорогами;
- коллапсом.
В ряде случаев возможен летальный исход (пациент умирает при приеме 10-15 г гидроксида аммония).
Лечение при передозировке симптоматическое.
Иногда люди интересуются, что будет, если выпить нашатырный спирт. Следует знать, что пероральный прием раствора в чистом виде может спровоцировать сильные ожоги пищеварительного канала.
Симптомы отравления аммиаком
Воздействие на человека аммиака при вдыхании его паров проявляется в виде раздражения слизистых глаз и респираторного тракта. При этом интенсивность раздражения зависит от концентрации газа.
Признаки отравления аммиачными парами:
- обильное слезотечение;
- слюнотечение;
- учащенность дыхания;
- повышенное потоотделение;
- гиперемия лица;
- чувство тяжести и стеснения в груди;
- боль за грудиной;
- судорожный кашель;
- чихание;
- насморк;
Источник: https://medside.ru/ammiaka-rastvor




