У
органических кислот своя классификация.
По типу углеводородного радикала
различают предельные карбоновые кислоты, у которых све связи
сигма-типа, например, пропановая кислота, или масляная; непредельные,
у которых есть кратные связи, например, акриловая, или пропэновая кислота; и ароматические
карбоновые кислоты, у которых есть ароматическое кольцо: например,
бензойная кислота.
По
числу карбоксильных групп различают одноосновные карбоновые кислоты, у
которых одна карбоксильная группа, например, муравьиная, уксусная кислота; двухосновные,
у которых две карбоксильные группы, например, щавелевая, малоновая кислота; и многоосновные
кислоты, у которых несколько карбоксильных групп, например, лимонная
кислота.
Органические
кислоты, как и неорганические, обладают кислотными свойствами, то есть
способностью к отщеплению иона водорода.
Карбоновые
кислоты
– слабые электролиты. Так, константа диссоциации уксусной кислоты: одна
целая восемь десятых на десять в минус пятой степени.

![]()
От чего же зависит сила карбоновой кислоты?
Во-первых, от строения. То есть чем больше положительный заряд
на атоме водорода в молекуле кислоты, тем более сильным электролитом она будет.
Наличие углеводородных радикалов с карбоксильной группой уменьшает способность
кислоты диссоциировать, поэтому и сила кислоты будет уменьшаться.
Так, в ряду от муравьиной до два-два-диметил-пропановой кислоты
сила кислот будет уменьшаться.

- То есть самой сильной кислотой будет муравьиная, или
метановая кислота, у которой и самая высокая константа диссоциации. - Введение
электроноакцэпторных заместителей увеличивает положительный заряд на томе
водорода, а значит, и силу кислоты. - Например,
в ряду от уксусной до трихлор-уксусной кислоты сила кислот будет увеличиваться,
так как увеличивается число электроноакцэпторного заместителя – хлора.

Карбоновые кислоты
обладают свойствами, характерными для минеральных кислот. Из-за смещения
электронной плотности от гидроксильной группы к сильно поляризованной
карбонильной группе молекулы карбоновых кислот способны к электролитической
диссоциации.
Так, при
диссоциации уксусной кисоты образуется ион водорода и ацэтат-ион.

Неорганические
кислоты в растворе также диссоциируют с образованием ионов водорода и изменяют
окраску индикаторов. При диссоциации соляной кислоты образуются ионы водорода и
хлорид-ионы.
Органические и
неорганические кислоты реагируют с металлами, стоящими в электрохимическом ряду
напряжений металлов до водорода.

Например, в
реакции уксусной кислоты с магнием образуется соль – ацэтат магния и выделяется
газ – водород, в реакции соляной кислоты с магнием образуется соль – хлорид
магния и газ водород.

Органические и
неорганические кислоты реагируют с основными и амфотэрными оксидами.
В реакции уксусной
кислоты с основным оксидом – оксидом меди два, образуется соль – ацэтат меди
два и вода; в реакции соляной кислоты с оксидом меди два образуется соль –
хлорид меди два и вода.

- В реакции уксусной
кислоты с амфотэрным оксидом – оксидом алюминия образуется соль – ацэтат
алюминия и вода; в реакции соляной кислоты с оксидом алюминия образуется хлорид
алюминия и вода.
Органические и
неорганические кислоты взаимодействуют с основаниями. Эти реакции
являются реакциями нейтрализации.
- Так, в реакции
уксусной кислоты с гидроксидом калия образуется соль – ацэтат калия и вода, в
реакции соляной кислоты с гидроксидом калия образуется соль – хлорид калия и
вода. - Органические и
неорганические кислоты реагируют с аммиаком с образованием солей аммония. - Например, в
реакции уксусной кислоты с аммиаком образуется соль – ацэтат аммония; в реакции
соляной кислоты с аммиаком образуется соль – хлорид аммония. - Органические и
неорганические кислоты реагируют с солями слабых кислот. - Так, в реакции
уксусной кислоты с карбонатом натрия образуется соль – ацэтат натрия,
углекислый газ и вода; в реакции соляной кислоты с карбонатом натрия образуется
соль – хлорид натрия, углекислый газ и вода.
Таким образом,
химические свойства органических кислот обусловлены в основном наличием в
молекуле карбоксильной группы. Общие свойства органических и неорганических
кислот проявляются в реакциях с основаниями, некоторыми активными металлами,
основными и амфотэрными оксидами, солями более слабых кислот.
Источник: https://videouroki.net/video/41-organicheskie-i-neorganicheskie-kisloty.html
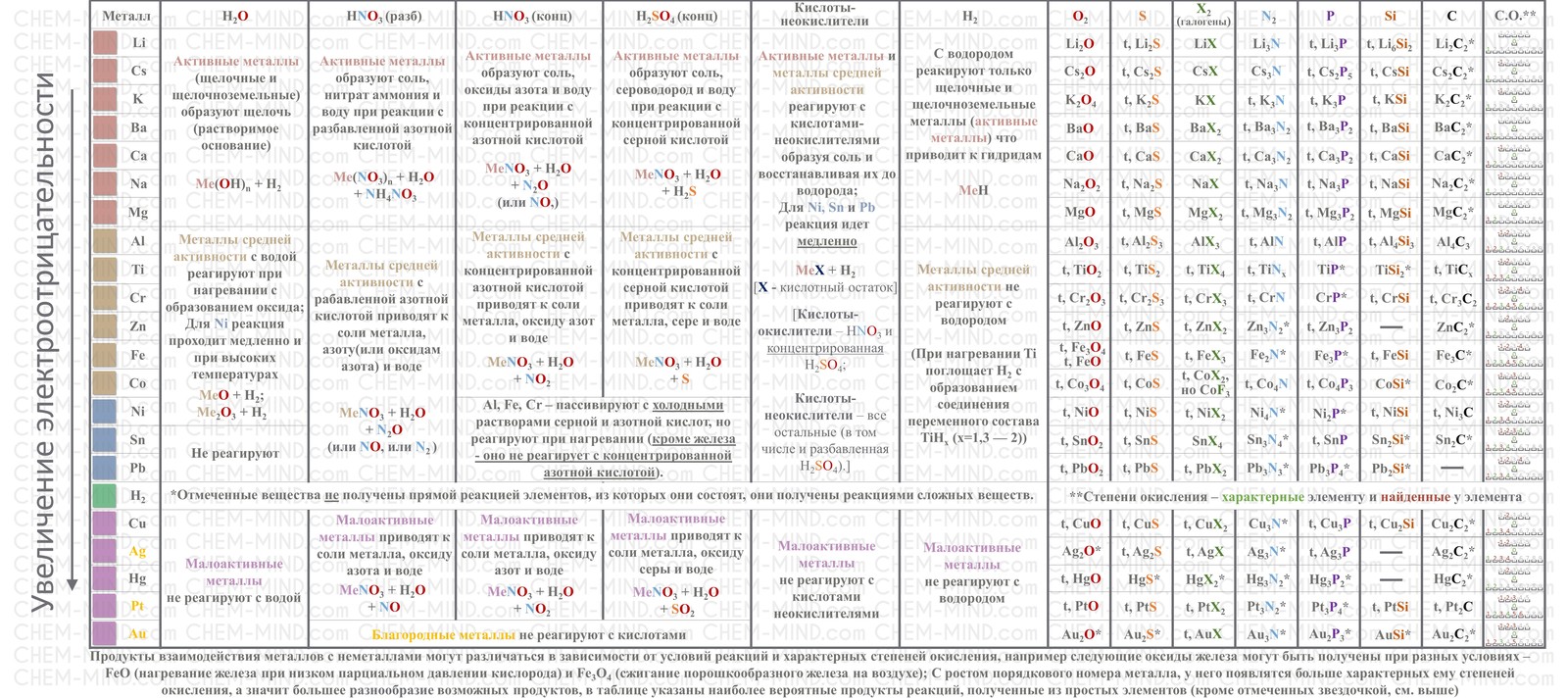
Классификация неорганических веществ
Неорганическая химия — раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO — соответствует основанию Cu(OH)2
- Li2O — соответствует основанию LiOH
- FeO — соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 — соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 — соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

- Основные
- Амфотерные (греч. ἀμφότεροι — двойственный)
- Кислотные
- SO2 — H2SO3
- SO3 — H2SO4
- P2O5 — H3PO4
- N2O5 — HNO3
- NO2 — HNO2, HNO3
- Mn2O7 + H2O → HMnO4 (сохраняем СО марганца +7)
- SO3 + H2O → H2SO4 (сохраняем СО серы +6)
- SO2 + H2O → H2SO3 (сохраняем СО серы +4)
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO. Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют. Li2O + H2O → LiOH (основный оксид + вода → основание) Li2O + P2O5 → Li3PO4 (осн. оксид + кисл. оксид = соль) Li2O + H3PO4 → Li3PO4 + H2O (осн. оксид + кислота = соль + вода) Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3. С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами. Fe2O3 + K2O → (t) KFeO2 (амф. оксид + осн. оксид = соль) ZnO + KOH → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль) ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции) Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции) 
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7. Каждому кислотному оксиду соответствует своя кислота. Это особенно важно помнить при написании продуктов реакции: следует сохранять степени окисления. Некоторым кислотным оксидам соответствует сразу две кислоты.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 — не реагирует с водой, так как продукт реакции — H2SiO3 является нерастворимой кислотой.

- Несолеобразующие оксиды — оксиды неметаллов, которые не имеют соответствующих им гидроксидов и не вступают в реакции солеобразования. К таким оксидам относят:
- Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
- FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания — химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр — NaOH, едкое кали — KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода — реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
- Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
- LiOH + MgCl2 → LiCl2 + Mg(OH)2↓
- KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
- В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами — с образованием соли и воды, так и с основаниями — с образованием комплексных солей.
- Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
- Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
- При нагревании до высоких температур комплексные соли не образуются.
- Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода — при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота — химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
- H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода — реакция нейтрализации)
- Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
- Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
- Существуют нестойкие кислоты, которые в водном растворе разлагаются на кислотный оксид (газ) и воду — угольная и сернистая кислоты:
- H2CO3 → H2O + CO2↑
- H2SO3 → H2O + SO2↑
Записать эти кислоты в растворе в виде «H2CO3 или H2SO3» — будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде — виде газа и воды.
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
- Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной — серную кислоту. Природу не обманешь ?
- K2S + HCl → H2S + KCl (из сильной — соляной кислоты — получили более слабую — сероводородную)
- K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной — серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота — H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Соли
Соль — ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль — NaCl.
По классификации соли бывают:
- Средние — продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые — продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные — продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные — содержат два разных металла и один кислотный остаток (NaCr(SO4)2
- Смешанные — содержат один металл и два кислотных остатка MgClBr (хлорид-бромид магния
- Комплексные — содержат комплексный катион или анион — атом металла, связанный с несколькими лигандами: Na[Cr(OH)4] (тетрагидроксохромат натрия)
Растворы или расплавы солей могут вступать в реакцию с металлом, который расположен левее металла, входящего в состав соли. В этом случае более активный металл вытеснит менее активный из раствора соли. Например, железо способно вытеснить медь из ее солей:
Fe + CuSO4 → FeSO4 + Cu (железо стоит левее меди в ряду активности и способно вытеснить медь из ее солей)
Замечу важную деталь: исход реакции основание + кислота иногда определяет соотношение. Запомните, что если двух- или трехосновная кислота дана в избытке — получается кислая соль, если же в избытке дано основание — средняя соль.
NaOH + H2SO4 → NaHSO4 (кислота дана в избытке)
2NaOH + H2SO4 → Na2SO4 + H2O (основание дано в избытке)
Если в ходе реакции соли с кислотой, основанием или другой солью выпадает осадок, выделяется газ или образуется слабый электролит (вода), то такая реакция идет. Кислую соль также можно получить в реакции соли с соответствующей двух-, трехосновной кислотой.
- Na2CO3 + HCl → NaCl + H2O + CO2↑ (сильная кислота — соляная, вытесняет слабую — угольную)
- MgCl2 + LiOH → Mg(OH)2↓ + LiCl
- K2SO4 + H2SO4 → KHSO4 (средняя соль + кислота = кислая соль)
- Чтобы сделать из кислой соли — среднюю соль, нужно добавить соответствующее основание:
- KHSO4 + KOH → K2SO4 + H2O (кислая соль + основание = средняя соль)
Источник: https://studarium.ru/article/161
Органические кислоты
- Карбоновые кислоты
- Если в неорганической химии понятие «кислота» определяется наличием протона водорода в растворе H+, то органические кислоты определяются группой -СOOH.
- Карбоксильная группа -COOH состоит по сути из двух групп: карбонильной -СOH (альдегидная группа) и гидроксильной группы -OH (в органической химии эта группа относится к спиртам).
- Интересно то, что группа -СOH очень редко вступает в химические реакции (в школьном курсе и в формате ЕГЭ — крайне редко), а вот гидроксильная группа -OH — «отдувается за двоих»! ????
- Классификация органических кислот

- Здесь все просто — деление по числу карбоксильных групп и по составу радикала.
- Номенклатура
- Номенклатура карбоновых кислот достаточно проста:
- название R по общему количеству атомов + «-овая» + «кислота«. Если карбоксильный групп несколько, то перед «-овая» указывается количество групп — «-диовая», «-триовая» и т.д.
- нумерация цепи начинается от карбоксильной группы
- С6H5COOH — бензойная кислота (бензолкарбоновая кислота)
Изомерия органических кислот
- Начиная с С4 — изомерия углеродного скелета
- межклассовая: органические кислоты изомерны сложным эфирам:

Физические свойства:
- Естественно, это жидкости. «Естественно» — т.к. такие молекулы образуют водородные связи.
- Хорошо растворимы в воде (тоже следствие водородных связей)

Химические свойства карбоновых кислот

Карбоксильная группа устроена таким образом, что молекула достаточно легко может отщеплять водород — проявлять свойства кислоты. Кислород карбонильной группы тянет электронную плотность на себя, поэтому связь O-H в гидроксильной группе поляризуется, и H становится более подвижным.
Важно понимать, что органические кислоты НАМНОГО слабее неорганических (но: угольная H2CO3 и кремниевая H2SiO3 — слабее органических).
Соответственно, органические кислоты реагируют с
- металлами и их соединениями:
2CH3COOH + 2Na = 2CH3COONa + H2
2CH3COOH + CaO = (CH3COO)2Ca + H2O
CH3COOH + NaOH = CH3COONa + H2O - вытесняют более слабые кислоты из их солей:
2СH3COOH + Na2CO3 = 2CH3COONa + CO2 + H2O - Реакции этерификации = образования сложных эфиров:

CH3COOH + CH3OH = CH3COOCH3 + H2O
- Восстанавливаются до альдегидов
Получение кислот
- Оокислением из альдегидов и спиртов
- Гидролиз сложных эфиров:
CH3COOCH3 + H2O (KOH) = CH3COOH + CH3OH - Именно метановую кислоту можно получить из неорганических продуктов:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
- в ЕГЭ это вопрос А16 — Характерные химические свойства альдегидов, предельных карбоновых кислот
- в ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: кислородсодержащих веществах: карбоновых кислотах
Обсуждение: «Органические кислоты»
(Правила комментирования)
Источник: https://distant-lessons.ru/ximiya/organicheskie-kisloty
Неорганические кислоты
Сложные вещества, состоящие из атомов водорода и кислотного остатка, называются минеральными или неорганическими кислотами. Кислотным остатком являются оксиды и неметаллы, соединённые с водородом. Главное свойство кислот – способность образовывать соли.

Основная формула минеральных кислот – HnAc, где Ac – кислотный остаток. В зависимости от состава кислотного остатка выделяют два типа кислот:
- кислородные, содержащие кислород;
- бескислородные, состоящие только из водорода и неметалла.
Основной список неорганических кислот в соответствии с типом представлен в таблице.
| Тип | Название | Формула |
| Кислородные | Азотная | HNO3 |
| Азотистая | HNO2 | |
| Борная | H3BO3 | |
| Дихромовая | H2Cr2O7 | |
| Йодная | H5IO6 | |
| Йодноватая | HIO3 | |
| Кремниевые – метакремниевая и ортокремниевая | H2SiO3 и H4SiO4 | |
| Марганцовая | HMnO4 | |
| Марганцовистая | H2MnO4 | |
| Метафосфорная | HPO3 | |
| Мышьяковая | H3AsO4 | |
| Ортофосфорная | H3PO4 | |
| Серная | H2SO4 | |
| Сернистая | H2SO3 | |
| Тиосерная | H2S2O3 | |
| Тетратионовая | H2S4O6 | |
| Угольная | H2CO3 | |
| Фосфористая | H3PO3 | |
| Фосфорноватистая | H3PO2 | |
| Хлорная | HClO4 | |
| Хлорноватая | HClO3 | |
| Хлористая | HClO2 | |
| Хлорноватистая | HClO | |
| Хромовая | H2CrO4 | |
| Циановая | HOCN | |
| Бескислородные | Фтороводородная (плавиковая) | HF |
| Хлороводородная (соляная) | HCl | |
| Бромоводородная | HBr | |
| Йодоводородная | HI | |
| Сероводородная | H2S | |
| Циановодородная | HCN |
Кроме того, в соответствии со свойствами кислоты классифицируются по следующим признакам:
- растворимость: растворимые (HNO3, HCl) и нерастворимые (H2SiO3);
- летучесть: летучие (H2S, HCl) и нелетучие (H2SO4, H3PO4);
- степень диссоциации: сильные (HNO3) и слабые (H2CO3).
Рис. 1. Схема классификации кислот.
Для обозначения минеральных кислот используются традиционные и тривиальные названия. Традиционные названия соответствуют наименованию элемента, который образует кислоту с добавлением морфем -ная, -овая, а также -истая, -новатая, -новатистая для обозначения степени окисления.
Основные методы получения кислот представлены в таблице.
| Метод | Описание | Примеры |
| Взаимодействие простых веществ | Образование бескислородных кислот | – H2 + Cl2 = 2HCl; – H2 + S = H2S |
| Взаимодействие оксидов с водой | Образование кислородных кислот | SO3 + H2O = H2SO4 |
| Взаимодействие солей с растворами кислот | Получение слабых кислот | Na2SiO3 + 2HCl = H2SiO3 + 2NaCl |
| Электролиз | Под действием электричества водные растворы солей образуют сильные кислоты | 2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 |
Большинство кислот – жидкости с кислым вкусом. Вольфрамовая, хромовая, борная и несколько других кислот находятся в твёрдом состоянии при нормальных условиях. Некоторые кислоты (Н2СО3, H2SO3, HClO) существуют только в виде водного раствора и относятся к слабым кислотам.
Рис. 2. Хромовая кислота.
Кислоты – активные вещества, реагирующие:
- с металлами:
- с оксидами:
CaO + 2HCl = CaCl2 + H2O; - с основанием:
H2SO4 + 2KOH = K2SO4 + 2H2O; - с солями:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Все реакции сопровождаются образованием солей.
Возможна качественная реакция с изменением цвета индикатора:
- лакмус окрашивается в красный;
- метил оранж – в розовый;
- фенолфталеин не меняется.
Рис. 3. Цвета индикаторов при взаимодействии кислоты.
Химические свойства минеральных кислот определяются способностью диссоциироваться в воде с образованием катионов водорода и анионов водородных остатков. Кислоты, реагирующие с водой необратимо (диссоциируются полностью) называются сильными. К ним относятся хлорная, азотная, серная и хлороводородная.
Неорганические кислоты образованы водородом и кислотным остатком, которым являются атомы неметалла или оксид. В зависимости от природы кислотного остатка кислоты классифицируются на бескислородные и кислородсодержащие.
Все кислоты имеют кислый вкус и способны диссоциироваться в водной среде (распадаться на катионы и анионы). Кислоты получают из простых веществ, оксидов, солей.
При взаимодействии с металлами, оксидами, основаниями, солями кислоты образуют соли.
Средняя оценка: 4.4. Всего получено оценок: 119.
Источник: https://obrazovaka.ru/himiya/neorganicheskie-kisloty-spisok-osnovnye-formuly.html
Кислоты — классификация, свойства, получение и применение
Кислоты (неорганические, минеральные) — это сложные соединения состоящие из катиона водорода (H+) и аниона кислотного остатка(SO32-, SO42-, NO3— и т.д).
Кислотам дали такое название не просто так. Большинство из них имеют кислый вкус. С некоторыми из них знаком каждый из вас. Это, например, уксусная кислота, которая есть в каждом доме, аскорбиновая кислота (она же витамин C), лимонная кислота и т.д. Но не стоит все кислоты пробовать на вкус. Кислоты являются очень едкими веществами.
Даже всем нам привычная и известная аскорбиновая кислота в большой концентрации будет вредна нашему организму. А от более сильных кислот — серной, соляной и даже уксусной — можно получить очень сильные ожоги, вплоть до летального исхода.
Поэтому при работе с кислотами нужно быть осторожными, а также соблюдать технику безопасности!!!
Таблица названий некоторых кислот и их солей
| Серная | H2SO4 | Сульфат |
| Сернистая | H2SO3 | Сульфит |
| Сероводородная | H2S | Сульфид |
| Соляная (хлористоводородная) | HCl | Хлорид |
| Фтороводородная (плавиковая) | HF | Фторид |
| Бромоводородная | HBr | Бромид |
| Йодоводородная | HI | Йодид |
| Азотная | HNO3 | Нитрат |
| Азотистая | HNO2 | Нитрит |
| Ортофософорная | H3PO4 | Фосфат |
| Угольная | H2CO3 | Карбонат |
| Кремниевая | H2SiO3 | Силикат |
| Уксусная | CH3COOH | Ацетат |
Классификация кислот
| Кислородсодержащие (H2SO4) | Бескислородные (HCl) |
| Одноосновные (HCl) | Двухосновные (H2SO4) | Трёхосновные (H3PO4) |
Понятие «одноосновная кислота» произошло по причине того, что для нейтрализации одной молекулы одноосновной кислоты нам понадобится одна молекула основания. для двухосновной — соответственно две молекулы и т. д.
| Растворимые (HCl) | Нерастворимые (H2SiO3) |
| Сильные (H2SO4) | Слабые (CH3COOH) |
| Летучие (H2S) | Нелетучие (H2SO4) |
| Устойчивые (H2SO4) | Неустойчивые (H2CO3) |
Свойства кислот
Изменение цвета индикаторов в кислой среде
| Метилоранж | оранжевый | красный |
| Лакмус | фиолетовый | красный |
| Фенолфталеин | бесцветный | бесцветный |
| Бромтимоловый синий | зеленый | желтый |
| бромкрезоловый зеленый | синий | желтый |
Химические свойства кислот
- Взаимодействие с металлами (в ряду активности находящихся до водорода), протекает с выделением газообразного водорода и образованием солей:
H2SO4 + 2Na → Na2SO4 + H2↑
Металлы, находящиеся в ряду активности после водорода, не вступают в реакцию с кислотой (кроме концентрированной серной кислоты).
Азотная и концентрированная серная кислоты проявляют свойства окислителей, и продукты реакций будут зависеть от концентрации, температуры и природы восстановителя.
- Взаимодействуют с оксидами основных и амфотерных металлов с образованием солей и воды:
H2SO4 + MgO → MgSO4 + H2O
- С основаниями, с образованием солей и воды (так называемая реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + H2O
- Кислоты могут взаимодействовать с солями, если в результате реакции будет образовываться нерастворимая соль, или выделяться газ:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2↑
- Сильные кислоты могут вытеснять из солей более слабые кислоты:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Получение кислот
- Взаимодействие кислотного оксида с водой:
H2O + SO3 →H2SO4
- Взаимодействие водорода и неметалла:
H2 + Cl2 → 2HCl
- Вытеснение слабой кислоты из солей, более сильной кислотой:
3H2SO4 + 2K3PO4 → 3K2SO4 + H3PO4
Применение кислот
В настоящее время, минеральные и органические кислоты находят множество сфер применения.
Серная кислота (H2SO4), находит широкое применение в химической технологии, для производства лакокрасочных материалов, производстве минеральных удобрений, в пищевой промышленности (пищевая добавка Е513), в качестве электролита в производстве аккумуляторных батарей.
Раствор двухромовокислого калия в серной кислоте (хромовая смесь) используются в лабораториях для мытья химической посуды. Являясь сильным окислителем, хромка позволяет отмывать посуду от следов загрязнений органическими веществами. Так же, хромовая смесь используется в органическом синтезе.

Борная кислота (H3BO3) используется в медицине как антисептик, в качестве флюса при пайке металлов, как борсодержащее удобрение, в домашнем хозяйстве используется как средство от тараканов.
Широко известны в домашнем использовании при выпечке уксусная и лимонная кислоты. Также в быту их используют для удаления накипи.
Знакомая всем с детства аскорбиновая кислота, более известная в народе как витамин С, применяется при лечении простудных заболеваний.
Азотная кислота (HNO3) находит применение при производстве взрывчатых веществ, при производстве минеральных азотсодержащих удобрений (аммиачная, калиевая селитра), в производстве лекарственных средств (нитроглицерин).
Источник: https://in-chemistry.ru/kisloty-klassifikatsiya-svojstva-poluchenie-primenenie
Урок химии в 11 классе по теме: «Кислоты органические и неорганические»
- Тема урока: Кислоты неорганические и органические.
- Цель: Изучение и закрепление знаний о кислотах и их свойствах.
- Задачи.
- Образовательные: выработать представление о наличие общих химических свойств кислот; закрепить умения пользоваться рядом напряжения металлов и таблицей растворимости.
- Развивающие:выяснить причины общности химических свойств кислот;
- прогнозировать возможные химические реакции кислот с использованием ряда напряжений металлов и таблицы растворимости; установить закономерности и отработать умения писать уравнения реакций взаимодействия кислот с основаниями, основными оксидами, металлами и солями; отработать навыки работы с лабораторным оборудованием.
- Воспитательные: осознание учащимися места неорганических кислот в системе естествознания наряду с организмами; понимание взаимосвязи полученных знаний о химических свойствах кислот с функционированием организма человека, применение в быту.
- Оборудование: микролаборатория для химического эксперимента, влажные салфетки, аскорбиновая кислота, лимон, NaOH, Na2CO3, HCl, CaO, Zn, фенолфталеин, индикаторная бумага, пробирки
- Ход урока
- 1.Организационный момент
- 2.Изучение нового
- Учитель: Тема нашего урока: «Кислоты органические и неорганические».
Мы с вами сегодня повторим, обобщим, систематизируем и углубим знания о неорганических и органических кислотах, об их составе, свойствах и применении. Во время работы на уроке будут проводится лабораторные опыты. Работу вы будете выполнять в группах по инструкции, которая находится у вас на столах. Результаты работы вы запишите в таблицу «Общие химические свойства кислот», которую вы подпишите и сдадите на проверку. Каждая группа будет отчитываться за выполненное задание.
Учитель: В повседневной жизни, в быту и природе мы часто сталкиваемся с кислотами. Скажите, где вы используете, и встречаются кислоты?
- Ученики:
- Если ты проглотил аскорбинку,
- Твой организм получил витаминку.
- Она закрывает болезни врата –
- Аскорбиновая кислота.
- Вы простудились – болит голова,
- Вас аспирин выручает всегда.
- Ну, и бесспорно, полезен лимон,
- Кислотою, лимонной наполнен он.
- Жуйте лимон, если горло болит,
- Сок чудотворный вас исцелит.
- Яблоко ешь – кислый вкус, красота,
- В яблоке яблочная кислота.
- Яблочный уксус по ложечке пейте,
- Вы обязательно похудеете.
- Уксус в столовой на кухне хранится
- Для консервации он пригодится.
- Ну и компресс из него помогает,
- Быстро он жар при простуде снижает.
- Фрукты и овощи, щавель, крапива
- Содержат кислоты – это не диво.
- Есть в муравьях и крапиве – невинная,
- С пользой для нас кислота муравьиная.
- Жжёт она кожу, но есть в ней и прок-
- Ваш ревматизм она вылечит в срок.
- Лучше не жуйте косточки вишни,
- Косточки сливы – это всё лишнее.
- Будет вам плохо – диагноз такой:
- Отравились синильной вы кислотой.
- Учитель: Вы просто молодцы, знаете, где встречаются кислоты в природе.
- Я лишь хочу добавить, что в желудке человека содержится сильная бескислородная одноосновная кислота — своеобразный санитарный кордон для микробов, которые попадают в организм с пищей.
- При скисании виноградного сока получается уксусная кислота, а при скисании молока или квашении капусты и при силосовании кормов для скота – молочная кислота.
- Учитель: в 8, 9и 10 классах вы уже говорили о кислотах, поэтому я прошу вас вспомнить определение кислоты.
- Ученики: Кислоты — это сложные вещества, в молекулах которых один или несколько атомов соединены с кислотными остатками.
- Кислоты – это электролиты, которые диссоциируют с образованием катионов водорода и анионов кислотного остатка.
- Какое определение можно дать органическим кислотам?
Учитель: Как и в биологии в химии существует классификация. Кислоты можно классифицировать по нескольким признакам, классификация кислот распечатана и лежит на ваших столах. Как же классифицируют кислоты? Каковы принципы классификации?
Ученики: рассказывают о классификации кислот.
Учитель: А теперь рассмотрим химические свойства кислот. Какими же свойствами будут обладать кислоты?
- Ученики: кислый вкус, действие на индикаторы, электрическая проводимость растворов, взаимодействие с металлами, оксидами металлов, основаниями, солями – все эти свойства характерны как для органических, так и для неорганических кислот.
- Учитель: проведём лабораторную работу по инструкциям, которые находятся на ваших столах.
- Инструкция для выполнения лабораторной работы
- Инструкция к заданию 1
- Цель: сравнить взаимодействие неорганических и органических кислот с металлами.
- Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, магний, цинк.
Возьмите пробирку и налейте в неё 1мл соляной кислоты и поместите туда 1-2 гранулы цинка. Что наблюдаете? Во вторую пробирку поместите 1-2 гранулы цинка и добавьте 1мл уксусной кислоты. Что наблюдаете? Повторите опыте с магнием соляной и уксусной кислотами. Сделайте запись в таблице. Запишите уравнения реакций.
- Инструкция к заданию 2
- Цель: сравнить взаимодействие неорганических и органических кислот с оксидами металлов.
- Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, оксид кальция.
В 2 пробирки поместите немного оксида кальция. Прилейте к нему растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения химических реакций.
- Инструкция к заданию 3
- Цель: сравнить взаимодействие неорганических и органических кислот с солями
- Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, раствор карбоната натрия
В 2 пробирки налейте по 1-2 мл раствора карбоната натрия, затем к нему прилейте растворы соляной и уксусной кислот. Что наблюдаете? Сделайте соответствующую запись в таблице. Составьте уравнения химических реакций.
- Инструкция к заданию 4
- Цель: сравнить взаимодействие неорганических и органических кислот с основаниями
- Оборудование и реактивы: растворы соляной и уксусной кислот, пробирки, растворы гидроксида натрия и фенолфталеин.
В пробирку налейте 1мл гидроксида натрия, добавьте в него несколько капель фенолфталеина. Что наблюдаете? Затем по каплям прилейте соляной кислоты. Что наблюдаете? Во второй пробирке проведите такую же реакцию с уксусной кислотой. Сделайте соответствующую запись в таблицу
Учитель: результаты опытов учащиеся вносят в таблицу « Свойства кислот».
Учитель: Давайте подведём итог урока и ответим на вопросы.
1.В чём проявляется сходство органических и неорганических кислот?
2.Чем определяются свойства органических и неорганических кислот?
3.Как можно определить наличие кислот в продуктах питания?
4.Почему при изжоге медики советуют применять растворы пищевой соды или лекарственные препараты, содержащие карбонат кальция, гидроксиды алюминия или магния?
5.Каково применение кислот в быту? Какие кислоты находят наибольшее применение в быту?
Учитель : итак, кислоты органические и неорганические имеют сходства в химических свойствах, т.к.они имеют черты сходства в строении.
3.Рефлексия
Учитель: как вам понравился урок? Выразите своё отношение к уроку путём выбора картинки №1 или №2 на слайде презентации. А теперь для закрепления выполните тесты.
- 4.Закрепление
- Выбери правильный ответ.
- А-1
- С какими из приведённых веществ не будет взаимодействовать соляная кислота:
- а) Al
- б) Hg
- в) Zn
- А-2
- В какой цвет окрасится лакмус в растворе соляной кислоты:
- а) синий
- б) малиновый
- в) красный
- А-3
- Реакция взаимодействия кислот со щелочами называется:
- а) замещения
- б) нейтрализации
- в) соединения
- А -4
- В результате взаимодействия соляной кислоты с нитратом серебра выпадает :
- а) чёрный осадок
- б) красный осадок
- в) белый осадок
- А -5
- За общие свойства кислот отвечает:
- а) ион водорода
- б) ион металла
- в) ион кислотного остатка.
- А-6 С какими веществами реагирует уксусная кислота:
- А) оксид магния б) углекислый газ в) соляная кислота
- А-7 Реакция этерификации – взаимодействие кислоты с
- А) металлом б) спиртом в) основанием
А-8 Первые представители кислот при н.у. по агрегатному состоянию
- А)твердые б)газы в) жидкости
- А-9кислотные остатки карбоновых кислот имеют заряд
- А)-2 б)+1 в)-1
- А-10 Кислотам изомерны
- А)спирты б)сложные эфиры в) альдегиды
5.Задание на дом: п 22.№1-7
Источник: https://infourok.ru/urok-himii-v-klasse-po-teme-kisloti-organicheskie-i-neorganicheskie-847507.html
Неорганические кислоты — это… Что такое Неорганические кислоты?
Основная статья: Кислота
Неоргани́ческие (минера́льные) кисло́ты — неорганические вещества, обладающие комплексом физико-химических свойств, которые присущи кислотам. Вещества кислотной природы известны для большинства химических элементов за исключением щелочных и щёлочноземельных металлов.
Свойства и классификация неорганических кислот
Формы существования и агрегатное состояние
Большинство неорганических кислот при обычных условиях существуют в жидком состоянии, некоторые – в твёрдом состоянии (ортофосфорная, борная, вольфрамовая, поликремниевые (гидраты SiO2) и др.).
Кислотами также являются водные растворы некоторых газообразных соединений (галогеноводородов, сероводорода H2S, диоксида азота NO2, диоксида углерода CO2 и др.). Некоторые кислоты (например, угольную Н2СО3, сернистую Н2SO3, хлорноватистую HClO и др.
) невозможно выделить в виде индивидуальных соединений, они существуют только в растворе.
По химическому составу различают бескислородные кислоты (HCl, H2S, HF, HCN) и кислородсодержащие (оксокислоты)(H2SO4, H3PO4)[1].
Состав бескислородных кислот можно описать формулой: HnХ, где Х — химический элемент образующий кислоту (галоген, халькоген) или бескислородный радикал: например, бромоводородная HBr, циановодородная HCN, азидоводородная HN3 кислоты.
В свою очередь, все кислородсодержащие кислоты имеют состав, который можно выразить формулой: НnXОm, где X — химический элемент, образующий кислоту.
Таутомерные формы родановодородной кислоты
Таутомерные формы фосфористой кислоты
Атомы водорода в кислородсодержащих кислотах чаще всего связаны с кислородом полярной ковалентной связью. Известны кислоты с несколькими (чаще двумя) таутомерными или изомерными формами, которые различаются положением атома водорода:
Отдельные классы неорганических кислот образуют соединения, в которых атомы кислотообразующего элемента образуют молекулярные гомо- и гетерогенные цепные структуры. Изополикислоты — это кислоты, в которых атомы кислотообразующего элемента связаны через атом кислорода (кислородный мостик).
Примерами выступают полисерные H2S2O7 и H2S3O10 и полихромовые кислоты H2Cr2O7 и H2Cr3O10. Кислоты с несколькими атомами разных кислотообразующих элементов, соединенных через атом кислорода, называются гетерополикислотами.
Существуют кислоты, молекулярная структура которых образована цепочкой одинаковых кислотообразующих атомов, например в политионовых кислотах H2SnO6 или в сульфанах H2Sn, где n≥2.
Отдельно выделяют пероксокислоты — кислоты, содержащие пероксогруппы [–O–O–], например пероксомоносерная H2SO5 и пероксодисерная H2S2O8 кислоты. Тиокислотами называют кислоты, содержащие вместо атомов кислорода атомы серы, например тиосерная кислота H2SO3S. Существуют и комплексные кислоты, например: H2[SiF6], H[AuCl4], H4[Fe(CN)6] и др.
Равновесные процессы в водных растворах
Химические свойства кислот определяются способностью их молекул диссоциировать в водной среде с образованием гидратированных ионов H+ и анионов кислотных остатков А–:
(упрощённая запись)
В зависимости от значения константы химического равновесия, также называемой константой кислотности Ka[2], выделяют сильные и слабые кислоты:
Из числа распространённых кислот к сильным относятся хлорная, азотная, серная и хлороводородная. Азотистая HNO2, угольная H2CO3 (CO2·H2O), фтороводородная HF – примеры слабых кислот. Также используется более детальная классификация по значению Ka на очень слабые (≤10-7), слабые (~10-2), средней силы (~10-1), сильные (~103), очень сильные (≥108).
Для неорганических кислородсодержащих кислот вида HnXOm известно эмпирическое правило, по которому значение первой константы связано со значением (m – n). При (m – n) = 0 кислота очень слабая, при 1 — слабая, при 2 — сильная, и, наконец, при 3 — кислота очень сильная[3]:
| HClO | 10-8 | |
| H3AsO3 | 10-10 | |
| Н2SО3 | 1 | 10-2 |
| Н3РО4 | 1 | 10-2 |
| HNO3 | 2 | 101 |
| H2SO4 | 2 | 103 |
| HClO4 | 3 | 1010 |
Данная закономерность обусловлена усилением поляризации связи Н-О вследствие сдвига электронной плотности от связи к электроотрицательному атому кислорода по подвижным π-связям Э=O и делокализацией электронной плотности в анионе.
Неорганические кислоты обладают свойствами, общими для всех кислот, среди которых: окрашивание индикаторов, растворение активных металлов с выделением водорода (кроме HNO3), способность реагировать с основаниями и основными оксидами с образованием солей, например:
Число атомов водорода, отщепляемых от молекулы кислоты и способных замещаться на металл с образованием соли, называется основностью кислоты. Кислоты можно разделить на одно-, двух- и трехосновные. Кислоты с более высокой основностью неизвестны.
Одноосновными являются многие неорганические кислоты: галогеноводородные вида HHal, азотная HNO3, хлорная HClO4, роданистоводородная HSCN и др. Серная H2SO4, хромовая H2CrO4, сероводородная H2S служат примерами двухосновных кислот и т. д.
Многоосновные кислоты диссоциируют ступенчато, каждой ступени отвечает своя константа кислотности, причем всегда каждая последующая Кa меньше предыдущей ориентировочно на пять порядков. Ниже показаны уравнения диссоциации трехосновной ортофосфорной кислоты:
Основность определяет число рядов средних и кислых солей − производных кислоты[4].
К замещению способны только атомы водорода, входящие в состав гидроксигрупп −OH, поэтому, например, ортофосфорная кислота H3PO4 образует средние соли — фосфаты вида Na3PO4, и два ряда кислых − гидрофосфаты Na2HPO4 и дигидрофосфаты NaH2PO4. Тогда как, у фосфористой кислоты H2(HPO3) только два ряда − фосфиты и гидрофосфиты, а у фосфорноватистой кислоты H(H2PO2) − только ряд средних солей − гипофосфитов.
Исключение составляет борная кислота H3BO3, которая в водном растворе существует в виде одноосновного гидроксокомплекса:
Современные теории кислот и оснований значительно расширяют понятие кислотных свойств.
Так, кислота Льюиса — вещество, молекулы или ионы которого способны принимать электронные пары, в том числе и не содержащие ионов водорода: например, катионы металлов (Ag+, Fe3+), ряд бинарных соединений (AlCl3, BF3, Al2O3, SO3, SiO2). Протонные кислоты рассматриваются теорией Льюиса как частный случай класса кислот.
Окислительно-восстановительные свойства
Все пероксокислоты и многие кислородсодержащие кислоты (азотная HNO3, серная H2SO4, марганцовая HMnO4, хромовая Н2CrO4, хлорноватистая HClO и др.) — сильные окислители.
Окислительная активность этих кислот в водном растворе выражена сильнее, чем у их солей; при том окислительные свойства сильно ослабевают при разбавлении кислот (например, свойства разбавленной и концентрированной серной кислоты). Неорганические кислоты также всегда менее термически устойчивы, чем их соли.
Указанные различия связаны с дестабилизирующим действием сильнополяризованного атома водорода в молекуле кислоты. Наиболее выразительно это проявляется в свойствах кислородсодержащих кислот-окислителей, например, хлорной и серной. Этим же объясняется невозможность существования вне раствора ряда кислот при относительной стабильности их солей.
Исключение составляет азотная кислота и её соли, проявляющие сильно выраженные окислительные свойства вне зависимости от разбавления раствора. Такое поведение связано с особенностями строения молекулы HNO3.
Номенклатура
Номенклатура неорганических кислот прошла долгий путь развития и складывалась постепенно. Наряду с систематическими названиями кислот широко применяются традиционные и тривиальные. Некоторые распространённые кислоты могут в различных источниках иметь разные названия: например, водный раствор HCl может именоваться соляной, хлороводородной, хлористоводородной кислотой.
Традиционные русские названия кислот образованы прибавлением к названию элемента морфем -ная или -овая (хлорная, серная, азотная, марганцовая).
Для разных кислородсодержащих кислот, образованных одним элементом, используется -истая для более низкой степени окисления (сернистая, азотистая).
В ряде случаев для промежуточных степеней окисления дополнительно используются морфемы -новатая и -новатистая (см. ниже названия кислородсодержащих кислот хлора).
Традиционные названия некоторых неорганических кислот и их солей приведены в таблице:
| H3AsO4 | Мышьяковая | Арсенаты | |
| H3ВO3 | Борная | Бораты | |
| Н2СО3 (CO2•H2O) | Угольная | Карбонаты | |
| НCN | Циановодородная | Синильная | Цианиды |
| Н2CrO4 | Хромовая | Хроматы | |
| НМnO4 | Марганцовая | Перманганаты | |
| HNO3 | Азотная | Нитраты | |
| HNO2 | Азотистая | Нитриты | |
| Н3РО4 | Ортофосфорная | Фосфорная | Ортофосфаты |
| H2SO4 | Серная | Сульфаты | |
| Н2SiO3 (SiO2•H2О) | Метакремниевая | Кремниевая | Метасиликаты |
| H4SiO4 (SiO2•2H2O) | Ортокремниевая | Ортосиликаты | |
| H2S | Сероводородная | Сульфиды | |
| HF | Фтороводородная | Плавиковая | Фториды |
| НCl | Хлороводородная | Соляная | Хлориды |
| НВr | Бромоводородная | Бромиды | |
| HI | Иодоводородная | Иодиды |
Для менее известных кислот, содержащих кислотообразующие элементы в переменных степенях окисления, обычно применяются систематические названия.
В систематических названиях кислот к корню латинского названия кислотообразующего элемента добавляют суффикс -ат, а названия остальных элементов или их групп в анионе приобретают соединительную гласную -о.
В скобках указывают степень окисления кислотообразующего элемента, если она имеет целочисленное значение. В противном случае в название включают и число атомов водорода[5].
Например (в скобках традиционные названия):
HClO4 — тетраоксохлорат(VII) водорода (хлорная кислота)
HClO3 — триоксохлорат(V) водорода (хлорноватая кислота)
HClO2 — диоксохлорат(III) водорода (хлористая кислота)
HClO — оксохлорат(I) водорода (хлорноватистая кислота)
H2Cr2O7 — гептаоксодихромат(VI) диводорода (дихромовая кислота)
H2S4O6 — гексаоксотетрасульфат диводорода (тетратионовая кислота)
Н2В4О6 — гексаоксотетраборат диводорода (тетраметаборная кислота)
HAuCl4 — тетрахлороаурат(III) водорода (золотохлористоводородная кислота)
H[Sb(OH)6] — гексагидроксостибат(V) водорода
Ниже приведены корни латинских названий кислотообразующих элементов, не совпадающие с корнями русских названий тех же элементов: Ag — аргент(ат), As — арсен(ат), Аu — аур(ат), Cu — купр(ат), Fe — ферр(ат), Hg — меркур(ат), Pb — плюмб(ат), Sb — стиб(ат), Si — силик(ат), Sn — станн(ат), S — сульф(ат).
В формулах тиокислот, образованных из оксикислот замещением атомов кислорода на атомы серы, последние помещают в конце: H3PO3S — тиофосфорная кислота, H2SO3S — тиосерная кислота.
Общие методы получения кислот
Существует множество методов получения кислот, в т. ч. общих, среди которых в промышленной и лабораторной практике можно выделить следующие:
- Взаимодействие кислотных оксидов (ангидридов) с водой, например:
- Вытеснение более летучей кислоты из ее соли менее летучей кислотой, например:
- Гидролиз галогенидов или солей, например:
- Синтез бескислородных кислот из простых веществ
Применение
Минеральные кислоты широко применяют в металло- и деревообработке, текстильной, лакокрасочной, нефтегазовой и других отраслях промышленности и в научных исследованиях. К числу веществ, производимых в наибольшем объёме, относятся серная, азотная, фосфорная, соляная кислоты. Суммарное годовое производство в мире этих кислот исчисляется сотнями миллионов тонн в год.
В металлообработке они часто используются для травления железа и стали и в качестве очищающих агентов перед сваркой, металлизацией, окраской или гальванической обработкой.
Серная кислота, метко названная Д. И.
Менделеевым «хлебом промышленности», применяется в производстве минеральных удобрений, для получения других минеральных кислот и солей, в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ, в нефтяной, металлообрабатывающей, текстильной, кожевенной, пищевой и др. отраслях промышленности, в промышленном органическом синтезе и т. п.
Соляная кислота применяется для кислотной обработки, очищения руд олова и тантала, для производства патоки из крахмала, для удаления накипи с котлов и теплообменного оборудования ТЭЦ. Она также используется в качестве дубильного вещества в кожевенной промышленности.
Азотная кислота применяется при получении аммонийной селитры, использующейся в качестве удобрения и в производстве взрывчатых веществ. Кроме того, она применяется в процессах органического синтеза, в металлургии, при флотации руды и для переработки отработанного ядерного топлива.
Ортофосфорную кислоту широко используют при производстве минеральных удобрений. Она используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали). Входит в состав ингибиторов коррозии. Также применяется в составе фреонов в промышленных морозильных установках как связующее вещество.
Пероксокислоты, кислородсодержащие кислоты хлора, марганца, хрома находят применение как сильные окислители.
Литература
- Некрасов Б. В., Основы общей химии, 3 изд., т. 1—2. М., 1973;
- Кемпбел Дж., Современная общая химия, пер. с англ., т. 1—3, М., 1975;
- Белл Р., Протон в химии, пер. с англ., М., 1977;
- Хьюн Д., Неорганическая химия, пер. с англ., М., 1987.
См. также
Примечания
Источник: https://dic.academic.ru/dic.nsf/ruwiki/16940




