Предельные одноосновные карбоновые кислоты.
Понятие о сложных эфирах
Карбоновые кислоты – это соединения, которые содержат карбоксильную группу – СООН. Эта группа является функциональной группой для карбоновых кислот.
Общая формула предельных одноосновных карбоновых кислот R – COOH, где R — углеводородный радикал, а также можно использовать и другую общую формулу – CnH2n+1COOH, где n – число атомов углерода.
Одноосновными они называются потому, что содержат одну карбоксильную группу – СООН, предельными, потому что связи между атомами углерода одинарные, то есть насыщены.

Предельные одноосновные карбоновые кислоты можно получить путём следующих превращений: предельный углеводород → непредельный углеводород → спирт → альдегид → кислота.

Первым представителем этого класса соединений является метановая кислота, или муравьиная – НСООН, вторым представителем – этановая кислота, или уксусная кислота – СН3СООН, третьим – пропановая, или пропионовая кислота – CH3CH2COOH, четвёртым представителем является бутановая, или масляная кислота – CH3CH2CH2COOH.

Карбоновые кислоты и их производные встречаются во многих природных объектах. Так, муравьиная кислота, или метановая – в выделениях муравьёв, изовалериановая – в корнях валерианы, бензойная – в бруснике, клюкве и чернике, щавелевая – в листьях щавеля, ревеня, малоновая – в соке сахарной свёклы, яблочная – в ягодах и фруктах, лимонная – в лимонном соке.

Чистая уксусная кислота представляет собой бесцветную жидкость с резким запахом. Смешивается с водой в любых соотношениях.
Водный раствор с массовой долей уксусной кислоты 3-9% под названием уксус применяется как приправа к пище, а 70-80% кислота называется уксусной эссенцией.
Безводная уксусная кислота при комнатной температуре представляет собой жидкость, при 17 0С она замерзает и превращается в льдистое вещество, которое называют ледяной уксусной кислотой.


По химическим свойствам уксусная кислота – типичная кислота. Поэтому она проявляет все свойства, характерные для неорганических кислот.
Уксусная кислота изменяет окраску индикаторов. Например, если мы нальём в пробирку уксусной кислоты и добавим несколько капель лакмуса, то раствор кислоты станет красного цвета. Таким образом, уксусная кислота в растворе диссоциирует с образованием иона водорода и аниона кислотного остатка – ацетат-иона.
![]()

Если к полученному раствору добавить раствор щёлочи – гидроксида натрия, то окраска станет фиолетового цвета. Таким образом, уксусная кислота вступает в реакции обмена со щелочами. В результате этой реакции образуется соль – ацетат натрия и вода.

Уксусная кислота реагирует с активными металлами. Для того, чтобы в этом убедиться, в пробирку с уксусной кислотой добавим гранулу цинка. У нас появляются пузырьки газа. В результате этой реакции образуется соль – ацетат цинка и выделяется газ – водород.

Кроме этого, уксусная кислота реагирует и с основными оксидами. Если мы в пробирку с раствором уксусной кислоты добавим оксид магния и содержимое слегка нагреем, то у нас постепенно оксид магния растворяется и образуется соль – ацетат магния.
Как и другие кислоты, уксусная кислота реагирует с солями слабых кислот – карбонатами. Например, если в пробирку с уксусной кислотой добавить соды, то происходит вскипание раствора, вследствие образования углекислого газа. Таким образом, уксусная кислота вытеснила угольную из соли. В результате реакции образовалась новая соль – ацетат натрия, углекислый газ и вода.
Уксусная кислота имеет и особое свойство: она реагирует со спиртами.
Например, если в пробирку налить этилового спирта и столько же уксусной кислоты, добавить к этой смеси немного концентрированной серной кислоты и нагреть смесь, а затем вылить образовавшееся соединение в пробирку с водой, то полученное соединение собирается на поверхности воды. Таким образом, это соединение плохо растворяется в воде, но обладает приятным запахом.
В результате реакции между уксусной кислотой и этиловым спиртом образовалось соединение, которое относится к классу сложных эфиров. Это этиловый эфир уксусной кислоты, или этилацетат. Причём в этой реакции, ОН группа отщепляется от кислоты, а водород от спирта. И образуется таким образом – вода. Эта реакция является обратимой.
Сложные эфиры способны к гидролизу в присутствии кислоты или щёлочи. Если нагреть смесь сложного эфира с разбавленной сильной кислотой, то происходит кислотный гидролиз. Например, при кислотном гидролизе этилового эфира уксусной кислоты образуется уксусная кислота и этиловый спирт.
CH3COOC2H5 + H2O СН3COOH + C2H5ОН
При щелочном гидролизе сложных эфиров образуется спирт и соль карбоновой кислоты. Этот гидролиз необратим. Например, при щелочном гидролизе этилацетата образуется ацетат натрия – соль уксусной кислоты и этиловый спирт.
CH3COOC2H5 + NaOH→ СН3COONa + C2H5ОН
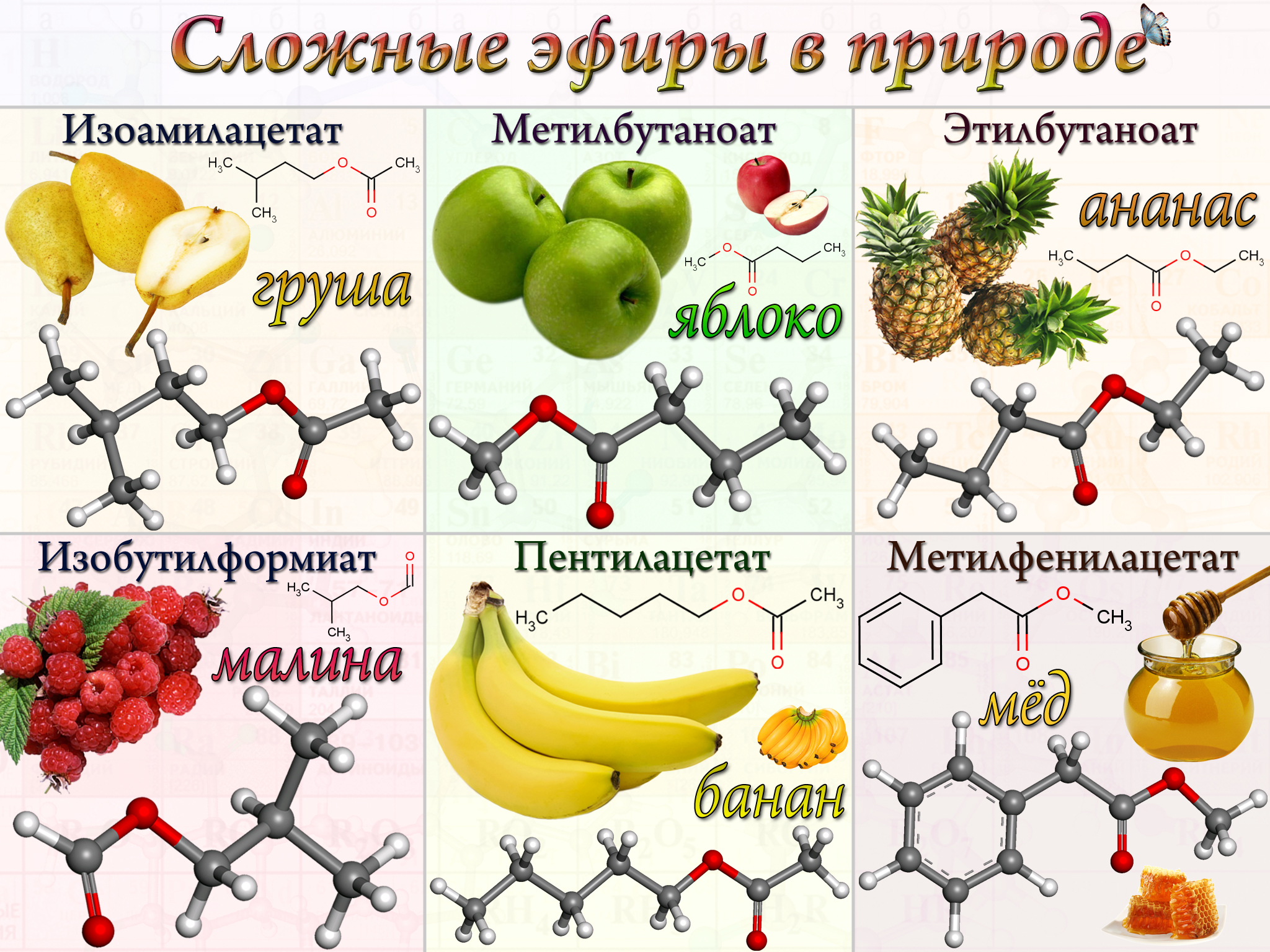
Сложные эфиры, в основном, представляют собой жидкости, обладающие приятным фруктовым вкусом. Многие сложные эфиры имеют запахи ананаса, груш, яблок, абрикос, жасмина, хризантем. Сложные эфиры находятся в ягодах, фруктах, цветах и придают им аромат.
Воски – это тоже сложные эфиры: пчелиный воск, ланолин из овечьей шерсти. Они плохо растворяются в воде, но хорошо растворимы в спиртах.
Благодаря приятному аромату некоторые сложные эфиры составляют основу эссенций для приготовления фруктовых вод, кондитерских изделий и духов. Сложные эфиры используют в лакокрасочной промышленности, в производстве искусственных волокон и некоторых полимерных материалов, они применяются как растворители органических веществ, при проведении химических реакций.
- Реакцию между органической кислотой и спиртом называют реакцией этерификации, в результате этих реакций образуются сложные эфиры.
- Уксусную кислоту применяют при синтезах полимеров, красителей (индиго), лекарств (аспирина), при консервировании, для получения искусственного волокна – ацетатного шёлка, киноплёнки, душистых веществ в парфюмерии и косметике, гербицидов, её применяют для получения фруктовых эссенций.
Таким образом, насыщенные одноосновные карбоновые кислоты – это производные углеводородов, в молекулах которых один атом водорода замещён на карбоксильную группу – СООН. Общая формула этих кислот CnH2n+1COOH.
Уксусная кислота – представитель насыщенных одноосновных карбоновых кислот. Она проявляет свойства, характерные для большинства кислот: реагирует с активными металлами, основными оксидами, основаниями и солями слабых кислот. Для карбоновых кислот характерны реакции этерификации.
Реакции этерификации – это реакции между карбоновой кислотой и спиртом, в результате которых образуются сложные эфиры. Сложные эфиры широко распространены в природе. Сложные эфиры гидролизуются растворами минеральных кислот и щелочей.
Карбоновые кислоты и сложные эфиры имеют большое значение в различных областях промышленности.
Источник: https://videouroki.net/video/36-priediel-nyie-odnoosnovnyie-karbonovyie-kisloty-poniatiie-o-slozhnykh-efirakh.html
Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные — 1 карбоксильная группа
- Двухосновные — 2 карбоксильных группы
- Трехосновные — 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса «овая» к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая — HCOOH — муравьиная кислота
- Этановая — CH3-COOH — уксусная кислота
- Пропановая — C2H5-COOH — пропионовая кислота
- Бутановая — C3H7-COOH — масляная кислота
- Пентановая — C4H9-COOH — валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.

Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты. 
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот. 
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды — реакцией серебряного зеркала. 
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
 Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.
Окисление альдегидов также может быть успешно осуществлено другим реагентом — свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I. 
Существует специфический способ получения муравьиной кислоты, который заключается в реакции щелочи с угарным газом — в результате образуется формиат (соль муравьиной кислоты). При подливании к формиату раствора серной кислоты получается муравьиная кислота. 
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется. Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусной альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.
Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее — у вторичного, и значительно сложнее — у первичного атома углерода. Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот — уксусная, чуть сильнее — хлоруксусная, за ней — дихлоруксусная и самая сильная — трихлоруксусная. Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.
Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала. В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.
При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ. HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether — эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = метиловый эфир уксусной кислоты (метилацетат)
- Пропановая кислот + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
Для сложных эфиров характерной реакцией является гидролиз — их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной — необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
Ангидриды
Ангидриды — химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.
Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.
Источник: https://studarium.ru/article/190
Карбоновые кислоты — номенклатура, получение, химические свойства

Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
Классификация карбоновых кислот
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН (малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CH-COOH);
ароматические (C6H5COOH).
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса —овая и слова кислота: HCOOH — метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота.

Изомерия карбоновых кислот
- Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2. - Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
- Строение карбоксильной группы:

Электронная плотность π-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
- В водном растворе карбоновые кислоты диссоциируют на ионы.
- Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
- .

- С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Способы получения карбоновых кислот

Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Влияние заместителей на силу карбоновых кислот
- Донорные группы увеличивают прочность связи кислород-водород или дестабилизируют карбоксилат анион, подавая ещё больше электронной плотности, это приводит к уменьшению силы кислот.
- Акцепторные группы уменьшают электронную плотность связи кислород-водород или стабилизируют карбоксилат анион, это приводит к увеличению силы кислот (значение рКа уменьшается).

Источник: http://himege.ru/karbonovye-kisloty-nomenklatura-poluchenie-ximicheskie-svojstva/
Х и м и я
Карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН.

Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
![]()
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
![]()
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная.
Карбоновые кислоты со спиртами образуют сложные эфиры. Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира.
Классификация карбоновых кислот
Карбоновые кислоты можно классифицировать по различным признакам:
- По количеству гидрокильных групп (одно- и двухосновные),
- По числу атомов углерода (низшие, средние, высшие),
- По наличию в них предельных и не предельных связей (предельные и непредельные).
Одноосновные и двухосновные карбоновые кислоты
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.

Низшие, средние и высшие карбоновые кислоты
- По числу атомов углерода в молекуле карбоновые кислоты делят на:
- Низшие (С1-С3),
- Средние (С4-С8) и
- Высшие (С9-С26).
- Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты.
Таким образом, термины «жирные кислоты» и «карбоновые кислоты» часто используются как синонимы.
Предельные и непредельные карбоновые кислоты
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.

Примеры предельных высших жирных кислот:
- Каприновая кислота — C9H19COOH,
- Лауриновая кислота — С11Н23СООН,
- Миристиновая кислота — С13Н27СООН,
- Пальмитиновая кислота — С15Н31СООН,
- Стеариновая кислота – С17Н35СООН.
Примеры непредельных высших жирных кислот:
- Олеиновая кислота — С17Н33СООН – имеет одну двойную связь,
- Линолевая кислота – С17Н31СООН — имеет две двойных связи,
- Линоленовая кислота – С17Н29СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:

В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой.
В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С) и водорода(Н) не изображаются.
- Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
- Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
- Натриевые и калиевые соли высших жирных кислот называют мылами.
- Например:
- C17H35COONa – стеарат натрия,
- С
Источник: http://xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai/views/alchemy/theory/chemistry/organic-chemistry/carboxylic_acid.php
Тема урока : Предельные одноосновные карбоновые кислоты. Сложные эфиры. — презентация
1 Тема урока : Предельные одноосновные карбоновые кислоты. Сложные эфиры
2 Цель урока : познакомить обучающихся с новым классом органических соединений – карбоновыми кислотами.
3 1. Запишите определение. Карбоновые кислоты — это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или водородным атомом.
4 Карбоксильная группа
5 2. Запишите общую формулу предельных одноосновных карбоновых кислот Общая формула : RCOOH или C n H 2n+1 COOH
6 Поиграйте в « крестики — нолики ». Покажите выигрышный путь, состоящий из молекулярных формул предельных одноосновных карбоновых кислот. CH 3 COHCH 2 OC3H6O2C3H6O2 C2H4OC2H4OCH 2 O 2 C3H6OC3H6O C2H4O2C2H4O2 HCOOHC2H6OC2H6O
- 7 Сформулируйте общий принцип построения названия карбоновых кислот.
- 8 Номенклатура По международной номенклатуре название кислоты производят от названия соответствующего ( с тем же числом атомов углерода ) углеводорода с добавлением окончания — новая и слова кислота. Метан — метанновая HCOOH Этан – этанновая CH 3 COOH
- 9 Составьте полные структурные формулы веществ, образующих выигрышный путь, и назовите их.
10 . 3. Найдите фразы, в которых говорится об областях применения уксусной кислоты. Из букв, соответствующих правильным ответам, вы составите название галогена.
А ) получение водорода И Б ) пищевая приправа А В ) консервирование пищевых продуктов С Г ) получение этилового спирта О Д ) синтез красителей и лекарств Т Е ) дезинфицирующее средство Д Ж ) приготовление маринадов А З ) производство полимеров Т АСТАТ
11 4. Химические свойства карбоновых кислот Составьте уравнения практически осуществимых реакций.
Из букв, соответствующих правильным ответам, вы составите название кислотного остатка уксусной кислоты : а) CH 3 COOH+ Cu(OH) 2 А б) CH 3 COOH+ Na 2 SiO 3 Ц в) CH 3 COOH+ Cu Ф г) CH 3 COOH+ Mg E д) CH 3 COOH+ SO 3 О е) CH 3 COOH+ Na 2 CO 3 T ж) CH 3 COOH+ NaCl Р з) CH 3 COOH+ HOC 2 H 5 A и) CH 3 COOH+ KOH Т
12 R – C + HO — R H 2 SO 4,t 0 O ОHОHOH H Кислота Спирт Сложный эфир CH 3 –CОOH + HОC 2 H 5 CH 3 –СООC 2 H 5 + H 2 О уксусная этиловый этиловый эфир кислота спирт уксусной кислоты + R – C О — R O
13 5. Запишите определения. Реакция этерификации — это реакция образования сложных эфиров при взаимодействии кислот и спиртов : RCOOH + ROH RCOOR' + Н 2 О
14 5. Запишите определения. Сложные эфиры – это органические соединения, производные кислот, в молекулах которых гидроксильная группа — OH замещена на остаток спирта. СН 3 COOH + C 2 H 5 OH = СН 3 COOC 2 H 5 + H 2 O
15 6. Напишите уравнения реакции этерификации, в результате которой образуется : а ) метиловый эфир муравьиной кислоты б ) метиловый эфир уксусной кислоты Назовите исходные вещества.
16 Закрепление Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения :
17 Домашнее задание Параграф, задание 7 рабочей тетради.
Источник: http://www.myshared.ru/slide/1300028/
Презентация к уроку по химии (10 класс) на тему
- Слайд 2
- Кислородсодержащие органические соединения Спирты -одноатомные — многоатомные Альдегиды и кетоны Кислородсодержащие органические соединения Карбоновые кислоты Эфиры -простые -сложные Углеводы
- Слайд 3
Задачи 1.
Выяснить функциональную группу, общую формулу карбоновых кислот. 2. Сформулировать определение. 3. Изучить классификацию карбоновых кислот. 4. Овладеть навыками номенклатуры. 5. Рассмотреть физические и химические свойства наиболее важных карбоновых кислот. 6.
Выяснить области применения некоторых карбоновых кислот.
Слайд 4
Все карбоновые кислоты имеют функциональную группу — С ОН О Карбо нильная группа Гидро ксильная группа Карбоксильная группа Общая формула R C ОН О С n Н 2n +1 С Или для предельных одноосновных кислот О ОН ? Что называется карбоновыми кислотами? Карбоновые кислоты- это органические соединения, молекулы которых содержат карбоксильную группу – СООН, связанную с углеводородным радикалом. ? Каким образом генетически карбоновые кислоты связаны с ранее изученным классом альдегидов? R C О Н + [О] R C О ОН [О]= КМ nO 4 , К 2 Cr 2 O 7+ H 2 SO 4 конц.
- Слайд 5
- Классификация карбоновых кислот В зависимости от числа карбоксильных групп Одноосновные Двухосновные (уксусная) (щавелевая) СН 3 С С — С О ОН Многоосновные (лимонная) О ОН О НО Н 2 С – С О ОН НС — С О ОН Н 2 С — С О ОН В зависимости от природы радикала Предельные (пропионовая) О СН 3- СН 2- С ОН Непредельные (акриловая) О СН 2 =СН-С ОН Ароматические (бензойная) С О ОН По содержанию атомов С : С 1 -С 9 — низшие , С 10 и более — высшие
- Слайд 6
Проклассифицируйте предложенные кислоты 1) С H 3 – СН 2 – СН 2 – СН 2 — COOH 2) HOOC — СН 2 — СН 2 — COOH 3 ) COOH 4 ) CH 3 – ( C Н 2 ) 7 – СН = СН — (СН 2 ) 7 — COOH 5 ) HOOC – СН 2 — CH – СН 2 — COOH COOH СН 3 1.Одноосновная, предельная , низшая 2. Двухосновная, предельная, низшая 3.Одноосновная, предельная, низшая 4. Одноосновная, непредельная, высшая 5.Многоосновная, предельная, низшая
- Слайд 7
- НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ АЛКАН + ОВ + АЯ КИСЛОТА МЕТАН ОВ АЯ КИСЛОТА (МУРАВЬИНАЯ КИСЛОТА)
- Слайд 8
- СН3 – СООН 1 2 ЭТАН ОВ АЯ КИСЛОТА (УКСУСНАЯ КИСЛОТА ) СН3 – СН2 – СН2 — СООН 1 2 3 4 БУТАН ОВ АЯ КИСЛОТА (МАСЛЯНАЯ КИСЛОТА)
- Слайд 9
- СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАН ОВ АЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) 1 2 3 4 5 НООС – СООН ЭТАН ДИ ОВ АЯ КИСЛОТА (ЩАВЕЛЕВАЯ КИСЛОТА) 1 2
- Слайд 10
- Гомологический ряд карбоновых кислот Химическая формула Систематическое название кислоты Тривиальное название кислоты Название кислотного остатка НСОО Н Муравьиная Форми ат СН3СОО Н Уксусная Ацет ат СН3СН2СОО Н Пропионовая Пропион ат СН3СН2СН2СОО Н Масляная Бутир ат СН3СН2СН2СН2СОО Н Валериановая валерин ат СН3-(СН2)4–СОО Н Капроновая капрон ат СН3-(СН2)8 – СОО Н каприновая каприн ат СН3-(СН2)14 – СОО Н Пальмитиновая пальмит ат СН3-(СН2)16- СОО Н Стеариновая стеар ат Метановая Этановая Пропановая Бутановая Пентановая Гексановая Декановая Гексадекановая Октадекановая
- Слайд 11
Алгоритм названия карбоновых кислот: 1 . Находим главную цепь атомов углерода и нумеруем её, начиная с карбоксильной группы. 2. Указываем положение заместителей и их название (названия). 3.
После корня, указывающего число атомов углерода в цепи, идет суффикс «-овая» кислота. 4.
Если карбоксильных групп несколько, то перед «- овая» ставится числительное ( -ди, — три…) Пример: 3- метил бутан + -овая = 3-метил бутан овая кислота кислота
Слайд 12
ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ (2 – МЕТИЛ ПРОПАН ОВАЯ КИСЛОТА) СН3 – СН – СООН 2. СН3 – СН2 – СН – СН – СООН 3. СН3 – СН = СН – СН – СООН 4. НООС – СН2 – СН – СООН ( 2, 3 – ДИМЕТИЛ ПЕНТА- Н ОВАЯ КИСЛОТА ) ( 2 – МЕТИЛ ПЕНТ ЕН – 3 – ОВАЯ КИСЛОТА ) ( 2 –ЭТИЛ БУТАН ДИ ОВАЯ КИСЛОТА ) СН3 СН3 СН3 СН3 С 2 Н 5
Слайд 13
: 1 . Выделить корень слова на основании, которого записать углеродный скелет в состав, которого входит карбоксильная группа. 2. Нумеруем атомы углерода, начиная с карбоксильной группы. 3.
Указываем заместители согласно нумерации. 4. Необходимо дописать недостающие атомы водорода (углерод четырёхвалентен). 5. Проверить правильность записи формулы. 2- метил бутан овая кислота .
Пример: Алгоритм записи формул карбоновых кислот
- Слайд 14
- ФИЗИЧЕСКИЕ СВОЙСТВА С 1 – С 3 Жидкости с характерным резким запахом, хорошо растворимые в воде С 4 – С 9 Вязкие маслянистые жидкости с неприятным запахом, плохо растворимые в воде C 10 и более Твердые вещества, не имеющие запаха, не растворимые в воде
- Слайд 15
- Агрегатное состояние жидкое Цвет бесцветная прозрачная жидкость Запах резкий уксусный Растворимость в воде хорошая Температура кипения 118 º С Температура плавления 17 º С Физические свойства уксусной кислоты:
- Слайд 16
Низшие карбоновые кислоты – жидкости ; высшие – твердые вещества Чем больше относительная молекулярная масса кислоты, тем меньше ее запах.
С увеличением относительной молекулярной массы кислоты растворимость уменьшается Зависимость физических свойств карбоновых кислот от строения молекулы: Гомологический ряд альдегидов начинается с двух газообразных веществ (при комнатной температуре), а среди карбоновых кислот газов нет. С чем это связано?
Слайд 17
Химические свойства карбоновых кислот І.
Общие с неорганическими кислотами Растворимые карбоновые кислоты в водных растворах диссоциируют: СН 3 – СООН СН 3 – СОО + Н + Среда кислая ? Как изменятся окраска индикаторов в кислой среде ? Лакмус (фиолетовый) – краснеет Метилоранжевый- розовеет Фенофталеин – не меняет цвет 2.
Взаимодействие с металлами , стоящими в электрохимическом ряду напряжений до водорода: 2СН 3 – СООН +М g Уксусная кислота (СН 3 –СОО) 2 М g Ацетат магния + Н 2 2СН 3 — СООН + Zn Уксусная кислота (СН 3 –СОО)2 Zn Ацетат цинка + Н 2 При взаимодействии металла с раствором карбоновой кислоты образуется водород и соль
Слайд 18
3.Взаимодействие с основными оксидами: 2 СН 3 – СООН + С u О Уксусная кислота t (СН 3 – СОО) 2 С u Ацетат меди + Н 2 О 4. Взаимодействие с гидроксидами металлов (реакция нейтрализации) СН 3 – СООН + НО – Na Уксусная кислота СН 3 СОО Na Ацетат натрия + Н 2 О 5.
Взаимодействие с солями более слабых и летучих кислот кислот (н-р, угольной, кремниевой, сероводородной, стеариновой, пальмитиновой…) 2СН 3 – СООН Уксусная кислота + Na 2 CO 3 карбонат натрия 2СН 3 СОО Na Ацетат натрия + Н 2 СО 3 СО 2 Н 2 О 2 СН3 – СООН + Cu( ОН ) 2 Уксусная кислота ( СН3СОО ) 2 Cu Ацетат меди + Н2О
- Слайд 19
- Специфические свойства муравьиной кислоты Реакция «Серебряного зеркала» Н- С О ОН + Ag 2 O t 2Ag + Н 2 СО 3 СО 2 Н 2 О Муравьиная кислота Оксид серебра серебро
- Слайд 20
Нахождение в природе и применение карбоновых кислот Муравьиная кислота ( Метановая кислота) — Химическая формула СН2О2, или НСООН. — Муравьиная кислота открыта в кислых выделениях рыжих муравьев в 1670 г.
английским естествоиспытателем Джоном Реем.
Муравьиная кислота присутствует также в тончайших волосках крапивы, в пчелином яде, сосновой хвое, в небольших количествах найдена в различных фруктах, тканях, органах, выделениях животных и человека.
Слайд 21
Применение муравьиной кислоты Муравьиная кислота обладает ярко выраженными бактерицидными свойствами .
Поэтому ее водные растворы используют как: — Пищевой консервант; Парами дезинфицируют тару для продовольственных товаров ( в том числе винные бочки); В пчеловодстве — эффективное средство от варроатоза – болезни пчел, вызываемой клещами-паразитами ; Консервант при заготовке силоса; В медицине слабый водно-спиртовой раствор муравьиной кислоты(муравьиный спирт) используется при ревматических и неврологических болях для растирания; В органическом синтезе в качестве восстановителя ; -Протрава при крашении тканей; -В кожевенном производстве – для отмывания извести, используемой при обработке шкур; -При изготовлении тяжелых жидкостей – водных растворов, обладающих большой плотностью, в которых не тонут даже камни. Такие жидкости нужны геологам для разделения минералов по плотности. Насыщенный раствор формиата таллия НСООТ l в зависимости от температуры может иметь плотность от 3,40г / см³ (при 20°С) до 4,76 г / см³( при 90°С)
Слайд 22
Вопрос : Почему нельзя смачивать водой место муравьиного укуса или ожога крапивой? Это приводит только к усилению болевых ощущений.
Почему боль утихает, если пораненное место смочить нашатырным спиртом? Что ещё можно использовать в данном случае? При растворении муравьиной кислоты в воде происходит процесс электролитической диссоциации: НСООН НСОО + Н В результате кислотность среды повышается, и процесс разъедания кожи усиливается.
Чтобы боль утихла, нужно нейтрализовать кислоту, для чего необходимо использовать растворы, обладающие щелочной реакцией, н-р, раствор нашатырного спирта. НСООН + N Н4ОН НСОО NH4 + Н2О или НСООН + NaHCO3 НСОО Na + CO2 + H2O
Слайд 23
Уксусная кислота (этановая кислота) Это – первая кислота, полученная и использованная человеком. «Родилась» более 4 тыс.лет назад в Древнем Египте. На рубеже Х VII – Х VIII вв.в России ее называли «кислая влажность». Впервые получили при скисании вина. Латинское название – Acetum acidum , отсюда название солей – ацетаты.
Ледяная уксусная кислота при температуре ниже 16,8 º С твердеет и становится похожей на лед — Уксусная эссенция — 70 % -раствор кислоты. — Столовый уксус — 6 % или 9 % -й раствор кислоты.
Уксусная кислота — содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в частности ,в зеленых листьях) , в кислом молоке и сыре; — образуется при брожении, гниении, скисании вина и пива, при окислении многих органических веществ;
- Слайд 24
- Применение уксусной кислоты — Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E- 260 ) и бытовой кулинарии, а также в консервировании; при производстве: лекарств, н-р, аспирина; искусственных волокон, н-р, ацетатного шелка; красителей-индиго, негорючей кинопленки, органического стекла; растворителей лаков; химических средств защиты растений , — стимуляторов роста растений; Ацетат натрия СН3СОО N а применяется в качестве консерванта крови, предназначенной для переливания; Ацетат калия СН3СООК – как мочегонное средство; Ацетат свинца (СН3СОО) 2 Pb — для определения сахара в моче; Ацетаты железа ( III) ( СН3СОО )3Fe , алюминия (СН3СОО) 3Al и хрома ( III) (СН3СОО) 3 С r используют в текстильной промышленности для протравного крашения; Ацетат меди ( II ) (СН3СОО) 2 С u входит в состав препарата для борьбы с вредителями растений, так называемой парижской зелени;
- Слайд 25
Применение уксусной кислоты Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски.
Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды — 3-4 ложки уксуса). В народной медицине уксус используется как неспецифическое жаропонижающее средство. при головных болях методом примочек.
при укусах насекомых посредством компрессов.
незаменима в производстве парфюмерных продуктов Знаете ли вы , что — Если потребуется отвинтить ржавую гайку, то рекомендуется вечером положить на нее тряпку, смоченную в уксусной кислоте ? Утром отвинтить эту гайку будет значительно легче. — В течении суток в организме образуется 400г уксусной кислоты ? Этого хватило бы для изготовления 8 л обычного уксуса
Слайд 26
Из всех кислот Она, конечно, прима. Присутствует везде И зримо и незримо. В животных и растениях есть она, С ней техника и медицина навсегда. Её потомство – ацетаты- Очень нужные «ребята». Всем известный аспирин, Он, как добрый господин, Жар больного понижает И здоровье возвращает. Это – меди ацетат. Он растеньям друг и брат, Убивает их врагов.
От кислоты ещё есть толк – Нас одевает в ацетатный шелк. А пельмени любит кто, Знает уксус тот давно. Есть ещё вопрос кино: Хорошо всем надо знать, Что без пленки ацетатной нам кино не увидать. Конечно, есть и другие применения. И вам они известны без сомнения. Но главное, что сказано, друзья, «Хлеб промышленности» уксусная кислота.
СН 3 СООН СН3СООН Водный раствор ацетата меди
- Слайд 27
- Лимонная кислота COOH HOOC – CH 2 – C – CH 2 – COOH OH Щавелевая кислота HOOC –– COOH Муравьиная кислота Н –– COOH Ацетилсалициловая кислота СООН ОСОСН 3 Винная кислота HOOC – СН — СН –– COOH ОН ОН Молочная кислота СН 3 — СН –– COOH ОН Яблочная кислота HOOC – СН — СН 2 –– COOH ОН Янтарная кислота HOOC – СН 2 — СН 2 –– COOH Бензойная кислота СООН Аскорбиновая кислота НО ОН Н =О НОН 2 С-НОНС О Уксусная кислота H 3 C –– COOH Карбо- новые кислоты в порядке увеличе- ния их кислот- ности
- Слайд 28
Выводы 1.Карбоновые кислоты- это органические соединения, молекулы которых содержат карбоксильную группу – СООН, связанную с углеводородным радикалом. 2.
Карбоновые кислоты классифицируются : по основности (одно-, двух- и многоосновные) по углеводородному радикалу ( предельные, непредельные и ароматические) по содержанию атомов С (низшие и высшие) 3. Название карбоновой кислоты складывается из названия алкана + овая кислота . 4.
С увеличением молекулярной массы карбоновой кислоты растворимость и сила кислоты уменьшается. 5. Как и неорганические кислоты , растворимые карбоновые кислоты диссоциируют в водном растворе , образуя ионы водорода и изменяют окраску индикатора.
Реагируют с металлами (до Н), основными и амфотерными оксидами и гидроксидами, солями более слабых кислот, образуя соли. 6 Широко распространены в природе и имеют большое практическое значение для человека.
Слайд 29
Домашнее задание § 14 , упражнения №6 упр.№9 Царица Клеопатра по совету придворного медика растворила в уксусе самую крупную из известных ювелирам жемчужину, а затем принимала полученный раствор в течение некоторого времени. Какую реакцию осуществила Клеопатра? Какое соединение она принимала? 3. Подготовить сообщение по высшим карбоновым кислотам
Слайд 30
Спасибо за внимание
Источник: https://nsportal.ru/shkola/khimiya/library/2015/11/13/karbonovye-kisloty-prezentatsiya








