| Атомный номер | 9 |
| Внешний вид простого вещества |  Фтор в сосуде Бледно-жёлтый газ, чрезвычайно химически активен.Очень ядовит. Фтор в сосуде Бледно-жёлтый газ, чрезвычайно химически активен.Очень ядовит. |
| Атомная масса (молярная масса) | 18,998403 а. е. м. (г/моль) |
| Радиус атома | 71 пм |
| Энергия ионизации (первый электрон) | 1680,0 (17,41) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s2 2p5 |
| Ковалентный радиус | 72 пм |
| Радиус иона | (-1e)133 пм |
| Электроотрицательность (по Полингу) | 3,98 |
| Электродный потенциал | 0 |
| Степени окисления | −1 |
| Плотность | (при −189 °C)1,108 г/см³ |
| Молярная теплоёмкость | 31,34 Дж/(K·моль) |
| Теплопроводность | 0,028 Вт/(м·K) |
| Температура плавления | 53,53 K |
| Теплота плавления | (F-F) 0,51 кДж/моль |
| Температура кипения | 85,01 K |
| Теплота испарения | 6,54 (F-F) кДж/моль |
| Молярный объём | 17,1 см³/моль |
| Структура решётки | моноклинная |
| Параметры решётки | 5,50 b=3,28 c=7,28 β=90.0 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| F | 9 |
| 18,9984 | |
| [He]2s22p5 | |
| Фтор |
Фтор — элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером 9. Обозначается символом F Fluorum.
Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов.
Простое вещество фтор (CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор (формула F2). Очень ядовит.
История
 Схема атома фтора
Схема атома фтора
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere — «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
- В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
- В некоторой степени относительно богаты фтором растения чечевица и лук
- Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F.
Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm.
Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
 Применение метода МО для молекулы F2
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Кристаллическая решётка
 Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Кристаллическая решётка фтора в твёрдом состоянии является моноклиной гранецентрированной со следующими параметрами решётки:
| a | 550 пм |
| b | 328 пм |
| c | 728 пм |
| α=β=γ | 90° |
Получение
 Лабораторный метод получения фтора
Лабораторный метод получения фтора
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1.
Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4.
Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Физические свойства
Слабо светло-оранжевый газ, в малых концентрациях запах напоминает одновременно озон и хлор, очень агрессивен и ядовит.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
XeF8 → XeF6 + F2 MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение в химической деятельности (химической промышленноси)
- Газообразный фтор используется для получения: гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности.
трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров
- гексафтороалюмината натрия — для последующего получения алюминия электролизом
различных соединений фтора
Ракетная техника
Соединения фтора широко применяются в ракетной технике как окислитель ракетного топлива.
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Дополнительная информация
- Фториды Соединения фтора в ракетной технике Соединения фтора в медицине
- Категория:Соединения фтора
Фтор, Fluorum, F(9) Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла.
Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов.
Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата.
В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф.
Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах.
Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота.
Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой.
Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте.
При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой.
О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями.
Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.).
Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета.
Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором.
U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение.
Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
Источник: http://himsnab-spb.ru/article/ps/f
Фтор
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 г.
Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (от др.-греч. φθόρος — «разрушение, порча, вред»), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от лат.
fluorum (от fluere — «течь», — по способности некоторых соединений фтора, например флюорита (CaF2), понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C). Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1).
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета.
Электронное строение
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы
 Применение метода МО для молекулы F2
Применение метода МО для молекулы F2
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы
 Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Кристаллическая структура α-фтора (стабильная при атмосферном давлении)
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий, существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К);
- β-фтор, прозрачный и менее плотный и твёрдый, существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2. Следует отметить, что в раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3, и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3.
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм.
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву.
Изотопный состав
Основная статья: Изотопы фтора
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона.
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
В атмосфере фтора горят даже вода и платина.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
2F2 + 2H2O → 4HF↑ + O2↑ 12F2 + 11H2O → 19HF↑ + H2O2 + HOF ↑ + O2↑ + O3↑ + OF2 ↑ + O2F2↑ Pt + 2F2 →350−400oC PtF4
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
2CoF3 → 2CoF2 + F2↑ 2MnF4 → 2MnF3 + F2↑
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
Получение
 Лабораторный метод получения фтора
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно потому, что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции с фтором).
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия электролизом;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами;
Основная статья: Соединения фтора в ракетной технике
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям.
На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих ракетных топлив. Однако продукты горения с фторсодержащими окислителями токсичны.
Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Основная статья: Соединения фтора в медицине
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор в основном содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г.
Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг.
При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома, соответственно.
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %.
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное ядовитое вещество. Является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода.
Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи.
При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Источник: https://chem.ru/ftor.html
Фтор
Атом, молекула, ядерные свойства
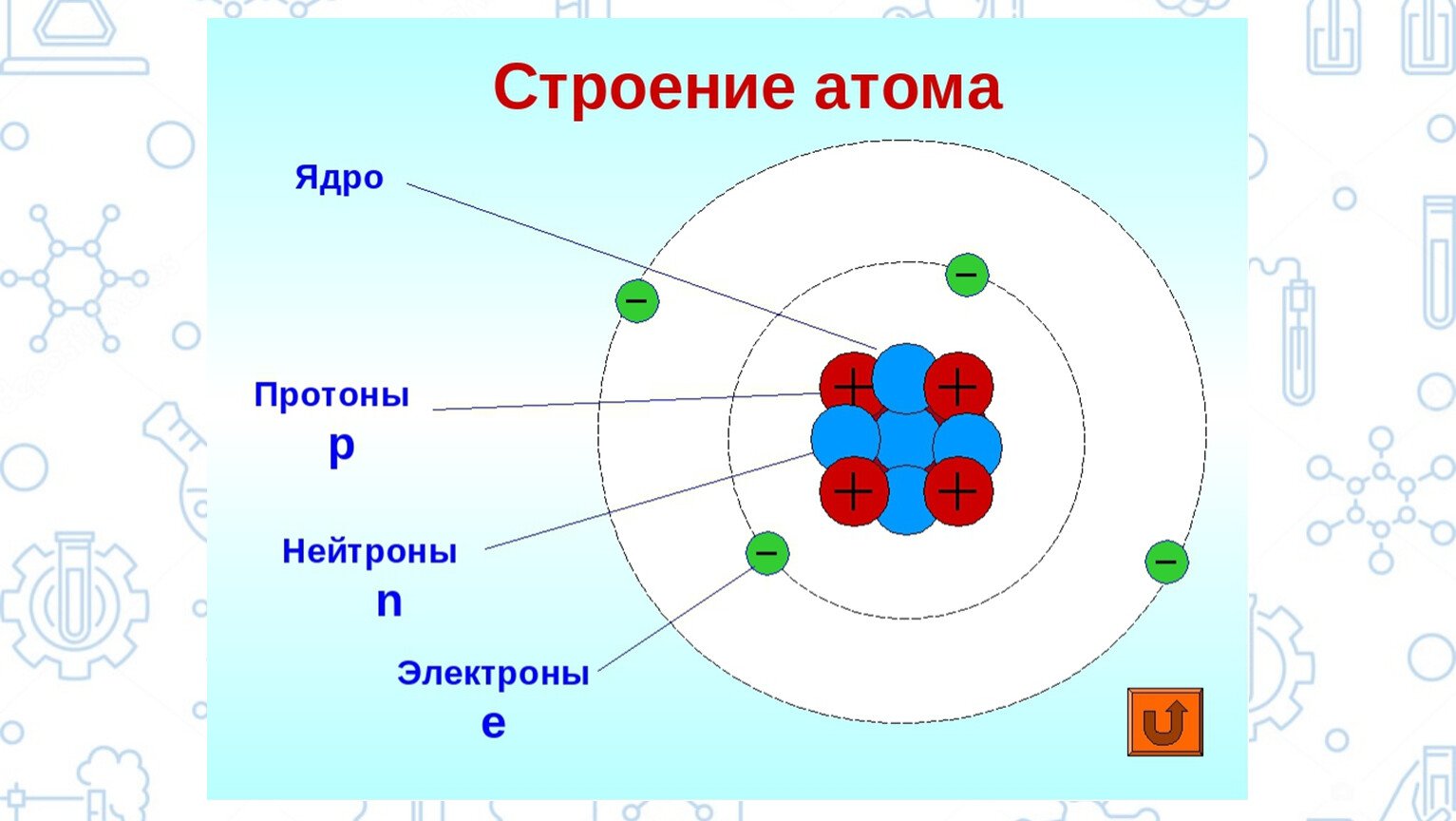
Строение атома фтора.
В центре атома находится положительное заряженное ядро. Вокруг вращаются 9 отрицательно заряженных электронов.
Электронная формула: 1s2;2s2;2p5
m прот. = 1,00783 (а.е.м.)
m нейтр.= 1,00866 (а.е.м.)
- m протона = m электрона
- Изотопы фтора.
- Изотоп: 18F
- Краткая характеристика: Распространённость в природе: 0 %
Число протонов в ядре — 9. Число нейтронов в ядре — 9. Число нуклонов — 18.Е связи = 931,5(9*m пр.+9*m нейтр-М(F18)) = 138,24 (МЭВ)Е удельн. = Е связи/N нуклонов = 7,81 (МЭВ/нукл.)
- Альфа-распад невозможенБета минус-распад невозможенПозитронный распад: F(Z=9,M=18)—>O(Z=8,M=18)+e(Z=+1,M=0)+0,28(Мэв)Электронный захват: F(Z=9,M=18)+e(Z=-1,M=0)—>O(Z=8,M=18)+1,21(Мэв)
- Изотоп: 19F
- Краткая характеристика: Распространённость в природе: 100 %
- Молекула фтора.
Свободный фтор состоит из двухатомных молекул. С химической стороны фтор может быть охарактеризован как одновалентный неметалл, и притом самый активный из всех неметаллов.
Обусловлено это рядом причин, в том числе легкостью распада молекулы F2 на отдельные атомы — необходимая для этого энергия составляет лишь 159 кДж/моль (против 493 кДж/моль для О2 и 242 кДж/моль для С12). Атомы фтора обладают значительным сродством к электрону и сравнительно малыми размерами.
Поэтому их валентные связи с атомами других элементов оказываются прочнее аналогичных связей прочих металлоидов (например, энергия связи Н-F составляет — 564 кДж/моль против 460 кДж/моль для связи Н-О и 431 кДж/моль для связи Н-С1).
- Связь F-F характеризуется ядерным расстоянием 1,42 А. Для термической диссоциации фтора расчетным путем были получены следующие данные:
- Температура, °С 300 500 700 900 1100 1300 1500 1700
- Степень диссоциации, % 5·10-3 0,3 4,2 22 60 88 97 99
Атом фтора имеет в основном состоянии структуру внешнего электронного слоя 2s22p5 и одновалентен. Связанное с переводом одного 2р-элсктрона на уровень 3s возбуждение трехвалентного состояния требует затраты 1225 кДж/моль и практически не реализуется.
Сродство нейтрального атома фтора к электрону оценивается в 339 кДж/моль. Ион F- характеризуется эффективным радиусом 1,33 А и энергией гидратации 485 кДж/моль. Для ковалентного радиуса фтора обычно принимается значение 71 пм (т. е.
половина межъядерного расстояния в молекуле F2).
Химические свойства фтора.
Так как фтористые производные м е т а л л о и д н ы х элементов обычно легколетучи образование их не предохраняет поверхность металлоида от дальнейшего действия фтора.
Поэтому взаимодействие часто протекает значительно энергичнее, чем со многими металлами. Например, кремний, фосфор и сера воспламеняются в газообразном фторе.
Аналогично ведет себя аморфный углерод (древесный уголь), тогда как графит реагирует лишь при температуре красного каления. С азотом и кислородом фтор непосредственно не соединяется.
От водородных соединений других элементов фтор отнимает водород. Большинство оксидов разлагается им с вытеснением кислорода. В частности, вода взаимодействует по схемеF2 + Н2О —> 2 НF + O
причем вытесняемые атомы кислорода соединяются не только друг с другом, но частично также с молекулами воды и фтора. Поэтому, помимо газообразного кислорода, при этой реакции всегда образуются пероксид водорода и оксид фтора (F2О). Последняя представляет собой бледно-желтый газ, похожий по запаху на озон.
Окись фтора (иначе — фтористый кислород — ОF2) может быть получена пропусканием фтора в 0,5 н. раствор NаОН. Реакция идет по уравнению:2 F2 + 2 NаОН = 2 NаF + Н2О + F2ОТак же для фтора характерны следующие реакции:
H2 + F2 = 2HF (со взрывом)
Cl2 + F2 = 2ClF
Источник: https://mirznanii.com/a/10084/ftor
Фтор – элемент, отнявший жизни многих исследователей
Из уроков химии нам известно, что фтор (как простое вещество) – это газ бледно-желтого цвета, с резким запахом, сильно токсичный. Как элемент Периодической Системы, фтор обладает наивысшей активностью. В ряду электроотрицательности неметаллов, фтор занимает крайне правое положение, а это означает, что его окислительная активность даже выше чем у кислорода. Это очень легко доказать. Например, если поместить бумагу или древесину в атмосферу фтора, они самовоспламенятся и быстро сгорят. Многие металлы так же воспламеняются в атмосфере фтора (например, алюминий и цинк).
- Zn+F2 = ZnF2
- 2AL+ 3F2 = 2ALF3
- Даже вода, которую поджечь казалось бы невозможно, в атмосфере фтора послушно загорается синим пламенем:
- 2F2 + 2H2O → 4HF + O2
История открытия фтора, берет свое начало в 1771 г., когда Карл Шееле впервые синтезировал плавиковую кислоту (HF). Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 г., а выделен лишь 76 лет спустя Анри Муассаном, при электролизе жидкого фтороводорода, содержащего примеси кислого фторида калия (KHF2).
До этого, из-за крайней агрессивности фтора, попытки многих химиков получить данное вещество в чистом виде, заканчивались неудачно и даже трагично. Первой жертвой Фтора был Гемфри Дэви. Затем умерли ирландские химики братья Нокс, повредили свое здоровье Тенар и Гей-Люссак из Франции, а так же погиб профессор Луйе из Бельгии.
Немудрено, что название данного элемента, Фтор, произошло от древнегреческого слова Ftoros – Разрушающий, Наносящий вред, Порча.
Однако, многие соединения фтора, были известны людям давно и нашли широкое применение в деятельности человека, например:
Флюорит (CaF2) – минерал, который может быть окрашен в различные цвета (голубой, синий, зеленый, желтый и др.). Его окраска зависит от дефектов кристаллической структуры, которая весьма чувствительна к различным внешним факторам. За способность данного вещества делать металлы более легкоплавкими, его называют так же плавиковый шпат.
Криолит (Na3[AlF6]) – редкий минерал из класса природных фторидов, обладающий свойствами схожими с плавиковым шпатом. Его и сегодня применяют во всем мире при выплавки алюминия.
Фторуксусная кислота (FCH2COOH) – фторорганическая карбоновая кислота, очень токсичная. Известно, что индейцы смачивали этим ядом наконечники копий и стрел.
Спустя много лет химики установили, что этот яд очень похож на уксусную кислоту, но с атомом фтора вместо водорода. В природе, похожее соединение, фторацетат натрия (FCH2COONa) содержится в некоторых растениях семейства Дихапеталовые.
В южной Африки, представители этого семейства растений ответственны за 8% смертности крупного рогатого скота.
В наши дни, соединения фтора так же широко используются в производстве, к примеру:
Фреоны — техническое название группы фторсодержащих производных насыщенных углеводородов (CH3F – фторметан, CH2F2 – дифторметан, CHF3 – трифторметан, CF4 – тетрафторметан и др.).
Это хладагенты, находящие широкое применение в холодильной технике и при производстве кондиционеров. Фреоны так же образуют аэрозоли в миллионах баллончиков с дезодорантами, лаками и им подобными косметическими средствами.
Однако, фреоны вырвавшиеся наружу устремляются в верхние слои атмосферы и разрушают озоновый слой.
Фтор повинен в создание атомной бомбы, так как летучие фториды урана единственное вещество пригодное для разделения его изотопов. Однако, это значит, что при помощи фтора производится и топливо для атомных электростанций, играющих ключевую роль в мировой энергетики.
Конечно же, ни для кого не секрет, что фтор, а точнее его соединения, входят в состав зубных паст и придают зубам завидную прочность.
Поэтому, несомненно, фтор можно считать одним из самых противоречивых элементов, который с одной стороны причиняет много вреда, а с другой, несет неоценимую пользу. Когда то Парацельс сказал: «Всё есть яд и всё есть лекарство. Только доза делает лекарство ядом и яд лекарством». Так же и с Фтором, все зависит от того, кто и как его использует.
Источник: https://zen.yandex.ru/media/id/5c9f7825111e6e00b2e6ec6f/5d273ca7fe289100ac7ef351




