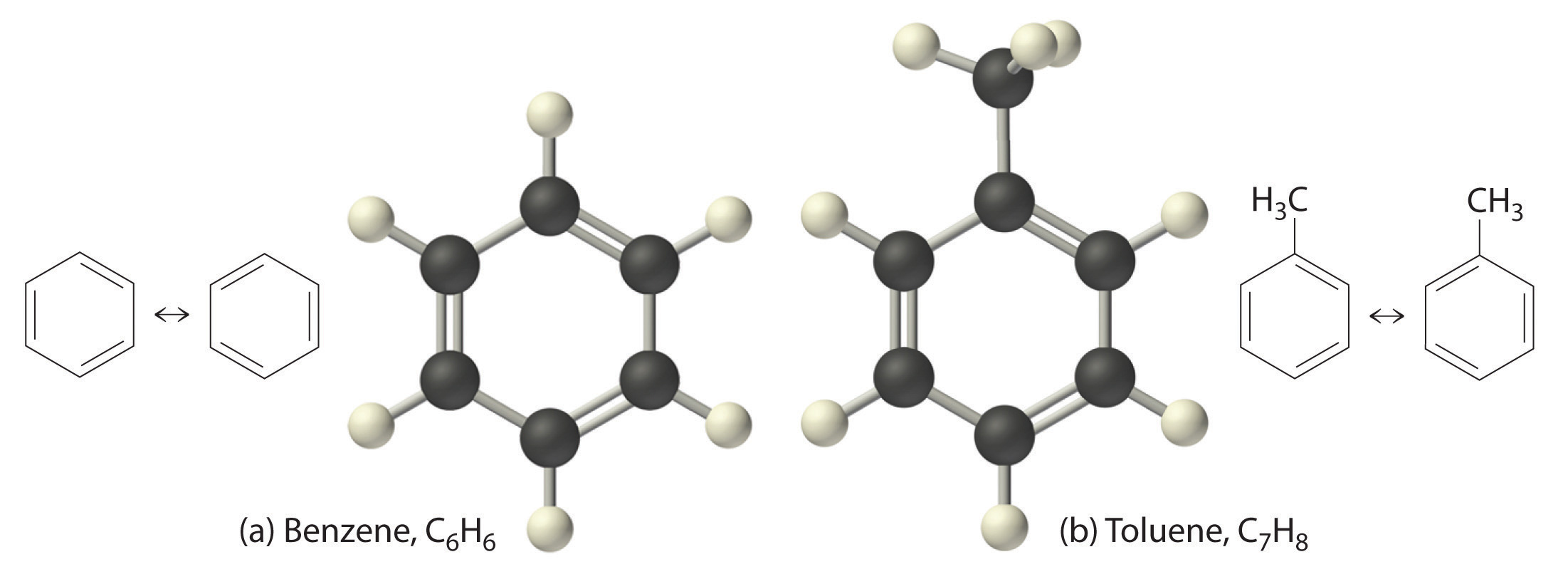
Арены — ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо составляют 6 атомов углерода, между которыми чередуются двойные и одинарные связи.
Важно заметить, что двойные связи в молекуле бензола не фиксированы, а постоянно перемещаются по кругу.
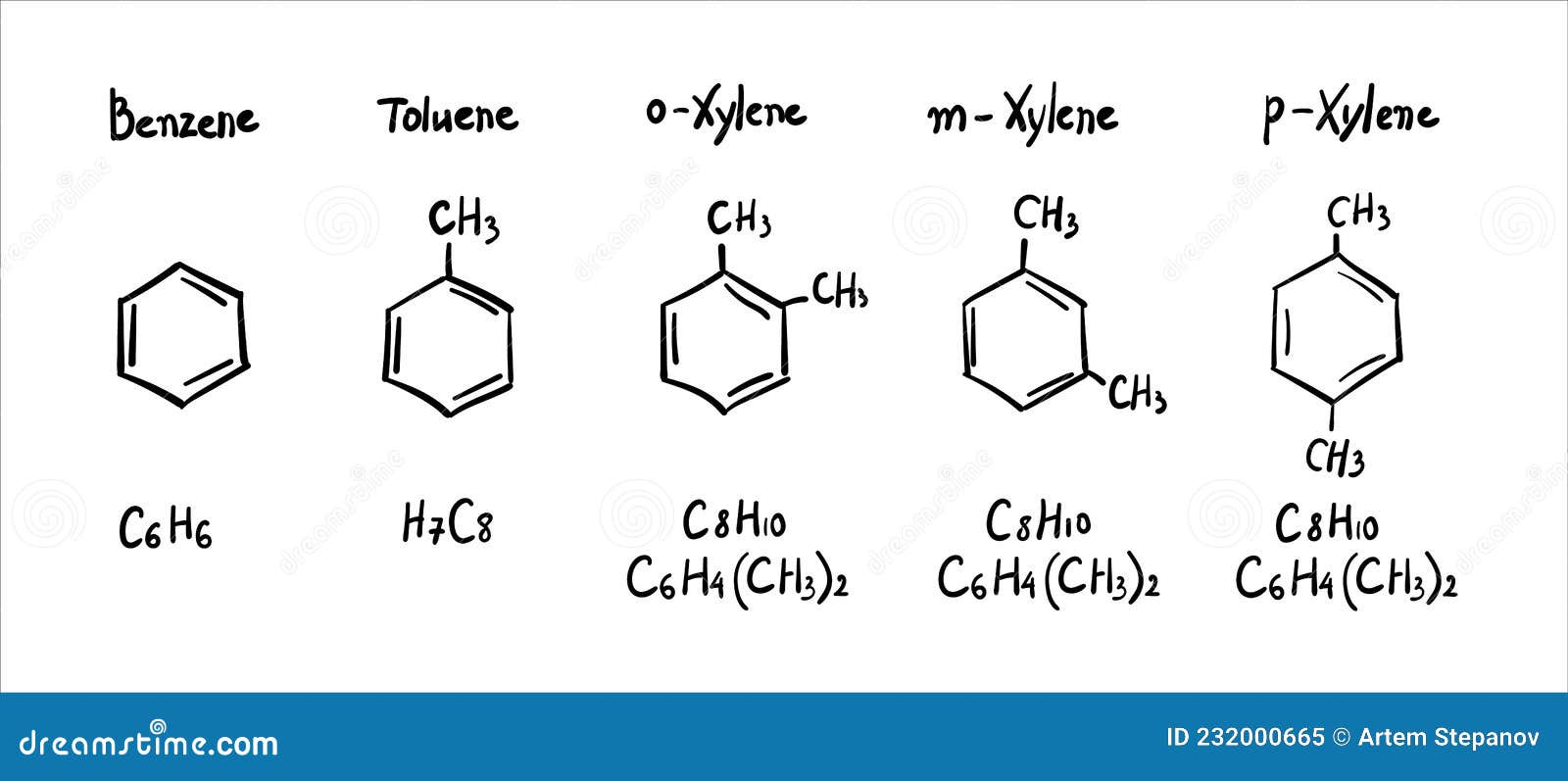
Арены также называют ароматическими углеводородами. Первый член гомологического ряда — бензол — C6H6. Общая формула их гомологического ряда — CnH2n-6.

Долгое время структурная формула бензола оставалась тайной. Предложенная Кекуле формула с двумя тройными связями не могла объяснить то, что бензол не вступает в реакции присоединения. Как уже было сказано выше, по современным представлениям, двойные связи в молекуле постоянно перемещают, поэтому правильнее рисовать их в виде кольца.
За счет чередования двойных связей в молекуле бензола формируется сопряжение. Все атомы углерода находятся в состоянии sp2 гибридизации. Валентный угол — 120°.
Номенклатура и изомерия аренов
Названия аренов формируются путем добавления названий заместителей к главной цепи — бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке. Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.

Для аренов характерна структурная изомерия, связанная с положением заместителей. Например, два заместителя в бензольном кольце могут располагаться в разных положениях.
Название положения заместителей в бензольном кольце формируется на основе их расположения относительно друг друга. Оно обозначается приставками орто-, мета- и пара. Ниже вы найдете мнемонические подсказки для их успешного запоминания ?

Получение аренов
Арены получают несколькими способами:
- Реакция Зелинского (тримеризация ацетилена)
- Дегидроциклизация алканов
- Дегидрирование циклоалканов
- Синтез Дюма
Данная реакция протекает при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический углеводород — бензол.  В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола.
В случае, если к ацетилену добавить пропин, то становится возможным получение толуола. Увеличивая долю пропина, в конечном итоге можно добиться образования 1,3,5-триметилбензола. 
В ходе таких реакций, протекающих при повышенной температуре и в присутствии катализатора — Cr2O3, линейная структура алкана замыкается в цикл, отщепляется водород.  При дегидроциклизации гептана получается толуол.
При дегидроциклизации гептана получается толуол. 
В результате дегидрирования уже «готовых» циклов — циклоалканов, отщепляются 3 моль водорода, и образуется соответствующий арен, с теми же заместителями, которые были у циклоалкана. 
Синтез Дюма заключается в сплавлении солей карбоновых кислот с щелочами. В результате такой реакции возможно образование различных органических веществ, в том числе аренов. 
Химические свойства аренов
Арены — ароматические углеводороды, которые содержат бензольное кольцо с сопряженными двойными связями. Эта особенность делает реакции присоединения тяжело протекающими (и тем не менее возможными!)
Запомните, что, в отличие от других непредельных соединений, бензол и его гомологи не обесцвечивают бромную воду и раствор перманганата калия.
- Гидрирование
- Галогенирование
- Нитрование
- Алкилирование
- Окисление
- Полимеризация
При повышенной температуре и наличии катализатора, водород способен разорвать двойные связи в бензольном кольце и превратить арен в циклоалкан. 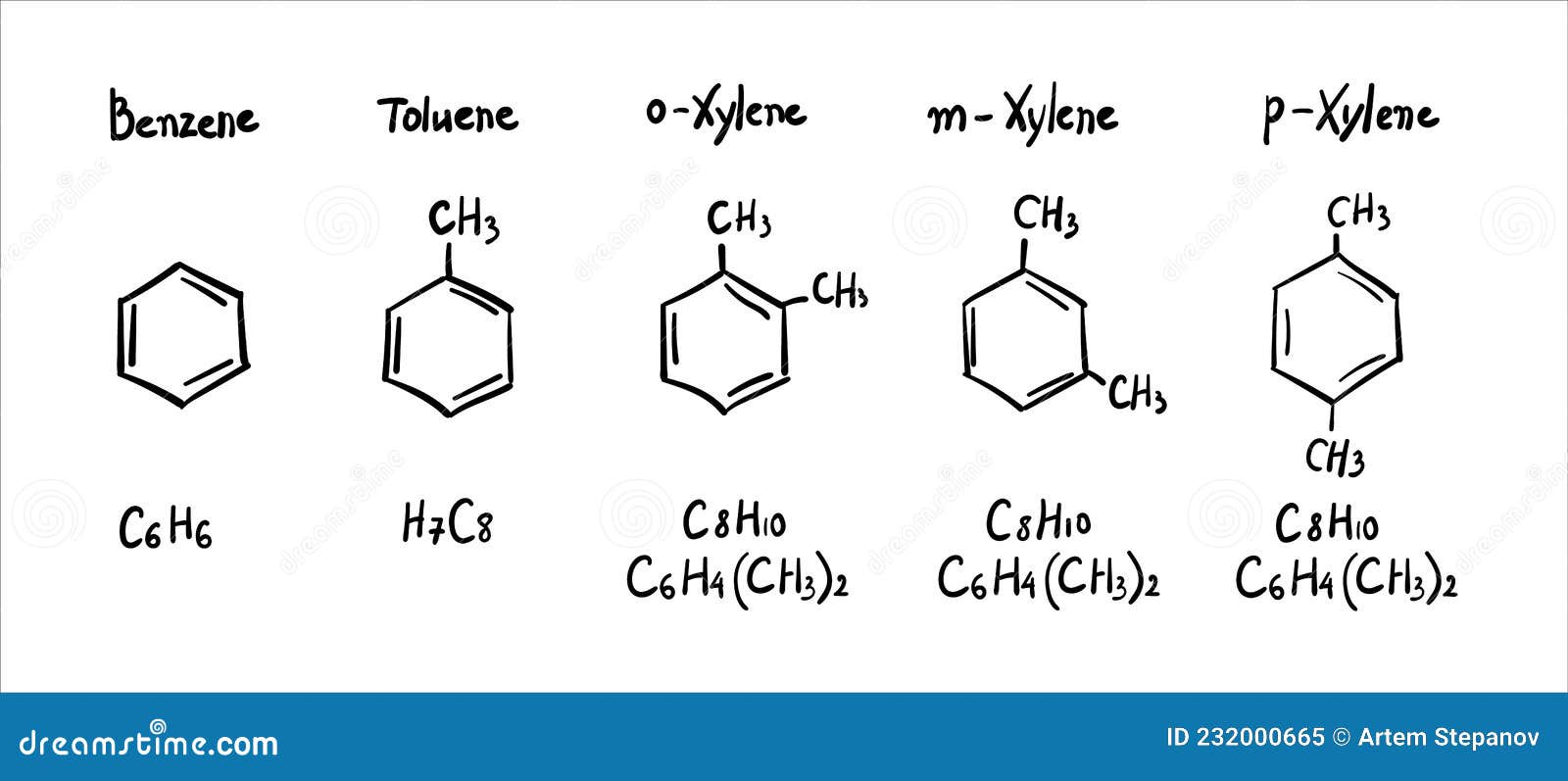
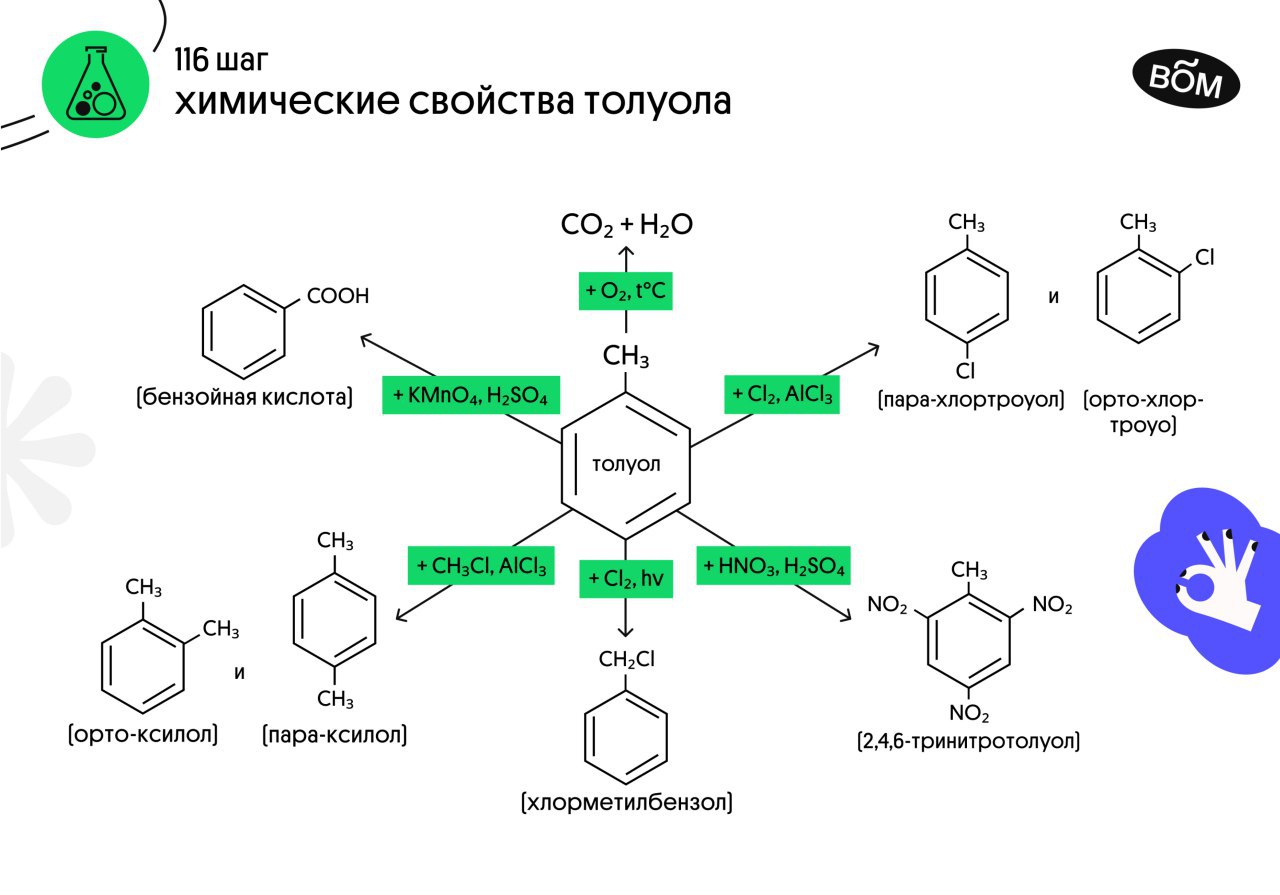
Реакция бензола с хлором на свету приводит к образованию гексахлорциклогексана, если же использовать только катализатор, то образуется хлорбензол. Реакции с толуолом протекают иначе: при УФ-свете хлор направляется в радикал метил и замещает атом водорода в нем, при действии катализатора хлор замещает один атом водорода в бензольном кольце (в орто- или пара-положении). Почему хлор направляется именно в орто- и пара-положения относительно метильной группы? Здесь самое время коснуться темы ориентантов I (орто-, пара-ориентантов) и II порядков (мета-ориентанты). К ориентантам первого порядка относятся группы: NH2, OH, OR, CR3, CHR2, CH 2R, галогены. К ориентантам второго: NO2, CN, SO3H, CCl3, CHO, COOH, COOR. Например, ориентант I порядка, гидроксогруппа OH, обеспечивает протекание хлорирования в орто- и пара-положениях. А карбоксильная группа COOH, ориентант II порядка, обуславливает хлорирование в мета-положениях.
Арены вступают в реакции нитрования, протекающие при повышенной температуре и в присутствии серной кислоты, обладающей водоотнимающими свойствами.
Алкилирование аренов осуществляется путем введения алкильного радикала в молекулу бензола. Алкильным радикалом чаще всего выступает алкен или галогеналкан. В случае если для алкилирования используется алкен, то с молекулой бензола соединяется наименее гидрированный атом углерода алкена, прилежащий к двойной связи. Один атом водорода переходит из бензольного кольца к радикалу.
Арены, как и все органические вещества, сгорают с образованием углекислого газа и воды. 2C6H6 + 15O2 → 12CO2 + 6H2O При неполном окислении гомологи бензола способны окисляться до бензойной кислоты (при подкислении раствора серной кислотой). Сам бензол не вступает в реакцию окисления с KMnO4, не обесцвечивает его раствор.
В реакцию полимеризации способен вступать стирол (винилбензол), в радикале которого содержится двойная связь.
Источник: https://studarium.ru/article/186
Глава 8. Арены. Ароматические углеводороды
Ароматическими называются соединения, содержащие в своем составе одно или несколько бензольных ядер. Бензольное ядро обуславливает определенные физические и химические свойства ароматических соединений, их ароматический характер. Общая формула аренов: CnH2n-6
8.1 Строение бензола. Бензол С6Н6 – простейший представитель ароматических углеводородов.
Из всех формул строения, которые предлагались учеными 19 века, наиболее приемлемой оказалась формула Кекуле (1865 г.), согласно которой бензол представляет шестичленный циклический углеводород с 3-мя сопряженными (=) связями.
циклогексатриен – 1, 3, 5
Эта формула правильно отразила равноценность всех шести атомов С и Н и некоторые другие особенности. Однако, эта формула не могла объяснить:
- при явной ненасыщенности состава (СnH2n-6) и в отличие от непредельных углеводородов бензол в обычных условиях не обесцвечивает бромную воду (Br2) и раствор KMnO4;
- вместе с тем бензол проявляет насыщенный характер при действии Br2 и HNO3, протекают реакции замещения.
С6Н6 + Br2 ® С6Н5Br + HBr
C6H6 + HONO2 ® C6H5NO2 + H2O
- устойчивость бензола к действию окислителей;
- способность вступления в реакции присоединения, но только в жестких условиях (сильное освещение, наличие катализаторов)
С6Н6 + 3Н2 ¾® С6Н12
С6Н6 + 3Cl2 ¾®¾® C6H6Cl6
Из этого следует, что бензол может проявлять ненасыщенный характер, но в обычных условиях это свойство ослаблено, бензол в тоже время проявляет и насыщенный характер. И только развитие электронных и квантово-механических представлений о химических связях позволило объяснить особенности ароматических соединений.
8.2 Природа ароматического состояния.Все атомы углерода в молекуле бензола находятся в состоянии sp2 – гибридизации. Каждый атом С образует три σ-связи (две С – С и одну С – Н) с углом между ними 1200.
|

Четвертый р-электрон всех шести атомов углерода расположен перпендикулярно к плоскости кольца, все шесть р-электронных облаков перекрываются друг другом и образуют общую π-систему – осуществляется круговое сопряжение.
Рентгенографическим методом установлено, что электронная плотность в бензольном ядре распределена равномерно, т.е. в нем нет ни (–) простых, ни (=) связей.
 |
 |
Все связи одинаковы, длина их равна 0,139 нм. Это плоская фигура – правильный шестиугольник из СН – групп, лежащих в одной плоскости и связанных ароматической системой связей. Их можно изобразить в виде кружков.
![]()
Природа ароматического состояния позволила объяснить, почему бензол, являясь сильно ненасыщенным соединением трудно вступает в реакции присоединения и легче в реакции замещения:
- Реакции замещения атомов водорода идут легче, т.к. они находятся на периферии от π-системы и при разрыве С –Н связи π-система не затрагивается.
- Реакции присоединения и окисления протекают трудно, т.к. при их протекании разрывается π-система, обладающая большой энергией. Энергия связи С – С в молекуле бензола составляет 490кДж/моль.
8.3 Изомерия производных бензола. Однозамещенные производные бензола изомеров не имеют, т.к. все атомы С в бензоле равноценны.
Двухзамещенные производные бензола имеют три изомера, отличающиеся взаимным расположением заместителей.
Если два заместителя расположены у рядом стоящих С атомов, то такой изомер называется орто – (о-); через один С атом – мета – (м-); через два С атома пара – (п-)



8.4 Номенклатура.Многие арены имеют травиальные названия (исторически сложившиеся).  Название аренов производится от названия заместителей (R) боковой цепи с прибавлением слова бензол.
Название аренов производится от названия заместителей (R) боковой цепи с прибавлением слова бензол.
-

- метилбензол этилбензон изопропилбензон винилбензон
- (толуол) (кумол) (стирол)
-
1,2 – (о) –диметилбензол (о-ксилол)
Источник: https://cyberpedia.su/15xa686.html
3.3 Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
- Видеоурок: Классификация органических веществ
- Лекция: Классификация органических веществ. Номенклатура органических веществ (тривиальная и международная)
- Классификация органических веществ
В основе классификации органических веществ лежит теория А.М. Бутлерова. В таблице показана классификация органических веществ в зависимости от типа строения углеродной цепи, т.е. по типу углеродного скелета:

Ациклические соединения — это органические вещества, в молекулах которых атомы углерода соединены друг с другом в прямые, а так же разветвленные открытые цепи.
К ациклическим, например, относится этан:

или ацетилен:

Иначе подобные соединения называются алифатическими или соединениями жирного ряда, потому что первые соединения данного ряда органических веществ были получены из растительных или животных жиров. Из ациклических соединений выделяются:
- Предельные (или насыщенные) — данные соединения содержат в углеродном скелете одинарные ковалентные неполярные углерод-углеродные С-С и слабополярные С-Н связи, это алканы.
Общая молекулярная формула алканов — CnH2n+2, где n — количество атомов углерода в молекуле углеводорода. К ним относятся открытые цепи, а также замкнутые (циклические) углеводороды. Все атомы углерода в алканах имеют sp3 — гибридизацию. Запомните следующие алканы:
- Метан — СH4
- Этан — C2H6: CH3—CH3
- Пропан — C3H8: CH3—CH2—CH3
- Бутан — C4H10: CH3—(CH2)2—CH3
- Пентан — C5H12: CH3—(CH2)3—CH3
- Гексан — C6H14: CH3—(CH2)4—CH3
- Гептан — C7H16: CH3—(CH2)5—CH3
- Октан — C8H18: CH3—(CH2)6—CH3
- Нонан — C9H20: CH3—(CH2)7—CH3
- Декан — C10H22: CH3—(CH2)8—CH3
- Непредельные (или ненасыщенные) — содержат кратные — двойные (С=С) или тройные (С≡С) связи, это алкены, алкины и алкадиены:
1) Алкены — содержат одну углерод-углеродную связь, которая является двойной C=C. Общая формула — CnH2n. Атомы углерода в данных соединениях имеют sp2 — гибридизацию. Связь C=C имеет π-связь и σ-связь, поэтому алкены более химически активны, чем алканы. Запомните следующие алкены:
- Этен (этилен) — C2H4: CH2=CH2
- Пропен (пропилен) — C3H6: СН2=СН—СН3
- Бутен — С4Н8: бутен-1 СН3—СН2—СН=СН, бутен-2 СН3—СН=СН—СН3, изобутен [СН3]2С=СН2
- Пентен — C5H10: 1-пентен CH3—CH2—CH2—CH=CH2, 2-пентен C2H5CH=CHCH3
- Гексен — C6H12: 1-гексен CH2=CH—CH2—CH2—CH2—CH3, цис—гексен-2 CH3—CH=CH—CH2—CH2—CH3 и другие изомеры.
- Гептен — C7H14: 1-гептен СН2=СН—СН2—СН—СН2—СН2—СН3, 2-гептен СН3—СН=СН—СН2—СН2—СН2—СН3 и др.
- Октен — C8H16: 1-октен СН2=СН—СН2—СН2—СН2—СН2—СН2—СН3, 2-октен СН3—СН=СН—СН2—СН2—СН2—СН2—СН3 и др.
- Нонен — C9H18: 3-нонен CH3—CH2—CH=CH—CH2—CH2—CH2—CH2—CH3, 5-нонен CH3—CH2—CH2—CH2—CH=CH—CH2—CH2—CH3 и др.
- Децен — C10H20: 2-децен СН3—СН2—СН2—СН2—СН2—СН2—СН2—СН=СН—СН3 и др.
Как вы заметили, названия алкенов схожи с названиями алканов, с разницей суффикса. Названия алканов имеют суффикс -ан, а алкенов суффикс -ен. Кроме того среди перечисленных алкенов отсутствует метен. Запомните, метена не существует, потому что метан имеет только один углерод. А для образования алкенов, обязательно образование двойных связей.
Местоположение двойной связи обозначается цифрой, например, 1-бутен: СН2=СН–СН2–СН3 или 1-гексен: СН3–СН2–СН2–СН2–СН=СН2. Обратите внимание на данное правило: нумерация углеводородных цепей должна производиться так, чтобы двойные связи находились под наименьшим номером, например, 2-гексен:
![]()
2) Алкины – в молекулах присутствует одна тройная С≡С связь. Общая формула — CnH2n-2. В названиях алкинов суффикс -ан заменен на-ин. Например, 3-гептин: СН3–СН2–СН2–С≡С–СН2–СН3. Для этина НС≡СН возможно и тривиальное название ацетилен.
Указание положения тройной связи производится также как в предыдущем случае с алкенами. Если в соединении тройных связей больше одной, то к названию прибавляется суффикс -диин или -триин.
Если же в соединении присутствуют и двойные, и тройные связи, то их нумерацию определяет двойная связь, следовательно, называют сначала двойную, затем тройную связи. Например, гексадиен-1,3-ин-5: СН2=СН–СН2=СН2–С≡СН.
3) Алкадиены – в молекулах присутствуют две двойные С=С связи. Общая формула — CnH2n-2, такая же, как и у алкинов. Алкины и алкадиены относятся к межклассовым изомерам. К примеру, 1,3-бутадиен или дивинил C4H6: СН2=СН—СН=СН2.
Циклические соединения — это органические вещества, в молекулах которых содержится три или более связанных в замкнутое кольцо атомов, образующих циклы.

Предельные циклические углеводороды называются циклоалканами. Их общая формула — CnH2n. В молекулах имеется замкнутая цепь или кольца. К примеру, циклопропан (C3H6):

и циклобутан (C4H8):

В зависимости от того, какими атомами были образованы циклы, данный вид соединений подразделяется на карбоциклические и гетероциклические.
Карбоциклические, которые иначе называются гомоциклическими, содержат в циклах только атомы углерода. В свою очередь, они делятся на алифатические и ароматические.
- Алициклические (алифатические) соединения отличаются тем, что атомы углерода могут соединяться между собой в прямые, разветвлённые цепочки или кольца одинарными, двойными или тройными связями.
Типичным алифатическим соединением является циклогексен:

- Ароматические соединения получили свое название благодаря ароматному запаху вещества. Иначе называются аренами. Они отличаются наличием в соединении бензольного кольца:

Таких колец в составе может быть несколько. Например, нафталин:
Также данная группа соединений имеет в составе ароматическую систему, что характеризует высокую устойчивость и стабильность соединения. Ароматичная система, содержит в кольце 4n+2 электронов (где n = 0, 1, 2, …). Данной группе органических веществ свойственно вступать в реакции замещения, а не присоединения.
Ароматические соединения могут иметь функциональную группу, прикрепленную непосредственно к кольцу. Например, толуол:
Гетероциклические соединения всегда содержат в составе углеводородного цикла один или несколько гетероатомов, которыми являются атомы кислорода, азота или серы. Если гетероатомов пять, то соединения называются пятичленными, если шесть, соответственно шестичленными. Примером гетероциклического соединения является пиридин:
Классификация производных углеводорода
Другие органические вещества рассматривают исключительно как производные углеводородов, которые образуются при введении в молекулы углеводородов функциональных групп, включающих в себя другие химические элементы.
Формулу соединений, имеющих одну функциональную группу, можно записать как R — X. Где R – углеводородный радикал (фрагмент молекулы углеводорода без одного или нескольких атомов водорода; Х – функциональная группа.
По наличию функциональных групп углеводороды подразделяются на:
- Галогенпроизводные — судя из названия ясно, что в данных соединениях атомы водорода замещены на атомы какого-либо галогена.
- Спирты и фенолы. В спиртах атомы водорода замещены на гидроксильную группу -OH. По количеству таких групп, спирты подразделяются на одноатомные и многоатомные, среди которых двухатомные, трехатомные и т.д.
Формула одноатомных спиртов: CnH2n+1OH или CnH2n+2O.
Формула многоатомных спиртов: CnH2n+2Ox; x – атомность спирта.
Спирты могут быть и ароматическими. Формула одноатомных ароматических спиртов: CnH2n-6O.
Следует помнить, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один/несколько атомов водорода не относятся к спиртам. Данный тип относят к классу фенолов.
Причина, по которой фенолы не относят к спиртам, содержится в их специфических химических свойствах. Одноатомные фенолы изомерны одноатомным ароматическим спиртам.
То есть они так же имеют общую молекулярную формулу CnH2n-6O.
- Амины — производные аммиака, в которых один, два или три атома водорода заменены на углеводородный радикал. Амины, в которых только один атом водорода замещен на углеводородный радикал, то есть имеющие общую формулу R-NH2, именуют первичными аминами. Амины, в которых, два атома водорода заменены на углеводородные радикалы, именуют вторичными. Их формула — R-NH-R’. Следует помнить, что радикалы R и R’ могут быть как одинаковые, так и разные. Если все три атома водорода молекулы аммиака замещены на углеводородный радикал, то амины являются третичными. При этом R, R’, R’’ могут быть как полностью одинаковыми, так и разными. Общая формула первичных, вторичных и третичных предельных аминов — CnH2n+3N. Ароматические амины с одним непредельным заместителем имеют формулу CnH2n-5N.
- Альдегиды и кетоны. У альдегидов при первичном атоме углерода два атома водорода замещены на один атом кислорода. То есть в их структуре имеется альдегидная группа – СН=О. Общая формула — R-CH=O. У кетонов при вторичном атоме углерода два атома водорода замещены на атом кислорода. То есть это соединения, в структуре которых есть карбонильная группа –C(O)-. Общая формула кетонов: R-C(O)-R’. При этом радикалы R, R’ могут быть как одинаковыми, так и разными. Альдегиды и кетоны достаточно схожи по строению, но их все-таки различают как классы, так как они имеют существенные различия в химических свойствах. Общая формула предельных кетонов и альдегидов имеет вид: CnH2nO.
- Карбоновые кислоты содержат карбоксильную группу –COOH. В случае, когда кислота содержит две карбоксильные группы, такую кислоту именуют дикарбоновой кислотой. Предельные монокарбоновые кислоты (с одной группой -COOH) имеют общую формулу — CnH2nO2. Ароматические монокарбоновые кислоты имеют общую формулу CnH2n-8O2.
- Простые эфиры – органические соединения, в которых два углеводородных радикала опосредованно соединены через атом кислорода. То есть, имеют формулу вида: R-O-R’. При этом радикалы R и R’ способны быть как одинаковыми, так и разными. Формула предельных простых эфиров — CnH2n+1OH или CnH2n+2О.
- Сложные эфиры – класс соединений на основе органических карбоновых кислот, у которых атом водорода в гидроксильной группе заменен на углеводородный радикал R.
- Нитросоединения – производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу –NO2. Предельные нитросоединения с одной нитрогруппой имеют формулу CnH2n+1NO2.
- Аминокислоты имеют в структуре одновременно две функциональные группы – амино NH2 и карбоксильную – COOH. Например: NH2-CH2-COOH. Предельные аминокислоты, имеющие одну карбоксильную и одну аминогруппу изомерны соответствующим предельными нитросоединениям то есть, имеют общую формулу CnH2n+1NO2.
Номенклатура органических соединений
Номенклатура соединения делится на 2 типа:
- тривиальную и
- систематическую.
Тривиальная — это исторически первая номенклатура, возникшая в самом начале развития органической химии. Названия веществ носили ассоциативный характер, например, щавелевая кислота, мочевина, индиго.
Создание систематической, т.е. международной номенклатуры началось с 1892 года. Тогда была начата Женевская номенклатура, которую с 1947 и по сегодняшний день продолжает ИЮПАК (IUPAC — международная единая химическая номенклатура).
Согласно систематической номенклатуре названия органических соединений составляются из корня, обозначающего длину основной цепи, т.е.
соединенных в неразветвленную цепь атомов углеродов, а также приставок и суффиксов, обозначающих наличие и расположение заместителей, функциональных групп и кратных связей.
Систематическая номенклатура алкановСистематическая номенклатура алкеновСистематическая номенклатура алкиновСистематическая номенклатура спиртов и феноловСистематическая номенклатура полиненасыщенных углеводородовСистематическая номенклатура ареновСистематическая номенклатура галогенопроизводныхСистематическая номенклатура альдегидов и кетоновСистематическая номенклатура карбоновых кислот и их производныхНоменклатура гетероциклических соединений
| Предыдущий урок | Следующий урок |
Источник: https://cknow.ru/knowbase/774-33-klassifikaciya-organicheskih-veschestv-nomenklatura-organicheskih-veschestv-trivialnaya-i-mezhdunarodnaya.html
Углеводороды, виды и их классификация
![]()
![]()
![]()
![]()
- Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Они служат фундаментальной основой органической химии
- Углеводороды
- Классификация и виды углеводородов
- Предельные (насыщенные) ациклические углеводороды
- Непредельные (ненасыщенные) ациклические углеводороды
- Алициклические углеводороды
- Ароматические углеводороды
Углеводороды:
Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Углеводороды служат фундаментальной основой органической химии – молекулы любых других органических соединений рассматривают как их производные.
Если в углеводороде один или несколько атомов водорода замещён на другой атом или группу атомов, называемую функциональной группой, то данное соединение называется производным углеводорода.
Атом углерода имеет 4 электрона на внешней оболочке, а потому способен образовывать четыре химические связи с другими атомами. Поэтому атом углерода является стабильным только в том случае, если все из этих связей – все четыре связи используются.
Существует огромное количество совершенно различных соединений углеводородов, которые различаются количеством атомов углерода и водорода, строением углеродного скелета и типом связей между атомами.
Большинство углеводородов в природе Земли встречаются в сырой нефти. Кроме того, основными источниками углеводородов являются природный газ, сланцевый газ, попутный нефтяной газ, горючие сланцы, уголь, торф.
Классификация и виды углеводородов:
- При систематизации (классификации) углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
- В зависимости от строения углеродного скелета углеводороды подразделяют на ациклические и карбоциклические.
- Ациклические соединения (ациклические углеводороды) – класс органических соединений, в молекулах которых отсутствуют циклы (кольца), и все атомы углерода соединены между собой в прямые или разветвлённые (открытые) цепи.
- Ациклические соединения также в литературе называются алифатическими соединениями.
Карбоциклические соединения (карбоциклические углеводороды) – класс органических соединений, характеризующихся наличием колец (циклов) из атомов углерода.
Карбоциклические соединения отличаются от гетероциклических соединений отсутствием в кольцах каких-либо других атомов, помимо атомов углерода.
В зависимости от кратности углерод-углеродных связей ациклические углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены) углеводороды. Предельные ациклические углеводороды также называются насыщенными, а непредельные – ненасыщенными.
В свою очередь циклические углеводороды в зависимости от кратности углерод-углеродных связей подразделяются на алициклические (циклоалканы, циклоалкены, циклоалкины) и ароматические (арены) углеводороды.
Предельные (насыщенные) ациклические углеводороды:
Алканы (также именуемые насыщенные углеводороды, предельные углеводороды, парафины) – ациклические углеводороды линейного или разветвлённого строения, содержащие только простые (одиночные) связи между атомами углерода и образующие гомологический ряд с общей формулой CnH2n+2.
Насыщенными алканы называются потому, что они содержат максимально возможное число атомов водорода для заданного числа атомов углерода.
Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации – все 4 гибридные орбитали атома углерода идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C-C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C-C составляет 0,154 нм, длина связи C-H – 0,1087 нм.
Алканы образуют гомологический ряд, также называемый рядом метана. К алканам относятся: метан CH4, этан C2H6, пропан C3H8, бутан C4H10, пентан C5H12, гексан C6H14, гептан C7H16, октан C8H18, нонан C9H20, декан C10H22 и т.д., которые имеют формулу CnH2n+2. Алкан с самой длинной цепью – нонаконтатриктан C390H782.
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии – изомерией углеродного скелета, а начиная с гептана – также оптической изомерией. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Непредельные (ненасыщенные) ациклические углеводороды:
Алкены (также именуемые олефины, этиленовые углеводороды) – ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации и имеют валентный угол 120°. Связи C=C представляют собой π-связи. Длина связи C=C составляет 0,134 нм.
По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены образуют гомологический ряд, также называемый рядом этилена. К алкенам относятся: этен (этилен) C2H4, пропен (пропилен) C3H6, бутен (бутилен) C4H8, пентен C5H10, гексен C6H12, гептен C7H14, октен C8H16, нонен C9H18, децен C10H20 и т.д., которые имеют формулу CnH2n.
Алкены, число атомов углерода в которых больше двух (т.е. кроме этилена), имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алкины (также именуемые ацетиленовые углеводороды) – ациклические непредельные углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют валентный плоский угол 180°. Таким образом у алкинов связь С≡С линейна (угол 180°) и находится в одной плоскости. Связи C≡C образованы одной σ-связью и двумя π-связями. Длина связи C≡C составляет 0,121 нм.
По номенклатуре IUPAC названия алкинов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ин»; положение тройной связи указывается арабскими цифрами.
Алкины образуют гомологический ряд, также называемый рядом ацетилена. К алкинам относятся: этин (ацетилен) C2H2, пропин C3H4, бутин C4H6, пентин C5H8, гексин C6H10, гептин C7H12, октин C8H14, нонин C9H16, децин C10H18 и т.д., которые имеют формулу CnH2n-2.
Алкины, число атомов углерода в которых больше трех (т.е. кроме ацетилена и пропина), имеют изомеры. Для алкинов характерны изомерия углеродного скелета, положения тройной связи и межклассовая. С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
- Диены (именуемые также алкадиены) – ациклические непредельные углеводороды, содержащие две двойных связи между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2.
- В зависимости от взаимного расположения кратных связей, диены подразделяются на три группы:
- – сопряжённые диены, в которых двойные связи разделены одинарной (1,3-диены)
- – аллены с кумулированными двойными связями (1,2-диены)
- – диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
- По номенклатуре IUPAC названия диенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-диен»; положение двух двойных связей указывается двумя арабскими цифрами.
Атомы углерода при двойной связи находятся в состоянии sp² гибридизации. Связи C=C представляют собой π-связи. В сопряженных диенах длина связи C=C составляет 0,137 нм, а C-C – 0,146 нм.
Диены образуют гомологический ряд. К диенам относятся: пропадиен (С3Н4), бутадиен (С4Н6), пентадиен (С5Н8), гексадиен (С6Н10), гептадиен (С7Н12), октадиен (С8Н14), нонадиен (С9Н16), декадиен (С10Н18) и т.д., которые имеют формулу CnH2n-2.
Диены, число атомов углерода в которых больше четырех (т.е. кроме пропадиена и бутадиена), имеют изомеры. Для диенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и геометрическая (пространственная, цис-транс-изомерия). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Алициклические углеводороды:
Алициклические углеводороды – циклические углеводороды, молекулы которых содержат замкнутые кольца из атомов углерода (но не имеющие ароматического кольца), которые являются частично или полностью насыщенными. Алициклические соединения классифицируют по числу атомов в кольце, по числу колец, по наличию или отсутствию кратных связей.
К алициклическим углеводородам относятся циклоалканы, циклоалкены, циклоалкины.
Алициклические углеводороды имеют изомеры. Для них характерны изомерия углеродного скелета (кольца и боковых цепей), положения заместителей в цепи, положения двойной или тройной связи, межклассовая и геометрическая (пространственная, оптическая, цис-транс-изомерия, конформационная). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
Циклоалканы (именуемые также полиметиленовые углеводороды, нафтены, цикланы, циклопарафины) – насыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие только простые (одиночные) связи между атомами углерода и образующие гомологический ряд с общей формулой CnH2n (n⩾3).
По номенклатуре IUPAC названия циклоалканов образуются от названий соответствующих алканов добавлением приставки «цикло-».
Атомы углерода при С-С связи находятся в состоянии sp3 гибридизации.
Циклоалканы образуют гомологический ряд. К циклоалканам относятся: циклопропан C3H6, циклобутан C4H8, циклопентан C5H10, циклогексан C6H12, циклогептан C7H14, циклооктан C8H16, циклононан C9H18, циклодекан C10H20 и т.д., которые имеют формулу CnH2n.
Циклоалкены (также именуемые циклоолефины) – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну двойную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-2 (n⩾3).
По номенклатуре IUPAC названия циклоалкенов образуются от названий соответствующих алкенов добавлением приставки «цикло-».
Циклоалкены образуют гомологический ряд. К циклоалкенам относятся: циклопропен C3H4, циклобутен C4H6, циклопентен C5H8, циклогексен C6H10, циклогептен C7H12 и т.д., которые имеют формулу CnH2n-2.
Циклоалкины – ненасыщенные алициклические углеводороды, имеющие циклическое строение (т.е. имеющие замкнутое кольцо атомов углерода), содержащие одну тройную связь между атомами углерода и образующие гомологический ряд с общей формулой CnH2n-4 (n⩾5).
По номенклатуре IUPAC названия циклоалкинов образуются от названий соответствующих алкинов добавлением приставки «цикло-».
Циклоалкины образуют гомологический ряд. К циклоалкинам относятся: циклопентин C5H6, циклогексин C6H8, циклогептин C7H10 и т.д., которые имеют формулу CnH2n-4.
Ароматические углеводороды:
- Ароматические углеводороды (арены) – циклические углеводороды, которые имеют в своём составе ароматическую систему.
- Ароматическая система – это электронная система молекулы, содержащая (в кольце), в соответствии с правилом Хюккеля, 4n+2 электронов (где n = 0, 1, 2, …).
- Различают бензоидные (арены и структурные производные аренов, которые содержат бензольные ядра) и небензоидные (все остальные) ароматические углеводороды.
- Состав аренов с одним бензольным кольцом отвечает общей формуле CnH2n-6 (n⩾6).
Атомы углерода в бензольном кольце находятся в состоянии sp2 гибридизации и имеют валентный угол 120°. Каждый атом углерода образует 3 σ-связи. Бензольное кольцо имеет плоскую форму и образуют шестигранник. У каждого атома есть негибридная р-обиталь, на которой находится неспаренный электрон.
Эта орбиталь перпендикулярна плоскости и поэтому все 6 π-электронов образует единую π-электронную систему. Длина связи между атомами углерода в бензольном кольце составляет 0,139 нм.
Ароматические углеводороды имеют множество изомеров.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
![]()
![]()
![]()
![]()
карта сайта
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/uglevodorodyi-ih-klassifikatsiya/
Гомологи бензола. Номенклатура и изомерия
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R):
![]()
![]()
Общая формула гомологического ряда бензола CnH2n-6 (n ≥ 6).
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими. Например:
Для дизамещенных бензолов R-C6H4-R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
орто— (о-) заместители у соседних атомов углерода кольца, то есть 1,2-;
мета— (м-) заместители через один атом углерода (1,3-);
пара— (п-) заместители на противоположных сторонах кольца (1,4-).

Ароматические одновалентные радикалы имеют общее название «арил» и обозначаются символом Ar. Из них наиболее распространены в номенклатуре органических соединений два:
C6H5– (фенил) и C6H5CH2– (бензилБензил относится к арилалкилам, или короче, аралкилам, поскольку свободная валентость находится при алкильной группе.).
Изомерия (структурная): 1) положения заместителей для ди-, три— и тетра-замещенных бензолов (например, о-, м— и п-ксилолы);
2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
 3) изомерия заместителей R, начиная с R = С2Н5.
3) изомерия заместителей R, начиная с R = С2Н5.
Например, молекулярной формуле С8Н10 соответствуют 4 изомера:
три ксилола CH3-C6H4-CH3 (о-, м-, п-) и этилбензол C6H5-C2H5.
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Источник: http://orgchem.ru/chem2/u72.php
Разработка урока химии "Бензол. Строение и физические свойства бензола."
МОУ-Гимназия
с.Чекмагуш,
учитель химии
высшей категории Давлетова Л.М.
Тема
урока: Бензол. Строение и физические
свойства бензола.
Задачи:
Образовательные:
- Рассмотреть электронное и пространственное строение молекулы бензола;
- На основе внутрипредметных связей с диенами развивать понятие о сопряжении;
- Познакомит учащихся с физическими свойствами бензола;
- Сформировать умения сравнивать свойства веществ и находить причины сходства и различия.
Развивающие:
- Развивать логическое мышление учащихся;
- Развивать умения излагать и доказывать своё мнение
- Развивать кратко и связно излагать материал
- Способствовать продолжению развития устойчивого интереса к химической науке и практике.
Воспитательные:
- Воспитывать стремление к повышению личных знаний
- Развивать нестандартное мышление
- Показать значимость химических знаний для современного человека.
- Тип урока:
изучение нового материала - Особенности
урока: урок
подготовлен по технологии «Развитие
критического мышления» - Методы:
исследовательский, фронтальный, работа
с учебной литературой, частично-поисковый. - Оборудование:
На столах учащихся приборы и реактивы
для проведения лабораторной работы,
карточки с индивидуальным заданием.
| Этап урока | Деятельность учителя | Деятельность учащихся |
| Организационный момент | Приветствует учащихся, создаёт доброжелательную атмосферу, проверяет отсутствующих, организует внимание. | Приветствуют учителя, настраиваются на работу. Работают две группы: теоретики и практики, |
| Целеполагание, мотивация, стадия вызова | 1. Предлагает решить задачу на вывод формулы вещества (приложение 1) 2. Предлагает заполнить колонку «Знаю» 3.. Предлагает заполнить колонку «Хочу узнать» | 1. Решение задачи (приложение 1). 2. Заполнение колонки «Знаю» и «Хочу узнать» |
| Стадия осмысления (добыча знаний) |
|
|
| Рефлексия |
С каким настроением вы уходите с урока. Нарисуйте. |
Работа в группах .Готовят ответы. Самооценка. 5 ответов «5», 4 – «4», 3 – «3» Анализ колонки «Узнал», сравнение с колонками «Знаю», «Хочу узнать» Написание синквейна на тему «Строение и физические свойства бензола») Дети рисуют мордашку, характеризуя свое настроение. |
| Домашнее задание. | Предлагает подготовить сообщение, «Физиологическое действие бензола и его гомологов на живые организмы». Учебник &21 упр.1,2,5 | . |
Конспект
урока.
Класс разделен на
две группы: теоретиков и практиков.
1. В начале урока
знакомлю учеников с историей открытия
бензола, которая весьма интересна.
В 1812 – 1815 годах
в Лондоне впервые появилось газовое
освещение. Светильный газ, добывавшийся
из жира морских животных, доставлялся
в железных баллонах. Эти баллоны
помещались обычно в подвале дома, из
них газ по трубкам распределялся по
всему помещению.
Вскоре было замечено
крайне неприятное обстоятельство – в
сильные холода газ терял способность
давать при горении яркий свет. Владельцы
газового завода в 1825 г.
обратились за
советом к Фарадею, который нашёл, что
те составные части, которые способны
гореть ярким пламенем, собираются на
дне баллона в виде прозрачного жидкого
слоя. При исследовании этой жидкости
Фарадей открыл новый углеводород.Девять
лет спустя то же вещество получил Э.
Митчерлих путем нагревания бензойной
кислоты с гидроксидом кальция. Название
нового вещества несколько раз менялось.
Фарадей назвал его”” карбюрированный
водород”, Митчерлих – бензином. В
18837г. Лоран обнаружил его в светильном
газе и назвал фен (греч. – освещать).
- Предположите о
каком веществе идет речь? - Название этому
веществу дал Либих – (суффикс –ол
указывает на его маслянистый характер,
от латинского oleum – масло). - 2. Затем предлагаю
учащимся решить задачу на вывод формулы
вещества - Задача1
(для
теоретиков)
При сжигании 2,5
г вещества выделилось 8,46 г углекислого
газа и 1,73 г воды. Масса 1 л вещества
составляет 3,5 г. Определите молекулярную
и возможную структурную формулы вещества
Задача 2
(для
практиков)
Плотность паров
вещества по воздуху: D = 2,69. Массовая доля
углерода: w = 92,3%,массовая доля водорода:
w = 7,7%
Решая задачу,
учащиеся выводят молекулярную формулу
вещества – С6Н6.
Возникает проблемная ситуация: “Какое
строение может иметь молекула бензола?”
- Добывать знания
вы будете сами – строить гипотезы и
искать им доказательства. Учитель
предлагает заполнить первую колонку
таблицы «Знаю» - Опираясь на знание
о непредельных углеводородах, учащиеся
предлагают возможные структурные
формулы для него: - НС С—СН2—СН2—
С СН - Н2С
= СН —С С—СН
= СН2 и
другие. - Учитель предлагает
заполнить вторую колонку «Хочу узнать» - Теоретики делают
вывод о том, что бензол является сильно
ненасыщенным соединением, вспоминают
качественные реакции на непредельность. - Предлагаю практикам
проверить гипотезу о непредельности
бензола в ходе выполнения эксперимента. - Опыт 1. Бензол и иодная вода; бензол и перманганат калия
- Проведя реакции
бензола с иодной водой и раствором
перманганата калия, ученики приходят
к выводу, что бензол, являясь ненасыщенной
системой, не даёт качественных реакций
на непредельность, следовательно, его
нельзя отнести к классу непредельных
углеводородов. - Какое же строение
имеет молекула бензола, и к какому классу
углеводородов его можно отнести? - Далее перехожу к
изложению строения молекулы бензола. - В 1865 г. немецким
учёным Кекуле была предложена структура
молекулы бензола, которая приснилась
ему в виде змеи, укусившей себя за хвост: - Но эта формула,
соответствуя элементарному составу
бензола, не отвечает многим его
особенностям: - — бензол не даёт
качественных реакций на непредельность; - — для бензола
характерны реакции замещения, а не
присоединения; - — формула Кекуле
не в состоянии объяснить равенства
расстояний междууглеродными атомами,
что имеет место в реальной молекуле
бензола. - Чтобы выйти из
этого затруднения, Кекуле допустил, что
в бензоле происходит непрерывное
перемещение двойных связей. - Использование
современных физических и квантовых
методов исследования дало возможность
создать исчерпывающее представление
о строении бензола.
Атомы углерода в
молекуле бензола находятся во втором
валентном состоянии (sp2).
Каждый атом углерода образует -связи
с двумя другими атомами углерода и одним
атомом водорода, лежащими в одной
плоскости. Валентные углы между тремя -связями
равны 120°. Таким образом, все шесть атомов
углерода лежат в одной плоскости, образуя
правильный шестиугольник (рис. 1):
Рис. 1. Схема
образования -связей
в
молекуле бензола
Каждый атом углерода
имеет одну негибридную р-орбиталь. Шесть
таких орбиталей располагаются
перпендикулярно плоскости -связей
и параллельно друг другу (рис. 2).
Все
шесть р-электронов взаимодействуют
между собой, образуя единое -электронное
облако. Таким образом, в молекуле бензола
осуществляется круговое сопряжение.
Наибольшая -электронная
плотность в этой сопряженной системе
располагается над и под плоскостью
кольца (рис. 3):
| Рис 2. Негибридные 2p-орбитали углерода в молекуле бензола |
В результате такого
равномерного перекрывания 2р-орбиталей
всех шести углеродных атомов происходит
“выравнивание” простых и двойных
связей – длина связи составляет 0,139 нм.
Эта величина является промежуточной
между длиной одинарной связи в алканах
(0,154 нм) и длиной двойной связи в алкенах
(0,133 нм). То есть, в молекуле бензола
отсутствуют классические двойные и
одинарные связи.
- Какими физическими
свойствами обладает бензол? - Теоретики делают
свои предположения, практики подтверждают
на опытах. - Опыт 2: бензол и
вода - Опыт 3: демонстрация
легкоплавкости бензола (в начале урока
поместить пробирку с бензолом в стакан
со снегом) - В результате
выполненных экспериментов, учащиеся
выясняют, что бензол представляет
бесцветную жидкость, нерастворимую в
воде. - Физические
константы: р = 0,88г/мл, t
плавления = 5,5 С, t
кипения = 80 С - При выполнении
опытов следует учитывать большую
токсичность бензола!
-
Выполнение тестового задания. Вставить пропущенные слова. Работают индивидуально, проводят самопроверку.
- 1. Бензол имеет
молекулярную формулу: - 1) С6Н10
- 2) С6Н12
- 3) С6Н6
- 4) С6Н14.
2. Какую гибридизацию
имеют атомы углерода в молекуле бензола?
- 1) sp3
- 2) sp3,
sp - 3) sp2
- 4) sp2,
sp3. - 3. Сколько сигма-
и пи- связей в молекуле бензола - 1) 12
и 6 - 2) 10 и 0
- 3) 6 и 3
- 4) 12 и 3
- 4. Какое название
имеет ближайший гомолог бензола - 1) 1,2-диметилбензол
- 2) метилбензол
- 3) этилбензол
- 4) 1,2,3-триметилбензол
- 5. Какую общую
формулу могут иметь углеводороды ряда
бензола - 1) CnH2n
- 2) CnH2n+2
- 3) CnH2n-2
- 4) CnH2n-6
- Самооценка. 5
ответов «5», 4 – «4», 3 – «3» - Ответы к тестовому
заданию - 1) 3, 2) 3, 3) 1, 4)
4
-
Предлагаю проанализировать колонку «Узнал», сравнить ее с колонками «Знаю», «Хочу узнать» Обратитесь к целям, которые поставлены перед вами на данном уроке, оцените, на сколько вы смогли их достичь? В какой степени? Проанализируйте свою работу на уроке и сделайте вывод
- И как вывод к
уроку предлагаю написать синквейн. - Синквейн — способ
творческой рефлексии — “стихотворение”,
написанное по определенным правилам: - 1 строка — одно
существительное, - 2-ая — два
прилагательных, - 3-я — три глагола,
- 4-ая — крылатая
фраза, - 5-ая — одно
существительное, которое выражает суть. - Учащиеся зачитывают
свои синквейны. - Домашнее задание:
подготовить сообщение «Физиологическое
действие бензола и его гомологов на
живые организмы», учебник &21 упр.1,2,5 - Человек рождается
на свет, Чтоб творить, дерзать – и
не иначе,
Чтоб оставить в жизни добрый
след
И решить все трудные задачи
Человек
рождается на свет…
Для чего? - Ищите
свой ответ.
С каким настроением
вы уходите с урока. Нарисуйте. (Дети
рисуют мордашку, характеризуя свое
настроение) Сдают тетради
Приложение 1
Задача 1.
При сжигании 2,5 г
вещества выделилось 8,46 г углекислого
газа и 1,73 г воды. Масса 1 л вещества
составляет 3,5 г. Определите молекулярную
и возможную структурную формулы вещества
- Задача 2.
- Плотность паров
вещества по воздуху: D = 2,69. Массовая доля
углерода: w = 92,3%,массовая доля водорода:
w = 7,7% - Приложение 2
- 1. Бензол имеет
молекулярную формулу: - 1)С6Н10
- 2) С6Н12
- 3) С6Н6
- 4) С6Н14.
2. Какую
гибридизацию имеют атомы углерода в
молекуле бензола?
- 1) sp3
- 2) sp3,
sp - 3) sp2
- 4) sp2,
sp3. - 3. Сколько сигма-
и пи- связей в молекуле бензола - 1) 12 и 6
- 2) 10 и 0
- 3) 6 и 3
- 4) 12 и 3
- 4. Какое название
имеет ближайший гомолог бензола - 1) 1,2-диметилбензол
- 2) метилбензол
- 3) этилбензол
- 4) 1,2,3-триметилбензол
- 5. Какую общую
формулу могут иметь углеводороды ряда
бензола - 1)CnH2n
- 2) CnH2n+2
- 3) CnH2n-2
- 4) CnH2n-6
- Самооценка. 5
ответов «5», 4 – «4», 3 – «3» - Приложение 3
- Человек рождается
на свет, Чтоб творить, дерзать – и
не иначе,
Чтоб оставить в жизни добрый
след
И решить все трудные задачи
Человек
рождается на свет…
Для чего? - Ищите
свой ответ. - Литература:
-
О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская. Настольная книга учителя химии. 10 класс. Дрофа, 2004 год
-
М.Ю. Горковенко. Поурочные разработки по химии, 10 класс. Москва «Вако», 2005 год
-
О.С. Габриелян, И.Г.Остроумов. Химия для поступающих в ВУЗы. Москва, Дрофа, 2006 год
-
Пособие-репетитор для поступающих в ВУЗы. Под редакцией В.Н. Чернышова, А.С. Егорова, Ростов-на-Дону «Феникс», 1997 год
-
Контрольные и проверочные работы. Химия. К учебнику О.С. Габриеляна, Г.Г.Лысовой «Химия. 10» Москва. Дрофа, 2006 год
Источник: https://pedsovet.su/load/165-1-0-11581




