Геометрия молекул как ключ к познанию свойств веществ
- Филатов Никита
- класс 9 «м», МАОУ СОШ № 197 г. Екатеринбурга
- Чиликова Светлана Алексеевна
- научный руководитель, учитель 1-й квалификационной категории, преподаватель химии МАОУ СОШ № 197 г. Екатеринбурга
Геометрия молекул непосредственно связана со строением атома. Представление о пространственном строении молекул веществ важно для химии в целом как для науки, изучающей вещества, их свойства, способы получения и использования.
- Кроме того, представления о пространственном строении молекул развивают абстрактное и пространственное мышление, что становится особенно актуально в условиях современного развития науки и техники.
- К сожалению, этот материал либо выводится за рамки учебных программ, либо на его изучение отводится немного времени.
- Понимание взаимосвязи между строением молекулы и свойствами вещества устанавливает логику родства внешне совершенно различных явлений и помогает формировать естественнонаучное мышление.
- В настоящей работе нами сделана попытка проанализировать взаимосвязь между пространственным строением молекул воды и метана и их физическими и химическими свойствами.
Вода — вещество, основной структурной единицей которого является молекула H2O. Согласно современным представлениям о строении атома, на втором — внешнем — электронном слое атома кислорода находится шесть электронов, электронная конфигурация обозначается 1ss22р4.
Основываясь на теории гибридизации атомных орбиталей и метода валентных связей, пара неспаренных валентных 2p-электронов атома кислорода, находящихся в состоянии sp3-гибридизации, взаимодействует с каждым из 1s-электронов двух атомов водорода, образуя молекулу воды.
На двух других sp3-гибридных орбиталях атома кислорода расположены две электронные пары, не участвующие в образовании связи. Все четыре пары электронов занимают определенные области в пространстве вокруг центрального атома кислорода в молекуле.
Из-за взаимного электростатического отталкивания между связывающими и несвязывающими электронными парами, молекула воды принимает симметричную форму. На рис. 1 представлена схема перекрывания электронных орбиталей атомов кислорода и водорода при образовании молекулы воды.

Рисунок 1. Схема перекрывания электронных орбиталей атомов водорода и кислорода в молекуле воды
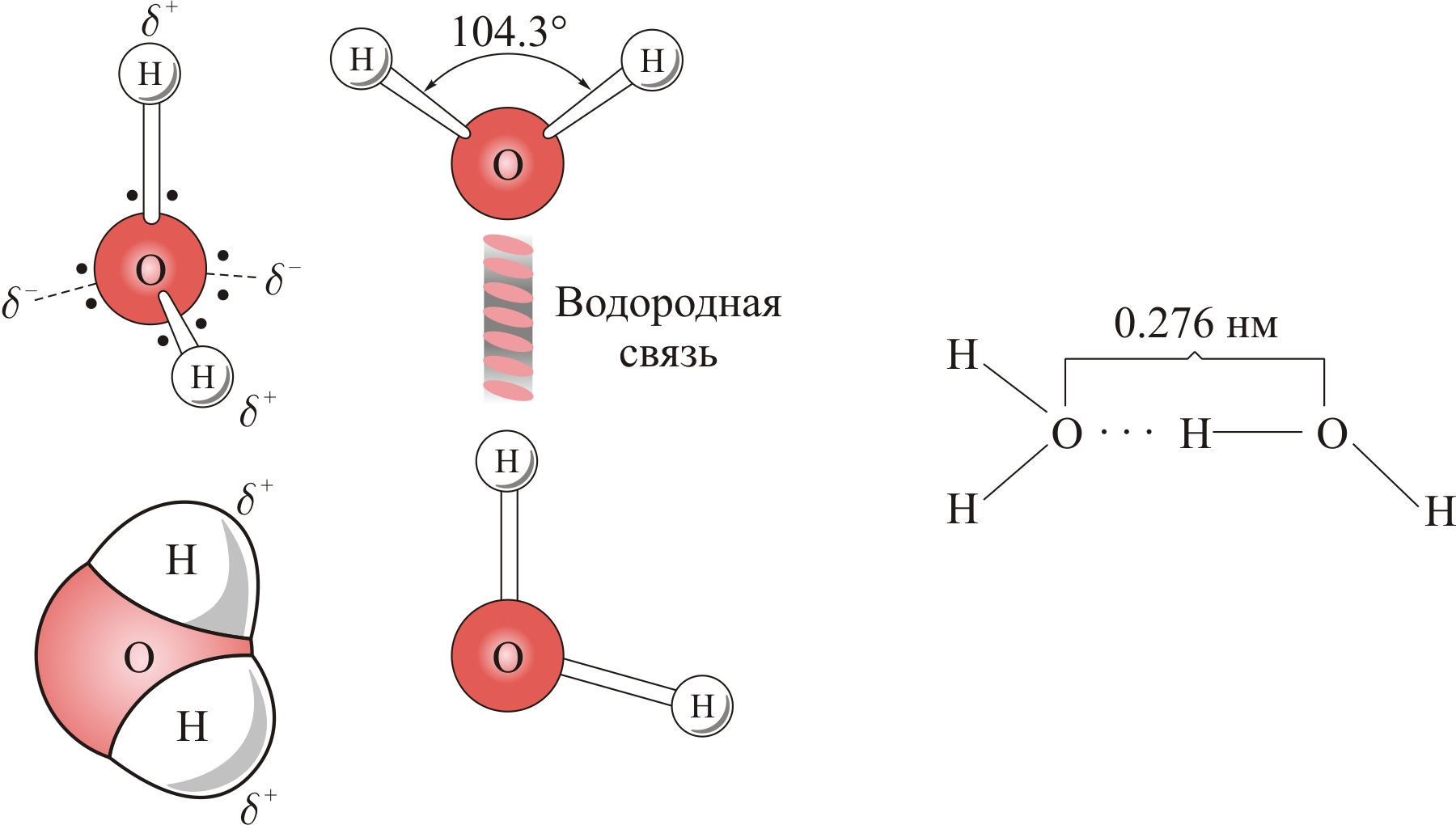
Молекула воды имеет структуру, напоминающую равнобедренный треугольник, в вершине которого расположен атом кислорода, а в основании — два атома водорода.
Угол при вершине составляет 104°27', а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений [1].
Схематически строение молекулы воды изображено на рисунке 2.
Молекула воды представляет собой диполь с положительно и отрицательно заряженными полюсами. Если допустить, что возможно поместить в электрическое поле отдельную молекулу воды, не связанную с другими молекулами, то она повернётся отрицательными полюсами в сторону положительного электрода, а положительными полюсами — в сторону отрицательного.

Рисунок 2. Схема молекулы воды
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов молекулы воды, получится объемная геометрическая фигура — правильный тетраэдр.
Так как молекула воды асимметрична, то центры тяжести положительных и отрицательных зарядов не совпадают. Молекулы воды имеют два полюса — положительный и отрицательный. Они, как магнит, создают молекулярные силовые поля. Такие молекулы называют полярными, или диполями (рис. 3) [2].

Рисунок3. Объёмная схема расположения гибридных орбиталей в молекуле воды
Водородные связи, как форма ассоциации между электроотрицательным атомом кислорода одной молекулы и атомами водорода других молекул, ответственны за многие уникальные свойства воды. Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль).
Однако этой энергии достаточно, чтобы вызывать ассоциацию молекул, то есть их объединение в димеры или полимеры [2].
Поскольку одна молекула воды может образовать до четырёх классических водородных связей с соседними молекулами, именно такое количество водородных связей объясняет аномально высокую теплоёмкость воды, её относительно высокую температуру кипения, высокие значения вязкости и поверхностного натяжения.
Из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо (рис. 4 б) [5].
Попытаемся проанализировать взаимосвязь между свойствами воды и особенностями строения ее молекул. В таблице 1 представлены результаты сопоставления. Как видно из таблицы, вода обладает аномальными значениями физических характеристик, что является, вероятно, следствием особенностей строения этого вещества.
- Рисунок 4. Кластеры воды
- Таблица 1.
- Физические свойства воды [4].
| Свойства вещества | Причина |
| Вода — хороший растворитель солей, кислот, оснований, т. е. веществ, при растворении диссоциирующих на ионы | 1.Полярность молекулы воды является причиной многих её признаков, в том числе позволяет образовывать до 4 водородных связей, что в свою очередь является причиной большинства свойств воды. 2.Водородные связи, которые являются причиной образования кластеров, обеспечивают все эти свойства воды |
| Показатель диссоциации: pKa = 15,7 (20 оC, вода) | |
| Диэлектрическая проницаемость 78,3 Ф/м. при 25 °C | |
| Дипольный момент молекулы 1,84 ЭДМ при 20 °C | |
| Температура плавления 0 °C | |
| Температура кипения 100 °C | |
| Удельная теплоемкость 4,2174 Дж/(г•К) | |
| Плотность: 1 г/см3 (при 4 °C) | |
| Поверхностное натяжение 75,62 мН/м при 0 °C |
Рассмотрим строение другого вещества. Метан — простейший углеводород, химическая формула которого CH4. Как и молекула воды, это вещество состоит из элемента, связанного с несколькими атомами водорода. Но при сходстве состава молекул метана и воды, свойства у этих веществ различны.
Попытаемся найти объяснение этому факту в особенностях строения молекулы метана [3].
Атом углерода на внешнем электронном слое имеет 4 электрона, электронная формула 1ssp2.
Казалось бы, что здесь мы сталкиваемся с противоречием — неспаренными являются только 2 р-электрона, а s-электроны спарены, но при этом все химические связи С-Н в молекуле метана совершенно одинаковы по длине и энергии.
Поскольку химические связи, как правило, устанавливаются за счет неспаренных электронов, молекула метана должна иметь формулу CH2, что не соответствует действительности. Это противоречие устраняется трактовкой образования химических связей за счет гибридизованных электронных орбиталей.
Когда атом углерода вступает во взаимодействие с атомами водорода, спаренные s-электроны его наружного слоя разделяются, один из них занимает свободное место на р-орбитали и при движении образует облако в виде объемной восьмерки, перпендикулярное по отношению к облакам двух других p-электронов. Атом переходит в возбужденное состояние, и электронная формула его может быть записана как 1ss12p3.
Теперь все четыре валентных электрона являются неспаренными и могут образовывать четыре химические связи.
При этом возникает новое противоречие. Теоретически, три p-электрона должны образовать три химические связи с атомами водорода во взаимно перпендикулярных направлениях, т. е. под углом 90 °, а четвертый атом водорода мог бы присоединяться в произвольном направлении, так как облако s-электрона имеет сферическую форму.
Такие связи, очевидно, отличались бы по свойствам. Между тем известно, что все связи C—H в молекуле метана одинаковы и расположены под углом 109°28'. Объяснить это противоречие помогает понятие о гибридизации электронных орбиталей атома углерода — смешивании и выравнивании орбиталей по форме и энергии (рис. 5).

Рисунок 5. Гибридизация электронных орбиталей атома углерода в молекуле метана
Итак, у метана четыре гибридные орбитали атома углерода в пространстве образуют геометрическую фигуру тетраэдр, углы между осями связей С—Н равны 109°28'. Такое валентное состояние атома углерода называется sp3-гибpидизaция.
Пространственное расположение атомов в молекуле метана можно показать с помощью тетраэдрических и шаростержневых моделей. На рис.6 изображены шаростержневые модели молекулы метана.
Как видно из рисунка, модель молекулы метана вписывается в тетраэдр [7].

Рисунок 6. Шаростержневые модели молекулы метана
В таблице 2 представлены физические свойства метана. Как видно из представленных данных, неполярность молекулы метана является причиной слабых межмолекулярных связей, как следствие — низких температур кипения и плавления.
Таблица 2.
Физические свойства метана.
| Свойства вещества | Причина |
| Плотность: 0,436, г/см3 при — 170 °C | Гибридизация атомных орбиталей атома углерода обеспечивает равнозначность всех четырех ковалентных связей между атомом углерода и атомами водорода, и как следствие – неполярность молекулы метана. |
| Удельная теплоемкость при постоянном давлении 2,22 Дж/г K | |
| Температура плавления — 182,48 °C | |
| Температура кипения — 161,49 °C | |
| Диэлектрическая проницаемость: 1,7 ф/м — при 173 °C | |
| Дипольный момент молекулы (в дебаях): 0 при 20 °C |
- В таблице 3 нами проведено сравнение молекул воды и метана и особенностей межмолекулярного взаимодействия.
- Таблица 3.
- Сравнение особенностей молекул и межмолекулярного взаимодействия метана и воды
| Свойство молекул(ы) | вода | метан |
| Состав молекулы | Н2О | СН4 |
| Молекулярная масса (относительная в а. е. м.) | 18 | 16 |
| Полярность молекулы | Диполь | Молекула неполярна |
| Межмолекулярная (водородная) связь | Сильная, требуется большая энергия , чтобы её разрушить | Слабая, молекулы метана почти не взаимодействуют друг с другом |
| Экранирование ядра | Отсутствует | Полное экранирование ядра |
| Схемы образования химических связей в молекулах и пространственное расположение орбиталей |  |
 |
Сравнивая строение молекул воды и метана и их свойства, можно сделать некоторые выводы.
Молекула метана так же, как и молекула воды, в пространстве образует тетраэдр. Однако, в отличие от молекулы воды, молекула метана не имеет полярности. Гибридные орбитали внешнего электронного слоя атома углерода перекрыты s- орбиталями атомов водорода и все четыре химические связи равноценны [6].
Полярность молекул воды определяет возможность образования водородных связей между молекулами воды, что обуславливает специфические физические и химические свойства воды. Каждая молекула воды подобно маленькому магниту притягивает к себе за счет образования водородных мостиков еще четыре молекулы.
При испарении воды разрушение этих многочисленных водородных связей требует больших затрат энергии, и как следствие — высокое значение поверхностного натяжения.
Высокая точка кипения воды является следствием высокой теплоемкости испарения, что в свою очередь обусловлено неравномерным распределением электронной плотности в молекуле воды.
Молекулы метана неполярны и относительно слабо взаимодействуют друг с другом. Вследствие этого жидкий метан испаряется при очень низких температурах. Молекулы метана не могут собирать устойчивые структуры и метан газообразен. Неполярность молекул метана объясняет также тот факт, что метан плохой растворитель.
Таким образом, мы делаем вывод о том, что именно строение молекул метана и воды обуславливает различие в их свойствах, и, следовательно, можно предположить, что свойства любых веществ напрямую зависят от строения молекул. Понимание теоретических основ строения веществ является ключом к пониманию свойств, разработке способов получения и использования веществ современными учеными.
Список литературы
1.Геометрия молекул / [Электронный ресурс] — Режим доступа — URL: http://images.yandex.ru (дата обращения октябрь 2012 г.).
2.Гиллеспи Р. Геометрия молекул. Москва, Изд. «Мир», 1975, 282 с.
3.Метан и его свойства / [Электронный ресурс] — Режим доступа — URL: www.rabbit.narod.ru/chem/metan.htm (дата обращения октябрь 2012 г.).
4.О воде // [Электронный ресурс] — Режим доступа — URL: http://www.o8ode.ru/article/water/ (дата обращения октябрь 2012 г.).
5.Строение молекулы воды // [Электронный ресурс] — Режим доступа — URL: http://www.meanders.ru/meiers2.shtml (дата обращения октябрь 2012 г.).
6.Химия // [Электронный ресурс] — Режим доступа — URL: http://himiy.ucoz.ru/index/0-9 (дата обращения октябрь 2012 г.).
7.Цветков Л.А. Эксперименты по органической химии в средней школе. Москва, Изд. «Школьная Пресса», 2000, 193 с.
Источник: https://sibac.info/shcoolconf/natur/i/29610
Строение молекул воды, их связи и свойства. Влияние внешних физических воздействий на молекулы воды?
В данной статье поговорим про строение молекул воды, их связи и свойства.
Забежав немного вперёд напишу:
Задача, выполняемая Ячейкой Мэйера — «лёгкое» разложение молекул воды под действием электрического тока, сопровождаемого электромагнитным излучением.
Для её решения разберёмся, что же вода из себя представляет? Каково строение молекул воды? Что известно о молекулах воды и их связях? В статье, я использовал различные публикации, имеющиеся в достаточном количестве в Интернете, но они размножены в большом количестве, поэтому, кто их автор, мне не понятно и ссылаться на источник с моей стороны глупо. Мало того, эти публикации «запутаны» до безобразия, что затрудняет восприятие, и значительно увеличивает время изучения. Анализируя статьи, я извлёк то, что может направить Вас на понимание того, с чем мы будем иметь дело в процессе добычи дешёвой энергии, а точнее в процессе разрыва молекул воды на составляющие – водород и кислород.
Итак, рассмотрим наиболее весомые понятия о строении молекул воды!

Вода — вещество, основной структурной единицей которого является молекула H2O, состоящая из одного атома кислорода и двух атомов водорода.
Молекула воды имеет структуру как бы равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода.
Угол при вершине составляет 104°27, а длина стороны — 0,096 нм. Эти параметры относятся к гипотетическому равновесному состоянию молекулы воды без ее колебаний и вращений.
Геометрия молекулы воды и её электронные орбиты изображены на рисунке.
Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах.
Если «свободную» молекулу воды — не связанную с другими молекулами, поместить в электрическое поле, то она «повернётся» отрицательными полюсами в сторону положительной пластины электрического поля, а положительными полюсами в сторону отрицательной пластины. Именно этот процесс изображён на рисунке 1, позиция — 3В, поясняющем работу Ячейки Мэйера в статье «Вода вместо бензина».
 Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр. Таково строение самой молекулы воды.
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — правильный тетраэдр. Таково строение самой молекулы воды.
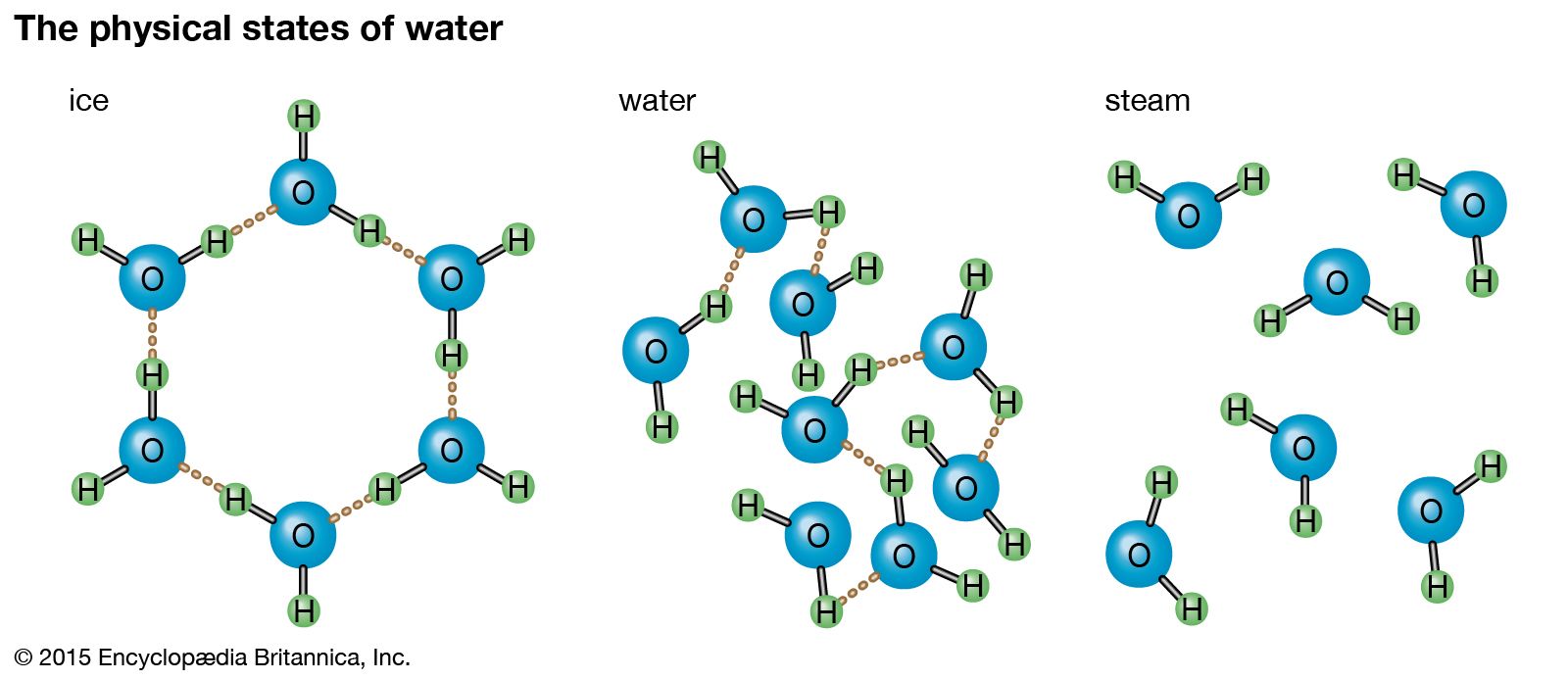
Благодаря наличию водородных связей каждая молекула воды образует водородную связь с 4-мя соседними молекулами, образуя ажурный сетчатый каркас в молекуле льда. Именно такое упорядоченное состояние молекул воды можно назвать «структурой».
Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, равными 109°28′, направленных к вершинам тетраэдра, которые не позволяют при замерзании создавать плотную структуру.
 Когда лёд плавится, его тетрагональная структура разрушается и образуется смесь полимеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды.
Когда лёд плавится, его тетрагональная структура разрушается и образуется смесь полимеров, состоящая из три-, тетра-, пента-, и гексамеров воды и свободных молекул воды.
В жидком состоянии вода – неупорядоченная жидкость. Эти водородные связи — спонтанные, короткоживущие, быстро рвутся и образуются вновь.
Группируясь, тетраэдры молекул воды образуют разнообразные пространственные и плоскостные структуры.
И из всего многообразия структур в природе базовой является гексагональная (шестигранная) структура, когда шесть молекул воды (тетраэдров) объединяются в кольцо.
 Такой тип структуры характерен для льда, снега и талой воды, которую из-за наличия такой структуры, называют «Структурированной водой». О полезных свойствах структурированной воды пишут много, но не это тема нашей статьи. Логично будет, что структурированная вода — образующая гексагональные структуры является наихудшим вариантом структуры воды, которую возможно использовать для разложения на водород и кислород. Поясню почему: Молекулы воды, группируясь по шесть в гексамер, имеют электронейтральный состав — у гексамеров нет положительных и отрицательных полюсов. Если поместить гексамер структурированной воды в электрическое поле, то он не будет никак на него реагировать. Поэтому логически можно заключить, что необходимо, чтобы в воде было как можно меньше организованных структур. На самом деле, всё наоборот, гексамер — это не завершённая структура, есть ещё более интересное понятие — кластер.
Такой тип структуры характерен для льда, снега и талой воды, которую из-за наличия такой структуры, называют «Структурированной водой». О полезных свойствах структурированной воды пишут много, но не это тема нашей статьи. Логично будет, что структурированная вода — образующая гексагональные структуры является наихудшим вариантом структуры воды, которую возможно использовать для разложения на водород и кислород. Поясню почему: Молекулы воды, группируясь по шесть в гексамер, имеют электронейтральный состав — у гексамеров нет положительных и отрицательных полюсов. Если поместить гексамер структурированной воды в электрическое поле, то он не будет никак на него реагировать. Поэтому логически можно заключить, что необходимо, чтобы в воде было как можно меньше организованных структур. На самом деле, всё наоборот, гексамер — это не завершённая структура, есть ещё более интересное понятие — кластер.
Структуры объединённых молекул воды называют кластерами, а отдельные молекулы воды — квантами. Кластер — объёмное соединение молекул воды, в том числе гексамеров, у которого имеются и положительные и отрицательные полюса.
В дистиллированной воде кластеры практически электронейтральны, потому что в результате испарения, произошло разрушение кластеров, а в результате конденсации, сильные связи между молекулами воды не появились. Однако, их электропроводность можно изменить.
Если дистиллированную воду помешать магнитной мешалкой, связи между элементами кластеров будут частично восстановлены и электропроводность воды изменится. Другими словами, дистиллированная вода – это вода, у которой минимальное количество связей между молекулами.
В ней диполи молекул находятся в разориентированном состоянии, поэтому диэлектрическая проницаемость дистиллированной воды очень высока, и она плохо проводит электрический ток.
В то же время, для повышения управляемости кластерами воды, в неё добавляют кислоты или щёлочи, которые участвуя в молекулярных связях, не позволяют молекулам воды образовывать гексагональные структуры, образуя при этом электролиты. Дистиллированная вода является противоположностью структурированной воде, в которой связей между молекулами воды в кластеры огромное количество.
На моём сайте имеются, и будут появляться статьи, которые, на первый взгляд «отдельные» и не имеют никакого отношения к другим статьям. На самом деле, большинство статей сайта имеет взаимосвязь в одно целое.
В данном случае, описывая свойства дистиллированной воды, я использую Дипольную теорию электрического тока, это альтернативное понятие об электрическом токе, которое подтверждается и наукой и практикой лучше, чем классическое понятие.
При воздействии энергии источника электрического тока, все диполи атомов воды (как проводника) поворачиваются, ориентируясь своими одноимёнными полюсами в одном направлении.
Если молекулы воды до появления внешнего электрического поля создавали кластерную (взаимно ориентированную) структуру, то для ориентации во внешнем электрическом поле потребуется минимальное количество энергии источника электрического тока.
Если же структура была не организованной (как у дистиллированной воды), то потребуется большое количество энергии.
Заметьте, «в народе» бытует мнение, что дистиллированная вода и талая вода должны обладать одинаковыми электропроводными свойствами, ведь что у одной, что у другой отсутствуют химические примеси (как правило – соли), их химический состав одинаков, да и строение молекул воды что в талой воде, что в дистиллированной одинаково.
На самом деле всё выглядит наоборот, отсутствие примесей совсем не говорит о свойствах электропроводности воды. Не понимая этого, некоторые люди, «убивают» аккумуляторные батареи ещё на этапе их заправки электролитом, подменяя дистиллированную воду на талую, или просто очищенную через угольный фильтр.
Как правило, заправленный аккумулятор, который куплен на автомобильном рынке служит меньше, чем тот, который вы купили сухозаряженным и разбавив серную кислоту дистиллированной водой, заправили его сами.
Это лишь потому, что «готовый» электролит, или заправленный аккумулятор – это в наше время средство заработка, а чтобы определить какая вода использовалась, надо провести дорогую экспертизу, никто этим не заморачивается. Торгашу не важно, сколько прослужит аккумулятор на твоём авто, а Вам тоже, возиться с кислотой не очень хочется.
Зато, я Вас уверяю, аккумулятор, над которым попотеете Вы, при минусовых температурах будет намного бодрее, чем заправленный из уже готового бутылочного электролита.
Продолжим!
В воде кластеры периодически разрушаются и образуются снова. Время перескока составляет 10-12 секунд.
Так как, строение молекулы воды несимметрично, то центры тяжести положительных и отрицательных зарядов ее не совпадают. Молекулы имеют два полюса — положительный и отрицательный, создающие, как магнит, молекулярные силовые поля.
Такие молекулы называют полярными, или диполями, а количественную характеристику полярности определяют электрическим моментом диполя, выражаемым произведением расстояния l между электрическими центрами тяжести положительных и отрицательных зарядов молекулы на заряд e в абсолютных электростатических единицах: p = l·e
Для воды дипольный момент очень высокий: p = 6,13·10-29 Кл·м.
Кластеры воды на границах раздела фаз (жидкость-воздух) выстраиваются в определенном порядке, при этом все кластеры колеблются с одинаковой частотой, приобретая одну общую частоту.
При таком движении кластеров, учитывая, что входящие в кластер молекулы воды являются полярными, то есть, имеют большой дипольный момент, следует ожидать появления электромагнитного излучения.
Это излучение отличается от излучения свободных диполей, так как диполи являются связанными и колеблются совместно в кластерной структуре.
Частота колебаний кластеров воды и соответственно, частота электромагнитных колебаний может быть определена по следующей формуле:
![]() где a — поверхностное натяжение воды при заданной температуре; М — масса кластера.где V — объем кластера.
где a — поверхностное натяжение воды при заданной температуре; М — масса кластера.где V — объем кластера.
Объем кластера определяется с учетом размеров фрактальной замкнутой структуры кластера или по аналогии с размерами домена белка. При комнатной температуре 18°С частота колебаний кластера f равна 6,79·109 Гц, то есть длина волны в свободном пространстве должна составлять λ = 14,18 мм.
 Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R0 до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R0 до R2).
Но что, же будет происходить при воздействии на воду внешнего электромагнитного излучения? Поскольку вода является самоорганизованной структурой и содержит как упорядоченные в кластеры элементы, так и свободные молекулы, то при воздействии внешнего электромагнитного излучения будет происходить следующее. При сближении молекул воды (расстояние изменяется от R0 до R1) энергия взаимодействия изменяется на большую величину, чем при их взаимном удалении (расстояние изменяется от R0 до R2).
Но, поскольку молекулы воды имеют большой дипольный момент, то в случае внешнего электромагнитного поля, они будут совершать колебательные движения (например, от R1 до R2). При этом в силу приведенной зависимости приложенное электромагнитное поле будет больше способствовать притяжению молекул и тем самым организованности системы в целом, т.е. образованию гексагональной структуры.
При наличии же примесей в водной среде, они покрываются гидратной оболочкой таким образом, что общая энергия системы стремится принять минимальное значение.
И если общий дипольный момент гексагональной структуры равен нулю, то в присутствие примесей гексагональная структура вблизи них нарушается таким образом, чтобы система приняла минимальное значение, в ряде случаев шестиугольники преобразуются в пятиугольники, и гидратная оболочка имеет форму близкую к шару. Примеси (например, ионы Na+) могут стабилизировать структуру, делать ее более устойчивой к разрушению.
Самоорганизованная система воды при воздействии электромагнитного излучения не будет перемещаться как единое целое, но каждый элемент гексагональной, а в случае примесей локально и другого вида, структуры будет смещаться, т.е. будет происходить искажение геометрии структуры, т.
е. возникать напряжения. Такое свойство воды очень напоминает полимеры. Но полимерные структуры обладают большими временами релаксации, которые составляют не 10-11–10-12 с, а минуты и больше.
Поэтому энергия квантов электромагнитного излучения, переходя во внутреннюю энергию организованной водной структуры в результате её искажений, будет накапливаться ею, пока не достигнет энергии водородной связи, которая в 500–1000 раз больше энергии электромагнитного поля.
При достижении этой величины происходит разрыв водородной связи, и структура разрушается.
Это можно сравнить со снежной лавиной, когда происходит постепенное, медленное накапливание массы, а затем стремительный обвал.
В случае с водой происходит разрыв не только слабой связи между кластерами, но и более сильных связей — в строении молекул воды. В результате этого разрыва могут образовываться Н+, ОН–, и гидратированный электрон е–.
Голубой цвет чистой воды обязан наличию именно этих электронов, а не только рассеянию естественного света.
Заключение
Таким образом, при воздействии электромагнитного излучения с водой происходит накапливание энергии в кластерной структуре до некоторого критического значения, затем происходит разрыв связей как между кластерами, так и других, происходит лавинообразное освобождение энергии, которая может затем трансформироваться в другие типы.
В следующей статье«Разрыв молекул воды на водород и кислород. Закон Ома и Ячейка Мэйера», мы определимся с условиями разрыва молекул воды и разберёмся, как Закон Ома препятствует «нашим желаниям».
Источник: https://meanders.ru/meiers2.shtml
Урок 3. Схема образования молекул – HIMI4KA
Архив уроков › Основные законы химии
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой.
Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную.
В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени.
А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2.
В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.

Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:

Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения.
Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра.
Структурная формула неразветвленного октана, одного из компонентов бензина, такова:

Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой.
Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.

Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
![]()
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м.
Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества.
Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- Ответ: относительная молекулярная масса воды равна 18.
- Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
- Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана? Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-3-shema-obrazovanija-molekul.html
Научная электронная библиотека Монографии, изданные в издательстве Российской Академии Естествознания
Молекула воды (H2O) состоит из двух атомов водорода (H1) и одного атома кислорода (O16).
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Расстояние O-H — 0,9568 Å; H-H — 1,54 Å. Модель молекулы воды, предложенная Нильсом Бором, показана на рис. 1.
Свойства воды в основном зависят от величины водородных связей. Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода.
По этой причине, а также из-за того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы. Благодаря чему, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Каждая молекула воды может участвовать максимум в четырёх водородных связях: два атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда.
При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение.
 |
 |
Рис. 1. Строение молекулы воды [1]
|
 |
При испарении рвутся все оставшиеся связи. Для разрыва связей требуется большое количество энергии, отсюда высокая температура, удельная теплота плавления и кипения, высокая теплоёмкость. Вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Строение электронного облака молекулы воды таково, что во льду каждая молекула связана четырьмя водородными связями с ближайшими к ней молекулами, координационное число молекул в структуре льда равно четырем. О размере молекулы можно судить по величине расстояния между ближайшими молекулами во льду, составляющего 2,67Å.
Соответственно молекуле воды можно приписать радиус равный 1,38Å.
Тенденция каждой молекулы воды к окружению четырьмя ближайшими молекулами и к образованию с ними водородных связей сохраняется и в жидкости, исследования показали, что в воде сохраняется ближняя упорядоченность, свойственная структуре льда. Расстояние между ближайшими молекулами при плавлении льда изменяется от 2,76 Å до 2,90 Å. Свойственное среднее расположение ближайших молекул ведет к очень рыхлой, ажурной структуре. Именно с этим связаны аномалии воды.
Почти шарообразная молекула воды имеет заметно выраженную полярность, так как электрические заряды в ней расположены асимметрично. Каждая молекула является миниатюрным диполем с высоким дипольным моментом.
Полярность молекул, наличие в них частично нескомпенсированных электрических зарядов создает группировки молекул — ассоциаты. Полностью соответствует формуле Н2O лишь вода, находящаяся в парообразном состоянии.
В температурном интервале от 0 до 100°С концентрация отдельных мономерных молекул жидкой воды не превышает 1%. Все остальные молекулы объединены в ассоциаты различной степени сложности, и их состав описывается общей формулой [Н2O]x. Причиной образования ассоциатов являются водородные связи.
Они возникают между ядрами водорода одних молекул и электронными «сгущениями» у ядер кислорода других молекул воды.
Источник: https://monographies.ru/en/book/section?id=2724
Молекула воды
Все живые организмы на планете Земля состоят из воды. Эта
жидкость встречается везде и без нее жизнь невозможна. Большая ценность воды
обусловлена уникальными свойствами жидкости и простым составом. Чтобы
разобраться во всех особенностях, рекомендуется детально ознакомиться со структурой
молекулы воды.
Модель строения воды
Молекула воды включает два атома водорода (Н) и один атом
кислорода (О). Элементы, из которых состоит жидкость, определяют всю
функциональность и особенности. Модель молекулы воды имеет форму треугольника.
Вершину этой геометрической фигуры представляет крупный элемент кислорода, а
внизу находятся небольшие атомы водорода.
Молекула воды обладает двумя положительными и двумя
отрицательными полюсами зарядов. Отрицательные заряды формируются из-за излишка
электронной плотности у атомов кислорода, а положительные – из-за нехватки
электронной плотности у водорода.

Неравномерное распределение электрических зарядов создает
диполе, где диполярный момент составляет 1,87 дебай. Вода обладает способностью
растворять вещества, поскольку ее молекулы пытаются нейтрализовать
электрическое поле. Диполя приводят к тому, что на поверхности погруженных в
жидкость веществ становятся слабее межатомные и межмолекулярные связи.
Вода отличает большой устойчивостью при растворении прочих
соединений. В обычных условиях из 1 млрд молекул только 2 распадаются, а протон
переходит в строение иона гидроксония (образуется при растворении кислот).
Вода не меняет свой состав при взаимодействии с другими
веществами и не влияет на структуру этих соединений. Такая жидкость считается
инертным растворителем, что особо важно для живых организмов.
Полезные вещества
поступают к различным органам через водные растворы, поэтому важно, чтобы их
состав и свойства оставались неизменными.
Вода сохраняет в себе память о
растворенных в ней веществах и может применяться многократно.
Каковы особенности пространственной организации молекулы
воды:
- Соединение проводится противоположными зарядами;
- Появляются межмолекулярные водородные связи, которые исправляют электронную неполноценность водорода с помощью дополнительной молекулы;
- Вторая молекула фиксирует водород по отношению к кислороду;
- Благодаря этому образуются четыре водородные связи, которые могут контактировать с 4 соседями;
- Такая модель напоминает бабочку и имеет углы равные 109 градусам.
Атомы водорода соединяются с атомами кислорода и образуют
молекулу воды с ковалентной связью. Водородные соединения более сильные,
поэтому, когда они разрываются, то молекулы присоединяются к другим веществам,
способствуя их растворению.
Прочие химические элементы, в состав которых входит водород,
замерзают при -90 градусах, а закипают при 70 градусах. Но вода становится
льдом, когда температура достигает нуля, а закипает при 100 градусах. Чтобы
объяснить такие отклонения от нормы, требуется разобраться, в чем особенность
строения молекулы воды. Дело в том, что вода – это ассоциированная жидкость.

Это свойство подтверждается и большой теплотой
парообразования, что делает жидкость хорошим энергоносителем. Вода – отличный
регулятор температуры, способен нормализировать резкие перепады этого
показателя. Теплоемкость жидкости повышается, когда ее температура 37 градусов.
Минимальные показатели соответствуют температуре человеческого тела.
Относительная молекулярная масса воды составляет 18.
Рассчитать этот показатель достаточно легко. Следует заранее ознакомиться с
атомной массой кислорода и водорода, которая равна 16 и 1 соответственно. В
химических задачах нередко встречается массовая доля воды. Этот показатель
измеряется в проценте и зависит от формулы, которую требуется рассчитать.
Строение молекулы в различных агрегатных состояниях воды
В жидком состоянии молекула воды состоит из моногидроля,
дигидроля и тригидроля. Количество этих элементов зависит от агрегатного
состояния жидкости. Пар включает одну H₂O – гидроль (моногидроль). Две H₂O
обозначают жидкое состояние – дигидроль. Три H₂O включает лед.
Агрегатные состояния воды:
- Жидкое. Между одиночными молекулами, которые связаны водородными связями, располагаются пустоты.
- Пар. Одиночные H₂O никак не соединяются между собой.
- Лед. Твердое состояние отличается прочными водородными связи.
При этом существуют переходные состояния жидкости, например,
при испарении или замерзании. Для начала требуется разобраться, отличаются ли
молекулы воды от молекул льда. Так замерзшая жидкость имеет кристаллическую
структуру. Модель льда может иметь форму тетраэдр, тригональной и моноклинной
сингонии, куба.
Обычная и замерзшая вода отличаются плотностью.
Кристаллическая структура приводит к меньшей плотности и увеличению объема.
Основное различие между жидким и твердым состоянием – это количество, сила и
разновидность водородных связей.
Состав не меняется ни в одном агрегатном состоянии.
Отличается строение и движение составных частей жидкости, сила связей водорода.
Обычно молекулы воды слабо притягиваются друг к другу, размещаются хаотично,
поэтому жидкость такая текучая. Лед отличается более сильным притяжением, так
как создается плотная кристаллическая решетка.
Многих интересует, одинаковы ли объемы и состав молекул
холодной и горячей воды. Важно запомнить, что состав жидкости не меняется ни в
одном из агрегатных состояний. Молекулы при нагревании или остывании жидкости
отличаются расположением. В холодной и горячей воде разные объемы, так как в первом
случае структура упорядоченная, а во втором – хаотичная.
Когда лед тает, то его температура не меняется. Только после
того, как жидкость меняется свое агрегатное состояние, показатели начинают
подниматься. Для таяния требуется определенное количество энергии, которое
называется удельной теплотой плавления или лямбда воды. Для льда показатель
равен 25000 Дж/кг.
Источник: https://VodaVoMne.ru/svojstva-vody/molekula-vody
Распространение воды в природе. Строение молекул воды — урок. Химия, 8–9 класс
Вода (оксид водорода) H2O — самое распространённое вещество на Земле. Это единственное вещество, которое существует на планете одновременно в трёх агрегатных состояниях.
Жидкая вода покрывает (75) % земной поверхности реками, озёрами, морями и океанами. Большое количество твёрдой воды в виде льда сосредоточено на Северном и Южном полюсах.
Газообразная вода содержится в атмосфере.

Вода входит в состав всех живых организмов. Например, организм человека содержит (70) % воды, рыбы — (80) %. В живой клетке вода представляет собой среду, в которой протекают жизненно важные процессы.
Она участвует во многих биохимических реакциях (фотосинтез, гидролиз сложных органических веществ). Ни один организм не может обходиться без воды.
Так, большое дерево для обеспечения всех жизненных потребностей летом поглощает из почвы и испаряет в течение суток (500)–(700) дм³ воды, а человек без воды не может прожить более (4) дней.
Живым организмам требуется пресная вода. Её запасы на планете ограничены. Поэтому важное значение приобретает проблема охраны водных источников от загрязнения и экономного расходования пресной воды.
В природе абсолютно чистой воды не бывает. В ней всегда содержатся примеси.
Для получения особо чистой воды используют дистилляцию (перегонку). Воду испаряют, а затем пары конденсируют в приёмнике.
Полученная таким способом вода называется дистиллированной и применяется для приготовления лекарств, лабораторных растворов и т. д.
- В молекуле воды — две ковалентные полярные связи O−H и две неподелённые электронные пары на атоме кислорода. Структурная формулы воды:
- H−O|H
- Электронная формула:
H:O….:H
Молекула воды имеет угловое строение. Угол между связями составляет (104,5)°. Молекула представляет собой диполь. В ней атом кислорода несёт отрицательный заряд, а атомы водорода — положительный:

Полярность молекул воды часто представляется упрощённо в виде эллипса с двумя полюсами:
Полярность молекулы воды оказывает сильное влияние на её физические и химические свойства.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/voda-159651/re-c324cd33-c94f-43af-81f5-ef6fa89e5035
Типы химической связи | CHEMEGE.RU
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Внутримолекулярные химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4
Источник: https://chemege.ru/chembonds/
Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды
Билет № 15
1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной воды
Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества):
2H2O = 2H2↑ + O2↑
Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105°:
O — H
|
H
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода — частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами — это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см3 при температуре около 4° С. При дальнейшем понижении температуры плотность воды снижается.
Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности.
Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства:
- Вода разлагается при пропускании электрического тока* на водород и кислород:
2H2O = 2H2↑ + O2↑ - Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия):
2Na + 2HOH = 2NaOH + H2↑ - Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть
даже причиной пожара. Образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2 + Q - Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий.
Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы.
Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
* Для электролиза воды используются растворы солей
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей
- Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
- CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
- или, в ионном виде:
- CO32− + 2H+ = H2O + CO2↑
- Доказать, что выделяется именно оксид углерода (IV), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
- CO2 + Ca(OH)2 = CaCO3↓ + H2O
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-15.htm




