- Видеоурок 1: Тепловой эффект реакции
- Видеоурок 2: Расчеты по термохимическим уравнениям
- Лекция: Тепловой эффект химической реакции. Термохимические уравнения
- Тепловой эффект химической реакции
Термохимия – это раздел химии, изучающий термические, т.е. тепловые эффекты реакций.

Как вам известно, каждый химический элемент обладает n-количеством энергии. Мы сталкиваемся с этим каждый день, т.к. каждый прием пищи запасает наш организм энергией химических соединений. Без этого у нас не будет сил двигаться, работать. Эта энергия поддерживает в нашем теле постоянную t 36,6.
В момент протекания реакций энергия элементов затрачивается либо на разрушение, либо на образование химических связей между атомами. Для разрушения связи энергию нужно затратить, а для образования выделить. И вот когда выделяемая энергия больше, чем затрачиваемая, образовавшийся избыток энергии превращается в тепло. Таким образом:
Выделение и поглощение теплоты при химических реакциях называется тепловым эффектом реакции, и обозначается буков Q.
Экзотермические реакции – в процессе таких реакций происходит выделение теплоты, и она передается окружающей среде.
У данного типа реакции положительный тепловой эффект +Q. В качестве примера возьмем реакцию горения метана:
Эндотермические реакции – в процессе таких реакций происходит поглощение теплоты.
У данного типа реакции отрицательный тепловой эффект -Q. К примеру, рассмотрим реакцию угля и воды при высокой t:
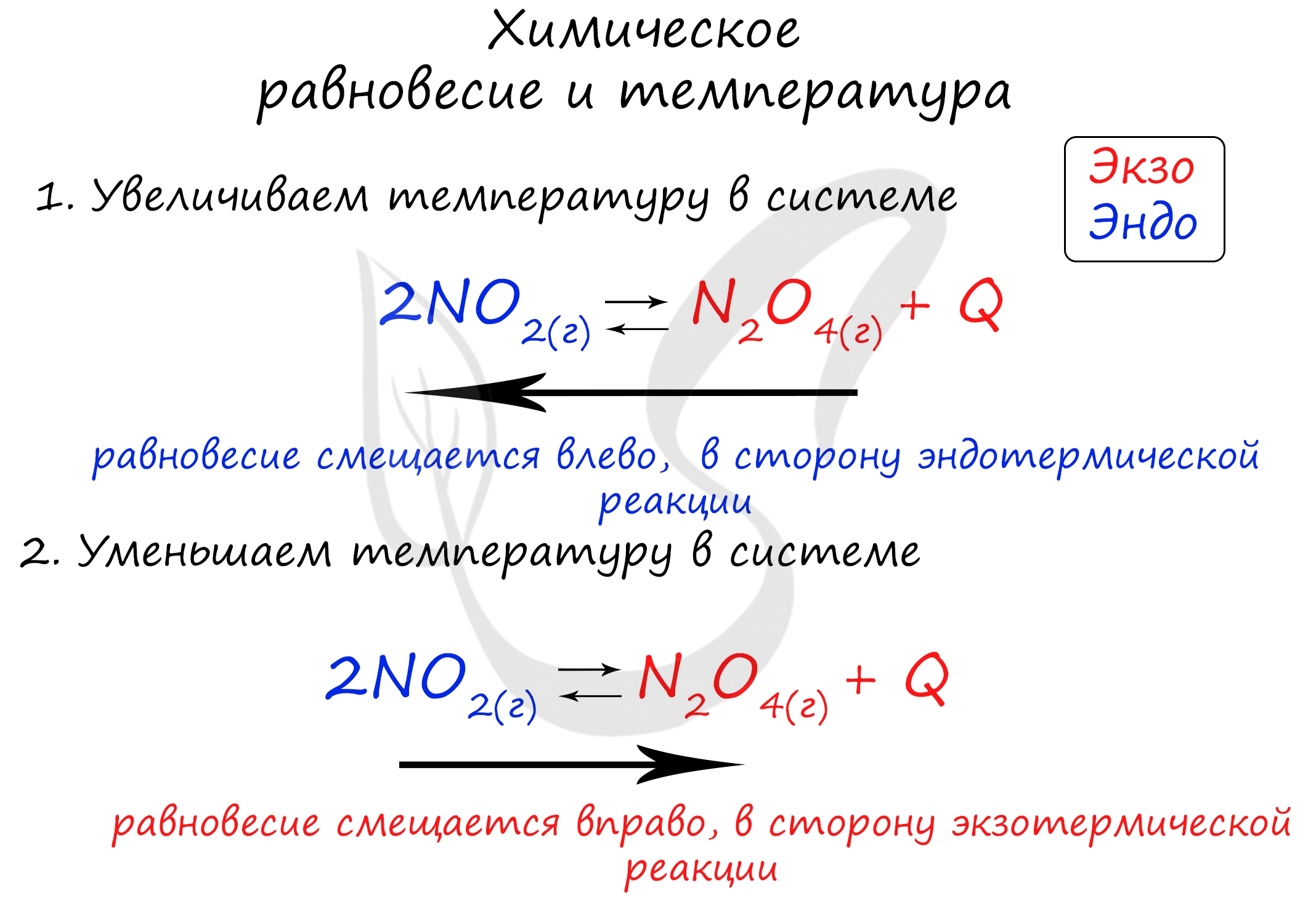
 Тепловой эффект реакции напрямую зависит от температуры, а также от давления.
Тепловой эффект реакции напрямую зависит от температуры, а также от давления.
Термохимические уравнения

Тепловой эффект реакции определяется с применением термохимического уравнения.
Чем оно отличается? В данном уравнении возле символа элемента указывается его агрегатное состояние (твердое, жидкое, газообразное). Это необходимо делать т.к.
на тепловой эффект химических реакций влияет масса вещества в агрегатном состоянии. В конце уравнения за знаком = указывается численное значение тепловых эффектов в Дж или кДж.
В качестве примера представлено уравнение реакции, показывающее процесс сгорания водорода в кислороде: H2(г) + ½O2(г) → H2O(ж) + 286 кДж.
Уравнение показывает, что на 1 моль кислорода, и на 1 моль образовавшейся воды выделяется 286 кДж теплоты. Реакция — экзотермическая. Данная реакция отличается значительным тепловым эффектом.
При образовании, какого — либо соединения, будет выделяться или поглощаться такое же количество энергии, какое поглощается или выделяется при его распаде на первичные вещества.
Практически все термохимические расчеты, основываются на законе термохимии – законе Гесса. Закон был выведен в 1840 году, знаменитым российским ученым Г. И. Гессом.
Основной закон термохимии: тепловой эффект реакции, зависит от природы и физического состояния исходных и конечных веществ, но не зависит от пути протекания реакции.
Применяя данный закон, удастся вычислить тепловой эффект промежуточной стадии реакции, если известны общий тепловой эффект реакции, и тепловые эффекты других промежуточных стадий.
Знание теплового эффекта реакции имеет большое практическое значение. К примеру, врачи – диетологи используют их при составлении правильного рациона питания; в химической промышленности эти знания необходимы при нагревании реакторов и наконец, без расчёта теплового эффекта невозможно вывести ракету на орбиту.
| Предыдущий урок | Следующий урок |
Источник: https://cknow.ru/knowbase/755-142-teplovoy-effekt-himicheskoy-reakcii-termohimicheskie-uravneniya.html
Термохимические уравнения в физике
В ходе химической реакции изменяется энергетическое состояние системы. Важнейшими функциями состояний являются характеристические функции такие как:
- внутренняя энергия U,
- энтальпия (теплосодержание) H,
- энтропия S,
- изохорно-изотермический потенциал (свободная энергия) F,
- изобарно-изотермический потенциал (потенциал Гиббса) Ф.
Вышеперечисленные функции зависят от массы и называются экстенсивными. Кроме того, особенностями этих функций относят то, что они зависят от количества вещества и не зависят от способа достижения состояния.
В связи с термохимическими уравнениями нас более всего интересует энтальпия химической реакции , которая есть тепловой эффект реакции. Реакция называется экзотермической, если в результате ее протекания теплота выделяется: и эндотермической, если теплота поглощается .
Использование термохимических уравнений
Термохимические уравнения используются для расчета тепловых эффектов. Такие уравнения включают в себя химическую формулу реакции, тепловой эффект реакции, кроме того указывается агрегатное состояние вещества (веществ).
Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, то есть коэффициентам.
Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Стандартная теплота образования вещества равна тепловому эффекту реакции образования 1 моль данного вещества из простых веществ в стандартных состояниях ( при давлении 1 атмосфера и заданной температуре).
Основы термохимических уравнений, закон Гесса
В основе термодинамических расчетов лежит закон Гесса: Тепловой эффект реакции, протекающей в системе при постоянном объеме или постоянном давлении, не зависит от промежуточных состояний, а определяется лишь начальным и конечным состоянием системы. В изохорном процессе ![]() , в изобарном процессе
, в изобарном процессе ![]() , где — тепловые эффекты соответствующих процессов.
, где — тепловые эффекты соответствующих процессов.
Закон Гесса, выражает первый закон термодинамики применительно к химическим реакциям (это основной закон термохимии). Из него вытекают следствия, которые упрощают расчет химических реакций, протекающих в системе при p=const или V=const:
- тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения;
- разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равна тепловому эффекту реакции перехода из одного начального состояния в другое;
- разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими.
![]()
- Зависимость количества теплоты, выделяющейся в реакции (E) от теплового эффекта реакции (Eo) и количества вещества (nb) одного из участников реакции (вещества b – исходного вещества или продукта реакции) выражается уравнением:
- Здесь – количество вещества b, задаваемое коэффициентом перед формулой вещества b в термохимическом уравнении.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/uravneniya-po-fizike/termoximicheskie-uravneniya/
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты теплового эффекта реакции
- Любая химическая реакция сопровождается выделением или поглощением энергии в виде теплоты.
- По признаку выделения или поглощения теплоты различают экзотермические и эндотермические реакции.
- Экзотермические реакции – такие реакции, в ходе которых тепло выделяется (+Q).
- Эндотермические реакции – реакции, при протекании которых тепло поглощается (-Q).
- Тепловым эффектом реакции (Q) называют количество теплоты, которое выделяется или поглощается при взаимодействии определенного количества исходных реагентов.
- Термохимическим уравнением называют уравнение, в котором указан тепловой эффект химической реакции. Так, например, термохимическими являются уравнения:
Также следует отметить, что термохимические уравнения в обязательном порядке должны включать информацию об агрегатных состояниях реагентов и продуктов, поскольку от этого зависит значение теплового эффекта.
Расчеты теплового эффекта реакции
- Пример типовой задачи на нахождение теплового эффекта реакции:
- При взаимодействии 45 г глюкозы с избытком кислорода в соответствии с уравнением
- C6H12O6(тв.) + 6O2(г) = 6CO2(г) + 6H2O(г) + Q
выделилось 700 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Решение:
Рассчитаем количество вещества глюкозы:
n(C6H12O6) = m(C6H12O6) / M(C6H12O6) = 45 г / 180 г/моль = 0,25 моль
Т.е. при взаимодействии 0,25 моль глюкозы с кислородом выделяется 700 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль глюкозы с кислородом образуется количество теплоты, равное Q (тепловой эффект реакции). Тогда верна следующая пропорция:
- 0,25 моль глюкозы — 700 кДж
- 1 моль глюкозы — Q
- Из этой пропорции следует соответствующее ей уравнение:
- 0,25 / 1 = 700 / Q
- Решая которое, находим, что:
- Q = 2800 кДж
- Таким образом, тепловой эффект реакции составляет 2800 кДж.
Расчёты по термохимическим уравнениям
Намного чаще в заданиях ЕГЭ по термохимии значение теплового эффекта уже известно, т.к. в условии дается полное термохимическое уравнение.
Рассчитать в таком случае требуется либо количество теплоты, выделяющееся/поглощающееся при известном количестве реагента или продукта, либо же, наоборот, по известному значению теплоты требуется определить массу, объем или количество вещества какого-либо фигуранта реакции.
Пример 1
В соответствии с термохимическим уравнением реакции
3Fe3O4(тв.) + 8Al(тв.) = 9Fe(тв.) + 4Al2O3(тв.) + 3330 кДж
образовалось 68 г оксида алюминия. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Решение
Рассчитаем количество вещества оксида алюминия:
n(Al2O3) = m(Al2O3) / M(Al2O3) = 68 г / 102 г/моль = 0,667 моль
В соответствии с термохимическим уравнением реакции при образовании 4 моль оксида алюминия выделяется 3330 кДж. В нашем же случае образуется 0,6667 моль оксида алюминия. Обозначив количество теплоты, выделившейся при этом, через x кДж составим пропорцию:
- 4 моль Al2O3 — 3330 кДж
- 0,667 моль Al2O3 — x кДж
- Данной пропорции соответствует уравнение:
- 4 / 0,667 = 3330 / x
- Решая которое, находим, что x = 555 кДж
Т.е. при образовании 68 г оксида алюминия в соответствии с термохимическим уравнением в условии выделяется 555 кДж теплоты.
Пример 2
В результате реакции, термохимическое уравнение которой
4FeS2(тв.) + 11O2(г) = 8SO2(г) + 2Fe2O3(тв.) + 3310 кДж
выделилось 1655 кДж теплоты. Определите объем (л) выделившегося диоксида серы (н.у.). (Запишите число с точностью до целых.)
Решение
В соответствии с термохимическим уравнением реакции при образовании 8 моль SO2 выделяется 3310 кДж теплоты. В нашем же случае выделилось 1655 кДж теплоты. Пусть количество вещества SO2, образовавшегося при этом, равняется x моль. Тогда справедливой является следующая пропорция:
- 8 моль SO2 — 3310 кДж
- x моль SO2 — 1655 кДж
- Из которой следует уравнение:
- 8 / х = 3310 / 1655
- Решая которое, находим, что:
- x = 4 моль
- Таким образом, количество вещества SO2, образовавшееся при этом, составляет 4 моль. Следовательно, его объем равен:
V(SO2) = Vm ∙ n(SO2) = 22,4 л/моль ∙ 4 моль = 89,6 л ≈ 90 л (округляем до целых, т.к. это требуется в условии.)
Больше разобранных задач на тепловой эффект химической реакции можно найти здесь.
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/teplovoj-jeffekt-himicheskoj-reakcii-termohimicheskie-uravnenija
Основные понятия и определения термохимии — fiziku5.ru
Энергетика (термодинамика ) химических реакций
В процессе химических реакций разрушаются связи между атомами в исходных веществах и возникают новые связи. Каждая связь характеризуется своим уровнем энергии и, следовательно, в процессе реакции будет меняться уровень внутренней энергии.
Внутренняя энергия включает в себя также энергию поступательного и вращательного движения молекул, колебания атомов, внутриядерную энергию и т. п. (Абсолютное значение внутренней энергии измерить невозможно).
Кинетическая или потенциальная энергия системы не относятся внутренней энергии.
Изменение внутренней энергии в процессе реакции приводит к выделению или поглощению теплоты, поэтому не бывает реакций без выделения или поглощения теплоты. Количество тепла, которое выделяется или поглощается при взаимодействии веществ, взятых в стехиометрических соотношениях, наз.тепловым эффектом реакции.
Раздел химической науки, в котором рассматриваются тепловые эффекты реакции, наз. ТЕРМОХИМИЯ. В экзотермических процессах (+Q) система выделяет теплоту, внутренняя энергия ее уменьшается. В эндотермических процессах (–Q) система поглощает теплоту из окружающей среды, ее внутренняя энергия возрастает.
Основные понятия и определения термохимии
СИСТЕМА— это тело или совокупность тел, мысленно обособленных от окружающей среды. Различают гомогенные (однородные) или гетерогенные (неоднородные) системы.
- Гомогенные состоят из одной фазы, гетерогенные из двух и более.
- ФАЗА – это часть системы, однородная по составу и свойствам во всех точках и отделяемая от других частей системы поверхностью раздела.
- Различают системы: изолированные, открытые и закрытые.
- Изолированная – (газ, нефть, полезные ископаемые в недрах Земли)-система, которая не обменивается с окружающей средой и веществом, ни энергией.
- Открытая-(жидкость и ее пар)- система, которая обменивается с окружающей средой и веществом, и энергией.
- Закрытая — (газ, находящийся в баллоне или в автоклаве)- система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Свойства системы — это совокупность всех ее физических и химических свойств. При изменении хотя бы одного из свойств, система переходит из одного состояния в другое.
Давление, температура, концентрация, объем –эти свойства системы, являющиеся независимыми переменными, называют термодинамическими параметрами состояния.
Свойства системы, являющиеся зависимыми переменными, наз. термодинамической функцией состояния. (внутренняя энергия, энтальпия, энтропия).
Химические реакции могут протекать, как при постоянном объеме –изохорные, так и при постоянном давлении — изобарные.
Подводимая к системе теплота Q расходуется на изменение внутренней энергии ∆U и работу против внешних сил A. Согласно закону сохранения энергии Q=∆U+A.
Большинство процессов (химических реакций ) совершаются при постоянном объеме (в закрытом сосуде) или при постоянном (обычно атмосферном ) давлении. Если объем системы не изменяется (V=соnst), то работа А=0. Следовательно, Qv=∆U. При постоянном давлении А= р∆V, тогда, Qр=∆U+ р∆V = U2-U1+p(V2-V1) = (U2+PV2) – (U1+PV1).
֑
U+PV называют энтальпией Н, следовательно, Qр=Н2 – Н1=∆Н. То есть, тепловой эффект реакции при постоянном давлении равен изменению энтальпии.
- В экзотермическом изохорном процессе Qv=∆U= U2-U1˂0, так как U2˂U1, а в изобарном процессе Qр =∆Н˂0
- Соответственно, в эндотермическом процессе Qv=∆U= U2-U1˃0 , а для
- Qр =∆Н˃0.
- Величины Q, ∆U, ∆Н выражают в кДж.
Термохимические уравнения. Закон Гесса.
Те уравнения химических реакций, в которых указывается тепловой эффект, называются термохимическими. Чаще всего ∆Н приводят для стандартных условий (ст. у.) Р=101320 Па, Т=298 К. Величину теплового эффекта относят к такому числу молей реагирующих веществ и продуктов реакции, который указаны стехиометрическими коэффициентами в уравнении реакции.
Например, 4Fe(k)+3O2(г)=2Fe2O3(k); ∆Н= — 1661 кДж, отсюда. Это значит, что 1661 кДж тепла выделится при взаимодействии 4 моль железа ( трех моль кислорода и при образовании двух моль триоксида дижелеза). То есть теплота образования 1 моль Fe2O3 будет равна –1661/2= –835,5 кДж
В термохимических уравнениях указывают также агрегатные состояния вещества (т или кр), (г), (ж).
Основной закон термохимии – закон Гесса — является частным случаем закона сохранения материи. «Тепловой эффект хим. реакции зависит от вида и состояния исх. в-в и продуктов реакции, но не зависит от пути, по которому протекает процесс».
- Пример:
- Получить углекислый газ можно двумя путями:
- 1) С(графит)+О2(г)→СО2(г); ∆Н1=-393,5 кДж
- и
- 2) С(графит)+О2(г)→СО(г); ∆Н2=-110,5 кДж
- и СО(г) + О2(г) → СО2(г); ∆Н3=-283 кДж
- Согласно закону Гесса ∆Н1 =∆Н2+∆Н3, то есть тепловой эффект реакции равен сумме тепловых эффектов промежуточных стадий.
- Действительно, уравнение С(графит)+О2(г)→СО2(г); ∆Н1=-393,5 кДж
- можно получить в результате сложения уравнений
- С(графит)+ ½ О2(г)→СО(г); ∆Н2= –110,5 кДж
- +
- СО(г) +½ О2(г) → СО2(г); ∆Н3= –283 кДж.
- Это значит, что химические уравнения можно складывать, вычитать, и аналогично им складываются или вычитаются их тепловые эффекты.
- Если начальные состояния исходных веществ различаются, то ∆Н этих реакций также будут разными.
- С(графит)+ О2(г)→ СО2 (г); ∆Н1= –393,5кДж
- С(алмаз) + О2(г) → СО2(г); ∆Н2= –395,3 кДж.
- Задача
- Определить ∆Н перехода графита в алмаз.
- С(графит) → С(алмаз)
- Согласно закону Гесса тепловой эффект этого превращения равен ∆Н1–∆Н2.
- Наиболее часто для расчета тепловых эффектов ∆Н (кДж) используются теплоты (энтальпии) образования веществ, ∆Н (кДж/моль).
- Под теплотой образования вещества понимают реакции получения 1 моля вещества из простых веществ, устойчивых в стандартных условиях:
- Са(т)+ С(графит)+ 3/2 О2(г)=СаСО3(т)
- Теплоты образования простых веществ равны 0.
- В справочниках теплоты образования приводятся для стандартных условий и обозначаются ∆Но298.
- Любую химическую реакцию можно представить как протекающую через стадии образования простых веществ, из которых потом образуются продукты реакции.
- Схемы протекания химической реакции
- 1 схема: исходные вещества → продукты реакции
- 2 схема: исходные вещества→простые вещества→продукты реакции
1.Al2O3+3SO3=Al2(SO4)3; ∆H x. р.
2. Al2O3=2Al+3/2О2; –∆Нообр Al2O3.
+ 3SO3=3S+9/2O2; –∆Нообр SO3
2Al+3S+3/2O2+9/2O2=Al2(SO4)3 ; ∆Нообр Al2(SO4)3
Согласно закону Гесса ∆H x. р.=∆Hoобразования продуктов -∆Hoобразования исходных веществ.
Следовательно, тепловой эффект реакции ∆H x. р. равен разности сумм теплот образования продуктов реакции и исходных веществ (с учетом стехиометрических коэффициентов).
∆H x. р.=∆Нообр Al2(SO4)3 — ∆Нообр Al2O3–3∆Нообр SO3.
Направленность процессов. Энтропия. Изобарный потенциал.
Большинство процессов идет таким образом, что энергия системы уменьшается, в связи с тем, что большая часть химических реакций идет с выделением тепла, то есть сопровождается уменьшением энергии. Однако известно много процессов, в том числе и химических, которые идут с поглощением тепла, то есть энергия системы возрастает.
А процесс самопроизвольного смешивания газов вообще не сопровождается заметным тепловым эффектом. Обратно процесс разделения газовой смеси на составляющие самопроизвольно не протекает. Смесь газов является более неупорядоченным состоянием системы.
Мерой неупорядоченного состояния системы является термодинамическая функция — энтропия S.
- S, то есть неупорядоченность, беспорядок, хаос возрастает, когда смешиваются газы, плавятся твердые вещества, испаряются жидкости, химическая реакция протекает с уменьшением числа частиц.
- Поскольку энтропия связана с тепловым движением атомов и молекул, ее изменение ∆S связано с количеством теплоты, подведенной к системе.
- Для обратимых процессов ∆S=Q/T;
- Для необратимых процессов ∆S˃Q/T;
- Приняв значение энтропии идеального кристалла при нуле Кельвинов равной 0, можно рассчитать возрастание энтропии при нагревании, плавлении, испарении вещества.
- Получение значения энтропии для 1 моля вещества называется стандартной энтропией Sо и приводится в справочниках [Sо298 ]=Дж/моль К
- Энтропия сильно зависит от агрегатного состояния вещества:
- Sо298 (Н2О г.)= 189 Дж/моль К Sо298 (Н2О ж) = 70 Дж/моль К
- Sо298 (Н2О т.) = 39,3 Дж/моль К
- Энтропия возрастает при увеличении числа атомов в молекуле, так как повышается число возможных колебательных и вращательных движений
- (Sо О3 ˃ Sо О2 ˃ Sо О), однако распад сложной молекулы на более простые частицы приводит к росту энтропии 2Sо О˃˃ Sо О2
Рассчитать ∆Sох. р. в ст. у. можно аналогично расчету ∆Нох. р.,
то есть ∆S x. р.=Soобразования продуктов — Soобразования исходных веществ
Для многих реакций величину ∆S и ее знак можно оценить без расчета, сравнив число частиц N2(г)+3H2(г)↔2NH3(г) , ∆S˂0 и агрегатные состояния исходных веществ и продуктов CaCO3(k)=CaO(k)+CO2(г) , ∆S˃0 .
Источник: http://fiziku5.ru/uchebnye-materialy-po-fizike/osnovnye-ponyatiya-i-opredeleniya-termoximii
Термохимические уравнения
Для
того, чтобы сравнивать энергетические
эффекты различных процессов, тепловые
эффекты определяют при стандартных
условиях.
За стандартные принимают давление 100
кПа (1 бар), температуру 250С
(298 К), концентрацию — 1 моль/л.
Если
исходные вещества и продукты реакции
находятся в стандартном состоянии, то
тепловой эффект химической реакции
называется стандартной
энтальпией системы
и обозначается ΔН298
или ΔН.
Уравнения
химических реакций с указанием теплового
эффекта называют термохимическими
уравнениями.
В
термохимических уравнениях указывают
фазовое состояние и полиморфную
модификацию реагирующих и образующихся
веществ: г —газовое, ж — жидкое, к
—кристаллическое, т — твердое, р —
растворенное и др.
Если агрегатные
состояния веществ для условий реакции
очевидны, например, О2,
N2,
Н2
— газы, Аl2О3,
СаСО3
— твердые вещества и т.д. при 298 К, то их
могут не указывать.
- Термохимическое
уравнение включает в себя тепловой
эффект реакции ΔН,
который в современной терминологии
записывают рядом с уравнением. Например: - С6Н6(Ж)
+ 7,5О2
= 6СО2
+ 3Н2О(Ж) ΔН= — 3267,7 кДж - N2
+ 3Н2
= 2NН3(Г)
ΔН
= — 92,4 кДж.
С
термохимическими уравнениями можно
оперировать, как и с алгебраическими
уравнениями (складывать, вычитать друг
из друга, умножать на постоянную величину
и т.д.).
Термохимические
уравнения часто (но не всегда) приводятся
для одного моля рассматриваемого
вещества (получаемого или расходуемого).
При этом другие участники процесса
могут входить в уравнение с дробными
коэффициентами. Это допускается, так
как термохимические уравнения оперируют
не с молекулами, а с молями веществ.
Термохимические расчеты
Тепловые
эффекты химических реакций определяют
как экспериментально, так и с помощью
термохимических расчетов.
В
основе термохимических расчетов лежит
закон Гесса
(1841 г):
Тепловой
эффект реакции не зависит от пути, по
которому протекает реакция (т.е. от числа
промежуточных стадий), а определяется
начальным и конечным состоянием системы.
- Например,
реакция горения метана может протекать
по уравнению: - СН4
+2О2
= СО2
+ 2Н2О(Г) ΔН1
= —802,34 кДж - Эту же реакцию
можно провести через стадию образования
СО: - СН4
+3/2О2
= СО + 2Н2О(Г) ΔН2
= —519,33 кДж - СО
+1/2О2
= СО2 ΔН3= —283,01 кДж
При
этом оказывается, что
ΔН1
= ΔН2
+ ΔН3
.
Следовательно, тепловой эффект реакции,
протекающей по двум путям, одинаков. Закон Гесса хорошо иллюстрируется с
помощью энтальпийных диаграмм (рис.2)
1. Тепловой эффект
прямой реакции равен тепловому эффекту
обратной реакции с противоположным
знаком.
2.
Если в результате ряда последовательных химических реакций система приходит
в состояние, полностью совпадающее с
исходным, то сумма тепловых эффектов
этих реакций равна нулю (ΔН
= 0).
Процессы, в которых система после
последовательных превращений возвращается
в исходное состояние, называются
круговыми процессами или циклами.
Метод циклов широко используется в
термохимических расчетах. .
3.
Энтальпия химической реакции равна
сумме энтальпий образования продуктов
реакций за вычетом суммы энтальпий
образования исходных веществ с учетом
стехиометрических коэффициентов.
Здесь
встречаемся с понятием ''энтальпия
образования''.
Энтальпией
(теплотой) образования химического
соединения называется тепловой эффект
реакции образования 1 моля этого
соединения из простых веществ, взятых
в их устойчивом состоянии при данных
условиях.
Обычно теплоты образования относят к
стандартному состоянию, т.е.
250С
(298 К) и 100 кПа. Стандартные энтальпии
образования химических веществ
обозначаются ΔН298
(или ΔН),
измеряются в кДж/моль и приводятся в
справочниках.
Энтальпию образования
простых веществ , устойчивых при 298 К и
давлении 100 кПа, принимают равной нулю.
В
таком случае следствие из закона Гесса
для теплового эффекта химической реакции
(ΔН(Х.Р.))
имеет вид:
ΔН(Х.Р.)
= ∑ΔНпродуктов
реакции—
∑ΔНисходных
веществ
Используя
закон Гесса, можно рассчитывать энергию
химической связи, энергию кристаллических
решеток, теплоты сгорания топлив,
калорийность пищи и т.д.
Наиболее
распространенные расчеты – вычисление
тепловых эффектов (энтальпий) реакций,
что необходимо для технологических и
научных целей.
Пример
1.
Напишите
термохимическое уравнение реакции
между СО2(Г)и водородом,
в результате которой образуются СН4(Г)и Н2О(Г),
вычислив ее тепловой эффект на основе
данных, приведенных в приложении. Сколько
теплоты выделится в этой реакции при
получении 67,2 л метана в пересчете на
стандартные условия?
- Решение.
Составляем и уравниваем химическую
часть требующегося термохимического
уравнения: - СО2(Г)
+ 3Н2(Г)
= СН4(Г)
+ 2Н2О(Г) - Находим
в справочнике (приложение) стандартные
теплоты образования соединений,
участвующих в процессе: - ΔН
(СО2(Г))
= —393,51 кДж/моль ΔН
(СН4(Г))
= —74,85 кДж/моль ΔН
(Н2(Г))
= 0 кДж/моль ΔН
(Н2О(Г))
= ―241,83
кДж/моль - Обратите
внимание, что теплота образования
водорода, как и всех простых веществ в
их устойчивом при данных условиях
состоянии, равна нулю. Рассчитываем
тепловой эффект реакции:
ΔН(Х.Р.)
= ∑ΔН(прод.)
—
∑ΔН(исх.)
=
- ΔН(СН4(Г))
+ 2ΔН(Н2О(Г))
— ΔН(СО2(Г))
—3ΔН
(Н2(Г)))
= - —74,85 + 2(—241,83) —
(—393,51) — 3·0 = —165,00 кДж/моль. - Термохимическое
уравнение имеет вид: - СО2(Г)
+ 3Н2(Г)
= СН4(Г)
+ 2Н2О(Г); ΔН = —165,00
кДж
Согласно
этому термохимическому уравнению,
165,00 кДж теплоты выделится при получении
1 моль, т.е. 22,4 л метана. Количество
теплоты, выделившейся при получении
67,2 л метана, находим из пропорции:
- 22,4 л —— 165,00 кДж 67,2·165,00
- 67,2 л —— Q кДж Q = —————— = 22,4
- = 495,00 кДж
Пример
2. При сгорании
1л этилена С2Н4(Г)
(стандартные условия) с образованием
газообразного оксида углерода (IV) и
жидкой воды выделяется 63,00 кДж теплоты.
Рассчитайте по этим данным мольную
энтальпию горения этилена и запишите
термохимическое уравнение реакции.
Вычислите энтальпию образования С2Н4(Г)
и сравните полученное значение с
литературными данными (приложение).
Решение.
Составляем и уравниваем химическую
часть требующегося термохимического
уравнения:
С2Н4(Г)
+ 3О2(Г)
= 2СО2(Г)
+ 2Н2О(Ж); Н
= ?
Создаваемое
термохимическое уравнение описывает
горение 1 моль, т.е. 22,4 л этилена. Необходимую
для него мольную теплоту горения этилена
находим из пропорции:
- 1л —— 63,00 кДж 22,4·63,00
- 22,4 л —— Q кДж Q = —————— =
- 1
- = 1410,96 кДж
- Н
= -Q,
термохимическое уравнение горения
этилена имеет вид: С2Н4(Г)
+ 3О2(Г)
= 2СО2(Г)
+ 2Н2О(Ж);
Н
= -1410,96 кДж
Для
расчета энтальпии образования С2Н4(Г)привлекаем
следствие из закона Гесса: ΔН(Х.Р.)
= ∑ΔН(прод.)
—
∑ΔН(исх.).
Используем
найденную нами энтальпию горения этилена
и приведенные в приложении энтальпии
образования всех (кроме этилена)
участников процесса.
—1410,96
= 2·(—393,51) + 2·(—285,84) — ΔН(С2Н4(Г))
— 3·0
Отсюда
ΔН(С2Н4(Г))
= 52,26 кДж/моль. Это совпадает со значением,
приведенным в приложении и доказывает
правильность наших вычислений.
- Пример
3. Напишите
термохимическое уравнение образования
метана из простых веществ, вычислив
энтальпию этого процесса из следующих
термохимических уравнений: - СН4(Г)
+ 2О2(Г)
= СО2(Г)+
2Н2О(Ж) ΔН1= -890,31 кДж (1) - С(
ГРАФИТ)
+ О2(Г)
= СО2(Г)Н2
= -393,51 кДж (2) - Н2(Г)
+ ½О2(Г)
= Н2О(Ж) Н3
= -285,84 кДж (3) - Сравните
полученное значение с табличными данными
(приложение). - Решение.
Составляем и уравниваем химическую
часть требующегося термохимического
уравнения: - С(ГРАФИТ)
+ 2Н2(Г)
= СН4(Г) Н4
= Н(СН4(Г)))
=? (4)
С
термохимическими уравнениями можно
оперировать так же, как и с алгебраическими.
Мы должны в результате алгебраических
действий с уравнениями 1, 2 и 3 получить
уравнение 4. Для этого следует уравнение
3 умножить на 2, результат сложить с
уравнением 2 и вычесть уравнение 1.
- 2Н2(Г)
+ О2(Г) = 2Н2О(Ж) Н(СН4(Г))
= 2Н3
+ Н2
— Н1 - + С(ГРАФИТ)
+ О2(Г)
+ СО2(Г) Н(СН4(Г))
= 2(—285,84) - — СН4(Г)
— 2О2(Г) —СО2(Г)—
2Н2О(Ж) + (—393,51) - ― (—890,31).
- С(ГРАФИТ)
+ 2Н2(Г)
= СН4(Г)Н(СН4(Г))
= —74,88 кДж - Это
совпадает со значением, приведенным в
приложении, что доказывает правильность
наших вычислений.
Источник: https://studfile.net/preview/2973278/page:3/
Составление термохимического уравнения реакции и вычисление теплот образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); = -285,84 кДж; б) С (к) + О2 (г) = СО2 (г); = -393,51 кДж;в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); = -890,31 кДж.Ответ: -74,88 кДж.
Решение:Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
- С (графит) + 2Н2 (г) = СН4 (г); = ?
- Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
- СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) == 2Н2О (ж) + СО2 — 2Н2О — СО2; = -890,31 – [-393,51 + 2(-285,84).
- Отсюда
- СН4 (г) = С (к) + 2Н2 (к); = +74,88 кДж.2
- Так как теплота образования равна теплоте разложения с обратным знаком, то
- (СН4) = -74,88 кДж.
- Ответ: -74,88 кДж.
Задание 89. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); = -635,60 кДж;Н2 (г) + 1/2О2 (г) = Н2О (ж); = -285,84 кДж;СаО (к) + Н2О (ж) = Са(ОН)2 (к); = -65,06 кДж.Ответ: —986,50 кДж.
Решение:Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
- Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); = ?
- Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
- СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); = -65,06 + (-635,60) + (-285,84) = -986,50 кДж.
- Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):
- == (Са(ОН)2 = -986,50 кДж.2
- Ответ: -986,50 кДж.
Задание 90. Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими.
В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой.
Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); = -3135,58 кДж.
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:
- = 6 (СО2) + 3 =0(Н2О) – (С6Н6)
- Отсюда
- (С6Н6) = [6 (СО2) + 3(Н2О)] — ; (С6Н6) = [6 -393,51 + 3(-241,83)] — (-3135,58) = +49,03 кДж.
- Ответ: +49,03 кДж.
Теплота образования
Задание 91. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими.
В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой.
Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жид-кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); = ?
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
- = 2(СО2) + (Н2О) – (С2Н2); = 2(-393,51) + (-241,83) – (+226,75) = -802,1 кДж.
- Термохимическое уравнение будет иметь вид:
- Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
- 22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
- Ответ: 5908,35 кДж.
Задание 92. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
- Решение:
- NH3 (г) + 5/4O2 = NO (г) + 3/2H2O (г)
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
- = (NO) + 3/2 (Н2О) – (NH3); = +90,37 +3/2 (-241,83) – (-46,19) = -226,185 кДж.
- Термохимическое уравнение будет иметь вид:
- Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
- 22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
- Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93. Реакция горения метилового спирта выражается термохимическим уравнением:СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); =?Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.Решение:
(СН3ОН (ж)) = (СН3ОН (г)); = +37,4 кДж;+37,4 кДж = -201,17 — (СН3ОН (ж)); (СН3ОН (ж)) = -201,17 +(- 37,4) = -238,57кДж.
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:
= 2(Н2O) + (СО2) – ( СН3ОН (ж)); = -393,51 +2 (-285,84) – (-238,57) = -726,62 кДж.
Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты.
Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:Мольная масса С2Н5ОН равна 46,0г/моль.Находим тепловой эффект реакции горения этилового спирта из пропорции:
- Следовательно, термохимическое уравнение реакции будет иметь вид:
- С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); = 1234,84кЛж. (1)
- Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
- Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
- Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
- Сравнивая уравнения (1) и (5), находим:
- Ответ: (С2Н5ОН) = -278,12 кДж/моль.
Источник: http://buzani.ru/zadachi/khiniga-shimanovich/913-termokbimicheskie-uravnenia-teplota-obrazovanie-88-94
Термохимические уравнения и расчеты — Физика
Химическая термодинамика в своих расчетах широко применяет математический аппарат классической термодинамики. Этот подход оказался весьма эффективным. Так, появилась возможность рассчитывать тепловые эффекты реакций, не проводя экспериментов.
Применение термодинамического аппарата позволило заранее прогнозировать направление протекания химических реакций и рассчитывать выход продуктов только на основе термодинамических данных отдельных реагентов.
Кроме того, удалось показать, что способность веществ вступать в химические реакции зависит не только от их природы, но и от условий проведения процесса — температуры и давления. Это позволило достаточно точно рассчитать значения внешних параметров и провести реакции, которые ранее считались неосуществимыми.
Теплотой реакции (Q) называется количество теплоты, поглощаемой из окружающей среды или выделяемой в окружающую среду при превращении исходных реагентов в продукты реакции при определенных температуре и давлении.
Реакции, которые протекают с выделением теплоты, называются экзотермическими.Для таких реакций Q > 0, DН < 0.
Реакции, которые протекают с поглощением теплоты, называются эндотермическими.В данном случаеQ < 0, DН > 0.
- Так как значения тепловых эффектов в той или иной степени зависят от внешних условий (температуры, давления и др.), то для того, чтобы иметь возможность сравнивать тепловые эффекты различных реакций термохимические измерения проводят при одинаковых условиях, а именно:
- 1) в реакции участвуют индивидуальные вещества в их наиболее устойчивых модификациях;
- 2) концентрации реагентов составляют 1 моль вещества на 1 кг растворителя;
- 3) температура равна 250С (298,15 К);
4) давление соответствует 1 атм (760 мм рт. ст.; 101325 Па).
- Такие условия называют стандартными.
- За стандартное состояние (обозначают верхним индексом 0) принято устойчивое состояние вещества (устойчивая модификация — для веществ в конденсированном состоянии; состояние идеального газа — для газов), в котором оно существует при давлении 101,3 кПа и данной температуре (обычно 298 К).
- Величину теплового эффекта реакции, измеренную при стандартных условиях и взятую с обратным знаком, называют стандартной энтальпией реакции и обозначают DН0.
C(тв.) + О2(газ) = СО2(газ); CO2 = -393,5 кДж/моль.
Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением. Термохимические уравнения составляют таким образом, чтобы в качестве продукта всегда образовывался 1 моль вещества, поэтому в таких уравнениях стехиометрические коэффициенты могут быть дробными. Например:
- обычное химическое уравнение:
- 2H2 + O2 = 2H2O;
- термохимическое уравнение:
- H2(газ) + O2(газ) = H2O(газ); H2O = -242 кДж/моль.
- Величины стандартных энтальпий образования наиболее устойчивых простых веществ считают равными нулю. Например:
- O2 = 0;
- O3 ¹ 0.
Величины стандартных энтальпий образования веществ — это справочный материал. Следует отметить, что различному агрегатному состоянию одного и того же вещества могут соответствовать различные значения стандартных энтальпий образования.
- Например:
- H2O(жидк.) = -286 кДж/моль;
- H2O(газ) = -242 кДж/моль.
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.);
- С6H12O6 = -2810 кДж/моль.
- Для высших оксидов элементов значения стандартных энтальпий сгорания принимают равными нулю.
- Например:
- СO2.
В 1840 г. русским ученым Г.И. Гессом на основании экспериментальных данных был открыт закон о постоянстве сумм теплот для различных путей превращения исходных веществ в продукты реакции. В современной термохимии закон Гесса рассматривается как следствие I закона термодинамики, но при этом имеет отдельное название, так как был открыт раньше установления эквивалентности теплоты и работы.
- В настоящее время закон Гесса формулируется так:
- Изменение энтальпии реакции образования заданных продуктов из данных реагентов не зависит от числа и вида реакций, в результате которых образуются эти продукты.
- Для расчета энтальпий некоторых процессов вместо закона Гесса удобнее применять следствия из него.
- I следствие:
- Энтальпия реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
- Для реакции:
- aA + bB = cC + dD
- математическое выражение I следствия из закона Гесса в общем виде выглядит следующим образом:
| (6) |
- II следствие:
- Энтальпия реакции равна сумме стандартных энтальпий сгорания исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов.
- В данном случае математическое выражение запишется так:
| (7) |
- Отметим, что из закона Гесса также следует, что термохимические уравнения можно складывать, вычитать и умножать на численные множители.
- Используя закон Гесса, можно рассчитать калорийность пищи, потребляемой ежедневно человеком, и дать необходимые рекомендации по составлению диеты в случае нарушения обмена веществ.
- Глюкоза, попадая в организм, претерпевает серию сложных превращений. В результате окисления глюкозы, как и большинства питательных веществ, образуются углекислый газ и вода:
С6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.); = -2810 кДж.
- Следовательно, если человек съест 180 г глюкозы (1 моль), то в организме человека в результате окисления 1 моль глюкозы теоретически должно выделиться 2810 кДж (672 ккал) энергии.
- Установлено, что при окислении основных питательных веществ выделяются следующие количества теплоты: 1 г жиров — 39,5 кДж, 1 г углеводов — 17,1 кДж, 1 г белков — 22,3 кДж.
- Энергетическую потребность человека можно определить, поместив его в калориметр (прибор, исключающий теплообмен с окружающей средой) и измерив количество израсходованной им энергии.
Отдача теплоты человеком в состоянии покоя: 6300-7500 кДж в сутки. Любое движение организма, любая работа, даже пищеварение, усиливают выделение тепла. Было установлено, что при легкой физической работе человеку необходимо 8400-12000 кДж в сутки, а при тяжелой — 16700-20900 кДж в сутки.
Человеку для поддержания термодинамического равновесия требуется количество энергии, равное отдаче тепла.
Зная состав отдельных питательных веществ и их энтальпии сгорания, можно рассчитать количество необходимых для питания человека продуктов.
При избыточном или нерациональном потреблении питательных веществ часть продуктов не усваивается и откладывается организмом в депо в виде жировой подкожной клетчатки, вызывая ожирение.
Процессы растворения также могут сопровождаться тепловыми эффектами. Такие процессы, как правило, экзотермичны.
Энтальпией растворенияназывается изменение энтальпии при растворении 1 моль вещества.
Изменение энтальпии при образовании раствора свидетельствует об изменении природы компонентов раствора.
Заметное изменение энтальпии наблюдается в реакциях нейтрализации водных растворов сильных кислот сильными основаниями.
При этом в расчете на 1 моль эквивалента кислоты или основания при стандартных условиях выделяется одинаковое количество теплоты (+57,1 кДж). Такое постоянство непосредственно вытекает из закона Гесса.
Действительно, независимо от того, какие были взяты кислоты и основания, нейтрализация всегда сводится к реакции образования воды:
| H+(р-р) + ОH-(р-р) = H2O(жидк.); | = -57,1 кДж. |
Изменение энтальпии при взаимодействии 1 моль ионов H+ c 1 моль ионов OH- при стандартных условиях называется стандартной энтальпией нейтрализации и составляет -57,1 кДж/моль.
Источник: https://student2.ru/fizika/1646397-termokhimicheskie-uravneniya-i-raschety/




