Аммиак — одно из важнейших соединений азота. Азот, входящий в состав белков и нуклеиновых кислот, является одним из компонентов, составляющих основу жизни.
Поэтому очень важно было научиться синтезировать химические соединения с азотом. Сначала использовали электричество, но этот способ оказался очень дорогим.
Более простым способом явилась химическая реакция соединения азота, находящегося в воздухе, с водородом в химическое соединение — аммиак!
Получение аммиака
Получение аммиака в промышленности связано с прямым его синтезом из простых веществ. Как уже отмечалось, источником азота служит воздух, а водород получают из воды.
3H2 + N2 → 2NH3 + Q
 Аммиак. Водный раствор
Аммиак. Водный раствор
Реакция синтеза аммиака обратима, поэтому важно подобрать условия, при которых выход аммиака в химической реакции будет наибольшим. Для этого реакцию проводят при высоком давлении (от 15 до 100 МПа). В ходе реакции объёмы газов (водорода и азота) уменьшаются в 2 раза, поэтому высокое давление позволяет увеличить количество образующегося аммиака.
Катализатором в такой реакции может служить губчатое железо. При этом интересно то, что губчатое железо действует как катализатор только при температуре выше 5000C. Но увеличение температуры способствует распаду молекулы аммиака на водород и азот.
Для избежания распада молекул, как только смесь газов проходит через губчатое железо, образовавшийся аммиак сразу охлаждают! Кроме того при сильном охлаждении аммиак превращается в жидкость.
Получение аммиака в лабораторных условиях производят из смеси твёрдого хлорида аммония (NH4Cl) и гашенной извести. При нагревании интенсивно выделяется аммиак.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Свойства аммиака
Аммиак при обычных условиях — газ с резким и неприятным запахом. Аммиак ядовит! При 20 0C в воде растворяется 700 л аммиака. Полученный раствор называют аммиачной водой. Из-за такой растворимости аммиак нельзя собирать и хранить над водой.
Аммиак — активный восстановитель. Такое свойство у него за счёт атомов азота, имеющих степень окисления «-3». Восстановительные свойства азота наблюдаются при горении аммиака на воздухе. Так как для азота наиболее устойчивая степень окисления — 0, то в результате этой реакции выделяется свободный азот.
Если в реакции горения использовать катализаторы (платину Pt и оксид хрома Cr2O3), то получают оксид азота.
4NH3 + 5 O2 → 4NO + 6H2O
Аммиак может восстанавливать металлы из их оксидов. Так реакцию с оксидом меди используют для получения азота.
2NH3 + 3CuO → 3Cu + N2 + 3H2O
 Реакция гидроксида меди с аммиаком
Реакция гидроксида меди с аммиаком
Аммиак обладает свойствами оснований и щелочей. При растворении его в воде образуется ион аммония и гидроксид-ион. При этом соединения NH4OH — не существует! Поэтому формулу аммиачной воды лучше записать, как формулу аммиака!
- Основные свойства аммиака проявляются также и в реакциях с кислотами.
- NH3 + HCl → NH4Cl (нашатырь)
- NH3 + HNO3 → NH4NO3 (аммиачная селитра)
Аммиак реагирует с органическими веществами. Например, искусственные аминокислоты получают с помощью реакции аммиака и A-хлорзамещёнными карбоновыми кислотами. Выделяющийся в результате реакции хлороводород (газ HCl) связывают с избытком аммиака, в результате которого образуется нашатырь (или хлорид аммония NH4Cl).
Многие комплексные соединения содержат в качестве лиганда аммиак. Аммиачный раствор оксида серебра, который используется для обнаружения альдегидов, представляет собой комплексное соединение — гидроксиддиаммин серебра.
Ag2O + 4NH3 + H2O →2[Ag(NH3)2]OH
Соли аммония
Соли аммония — твёрдые кристаллические вещества, не имеющие окраски. Почти все они растворяются в воде, и им характерны все те же свойства, которые имеют известные нам соли металлов. Они взаимодействуют со щелочами, при этом выделяется аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
При этом, если дополнительно воспользоваться индикаторной бумагой, то эту реакцию можно использовать — как качественную реакцию на соли аммония. Соли аммония взаимодействуют с другими солями и кислотами. Например,
- (NH4)2SO4 + BaCl2 → BaSO4 + 2NH4Cl
- (NH4)2CO3 + 2HCl2 → 2NH4Cl + CO2 + H2O
- Соли аммония неустойчивы к нагреванию. Некоторые из них, например хлорид аммония (или нашатырь), — возгоняются (испаряются при нагревании), другие, например нитрит аммония, — разлагаются
- NH4Cl → NH3 + HCl
- NH4NO2 → N2 + 2H2O
- Последняя химическая реакция — разложение нитрита аммония — используется в химических лабораториях для получения чистого азота.
Аммиак — это слабое основание, поэтому соли, образованные аммиаком в водном растворе подвергаются гидролизу. В растворах этих солей имеется большое количество ионов гидроксония, поэтому реакция солей аммония — кислая!
NH4+ + H2O → NH3 + H3O+
Применение аммиака и его солей основано на специфических свойствах. Аммиак служит сырьём для производства азотосодержащих веществ, а также в составе солей широко применяется в качестве минеральных удобрений. Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
Источник: https://www.kristallikov.net/page48.html
Аммиак
Аммиак является газообразным веществом с резким неприятным запахом. Какими свойствами он обладает, и с какими веществами вступает в реакции?

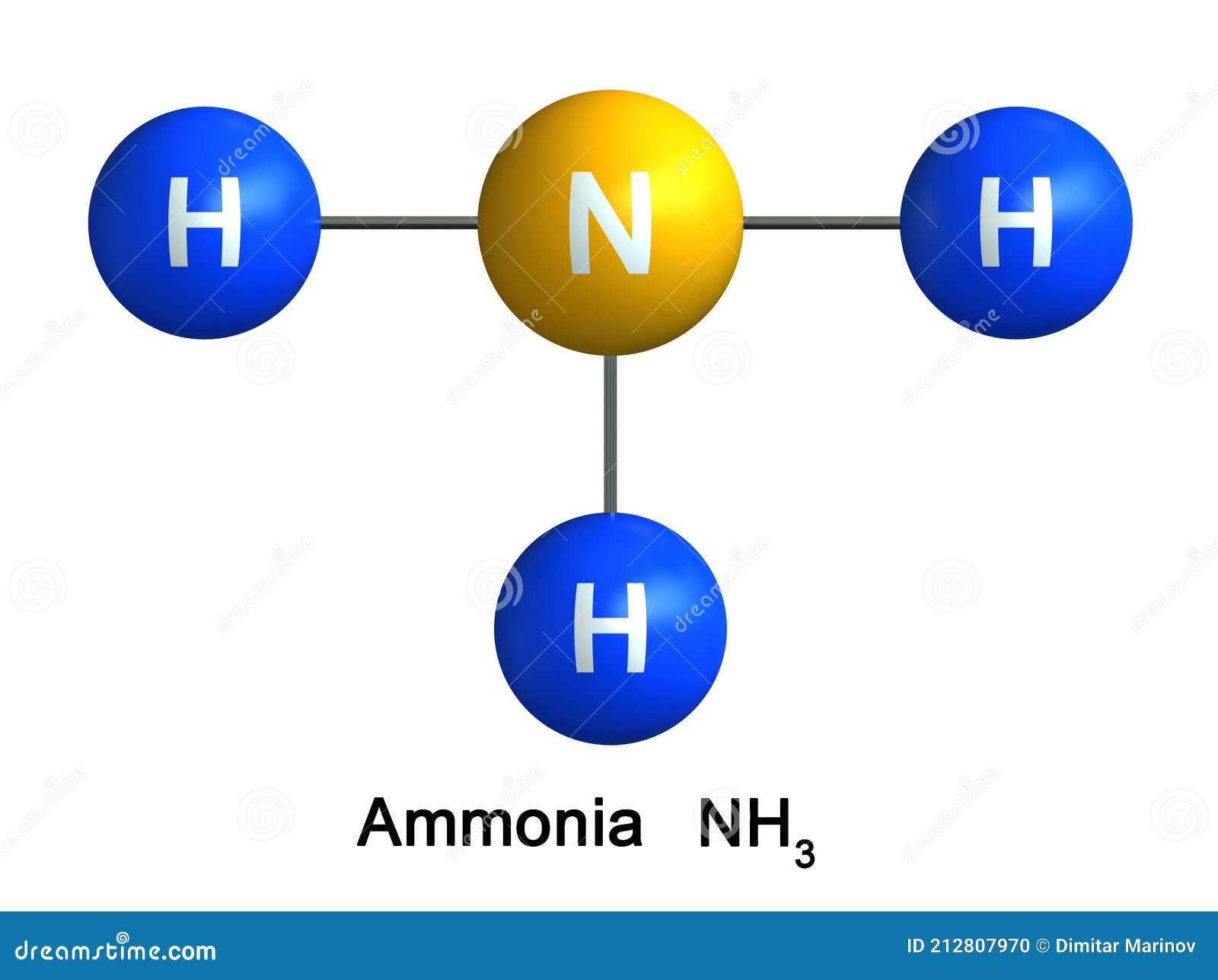
Электронная формула аммиака выглядит следующим образом:
Рис. 1. Электронная формула аммиака.
Из четырех электронных пар при атоме азота – три общие и одна неподеленная.
В образовании молекулы NH3 участвуют три неспаренных p-электрона атома азота, электронные орбитали которых взаимно перпендикулярны, и 1s-электроны трех атомов водорода.
Молекула имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота. Угол между связями H-N-H равен 107,78 градусов.
Аммиак – газ не имеющий цвета с характерным резким запахом. Температура кипения аммиака – -33,4 градуса по Цельсию, плавления – -77,8 градусов.
Аммиак хорошо растворяется в воде (при 20 градусах в 1 объеме воды растворяется до 700 объемов аммиака). Концентрированный раствор имеет плотность аммиака 0,91 г/см3.
Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При кипячении растворенный аммиак улетучивается из раствора.
Рис. 2. Нашатырный спирт.
Несколько хуже аммиак растворим в органических растворителях (спирт, ацетон, хлороформ, бензол). Аммиак хорошо растворяет многие азотосодержащие вещества.
Жидкий аммиак имеет большую теплоту испарения (при -50 градусах 145 кДж/кг, при 0 градусах 1260 кДж/кг, при 50 градусах 1056 кДж/кг).
Молярная масса и молекулярная масса аммиака равна 17
В химическом отношении аммиак довольно активен. реакции, в которых участвует аммиак, сопровождаются либо изменением степени окисления азота, либо образованием особого вида ковалентной связи. Большая растворимость химического вещества в воде обусловлена образованием водородных связей между их молекулами.
Аммиак способен реагировать со следующими веществами:
- при взаимодействии с кислотами аммиак нейтрализует их, образуя при этом соли аммония:
- при взаимодействии с галогенами аммиак обычно окисляется до свободного азота:
- в смеси с кислородом аммиак горит зеленовато-желтым пламенем:
- при нагревании аммиак восстанавливает оксид меди (II), а сам окисляется до свободного азота:
– с помощью данной реакции можно получить кислород в лабораторных условиях.
В лаборатории аммиак получают, нагревая хлоридом амония NH4Cl с гашеной известью Ca(OH)2 :
2NH4 Cl+Ca(OH)2 =CaCl+2NH3+2H2O
– выделяющийся аммиак содержит пары воды.
В промышленности аммиак получают из азота и водорода. Реакция синтеза аммиака протекает с выделением тепла и уменьшением объема:
Температура, необходимая для проведения синтеза аммиака, достигается путем предварительного подогрева азото-водородной смеси и за счет выделения реакционного тепла.
Катализатором синтеза аммиака является губчатое железо, активированное некоторыми металлами. Сероводород, кислород, оксид и диоксид углерода, пары и другие смеси, содержащиеся в азото-водородной смеси, резко понижают активность катализатора.
Синтез ведут при при температуре 500-550 градусов и давлении от 15 до 100 МПа.
Схема установки синтеза аммиака выглядит так:
Рис. 3. Схема производства аммиака.
Большая часть синтезируемого в промышленности аммиака используется для получения азотной кислоты и других азотосодержащих веществ. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Водные растворы аммиака применяются в химических лабораториях и производствах в качестве слабого легколетучего основания. Также водные растворы используют в медицине и быту.
Изучение аммиака входит в обязательный школьный курс химии. Аммиак – химическое соединение, в состав которого входит азот и водород. Газ является бесцветным веществом с ярко выраженным запахом и вступает в реакции с кислотами, водой, галогенами, кислородом и другими сложными и простыми веществами.
Средняя оценка: 4.7. Всего получено оценок: 92.
Источник: https://obrazovaka.ru/himiya/ammiak-formula-plotnost.html
Физические свойства аммиака
Аммиак [нитрид водорода] — химическая формула NH3, химическое соединение азота и водорода, молярная масса 17,03 кг/кмоль, при нормальных условиях является бесцветным газом с резким запахом, токсичен.
Важнейший источник азота для всех живых организмов на Земле. Один из основных продуктов химической промышленности, используется при производстве азотных удобрений, полимеров, азотной кислоты и др. Применяется в холодильной технике в качестве хладагента — R717.
Жидкий аммиак используется в качестве растворителя.
Плотность аммиака при нормальном атмосферном давлении 101,325 кПа (1 атм) и различной температуре
| Температура аммиака | Плотность аммиака, ρ |
| оС | кг/м3 |
| 27 | 0,6894 |
| 67 | 0,6059 |
| 87 | 0,5716 |
| 107 | 0,5410 |
| 127 | 0,5136 |
| 167 | 0,4664 |
| 227 | 0,4101 |
Динамическая и кинематическая вязкость аммиака при нормальном атмосферном давлении и различной температуре
| Температура | Динамическая вязкость аммиака, μ | Кинематическая вязкость аммиака, ν |
| оС | (Н • c / м2) x 10-7 | (м2 / с) x 10-6 |
| 27 | 101,5 | 14,7 |
| 47 | 109,0 | 16,9 |
| 67 | 116,5 | 19,2 |
| 87 | 124,0 | 21,7 |
| 107 | 131,0 | 24,2 |
| 127 | 138,0 | 26,9 |
Основные физические свойства аммиака NH3 при различной температуре
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Теплопроводность, λ | Кинематическая вязкость, ν | Число Прандтля, Pr |
| K | кг/м3 | Дж / (кг • К) | Вт / (м • К) x 10-3 | (м2 / с) x 10-6 | — |
| 300 | 0,6894 | 2158 | 24,7 | 14,7 | 0,887 |
| 400 | 0,5136 | 2287 | 37,0 | 26,9 | 0,853 |
| 500 | 0,4101 | 2467 | 52,5 | 42,2 | 0,813 |
| 580 | 0,3533 | 2613 | 63,8 | 56,5 | 0,817 |
* Табличные данные подготовлены по материалам зарубежных справочников
Формулы для расчета физических свойств аммиака
При проведении инженерных расчетов удобнее использовать приближённые формулы для оценки физических свойств аммиака NH3⋆:
⋆ Приближённые формулы физических свойств аммиака получены авторами настоящего сайта.
Размерность величин: температура — градусы Цельсия. Формула плотности аммиака выведена для атмосферного давления.
Приближённые формулы действительны в диапазоне температур от 25 до 230 oC.
Источник: http://www.highexpert.ru/content/gases/ammonia.html
Химические, физические и тепловые свойства аммиака (NH3), он же холодильный агент R 717
Химические, физические и тепловые свойства аммиака (NH3), он же холодильный агент R 717.
Химические, физические и тепловые свойства аммиака (NH3) : холодильный агент R 717. По умолчанию при атмосферном давлении.
| Молекулярная масса | 17.2 |
| Удельный объем жидкого аммиака при НУ | 1.43 м3/кг, 23.0 футов3/фунт |
| Плотность жидкого аммиака при НУ | 686 кг/м3, 42.6 фунтов/фут3 |
| Плотность газа аммиака при температуре кипения | 0.86 кг/м3 |
| Плотность газа аммиака при температуре 15oC = 59oF | 0.73 кг/м3 |
| Удельный объем газа аммиака при 21oC = 70oF | 1.411 м3/кг |
| Давление насыщенных паров аммиака при 25oC | 1.0 (MН/м2=МПа), 145.4 psia |
| Отношение объемов равных количеств газа аммиака и жидкого аммиака при температуре 15oC = 59oF | 947 |
| Абсолютная вязкость газа аммиака при 0oC | 0.01сПуаз, 6.72 10-6 фунтов/(фут*с) |
| Абсолютная вязкость жидкого аммиака при -23oC | 245*106 Н*сек/м2 |
| Абсолютная вязкость жидкого аммиака при 27oC | 141*106 Н*сек/м2 |
| Абсолютная вязкость жидкого аммиака при 127oC | 38*106 Н*сек/м2 |
| Скорость звука в газе при 25oC | 415 м/с |
| Скорость звука в газе при 930 oC | 870 м/с |
| Скорость звука в жидком аммиаке при -33°C | 1729 м/с |
| Удельная теплоемкость жидкого аммиака при -23 °C | 4.52 кДж/(кг*°C) |
| Удельная теплоемкость жидкого аммиака при 27 °C | 4.75 кДж/(кг*°C) |
| Удельная теплоемкость жидкого аммиака при 127 °C | 6.91 кДж/(кг*°C) |
| Удельная теплоемкость газа аммиака cp при 15 °C | 2,175 кДж/(кг*°C) |
| Показатель (коэффициент) адиабаты газа аммиака cp/cv при 15 °C | 1.3 |
| Теплопроводность жидкого аммиака при -23 °C | 592*106 кВт/(м*°C) |
| Теплопроводность жидкого аммиака при 27 °C | 477*106 кВт/(м*°C) |
| Теплопроводность жидкого аммиака при 127 °C | 207*106кВт/(м*°C) |
| Теплопроводность газа аммиака при 0oC = 32oF | 0.026 Вт/мoC, 0.015 БТЕ/(час*фут*oF) |
| Температура кипения аммиака | -28oF, -33.3oC |
| Удельная теплота парообразования аммиака при температуре кипения | 1373 кДж/кг, 589.3 БТЕ/фунт |
| Температура замерзания (таяния) аммиака | -77.7oC, -107.9 oF |
| Удельная теплота плавления аммиака(таяния) | 332,3 кДж/кг, 143.0 БТЕ/фунт |
| Критическая температура аммиака — температура при которой жидкая фаза существовать уже не может | 271.4oF, 132.5oC |
| Критическое давление аммиака — давление насыщенных паров при критической температуре | 11.4 (MН/м2=МПа), 1650 psia |
| Критический удельный объем аммиака – объем вещества в его критическом состоянии, когда теряется различие в свойствах между жидкостью и ее паром | 0.00424 м3/кг, 0.068 футов3/фунт |
| Растворимость газа аммиака в воде при 0oC = 32oF. Размерность : объем газа/объем воды | 862 |
| Токсичность аммиака | опасен Аммиак относится к токсическим веществам. По ГОСТ 12.1.005-88 аммиак относится к IV классу опасности. Действие газообразного аммиака на человека характеризуется следующими показателями в мг/куб. м: порог восприятия обонянием ………………………….. 35 можно терпеть несколько часов без серьезных последствий … 70 немедленное раздражение горла ………………………. 280 немедленное раздражение глаз, обильное слезотечение и боль …………………………………………….. 490 ларингоспазм, сильные приступы кашля, головокружение, боль в желудке, рвота. После этого в течение нескольких часов могут наблюдаться непроизвольные глотательные движения. Ларингоспазм может привести к мгновенной неспособности дыхания. Затруднение дыхания будет наблюдаться в течение нескольких часов. Возможен отек легких ……………………………………… 1200 получасовая экспозиция может быть смертельной ……….. 1700 смерть в результате прекращения дыхания и сердечной слабости ………………………………….. 3000 — 3500 Жидкий аммиак вызывает ожоги, а его пар — эритемы кожи. Предельно допустимые концентрации аммиака (ПДК), мг/куб. м: в воздухе рабочей зоны производственного помещения ….. 20 в атмосферном воздухе территории промышленного предприятия ……………………………………… 7 в атмосферном воздухе населенного пункта ……………. 0,2 в воде рыбохозяйственных водоемов ………………….. 0,05 в воде водоемов санитарно — бытового назначения (по азоту) ……………………………………. 2 мг/л. |
| Воспламеняемость, температура самовоспламенения, взрывоопасность аммиака | Газ горючий. Температура его самовоспламенения в стальной бомбе, обладающей каталитическим действием, равна 650°С, теплота сгорания равна 20790 кДж/кг (4450 ккал/кг), минимальная энергия зажигания равна 680 мДж. Смесь аммиака с воздухом становится горючей при содержании в смеси 15-28 об.% аммиака (нижний и верхний концентрационные пределы распространения пламени). С увеличением температуры пределы распространения пламени расширяются и при 100°С они лежат в интервале 14,5-29,5 об.% аммиака.жидкость — прекращает горение при прекращении кипения ( тепла от сгорания паров недостаточно для поддержания горения) — трудногорючая В связи с низкой нормальной скоростью горения аммиачновоздушной смеси, составляющей всего 0,1 м/сек., аммиак не способен к диффузионному горению, то есть гаснет при удаленииисточника поджигания. При поджигании аммиака в неограниченном объеме ударная взрывная волна, способная причинить разрушения, не образуется. Однако аммиак является горючим газом и при его сгорании (с воздухом или кислородом) внутри замкнутого объема (оборудования или помещения) давление может повыситься в 6 раз, вызвав разрушение оборудования или здания и ударную волну от расширения сжатых продуктов сгорания. Поэтому для помещений, в которыхобращается аммиак, по пожарной опасности в соответствии с ОНТП 24 — 86 устанавливается категория A, наружные установки не категорируются.По ПУЭ взрывоопасные зоны с аммиаком внутри помещения имеют класс B-1б, на наружных установках — B-1г. Аммиачно — воздушная смесь по взрывоопасности относится к категории — 11A и группе — T1. |
| Взрывоопасные соединения аммиака | Контакт аммиака с ртутью, хлором, йодом, бромом, кальцием, окисью серебра и некоторыми другими химическими веществами может привести к образованию взрывчатых соединений. |
| Коррозионные свойства аммиака. | Аммиак взаимодействует с медью, цинком и их сплавами, особенно в присутствии воды; растворяет обычную резину. Стали в жидком аммиаке с содержанием воды меньше 0,2% веса в присутствии кислорода могут подвергаться коррозионному растрескиванию при температуре эксплуатации до минус 20 град. C |
Источник: https://tehtab.ru/Guide/GuideMedias/Ammonia/AmmoniaProperties/
Разница между аммиаком и аммонием
Аммиак и аммоний являются азотсодержащими соединениями. Оба являются многоатомными соединениями, которые состоят из более чем двух атомов на молекулу или ион. Аммоний получают из аммиака.
Аммиак можно найти в виде газа, в то время как аммоний можно найти во всех трех фазах вещества. Хотя они имеют почти одинаковый химический состав, существует много различий между аммиаком и аммонием.
Основное различие между аммиаком и аммонием заключается в том, что аммиак является нейтральным соединением, тогда как аммоний является катионом.
Ключевые области покрыты
1. Что такое аммиак — определение, химическая структура, свойства 2. Что такое аммоний — определение, химическая структура, свойства 3. Каковы сходства между аммиаком и аммонием — Краткое описание общих черт 4. В чем разница между аммиаком и аммонием — Сравнение основных различий
- Ключевые термины: аммиак, аммоний, аммониевая соль, азан, азан, катион, одиночная пара, многоатомный
Что такое аммиак
Аммиак представляет собой неорганическое соединение, имеющее химическую формулу NH3, Это газообразное соединение. Молярная масса аммиака составляет 17,031 г / моль. Это соединение является щелочным и имеет характерный едкий запах. ИЮПАК название аммиака azane.
Геометрия аммиака является тригональной пирамидальной. Здесь тригональная пирамида состоит из трех N-H связей и неподеленной электронной пары на атоме азота. Хотя угол связи молекулы с типичной тригональной пирамидальной структурой составляет 109оиз-за наличия неподеленной пары угол связи в молекуле аммиака был уменьшен до 107о.
Рисунок 1: Химическая структура аммиака
Температура плавления аммиака составляет -77,73.оС и точка кипения составляет около -33,34оC. Принимая во внимание плотность аммиака, он легче воздуха.
Поскольку в этом соединении присутствуют N-H связи, аммиак легко превращается в жидкий аммиак. Это связано с тем, что связи N-H могут образовывать прочные водородные связи друг с другом.
Когда жидкий аммиак замерзает до точки плавления, он начинает образовывать белые кристаллы.
Аммиак смешивается с водой благодаря способности образовывать водородные связи с молекулами воды. Кипящий водный раствор аммиака может вытеснить аммиак из воды, поскольку аммиак имеет очень низкую температуру кипения по сравнению с температурой кипения воды. Аммиак может подвергаться сгоранию в присутствии кислорода. Сжигание аммиака можно наблюдать как пламя бледно-желтого цвета.
Что такое аммоний
Аммоний представляет собой катион, имеющий химическую формулу NH4+, Ион аммония представляет собой неорганический ион, состоящий из одного атома азота и четырех атомов водорода. У этого есть четыре N-H связи. Ион аммония является многоатомным. Молярная масса этого катиона составляет 18,039 г / моль. Название IUPAC аммоний-иона azanium.
Ион аммония имеет тригональную пирамидальную структуру. Здесь четыре N-H связи расположены в тригональной пирамидальной структуре.
Поскольку в этой молекуле все связи одинаковы, угол связи составляет 109о, Молекула образуется, когда одиночная пара на атоме азота молекулы аммиака передается протону.
Протон заставляет молекулу иметь положительный заряд. Степень окисления азота иона аммония составляет -3.
Рисунок 2: Химическая структура иона аммония
Ион аммония слабокислый. Может реагировать с основаниями и образовывать газообразный аммиак. Когда аммиак растворяется в воде, он может образовывать ионы аммония. Это равновесная реакция, которая сильно зависит от рН раствора. Реакция следующая.
ЧАС2O + NH3 ⇌ ОН− + NH+4
Ион аммония обычно можно найти в солях аммония. Соль аммония представляет собой химическое соединение, состоящее из катиона аммония и неорганического аниона. Некоторые примеры солей аммония включают хлорид аммония, сульфат аммония и карбонат аммония. Эти солевые соединения хорошо растворимы в воде.
Сходства между аммиаком и аммонием
- Оба соединения состоят из атомов азота и водорода
- Оба являются многоатомными соединениями
- Атом азота имеет +3 степень окисления в обоих соединениях
- Оба имеют треугольную пирамидальную геометрию
Определение
Аммиак: Аммиак представляет собой неорганическое соединение, имеющее химическую формулу NH3.
Аммоний: Аммоний представляет собой катион, имеющий химическую формулу NH4+.
Одинокие электронные пары
Аммиак: Аммиак имеет одиночную электронную пару.
Аммоний: Ион аммония не имеет одиночных электронных пар.
IUPAC
Аммиак: ИЮПАК название аммиака azane.
Аммоний: Название IUPAC аммоний-иона azanium.
Природа
Аммиак: Аммиак является щелочным соединением.
Аммоний: Ион аммония слабокислый.
Угол скрепления
Аммиак: Угол связи в аммиаке составляет 107 °.
Аммоний: Угол связи в ионе аммония составляет 109 °.
Молярная масса
Аммиак: Молярная масса аммиака составляет 17,031 г / моль.
Аммоний: Молярная масса иона аммония составляет 18,039 г / моль.
Электрический заряд
Аммиак: Аммиак является нейтральным соединением.
Аммоний: Ион аммония имеет +1 электрический заряд.
Заключение
Аммиак и аммоний являются двумя родственными соединениями, состоящими из атомов азота и водорода. Ион аммония получен из аммиака. Основное различие между аммиаком и аммонием заключается в том, что аммиак является нейтральным соединением, тогда как аммоний является катионом.
Рекомендации:
1. «Аммоний». Национальный центр биотехнологической информации. База данных PubChem Compound, Национальная медицинская библиотека США,
Источник: https://ru.strephonsays.com/difference-between-ammonia-and-ammonium




