Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
- В общем виде процесс электролитической диссоциации можно представить так:
- KA ⇄ K+ (катион) + A- (анион)
- NaCl ⇄ Na+ + Cl-

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

- Для средних солей диссоциация чаще всего происходит в одну ступень:
- Na3PO4 ⇄ 3Na+ + PO43-
- Из одной молекулы ортофосфата натрия образовалось 4 иона.
- K2SO4 ⇄ 2K+ + SO42-
- Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.

Источник: https://studarium.ru/article/159
Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2.В растворе или расплаве электролитов ионы движутся хаотически.
При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
К катионам относятся: ион водорода Н+, ион аммония NH4+, ионы металлов Na+, K+ , Fe2+, Al3+, катионы основных солей CuOH+, Аl(ОН)2+, FeOH2+ и т. д.
К анионам относятся: гидроксид-ион ОН—, ионы кислотных остатков Сl—, NO3—, SO42-, Cr2O72-, анионы кислых солей НСО3—, Н2РО4—, HPO42- и т. д.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:

Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями.
Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно.
Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
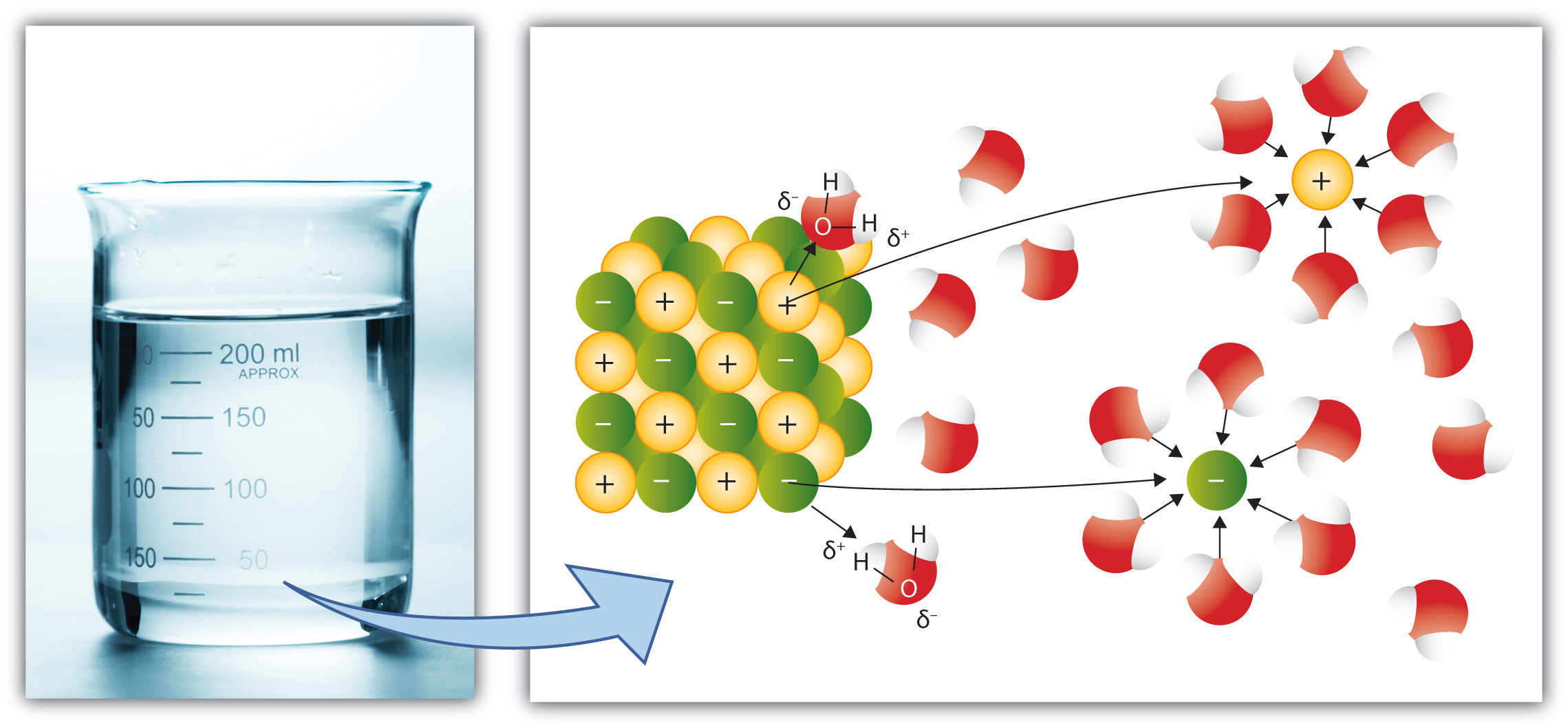
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Сl—, отрицательные полюсы — к положительным ионам Na+ .
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.

II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O.
Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.

Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:

Для простоты в химических уравнениях ионы изображают без молекул воды: Н+ , Ag+, Mg2 +, F—, SO42- и т. д.
Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na+ и хлорид-ионы Сl— не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы.
Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и р-элементов обычно бесцветны. Так, бесцветны ионы Н+, Na+, K+ , Ва2 +, Аl3+ и др. Ионы некоторых d-элементов имеют окраску.
Окраска гидратированных и негидратированных ионов одного и того же d-элемента может быть различной.
Например, негидратированные ионы Cu2+ — бесцветные, а гидратированные ионы меди Cu2+ • 4Н2О — синего цвета
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
- где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
- Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:

- Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%).
К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.
); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами.
Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:
где [Аm+], [Bn— ] — равновесные концентрации ионов Аm+ и Bn—, [АnВm] — равновесная концентрация недиссоциированных молекул АnВm.
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:

Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.
Значение электролитов для живых организмов
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия Na+, калия K+ , кальция Са2+, магния Mg2+, водорода Н+ , анионы ОН— , Сl—, SO42-, НСО3— имеют большое значение для физиологических и биохимических процессов.
Концентрации различных ионов в организме человека различны. Концентрации ионов водорода Н+ и гидроксид-ионов ОН— очень малы, но они играют большую роль в жизненных процессах.
Ионы водорода Н+ способствуют нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д. Концентрации ионов натрия Na+ и хлорид-ионов Cl— в организме человека весьма значительны. Эти ионы человек получает ежедневно, используя в пищу поваренную соль NaCl.
В медицине применяется 0,85%-ный раствор хлорида натрия в качестве физиологического раствора при большой потере жидкости организмом.
Источник: https://al-himik.ru/jelektroliticheskaja-dissociacija-stepen-i-konstanta-dissociacii/
Электролитическая диссоциация
 В начале XIX века была замечена способность растворов многих веществ проводить электрический ток (была обнаружена Майклом Фарадеем). Исследование электропроводности растворов показало, что растворы и расплавы многих веществ (например, поваренной соли) проводят электрический ток. Зато дистиллированная вода, кристаллические вещества и растворы некоторых других веществ (например, сахарозы) не проводит электрический ток – лампочка не горит, если замкнуть цепь.
В начале XIX века была замечена способность растворов многих веществ проводить электрический ток (была обнаружена Майклом Фарадеем). Исследование электропроводности растворов показало, что растворы и расплавы многих веществ (например, поваренной соли) проводят электрический ток. Зато дистиллированная вода, кристаллические вещества и растворы некоторых других веществ (например, сахарозы) не проводит электрический ток – лампочка не горит, если замкнуть цепь.
Вещества, которые проводят электрический ток назвали электролитами, вещества, непроводящие ток – неэлектролиты. Электролиты делятся на сильные и слабые. Сильные хорошо проводят ток, лампочка горит ярко, слабые – плохо проводят ток, лампочка горит тускло, например, в растворе уксусной кислоты (см. рисунок).
В чем же причина электропроводности? Почему одни вещества проводят электрический ток, а другие нет?
Электрический ток – это направленно движение заряженных частиц под действием разности потенциалов. Электрический ток в металлах осуществляется за счет электронов, именно электроны являются носителями заряда. А в растворах и расплавах заряд переносят ионы. Вещества, которые распадаются на ионы в растворе или расплаве и проводят электрический ток называются электролитами.
Запомнить! Электролиты – вещества, которые проводят электрический ток в растворах. Электролиты в растворах распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам. Это и есть причина электрического тока в растворах.
Химическая связь в электролитах — ионная или ковалентная сильнополярная (соли, кислоты, основания).
Неэлектролиты – вещества, которые не проводят электрический ток в растворах. Связь в таких веществах — ковалентная неполярная и слабополярная. При растворении они образуют не ионы, а молекулы, которые не способны переносить электрический ток, например, органические вещества (сахароза, бензин, спирт).
Теория электролитической диссоциации была сформулирована Сванте Аррениусом в 1887 году, но актуальна и по сей день. Основные положения этой теории:
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Под действием электрического тока катионы двигаются к катоду (-), а анионы – к аноду (+).
- Электролитическая диссоциация — процесс обратимый.
- Сила электролита ( на сколько полно происходит распад на ионы) определяется степенью диссоциации, обозначается α (альфа) . Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). Изменяется от 0 до 1, или в прощентах от 0 до 100% 0 означает – совсем не распадается на ионы, 1 или 100% — все молекулы распались на ионы.
- Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации.
- В зависимости от значения степени диссоциации, электролиты можно разделить на сильные, средние и слабые.

- Сильные электролиты имеют степень диссоциации α > 30%, средние от 3 – 30%, а слабые – меньше 3%.
К сильным относят все раств. соли, все щелочи и некоторые кислоты. В растворе эти соединения практически полностью распадаются на ионы.
При написании уравнений диссоциации помните, что суммарный заряд катионов и анионов должен быть равен нулю.
Эти реакции распада на ионы протекают необратимо (только в одну сторону), ионы обратно не соединяются в кристаллическую решетку, препятствуют молекулы воды, окружающие эти ионы (гидратные оболочки).
К электролиам средней силы относят гидроксид магния, сернистую и фосфорную кислоты.
К слабым электролитам, которые лишь частично распадаются на ионы, α < 3%, относят гидроксид аммония, угольную кислоту, сероводородную, уксусную кислоты и воду. Диссоциация слабых электролитов – обратимые процесс.

Источник: http://himege.ru/elektroliticheskaya-dissociaciya/
1.4.5 Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Видеоурок: Классификация и свойства растворов электролитов
- Лекция: Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Электролитическая диссоциация
Вам уже известно, что химические связи между атомами могут быть ионными, ковалентными, металлическими и водородными. Большинство химических реакций протекает в растворах. И как поведет себя вещество в этих растворах зависит от характера названных связей.
На уроках физики вы узнали, что некоторые вещества способны проводить электрический ток. Эта способность определяется наличием в их молекулах заряженных ионов. К таким веществам относятся растворы кислот, солей, оснований и называются они электролитами.
Эти вещества образуют ионную и сильно полярную ковалентную связи. Вещества, не относящиеся ни к одной из перечисленных групп, являются неэлетролитами. К ним можно отнести: простые вещества, оксиды, органические вещества (к примеру, спирты, углеводороды, углеводы, хлорпроизводные углеводородов).
Эти вещества образуют неполярные или малополярные ковалентные связи.
Под электролитической диссоциацией следует понимать распад вещества на свободные ионы при его растворении в воде.

Автором теории электролитической диссоциации является шведский физик и химик Сванте Аррениус. Его основная идея заключается в том, что под действием воды как растворителя электролиты распадаются на свободные ионы, переносящие электрический заряд:
- «+» — катион;
- «—» — анион.

Помните, реакция электролитической диссоциации относится к обратимым. Прямая реакция называется электролитической диссоциацией, а обратная – моляризацией.
Число молекул, распавшихся на ионы показывает степень диссоциации, которая обозначается буквой альфа – α. Зависит она от природы реагентов, их концентрации и t.
Степень диссоциации вычисляется по формуле a = n / N, где n – это число распавшихся ионов, N – число молекул.
Сильные и слабые электролиты
Если перед нами вещества, чьи молекулы отлично распадаются на ионы, то мы имеем дело с сильными электролитами. А те, чьи молекулы мало распадаются на ионы являются слабыми.
К сильным относятся:
- HCl, HBr, HClO4, H2SO4 и другие сильные кислоты;
- LiOH, NaOH, RbOH и другие щелочи;
- Ba(OH)2,Ca(OH)2 и другие гидроксиды щелочноземельных металлов;
- Все соли, растворимые в воде
К слабым электролитам относятся:
- Вода;
- Почти все органические кислоты (CH3COOH, C2H5COOH), некоторые неорганические кислоты (H2CO3, H2S)
- Малорастворимые в воде соли (Ca3(PO4)2)
- Малорастворимые основания и гидроксид аммония; Cu(OH)2; Al(OH)3; NH4OH).
Условная степень диссоциации сильных электролитов: α>30%; а слабых: α
Источник: https://cknow.ru/knowbase/758-145-elektroliticheskaya-dissociaciya-elektrolitov-v-vodnyh-rastvorah-silnye-i-slabye-elektrolity.html
Электролитическая диссоциация веществ
Все вещества делятся на те, которые проводят электрический ток и те, которые не проводят, проще говоря, на электролиты и неэлектролиты.

Электролиты — вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток.
Неэлектролиты — вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят.
| Электролиты | Неэлектролиты |
Т.е. вещества с металлической, ионной и ковалентной полярной связью |
т.е. вещества ковалентными неполярными или малополярными связями. |
- Распад электролитов на ионы при растворении их в воде называется
- электролитической диссоциацией.
- Как происходит электролитическая диссоциация веществ?
Молекулы воды полярны.
Когда в воду попадает вещество, само имеющее положительные и отрицательные заряды, то между зарядами вещества и водой возникают силы притяжения .
Притяжение между зарядами внутри кристаллической решетки ослабевает.
Эти заряды переходят в раствор в виде гидратированных ионов, частиц, связанных с молекулами воды.

- Электролитическая диссоциация веществ — процесс обратимый,
- в растворах электролитов наряду с их ионами присутствуют и молекулы.
- Поэтому растворы электролитов характеризуются степенью диссоциации.
Степень диссоциации — это отношение числа распавшихся на ионы молекул N’ к общему числу растворенных молекул N:
- если количество ионов больше, то α близка к 1 — ионов в растворе больше, чем молекул — значит, вещество — сильный электролит;
- если молекул больше, чем ионов, значит, вещество неохотно диссоциирует — слабый электролит.
| Сильные электролиты | слабые электролиты |
| 1) кислоты:
Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4 H2Cr2O7
|
Н2SO3 H2СО3, Н2S, НNO2, HClO, H2SiO3 3) основания: NH4OH, мало-и нерастворимые основания |
- в ЕГЭ это вопрос А22 — Ионный обмен и диссоциация
- в ГИА (ОГЭ) это А7 — Электролиты и неэлектролиты
Обсуждение: «Электролитическая диссоциация веществ»
(Правила комментирования)
Источник: https://distant-lessons.ru/elektroliticheskaya-dissociaciya-veshhestv.html
Теория электролитической диссоциации
Статьи
Основное общее образование
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Что такое электролитная диссоциация? В следствие чего она образуется и какие факторы влияют на ее степень? Как научиться составлять уравнения диссоциации? Кто открыл способность некоторых растворов проводить электрический ток и почему великий русский химик Д.И.Менделеев не получил Нобелевской премии?
Ответы на все эти вопросы вы узнаете из этой статьи.
26 апреля 2019
Изучение растворов с давних времен занимало умы исследователей. В начале XIX века М. Фарадей открыл способность некоторых растворов проводить электрический ток.
Геймгольц, немецкий физик, предположил, что электролиты в растворе полностью распадаются на ионы, то есть существует электролитическая диссоциация.
Однако увеличение электропроводности с уменьшением концентрации раствора объяснить не смог.
Ученые заметили, что растворы замерзают при более низкой температуре, чем чистые растворители. Именно этим свойством растворов и в наше время пользуются дворники, щедро посыпая солью обледеневшие тротуары. Однако, температура замерзания электролитов не соответствовала расчетным данным.
Научным несостыковкам требовалось найти объяснение. И молодой, 29-летний шведский ученый С. Аррениус, в 1887 г. исследуя проведение электрического тока в растворах различных веществ, выдвинул теорию, которая могла объяснить эти факты.
Основные положения теории электролитической диссоциации
- Химические субстанции делятся на электролиты — вещества, которые проводят электрический ток, и неэлектролиты. К электролитам относится большинство сложных неорганических веществ: кислоты, основания, соли. К неэлектролитам — большинство органических веществ.
- В воде электролиты распадаются на ионы: положительно заряженные катионы и отрицательно заряженные анионы. Ионы бывают простые и сложные. В растворе ионы находятся в хаотическом движении.
- Под действием электрического тока движение ионов упорядочивается, и катионы движутся к отрицательному полюсу — катоду, анионы к положительному аноду.
- На степень электролитической диссоциации влияют различные факторы: природа растворенного вещества и его количество, свойства растворителя, температура раствора.

Степень диссоциации
- В ходе научных исследований ученые определили, что в растворе диссоциирует некоторая часть молекул растворителя. Для количественной характеристики силы электролита был введен показатель степени диссоциации, который обозначается α и рассчитывается по формуле
- α = ν / ν0.
- Где ν — количество вещества, распавшееся на ионы,
- ν0 — общее количество вещества.
Степень диссоциации также можно выразить в процентах. Как это сделать, можно узнать в § 11 учебника «Химия. 9 класс» под редакцией В.В. Еремина.
В зависимости от степени диссоциации вещества делят на сильные и слабые электролиты.
Сильные электролиты представляют собой вещества, которые в разбавленных растворах практически полностью распадаются на ионы. Степень диссоциации более 0.5, или 50%.
Для слабых электролитов значение степени диссоциации α меньше 0.1, или 10%.
Вещества с промежуточными значениями от 10 до 50% иногда называют средними электролитами.
Уравнение диссоциации
- Уравнение электролитической диссоциации используют для записи процессов, происходящих в растворе.
- Диссоциация сильного электролита протекает практически необратимо, что показывает стрелка →.
- NaCl → Na+ + Cl-
- CaCl2 → Ca2+ + 2Cl-
- Диссоциация слабого электролита — обратимый процесс, протекает не полностью и не до конца, что обозначает стрелка ⇄
- СH3COOH ⇄ СH3COO- + H+
Умение составлять уравнения диссоциации будет отличным подспорьем при разборе темы «§ 13.
Реакции ионного обмена и условия их протекания» в учебнике «Химия. 9 класс» под редакцией В.В. Еремина и для решения ионных уравнений.
Противостояние титанов
Теория электролитической диссоциации Аррениуса вызвала жаркие споры среди ученых.
Химический мир разделился на два лагеря. Сторонники «физической» теории Аррениуса считали, что распад на ионы происходит без какого-либо воздействия сил внешней среды и раствор представляет собой механическую взвесь ионов и молекул воды.
Но эта теория не могла объяснить тепловые эффекты при растворении. Например, нагревание колбы при разведении в воде серной кислоты или покрытие сосуда инеем при растворении в воде аммиачной селитры или азотнокислого аммония.
Сторонники «химической», или гидратной, теории, автором которой был Д.И. Менделеев, считали, что в растворе происходит взаимодействие растворенного вещества и растворителя.
Много копий было сломано в этой борьбе. Проявились худшие человеческие качества. Так, Аррениус, пользуясь служебным положением (в 1905 году он был назначен директором физико-химического Нобелевского института в Стокгольме), приложил массу усилий, чтобы, несмотря на трехкратную номинацию на получение Нобелевской премии в 1905, 1906 и 1907 годах, Д.И. Менделеев так ее и не получил.
Но истина, как всегда, оказалась посередине: в ходе дальнейших экспериментов ученые выяснили, что растворитель и растворенное вещество, взаимодействуя между собой, дают необходимую энергию для разрушения кристаллической решетки электролитов. В споре великих умов родилась новая протолитическая, или протонная, теория кислот и оснований.
#ADVERTISING_INSERT#
Источник: https://rosuchebnik.ru/material/teoriya-elektroliticheskoy-dissotsiatsii/
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты.
К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl—. В воде этот кристалл распадается на структурные единицы-ионы.
При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl— вступают во взаимодействие с молекулами воды.
В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия).
Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na+ + Cl–
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H+ + Cl—.
- При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
- Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
- α=Nпродисс/Nисх, где:
- Nпродисс — это число продиссоциировавших молекул,
- Nисх — это исходное число молекул.
- По степени диссоциации электролиты делят на делят на сильные и слабые.
- Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е.
степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ.
В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
Источник: https://chemege.ru/ted/
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
Как известно из курса физики, электрическим током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными c ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Кроме металлов, существуют также вещества растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которых проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся попеременно в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, т.е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии.
Поэтому для того, чтобы хлорид натрия смог проводить электрический ток, его необходимо расплавить, т.е. превратить в жидкость.
В результате сообщения энергии кристаллу хлорида натрия в виде большого количества теплоты частично разрушаются ионные связи Na+Cl− , т.е. происходит диссоциация на свободные подвижные ионы:
Na+Cl− ↔ Na+ + Cl−
Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации, в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:
или более упрощенно:
NaCl ↔ Na+ + Cl−(участвующие в гидратации кристалла NaCl и ионов молекулы воды не записываются)
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными.
Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается молекулами воды, но выделяющаяся в результате этого энергия недостаточна отрыва ионов Ba2+ и SO42- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов. Например:
NaOH = Na+ + OH−
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты.
Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации. Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул.
Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
- Гидратация катионов водорода настолько сильна, что можно говорить не просто о катионе водорода, окружённом молекулами воды (как это было с катионами натрия), а о полноценной частице – ионе гидроксония H3O+, содержащей три полноценные ковалентные связи H-О, одна из которых образована по донорно-акцепторному механизму. Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:
- H2O + HCl = H3O+ + Cl−
- Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды.
- HCl = H+ + Cl−
- Диссоциация многоосновных кислот протекает ступенчато, например:
- H3PO4 ↔ H+ + H2PO4−
- H2PO4− ↔ HPO42- + H+
- HPO42- ↔ PO43- + H+
- Таким образом, как мы уже выяснили, к электролитам относят: соли, кислоты и основания.
- Для описания способности электролитов к электролитической диссоциации используют величину, которая называется степенью диссоциации (α).
- Степень диссоциации – отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.
- По степени диссоциации электролиты делят на сильные (α>30%), средней силы (30%> α>3%) и слабые (α30%)
средней силы (30%> α>3%) слабые (α Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/jelektroliticheskaja-dissociacija-jelektrolitov-v-vodnyh-rastvorah




