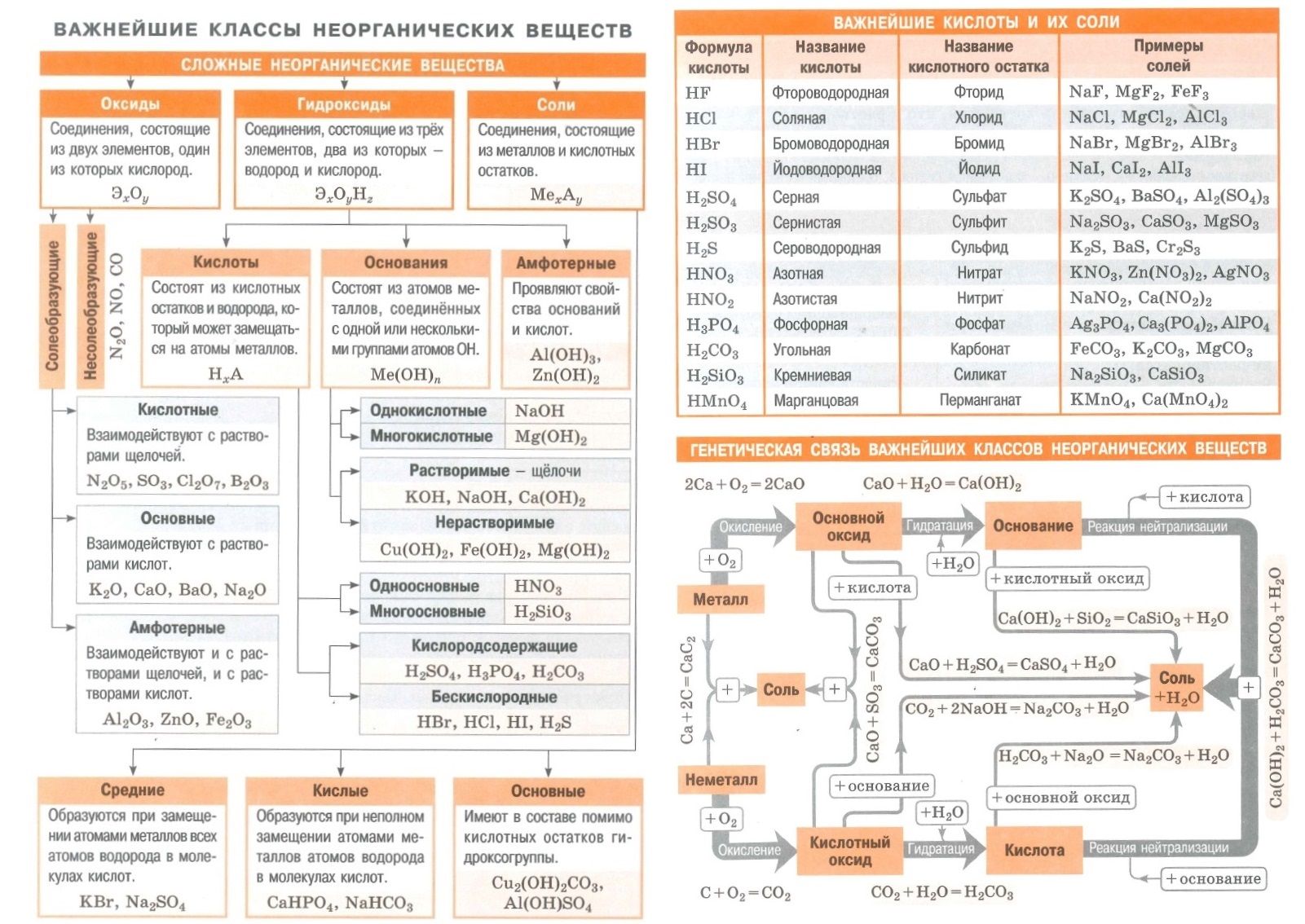
 Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты.
Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода.
Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pKb. Например, для аммиака NH3 имеем:
Получение
- 2Na + 2H2O → 2NaOH + H2
- Ca + 2H2O → Ca(OH)2 + H2
- Mg + 2H2O Mg(OH)2 + H2
- Na2O + H2O → 2NaOH,
- CaO + H2O → Ca(OH)2.
- 2NaCI + 4H2O 2NaOH + 2H2 + CI2
- Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
- MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.

Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
- Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
- фенолфталеин – малиновый
- лакмус – синий
- метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
- 2KOH + H2SO4 → K2SO4 + 2H2O,
- растворимое
- Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
- нерастворимое
- 2KOH + SO3 → K2SO4 + H2O
- а) при плавлении:
- 2NaOH + AI2O3 → 2NaAIO2 + H2O,
- NaOH + AI(OH)3 → NaAIO2 + 2H2O.
- б) в растворе:
- 2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
- NaOH + AI(OH)3 → Na[AI(OH)4].
- 2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
- 2NaOH + Si + H2O → Na 2SiO3 + 2H2
- 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
- Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
- Ca(OH)2 → CaO + H2O,
- Cu(OH)2 → CuO + H2O.
Источник: https://in-chemistry.ru/osnovaniya-gidroksidy
Основания
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.

Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3. В таких случаях валентность указывается в скобках после названия – гидроксид железа (II), гидроксид железа (III).
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Рис. 1. Щёлочи в твёрдом состоянии.
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs). Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы – кальций (Ca), стронций (Sr) и барий (Ba). Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.
Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Основные химические свойства оснований описаны в таблице.
| Реакции | Что образуется | Примеры |
| С кислотами | Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами | Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
| Разложение при высокой температуре | Оксид металла и вода | 2Fe(OH)3 → Fe2O3 + 3H2O |
| С кислотными оксидами (реагируют щёлочи) | Соль | NaOH + CO2 → NaHCO3 |
| С неметаллами (вступают щёлочи) | Соль и водород | 2NaOH + Si + H2O → Na2SiO3 +H2↑ |
| Обмена с солями | Гидроксид и соль | Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
| Щелочей с некоторыми металлами | Сложная соль и водород | 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин – малиновым, метилоранж – жёлтым.
Рис. 3. Реакция индикаторов на основания.
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые.
Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи.
Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Средняя оценка: 4.5. Всего получено оценок: 487.
Источник: https://obrazovaka.ru/himiya/osnovaniya-8-klass.html
Физические и химические свойства оснований
ОПРЕДЕЛЕНИЕ
- Основания называются электролитами, при диссоциации которых из отрицательных ионов образуются только ионы ( mathrm{OH} ):
- ( mathrm{Fe}(mathrm{OH}) 2 leftrightarrow mathrm{Fe} 2++2 mathrm{OH}- );
- ( mathrm{NH} 3+mathrm{H} 2 mathrm{O}
ightarrow mathrm{NH} 4 mathrm{OH} leftrightarrow mathrm{NH} 4++mathrm{OH}- ).
Все неорганические основания классифицируются на водорастворимые (щелочи) — ( mathrm{NaOH} ), ( mathrm{KOH} ) и нерастворимые в воде ( (mathrm{Ba}(mathrm{OH}) 2, mathrm{Ca}(mathrm{OH}) 2) ). В зависимости от их химических свойств среди оснований выделяются амфотерные гидроксиды.
- Химические свойства оснований
- Когда индикаторы действуют на растворы неорганических оснований, их цвет меняется, так что, когда база попадает в раствор, лакмусовая бумажка приобретает синий цвет, метиловый оранжевый становится желтым, а фенолфталеин становится малиновым.
- Неорганические основания способны реагировать с кислотами с образованием соли и воды, а нерастворимые в воде основания взаимодействуют только с водорастворимыми кислотами:
- ( mathrm{Cu}(mathrm{OH}) 2 downarrow+mathrm{H} 2 mathrm{SO} 4=mathrm{CuSO} 4+2 mathrm{H} 2 mathrm{O} );
- ( mathrm{NaOH}+mathrm{HCl}=mathrm{NaCl}+mathrm{H} 2 mathrm{O} ).
- Водонерастворимые основания термически нестабильны, то есть при нагревании они разлагаются с образованием оксидов:
- ( 2 mathrm{Fe}(mathrm{OH}) 3=mathrm{Fe} 2 mathrm{O} 3+3 mathrm{H} 2 mathrm{O} );
- ( mathrm{Mg}(mathrm{OH}) 2=mathrm{MgO}+mathrm{H} 2 mathrm{O} ).
- Alkalis (водорастворимые основания) взаимодействуют с кислотными окислами с образованием солей:
- ( mathrm{NaOH}+mathrm{CO} 2=mathrm{NaHCOZ} ).
- Alkalis также способны вступать в реакцию взаимодействия (IDR) с некоторыми неметаллами:
- ( 2 mathrm{NaOH}+mathrm{Si}+mathrm{H} 2 mathrm{O}
ightarrow mathrm{Na} 2 mathrm{SiO} 3+mathrm{H} 2 uparrow ). - Некоторые основания вступают в обменные реакции с солями:
- ( (0 mathrm{H}) 2+mathrm{Na} 2 mathrm{S} 04=2 mathrm{NaOH}+mathrm{BaSO} 4downarrow ).
- Амфотерные гидроксиды (основания) также обладают свойствами слабых кислот и реагируют с щелочами:
- ( mathrm{Al}(mathrm{OH}) 3+mathrm{NaOH}=mathrm{Na}[mathrm{Al}(mathrm{OH}) 4] ).
- Амфотерные основания включают алюминий, гидроксиды цинка. хром (III) и другие
- Физические свойства оснований
Большинство оснований — это твердые вещества, которые характеризуются разной растворимостью в воде. Алкалис — водорастворимые основания — чаще всего твердые вещества белого цвета.
Водонерастворимые основания могут иметь разные цвета, например, гидроксид железа (III) представляет собой коричневое твердое вещество, гидроксид алюминия представляет собой белое твердое вещество, а гидроксид меди (II) представляет собой синее твердое вещество.
- Получение оснований
- Базы получают по-разному, например, реакцией:
- — обмен
- ( mathrm{CuSO} 4+2 mathrm{KOH}
ightarrow mathrm{Cu}(mathrm{OH}) 2 downarrow+mathrm{K} 2 mathrm{SO} 4 ); - ( mathrm{K} 2 mathrm{CO} 3+mathrm{Ba}(mathrm{OH}) 2
ightarrow 2 mathrm{KOH}+mathrm{BaCO} 3downarrow ); - — взаимодействие активных металлов или их оксидов с водой
- ( 2 mathrm{Li}+2 mathrm{H} 2 mathrm{O}
ightarrow 2 mathrm{LiOH}+mathrm{H} 2 ); - ( mathrm{BaO}+mathrm{H} 20
ightarrow mathrm{Ba}(mathrm{OH}) 2 downarrow ); - — электролиз водных растворов солей
- ( 2 mathrm{NaCl}+2 mathrm{H} 20=2 mathrm{NaOH}+mathrm{H} 2 uparrow+mathrm{Cl} 2 uparrow ).
- Примеры решения проблем
- ПРИМЕР 1
Рассчитать практическую массу оксида алюминия (выход целевого продукта составляет 92%) путем реакции разложения гидроксида алюминия массой 23,4 г
Напишите уравнение реакции:
( 2 mathrm{Al}( ext { OH) } quad 3=mathrm{A} 1203+3 mathrm{H} 20 ).
Молярная масса гидроксида алюминия, рассчитанная с использованием таблицы химических элементов D.I. Менделеева — 78 г / моль. Найдите количество вещества гидроксида алюминия:
- ( mathrm{v}(mathrm{Al}(mathrm{OH}) 3)=mathrm{m}(mathrm{Al}(mathrm{OH}) 3) / mathrm{M}(mathrm{Al}(mathrm{OH}) 3) );
- ( mathrm{v}(mathrm{Al}(mathrm{OH}) mathrm{Z})=23,4 / 78=0,3 ) моль.
- Согласно уравнению реакции ( mathrm{v}(mathrm{Al}(mathrm{OH}) ext { 3): } mathrm{v}(mathrm{Al} 2 mathrm{O} 3)=2 : 1 ), поэтому количество вещества оксида алюминия будет:
- ( mathrm{v}(mathrm{A} | 2 mathrm{O} mathrm{Z})=0,5 imes mathrm{v}(mathrm{Al}(mathrm{OH}) 3) );
- ( mathrm{v}(mathrm{Al} 2 mathrm{O} mathrm{3})=0,5 imes 0,3=0,15 ) моль.
Молярная масса оксида алюминия, рассчитанная с использованием таблицы химических элементов D.I. Менделеева — 102 г / моль. Найти теоретическую массу оксида алюминия:
- ( mathrm{M}(mathrm{Al} 2 mathrm{O} 3) mathrm{th}=0,15 imes 102=15,3 mathrm{г} )
- Тогда практическая масса глинозема:
- ( mathrm{m}(mathrm{Al} 2 mathrm{O} 3) mathrm{pr}=mathrm{m}(mathrm{Al} 2 mathrm{O} 3) mathrm{th} imes 92 / 100 );
- ( mathrm{M}(mathrm{Al} 2 mathrm{O} 3) mathrm{np}=15,3 imes 0,92=14 mathrm{г} )
- Ответ Масса глинозема — 14 г.
- ПРИМЕР 2
- Выполнение серии преобразований:
- ( mathrm{Fe}
ightarrow mathrm{FeCl} 2
ightarrow mathrm{Fe}(mathrm{OH}) 2
ightarrow mathrm{Fe}(mathrm{OH}) 3
ightarrow mathrm{Fe}(mathrm{NO} 3) mathrm{Z} )
- Раствор Для получения хлорида железа из железа необходимо растворить его в соляной кислоте:
- ( mathrm{Fe}+2 mathrm{HCl}
ightarrow mathrm{FeCl} 2+mathrm{H} 2 uparrow ). - Чтобы получить соли железа (II) и соли железа (II), необходимо воздействовать на эту соль щелочью:
- ( mathrm{FeCl} 2+2 mathrm{NaOH}
ightarrow mathrm{Fe}(mathrm{OH}) 2+2 mathrm{NaCl} ). - Чтобы получить гидроксид железа (III) из гидроксида железа (II), необходимо уменьшить его железо:
- ( 4 mathrm{Fe}(mathrm{OH}) 2+2 mathrm{H} 2 mathrm{O}+mathrm{O} 2
ightarrow 4 mathrm{Fe}(mathrm{OH}) 3 downarrow ). - Чтобы получить соль железа (III) из гидроксида железа (III), необходимо обработать осадок гидроксида железа (III) соответствующей кислотой:
- ( mathrm{Fe}(mathrm{OH}) 3+3 mathrm{HNO} 3
ightarrow mathrm{Fe}(mathrm{NO} 3) quad 3+3 mathrm{H} 20 ).
Источник: https://sciterm.ru/spravochnik/fizicheskie-i-himicheskie-svojstva-osnovanij/
Свойства оснований
Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп. Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы.
По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Таблица 1 — Амфотерные гидроксиды
| Амфотерный гидроксид (основная и кислотная форма) | Комплексный ион | |
| Zn(OH)2 / H2ZnO2 | ZnO2 (II) | [Zn(OH)4]2– |
| Al(OH)3 / HAlO2 | AlO2 (I) | [Al(OH)4]–, [Al(OH)6]3– |
| Be(OH)2 / H2BeO2 | BeO2 (II) | [Be(OH)4]2– |
| Sn(OH)2 / H2SnO2 | SnO2 (II) | [Sn(OH)4]2– |
| Pb(OH)2 / H2PbO2 | PbO2 (II) | [Pb(OH)4]2– |
| Fe(OH)3 / HFeO2 | FeO2 (I) | [Fe(OH)4]–, [Fe(OH)6]3– |
| Cr(OH)3 / HCrO2 | CrO2 (I) | [Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания — твердые вещества различных цветов и различной растворимости в воде.
- Химические свойства оснований
- 1) Диссоциация: КОН + nН2О К+×mН2О + ОН–×dН2О или сокращенно: КОН К+ + ОН–.
- Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням:
- Fe(OH)2FeOH+ + OH– (1 ступень);
- FeOH+Fe2+ + OH– (2 ступень).
- 2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
- индикатор + ОН– (щелочь)окрашенное соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ZnO + H2O.
Таблица 2 — Температуры разложения некоторых гидроксидов металлов
| Гидроксид | tразл, °C | Гидроксид | tразл, °C | Гидроксид | tразл, °C |
| LiOH | 925 | Cd(OH)2 | 130 | Au(OH)3 | 150 |
| Be(OH)2 | 130 | Pb(OH)2 | 145 | Al(OH)3 | >300 |
| Ca(OH)2 | 580 | Fe(OH)2 | 150 | Fe(OH)3 | 500 |
| Sr(OH)2 | 535 | Zn(OH)2 | 125 | Bi(OH)3 | 100 |
| Ba(OH)2 | 1000 | Ni(OH)2 | 230 | In(OH)3 | 150 |
- 4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
- В растворе: 2Al + 2NaOH + 6H2O ® 2Na[Al(OH)4] + 3H2
- 2Al + 2OH– + 6H2О ® 2[Al(OH)4]– + 3H2.
- При сплавлении: 2Al + 2NaOH + 2H2O 2NaAlО2 + 3H2.
- 5) Взаимодействие щелочей с неметаллами:
- 6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
- 6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
- 2NaOH + СО2 ® Na2CO3 + H2O 2OH– + CO2 ® CO32– + H2O.
- В растворе: 2NaOH + ZnO + H2O ® Na2[Zn(OH)4] 2OH– + ZnO + H2О ® [Zn(OH)4]2–.
- При сплавлении с амфотерным оксидом: 2NaOH + ZnO Na2ZnO2 + H2O.
- 7) Взаимодействие оснований с кислотами:
- H2SO4 + Ca(OH)2 ® CaSO4¯ + 2H2O 2H+ + SO42– + Ca2+ +2OH– ® CaSO4¯ + 2H2O
- H2SO4 + Zn(OH)2 ® ZnSO4 + 2H2O 2H+ + Zn(OH)2 ® Zn2+ + 2H2O.
- 8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
- В растворе: 2NaOH + Zn(OH)2 ® Na2[Zn(OH)4] 2OH– + Zn(OH)2 ® [Zn(OH)4]2–
- При сплавлении: 2NaOH + Zn(OH)2 Na2ZnO2 + 2H2O.
- 9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
- CuSО4 + 2NaOH ® Na2SO4 + Cu(OH)2¯ Cu2+ + 2OH– ® Cu(OH)2¯.
- Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
- 2NaOH + ZnSО4 ® Na2SO4 + Zn(OH)2¯ Zn2+ + 2OH– ® Zn(OH)2¯.
- Щелочи получают:
- 1) Взаимодействием оксида металла с водой:
- Na2O + H2O ® 2NaOH CaO + H2O ® Ca(OH)2.
- 2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
- 2Na + H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2.
- 3) Электролизом растворов солей:
- 2NaCl + 2H2O H2 + 2NaOH + Cl2.
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2 + Na2CO3 ® 2NaOH + BaCO3¯ Ba2+ + CO32– ® BaCO3¯.
Л.А. Яковишин
Источник: http://sev-chem.narod.ru/spravochnik/teoriya/base.htm
2.5. Характерные химические свойства оснований и амфотерных гидроксидов
Прежде чем рассуждать о химических свойствах оснований и амфотерных гидроксидов, давайте четко определим, что же это такое?
1) К основаниями или основным гидроксидам относят гидроксиды металлов в степени окисления +1 либо +2, т.е. формулы которых записываются либо как MeOH , либо как Me(OH)2. Однако существуют исключения. Так, гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2 к основаниям не относятся.
2) К амфотерным гидроксидам относят гидроксиды металлов в степени окисления +3,+4, а также в качестве исключений гидроксиды Zn(OH)2, Be(OH)2, Pb(OH)2, Sn(OH)2. Гидроксиды металлов в степени окисления +4, в заданиях ЕГЭ не встречаются, поэтому рассмотрены не будут.
Химические свойства оснований
Все основания подразделяют на:
Напомним, что бериллий и магний к щелочноземельным металлам не относятся.
Помимо того, что щелочи растворимы в воде, они также очень хорошо диссоциируют в водных растворах, в то время как нерастворимые основания имеют низкую степень диссоциации.
Такое отличие в растворимости и способности к диссоциации у щелочей и нерастворимых гидроксидов приводит, в свою очередь, к заметным отличиям в их химических свойствах. Так, в частности, щелочи являются более химически активными соединениями и нередко способны вступать в те реакции, в которые не вступают нерастворимые основания.
Взаимодействие оснований с кислотами
Щелочи реагируют абсолютно со всеми кислотами, даже очень слабыми и нерастворимыми. Например:
Нерастворимые основания реагируют практически со всеми растворимыми кислотами, не реагируют с нерастворимой кремниевой кислотой:
Следует отметить, что как сильные, так и слабые основания с общей формулой вида Me(OH)2 могут образовывать основные соли при недостатке кислоты, например:
Взаимодействие с кислотными оксидами
Щелочи реагируют со всеми кислотными оксидами, при этом образуются соли и часто вода:
Нерастворимые основания способны реагировать со всеми высшими кислотными оксидами, соответствующими устойчивым кислотам, например, P2O5, SO3, N2O5, с образованием средних солей:
Нерастворимые основания вида Me(OH)2 реагируют в присутствии воды с углекислым газом исключительно с образованием основных солей. Например:
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O
С диоксидом кремния, ввиду его исключительной инертности, реагируют только самые сильные основания — щелочи. При этом образуются нормальные соли. С нерастворимыми основаниями реакция не идет. Например:
Взаимодействие оснований с амфотерными оксидами и гидроксидами
Все щелочи реагируют с амфотерными оксидами и гидроксидами. Если реакцию проводят, сплавляя амфотерный оксид либо гидроксид с твердой щелочью, такая реакция приводит к образованию безводородных солей:
Если же используют водные растворы щелочей, то образуются гидроксокомплексные соли:
В случае алюминия при действии избытка концентрированной щелочи вместо соли Na[Al(OH)4] образуется соль Na3[Al(OH)6]:
Взаимодействие оснований с солями
- Какое-либо основание реагирует с какой-либо солью только при соблюдении одновременно двух условий:
- 1) растворимость исходных соединений;
- 2) наличие осадка или газа среди продуктов реакции
- Например:
Термическая устойчивость оснований
- Все щелочи, кроме Ca(OH)2, устойчивы к нагреванию и плавятся без разложения.
- Все нерастворимые основания, а также малорастворимый Ca(OH)2 при нагревании разлагаются.
Наиболее высокая температура разложения у гидроксида кальция – около 1000oC:
- Нерастворимые гидроксиды имеют намного более низкие температуры разложения.
Так, например, гидроксид меди (II) разлагается уже при температуре выше 70 oC:
Химические свойства амфотерных гидроксидов
Взаимодействие амфотерных гидроксидов с кислотами
Амфотерные гидроксиды реагируют с сильными кислотами:
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с такими кислотами, как H2S, H2SO3 и H2СO3 ввиду того, что соли, которые могли бы образоваться в результате таких реакций, подвержены необратимому гидролизу до исходного амфотерного гидроксида и соответствующей кислоты:
Взаимодействие амфотерных гидроксидов с кислотными оксидами
Амфотерные гидроксиды реагируют с высшими оксидами, которым соответствуют устойчивые кислоты (SO3, P2O5, N2O5):
Амфотерные гидроксиды металлов в степени окисления +3, т.е. вида Me(OH)3, не реагируют с кислотными оксидами SO2 и СO2.
Взаимодействие амфотерных гидроксидов с основаниями
- Из оснований амфотерные гидроксиды реагируют только с щелочами. При этом, если используется водный раствор щелочи, то образуются гидроксокомплексные соли:
- А при сплавлении амфотерных гидроксидов с твердыми щелочами получаются их безводные аналоги:
Взаимодействие амфотерных гидроксидов с основными оксидами
Амфотерные гидроксиды реагируют при сплавлении с оксидами щелочных и щелочноземельных металлов:
Термическое разложение амфотерных гидроксидов
Все амфотерные гидроксиды не растворимы в воде и, как любые нерастворимые гидроксиды, разлагаются при нагревании на соответствующий оксид и воду:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/harakternye-himicheskie-svojstva-osnovanij-i-amfoternyh-gidroksidov
Химические свойства оснований
- Светлана Николаевна Шевченко, учитель химии МБОУ СОШ № 11 с.Волочаевка
- Уровень изучения: базовый
- Тип урока: изучения нового материала
- Цель урока:
— образовательная: изучить свойства оснований.
Сформировать представление о действии индикаторов в различных средах. Дать определение реакции нейтрализации. Научить подтверждать свойства оснований уравнениями химических реакций.
— развивающая: продолжить формировать умения составлять химические уравнения, развивать навыки проведения химического эксперимента, безопасной работы с веществами и оборудованием. Развивать умение анализировать, сопоставлять, делать выводы.
— воспитывающая: воспитывать уважительное отношение к товарищам, ответственность и дисциплинированность; интерес к предмету.
Приборы и оборудование: штативы с пробирками, растворы гидроксида натрия, соляной кислоты, сульфата меди. Индикаторы фенолфталеин, метилоранж, лакмусовая бумага, держатель, горелка. Мультимедийный комплекс.
УМК: Химия. 8 класс :учебн. для общеобразоват. организаций с прил. на электрон. носителе (DVD)/Г.Е.Рудзитис, Ф.Г.Фельдман.-М.:Просвещение, 2014.- 208с.:ил. Интерактивное учебное пособие «Окраска индикаторов в различных средах», «Техника проведения химического эксперимента».
- Формы работы: индивидуальная, работа в парах, фронтальная.
- Методы работы: частично- поисковый, иллюстративно- объяснительный, метод химического эксперимента.
- Ход урока
- Организация класса. (1-2 минуты)
- Определение темы урока, постановка целей и задач урока. (1-2 минуты)
- Актуализация опорных знаний. (2-3минуты)
- Изучение новой темы (20-25 минут)
- Первичное закрепление и осмысление полученных знаний (7-10 минут)
- Подведение итогов урока. Рефлексия. Оценивание работы на уроке. (2-3 минуты)
- Домашнее задание. (1-2 минуты)
.- Здравствуйте ребята! Сегодня продолжим наше знакомство с основаниями .Что кроме названий и классификации, мы должны знать об этом классе веществ? (свойства веществ, применение). Правильно, и тема нашего урока: «Химические свойства оснований».
Актуализация.
2. Наша задача — опытным путем изучить химические свойства оснований и научиться подтверждать их уравнениями реакций.
3. — Давайте вспомним классы неорганических веществ.
Дайте определения( учащиеся дают определения -оксиды, кислоты, соли, основания. Давайте вспомним, как называются основания и общая формула? (ответы учащихся – гидроксиды, условная запись общей формулы — Ме(ОН)m).)
Назовите класс вещества, формулы которых написаны на доске/H2SO4 CuSO4 NaOH CuCl2 SO3 K2O HCl NiSO4/
Немного истории.
Чем мыли волосы женщины в Древней Руси? Рецепт был такой: взять ковш золы (показать образец), да не простой, а еловой или подсолнечника, замочить в дубовом ведре ключевой водой, настоять сутки, процедить, фильтрат развести водой, подогреть и мыть волосы. Полученный чудо раствор мыльный на ощупь и носит название «щелок». Вот им и мыли волосы женщины. Полученное вещество относится к классу оснований.
Тема.
Сегодня мы с вами представим, что находимся в химической лаборатории и исследуем основания. Еще раз напоминаю правила техники безопасности при работе с хим веществами.У вас на столах лежат инструкции по проведению опытов
Задание 1. На ваших столах образцы оснований – NaOH KOH Ca(OH)2 Fe(OH)3 Cu(OH)2..Проверьте их на растворимость. Занесите наблюдения в таблицу.
Сделайте вывод 1./один из учащихся комментирует- Основания по растворимости делятся на растворимые-щелочи и нерасторимые/ Запишите в схему.Работа с табл растворимости
Учитель: щелочи образованы мет 1(А) и 2(А) группы , кроме Ве и Мg.(учащиеся записывают)Щелочи –мылкие на ощупь, едкие, разьедают кожу, ткани, бумагу, поэтому гидроксиды натрия и калия называют соответственно едкий натр и едкое кали. (учащиеся записывают названия).
Демонстрационный опыт учителя: шерстяная нить и конц щелочь(желтеет)
Изучим сначала свойства щелочей.
Задание 2. Изменяют и как цвет индикатора щелочи?(работа по инструкции)Запись наблюдений.
- Вывод 2 /один из учащихся комментирует – щелочи изменяют цвет индикатора, метил оранжевый на желтый, фенлфталеин на малиновый, лакмус на синий, индикаторная бумага//
- Вспомните и сравните как изменяет цвет индикатора кислоты(ответы учащихся)
- Демонстрационный опыт учителя: изменения цвета индикатора в конц щелочи и разб;.
Вывод 3. Насыщеность цвета зависит от концентрации щелочи.Знакомство со шкалой рН среды (рН-показателем шкалы)-таблица на доске
Демонстрационный опыт проверка раствора золы и определение рН.-слабый раствор щелочи
Задание 3.С чем могут взаимодействовать основания. Вспомните схему.(ответы учащихся с кислотами , с кислотными оксидами, с солями)
Работа по инструкции. Проведите два опыта. NaOH + HCl; КOH + H2SO4. Что наблюдаете?(ответы учащихся –изменение цвета индикатора , небольшое вскипание)
Учитель: После реакции цвет индикатора восстановился, так как кислота и щелочь нейтрализовали друг друга. Эта реакция называется р. нейтрализации. Р нейтрализации- это …
Запись наблюдений. У доски учащиеся пишут уравнения реакций
NaOH + HCl;
КOH + H2SO4 с объяснением.(составление формул веществ, уравнивание, дают названия продуктам и определяют класс. )
Вывод -В обоих реакциях образуется соль и вода.Делаем общий вывод.
Вывод 4. Щелочи реагируют с кислотами.
Учитель. По схеме щелочи реагируют с кислотными оксидами. Давайте запишем уравнения реакцих данных щелочей с кислотными оксидами. У доски учащиеся пишут уравнения с помощью учителя. Вывод –образуется соль и вода
- NaOH + СО2; (пример- образование белого налета на склянке с щелочью)
- КOH + SO3
- Вывод 5. Щелочи реагируют с кислотными оксидами
- Задание 4 .Возвращаемся к схеме-с чем еще могут реагировать щелочи (ответы –с солями)
Работа по инструкции. Проведите три опыта.
NaOH + СuCl2 Что наблюдаете?(ответы учащихся –выпадение голубого осадка)Запись уравнения реакции
NaOH+ К2SO4. Что наблюдаете?(нет признаков реакции)
- NaOH+ СuСО3 Что наблюдаете?(нет признаков реакции)
- Сделайте выводы.(подсказка-какие соли должны быть(работа с таблицей растворимости)
- Вывод:5 1)щелочи реагируют только с растворимыми солями; 2) реакция идет, только в случае выпадения осадка.
- Учитель Обобщите с какими классами веществ взимодействуют растворимые основания
- А теперь рассмотрим свойства нерастворимых оснований по аналогии с растворимыми
- Задание 5 Опустите индикаторную бумагу в пробирку с гидроксидом меди с водой. Сделайте вывод(ответ не изменяет цвет индикатора)
- Вывод. Нерастворимые основания не изменяют цвет индикатора
Задание 6. Работа по инструкции-добавьте серной кислоты к Си(ОН)2. Что наблюдаете? (ответы-растворение вещества и образование прозрачного раствора голубого цвета) Сделайте вывод.Учащийся у доски записывает уравнение реакции с объяснением.Тоже реакция нейтрализации
Вывод. Нерастворимые основания взаимодействуют с кислотами с образованием соли и воды.
Учитель. Нерастворимые основания не реагируют с кислотными оксидами и солями . но зато у них есть особое свойство — это реакция разложения при нагревании. Запишите уравнение реакции разложения гидроксида меди и гидроксида железа
Обобщите свойства нерастворимых оснований (ответы учащихся –нераств основания реагируют с кислотами и разлагаются при нагревании
Подведение итогов урока.
Что такое щелочи? С чем взаимодействуют?Как определить растворимое или не растворимое основание? С чем взаимодействует нераств основание?
- Рефлексия.
- Что нового узнали на этом уроке?
- Какое настроение сложилось в ходе урока?
- Понравился ли урок и ВАША работа на нем?
- Оценивание
Домашнее задание. параграф 42; стр. 144 выучить таблицу
Источник: https://kopilka.edu-eao.ru/himicheskie-svojstva-osnovanij/
Химические свойства нерастворимых оснований
Гидроксиды – это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами — ОН. Общая формула: Гидроксиды Основные (ОСНОВАНИЯ) Амфотерные Кислотные (КИСЛОТЫ) Все гидроксиды одновалентных металлов и большинства двухвалентных металлов.
Большинство гидроксидов металлов с валентностью III и IV. Гидроксиды неметаллов и гидроксиды металлов с валентностью V, VI и VII.
NaOH, KOH, Ba(OH)2, Fe(OH)2, Mg(OH)2, Cu(OH)2, Ca(OH)2 Be(OH)2, Al2(OH)3, Cr2(OH)3, Zn(OH)2, Fe(OH)3 H2CO3, H2SO4, HMnO4, K2CrO4 Растворимые (ЩЕЛОЧИ) Нерастворимые NaOH, KOH, Ba(OH)2, Ca(OH)2 Mg(OH)2, Cu(OH)2, Fe(OH)2
ОСНОВАНИЯ
Основания – это сложные вещества, в молекуле которых атомы металла связаны с одной или несколькими гидроксидными группами –OH (Ме ОН).
Щелочи – это растворимые в воде основания. Некоторые растворимые в воде основания называют едкими щелочами: NaOH – едкий натр, KOH – едкий кали.
Все основания – твёрдые вещества (кроме гидроксида аммония NH4OH), имеющие разные цвета: Cu(OH)2–голубой, Fe(OH)2 – бледно-зелёный, Ca(OH)2–белый, Co(OH)2 – розовый.
Графические формулы.
Показывают порядок связей и их количество (по валентности). В гидроксидах атомы кислорода связаны только с атомами других элементов и не связаны между собой.
| Ca(OH)2 | HO–Ca–OH |
| NaOH | Na–O–H |
Упражнение на закрепление материала:
Распределите формулы оснований согласно классификации гидроксидов. Изобразите их графические формулы и назовите их.
- NaOH, Ba(OH)2, Ni(OH)3, Fe(OH)2, H3PO4, LiOH, Mg(OH)2, Cu(OH)2, KOH, Sr(OH)2, H2SO4
- Получение оснований
- 1. Взаимодействием щелочных и щелочноземельных металлов с водой
- Металл + H2O = ЩЁЛОЧЬ + Н2↑
!!!Внимание! Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra)
- 2Na + 2HOH à 2NaOH + H2↑
- Ca + 2HOH à Ca(OH)2 + H2↑
- Просмотр видео «Взаимодействие активных металлов с водой»
- 2. Взаимодействием оксидов щелочных и щелочноземельных металлов с водой
- ОКСИД МЕТАЛЛА + H2O = ЩЁЛОЧЬ
- Na2O + H2O à 2NaOH (Na2O·H2O)
- BaO + H2O à Ba(OH)2 (BaO·H2O)
- 1. Взаимодействием щелочей с растворимыми солями металлов
- СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
- 2NaOH + CuSO4àCu(OH)2↓ + Na2SO4
- 2KOH + ZnCl2àZn(OH)2↓ + 2KCl
- Просмотр видео «Получение нерастворимых оснований»
- Упражнение на закрепление материала:
- Приведите по два уравнения реакций получения следующих оснований: 1) Гидроксид калия 2) Гидроксид кальция
- 3) Гидроксид железа (III)
- Химические свойства щелочей
- Общие свойства оснований объясняются наличием в их растворах анионов OH-, которые образуются в результате электролитической диссоциации молекул оснований:
- Me(OH)y ↔ Mey+ + yOH-
- 1. Водные растворы щелочей изменяют окраску индикаторов
| Индикатор | Цвет индикатора в среде | ||
| Щелочной (pH > 7) | Нейтральной (pH = 7) | Кислой (pH < 7) | |
| Универсальная индикаторная бумага | Синий | Желтый | Красный |
| Лакмус | Синий | Фиолетовый | Красный |
| Фенолфталеин | Малиновый | Бесцветный | Бесцветный |
| Метиловый оранжевый | Желтый | Оранжевый | Розовый |
Просмотр видео «Изменение окраски индикаторов в растворах щелочей», «Распознавание кислот, оснований и воды»
- 2. Взаимодействуют с кислотами с образованием соли и воды
- Щёлочь + Кислота = Соль + Вода
- NaOH + HCl à NaCl + HOH
- Cu(OH)2 + H2SO4à CuSO4 + 2HOH
- Просмотр видео «Реакция нейтрализации»
http://files.school-collection.edu.ru/dlrstore/15697243-0eed-4dc8-b916-9a7f4abac2e8/84.swf — тренажер «реакции нейтрализации»
- 3. Взаимодействуют с кислотными оксидами с образованием соли и воды
- Щёлочь + Кислотный оксид = Соль + Вода
- 2NaOH + SO2à Na2SO3 + H2O
- Ca(OH)2 + CO2à CaCO3 + H2O
- Просмотр видео «Взаимодействие оксида фосфора и щелочи»
- 4. Растворы щелочей взаимодействуют с растворами солей при образовании нерастворимого основания или нерастворимой соли
- Соль (раствор) + Щёлочь = Нерастворимое основание↓ + Новая соль
- 2NaOH + CuSO4à Cu(OH)2↓ + H2O
- Ba(OH)2 + Na2SO4à BaSO4↓ + 2NaOH
- Просмотр видео «Взаимодействие раствора соли и щелочи»
- 5. Растворы щелочей взаимодействуют металлами, которые образуют амфотерные оксиды и гидроксиды:
- Zn + 2NaOHàNa2ZnO2 + H2↑
- цинкат натрия
- 2Al + 2KOH + 6H2O à 2K[Al(OH)4] + 3H2↑
- тетрагидроксоалюминат калия
- Просмотр видео «Взаимодействие алюминия с щелочью»
- 6. Растворы щелочей взаимодействуют амфотерными оксидами:
- ZnO + 2NaOH à Na2ZnO2 + H2O
- цинкатнатрия
- Al2O3 + 2KOH à 2KAlO2 + H2O
- алюминаткалия
- 7. Щелочи взаимодействуют амфотерными гидроксидами:
- a. в расплаве
- Al(OH)3 + KOH à KAlO2 + 2H2O
- алюминат калия
- б. в растворе
- Al(OH)3 + KOH à K[Al(OH)4]
- 8. Щелочи взаимодействуют с неметаллами:
- 2NaOH + Cl20à NaCl-1 + NaCl+1O + H2O
- Просмотр видео «Химические свойства оснований»
http://files.school-collection.edu.ru/dlrstore/0ab6ce9a-4185-11db-b0de-0800200c9a66/ch08_19_05.swf — «Почему едкий натр?»
- Химические свойства нерастворимых оснований
- 1. Нерастворимые основания при нагревании разлагаются на основной оксид и воду
- Нерастворимое основание = основный оксид(амфотерный) + вода
- to
- Cu(OH)2à CuO + H2O
- Просмотр видео «Разложение нерастворимых оснований при нагревани»
- 2. С кислотами — реакция обмена
| Ме(OH)n↓ + Кислота = Соль + вода |
Внимание! Валентность металла в оксиде и соответствующем гидроксиде одинаковая.
Дата добавления: 2018-02-28; просмотров: 1694;
Источник: https://studopedia.net/2_32437_himicheskie-svoystva-nerastvorimih-osnovaniy.html




