Сколько 9-процентного раствора карбоната калия (K2CO3) и 12-процентного раствора хлорида кальция (CaCl2) (в граммах) потребуется для получения 30 грамм карбоната кальция (CaCO3)?
Решение задачи
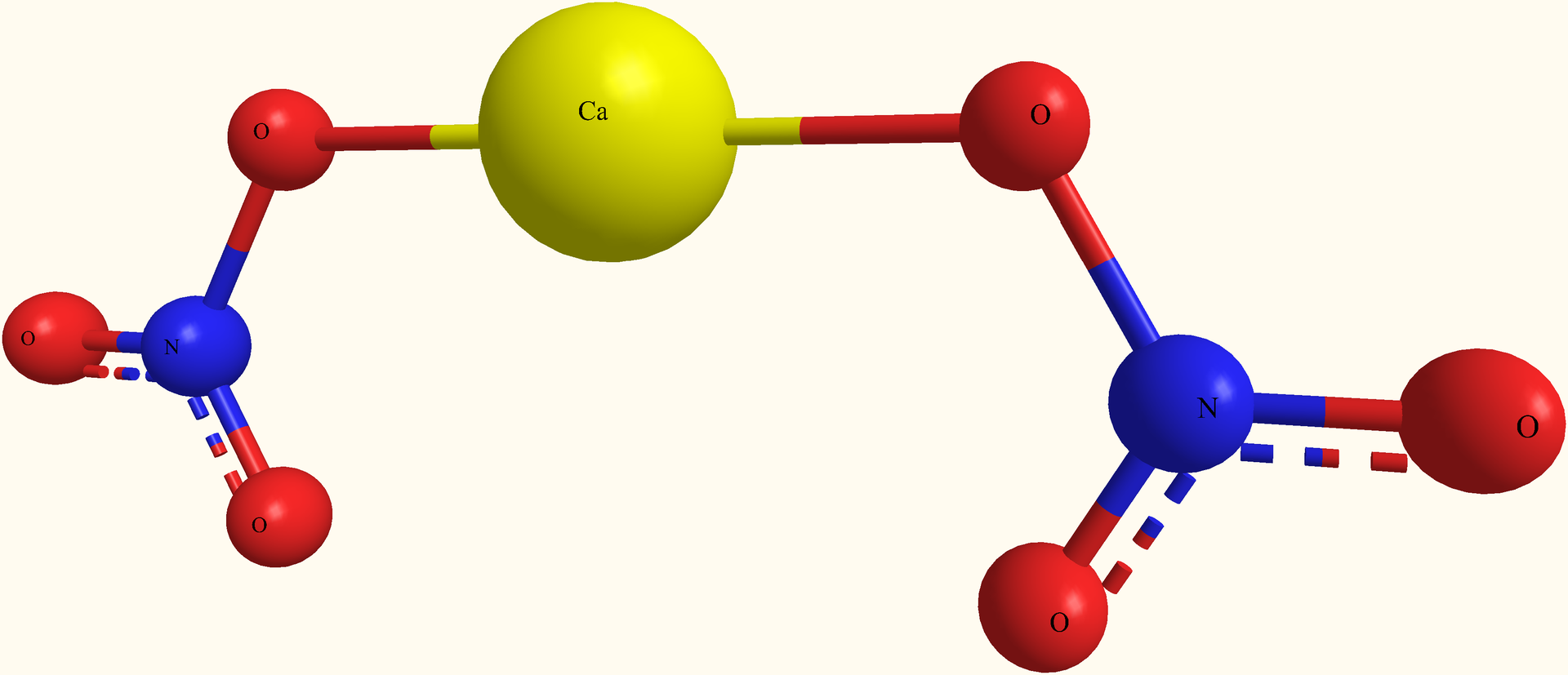
Запишем уравнение реакции образования карбоната кальция (CaCO3) при смешении раствора карбоната калия (K2CO3) и раствора хлорида кальция (CaCl2):
![]()
- Учитывая, что молярные массы карбоната калия (K2CO3), хлорида кальция (CaCl2) и карбоната кальция (CaCO3) соответственно равны 138, 111 и 100 г/моль (смотри таблицу Менделеева), вычислим массы данных веществ по формуле, учитывая количество моль из уравнения реакции:
- Получаем:
- m (K2CO3) = 1 моль ∙ 138 г/моль = 138 (г),
- m (CaCl2) = 1 моль ∙ 111 г/моль = 111 (г),
- m (CaCO3) = 1 моль ∙ 100 г/моль = 100 (г).
- Вычислим, сколько карбоната калия (K2CO3) и хлорида кальция (CaCl2) (в граммах) необходимо взять для получения 30 г карбоната кальция (CaCO3):

- для получения 100 г карбоната кальция потребуется 138 г карбоната калия
- для получения 30 г карбоната кальция потребуется х г карбоната калия
- Откуда:
![]()
- для получения 100 г карбоната кальция потребуется 111 г хлорида кальция
- для получения 30 г карбоната кальция потребуется y г хлорида кальция
- Откуда:
![]()
Найдем массу 9-процентного раствора карбоната калия (K2CO3), содержащего 41,4 г карбоната калия (K2CO3) по формуле:

- m (раствора) = 41,4 / 0,09 = 460 (г).
- Если раствор карбоната калия 9-процентный, то массовая доля карбоната калия (K2CO3) в нем 0,09.
- Найдем массу 12-процентного раствора хлорида кальция (CaCl2), содержащего 33,3 г хлорида кальция (CaCl2) по формуле:

m (раствора) = 33,3 / 0,12 = 277,5 (г).
Если раствор хлорида кальция 12-процентный, то массовая доля хлорида кальция (CaCl2)в нем 0,12.
Ответ:
масса раствора карбоната калия равна 460 грамм;
масса раствора хлорида кальция равна 277,5 грамм.
Источник: https://himik.pro/rastvory/rastvor-karbonata-kaliya
Карбонат калия
Карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
Старое название соли — поташ из нидерл. рotasсh напрямую или через нем. Pottasche, фр. potasse.
История

Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где вода предельно жёсткая).
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу». С целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков» то есть вторичная переработка.

Выглядит как бесцветные или белые кристаллы, имеющие моноклинную сингонию, переходит в гексагональную при 420 °C. Плотность моноклинной модификации 2,44 г/см3, гексагональной 2,27 г/см3. Температура плавления — 891 °C. Растворим в воде: 105,5/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C). Гигроскопичен.
Образует несколько различных гидратов с 5, 1,5 и 0,5 молекулами воды, гидрат с 1,5·H2O образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия. С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Получение
Карбонат калия получают:
- как побочный продукт получается при переработке нефелинов.
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия:
2KOH + CO2 → K2CO3 + H2O
- воздействием CO2 на раствор гидроксида калия.
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ).
Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию.
После лишнюю жидкость выпаривали в металлической посуде и получали поташ.

Карбонат калия применяют:
- для изготовления жидкого мыла;
- для производства пигментов;
- для производства хрустального, оптического или тугоплавкого стекла;
- крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей;
- в качестве добавки в строительный раствор и бетон для уменьшения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия;
- как поглотитель сероводорода при очистке газов;
- как обезвоживающий агент;
- зарегистрирован в качестве пищевой добавки E501.
Источник: https://chem.ru/karbonat-kalija.html
Формула Карбоната калия структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: CK2O3
Химический состав Карбоната калия
| C | Углерод | 12,011 | 1 | 8,7% |
| K | Калий | 39,102 | 2 | 56,6% |
| O | Кислород | 15,999 | 3 | 34,7% |
Молекулярная масса: 138,212
Карбона́т ка́лия(углеки́слый калий, пота́ш) K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности. Старое название соли — пота́ш, от лат. potassa, через нем. Pottasche, фр. potasse.
История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов.
Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке.
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу»
Получение
Его легко получить из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ).
Принцип добычи был таков: в глиняный обожженный сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию.
И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ. Как побочный продукт получается при переработке нефелинов.
Сегодня карбонат калия получается путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия. 2KOH + CO2 → K2CO3 + H2O
Применение
Поташ применяют для изготовления жидкого мыла, хрустального или тугоплавкого стекла, крашения, выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений), для фотодела, в качестве добавки в строительный раствор для уменьшения температуры замерзания (правда, потом могут выделяться белые пятна, поэтому сейчас появляются специальные противоморозные присадки, не дающие разводов). Используется как противозамерзающая добавка в бетоне. Зарегистрирован в качестве пищевой добавки E501.
Источник: http://formula-info.ru/khimicheskie-formuly/k/formula-karbonata-kaliya-strukturnaya-khimicheskaya
Карбонат калия
Калия карбонат (углекислый калий, поташ, пищевая добавка Е501) – средняя соль калия и угольной кислоты.
Физико-химические свойства
Химическая формула K2CO3. Внешний вид — безцветные моноклинные кристаллы. Не растворим в ацетоне. Нормально растворим в этаноле. Растворимость в метаноле (25°С) 6,0 г/100 г. Растворимость в глицерине (20°С) 39,4 г/100 г. Температура плавления 891°С. Плотность 2,43 г/см3.
Растворимость калия карбоната (поташа) в воде
| Температура воды, °С | Растворимость, г/100 г воды |
| 0 | 107 |
| 10 | 109,2 |
| 20 | 111 |
| 25 | 112,3 |
| 30 | 113,7 |
| 40 | 116,9 |
| 60 | 125,7 |
| 80 | 139,2 |
| 100 | 155,8 |
| 200 | 274 |
Применение
В промышленности используют следующие виды поташа: кальцинированный и полутароводный. В зависимости от физико-химических свойств поташ подразделяется также на первый, второй и третий сорт. Он используется в химической промышленности, стекольной, в пожарном деле, в легкой промышленности и в других отраслях.
В строительстве поташ применяют в качестве противоморозной добавки, в химической промышленности применяют для изготовления красок, а так же, он лучше соды поглощает из газовых смесей сероводород. В легкой промышленности для выделки кож. Также поташ применяется в изготовлении моющих средств. Он служит сырьем для производства оптического стекла.
В пожарном деле поташом обрабатывают деревянные строения и конструкции. Зарегистрирован в качестве пищевой добавки E501.
Применение поташа в качестве удобрения
Калия карбонат (калий углекислый, поташ) — калийное удобрение для дерново – подзолистых кислых почв. Высоконцентрированное щелочное калийное удобрение — содержит 50% окиси калия.
Необходимо его применять на кислых почвах в качестве основного калийного удобрения, особенно под культуры, чувствительные к хлору. Кстати, калий в печной (древесной) золе находится именно в форме поташа, что и определяет его щелочные свойства.
Рекомендуется внесение под картофель на кислых почвах.
Человек давно заметил, что внесение в почву золы приводит к увеличению урожайности. О том, что ее активным началом является карбонат калия K2CO3 – поташ, стало ясно гораздо позже.
До разработки промышленных способов производства соды поташ играл исключительно важную роль в различных производствах: стекольном, текстильном, мыловаренном и др. Его получали сжиганием древесины, обработкой водой золы с последующим выпариванием водного раствора.
Из золы сожженного 1 м3 вяза получали 0,76 кг поташа, ивы – 0,63, липы – 0,50 кг. В России лес бездумно сжигали на поташ до середины XIX в. Содержание калия в золе от сгоревших растений обычно очень высокое: в золе соломы злаков от 9 до 22%, гречишной соломы – 25…35, стеблей подсолнечника 36…
40, торфа 0,5…4,7%. Само слово “поташ” произошло от древнего немецкого “пот” – горшок и “аш” – зола, так как щелок, получающийся при обработке золы водой, выпаривался в горшках.
В XVI — XVII вв. поташ получали в огромных количествах из древесной золы, которую вываривали в больших котлах. Из поташа приготавливали главным образом литрованную (очищенную) калийную селитру, которая шла на изготовление черного пороха.
Особенно много поташа производилось в России, в лесах вблизи Арзамаса и Ардатова на передвижных заводах (майданах), принадлежавших родственнику царя Алексея Михайловича, ближнему боярину Б.И.Морозову. Такие заводики вырабатывали до 770 тн.
поташа в год.
В тот же период, производство поташа на Украине было менее концентрировано и сильней рассредоточено – каждый уважающий себя “заможный” казак почитал за честь иметь собственный микрозаводик по его производству – технология то элементарнейшая, и чрезвычайно доходная.
Применение поташа в строительстве
Применение калия карбоната в строительстве обусловлено, в первую очередь, особенностями гидратации цемента. При пониженных температурах она сильно замедляется, а на морозе прекращается вообще. Добавка поташа помогает устранить этот недостаток – строить становится возможным даже при -50 °С. Поэтому поташ является традиционной противоморозной добавкой-антифризом в строительстве.
- Бетонные смеси с добавками поташа можно использовать при возведении в вертикальной скользящей опалубке внутренних стен жесткости (ядер) в крупнопанельных многоэтажных зданиях, приставных и внутренних стен монолитных и лифтовых кирпичных и каркасных зданиях и наружных стен многоэтажных зданий.
- Однако, калия карбоната в строительстве имеет ряд ограничений:
- — нельзя применять калия карбонат в составе бетонов и растворов, где есть активный кремнезем,
- — нельзя использовать там, где возможен контакт с известью и силикатным кирпичом;
- — нельзя применять для изделий эксплуатирующихся при повышенной влажности,
- — малая эффективность в крупнопористых и беспесчаных бетонных смесях, а также в легких бетонах типа керамзитобетона,
- — не рекомендуется калия карбоната в условиях положительных температур либо колебания температуры с переходом через 0 °С.,
- — не рекомендуется в местах, где будет проложена скрытая электропроводка, так как имеет место эффект разрушения изоляции проводов,
– при больших дозировках калия карбоната, а также при наличии положительных температур и отсутствии соответствующих добавок бетон схватывается прямо в бетономешалке уже через 10-15 минут. Оригинальный выход был найден Красноярскими учеными из местного филиала Промстройниипроекта.
Они предложили добавлять к поташу пластификатор с ярко выраженным замедляющим эффектом. Наиболее подошел для этих целей технический лигносульфонат – бросовый отход лесохимического производства.
В итоге получили бетонные смеси повышенной пластичности с ярко выраженным ускоряющее/противоморозным эффектом, но без излишнего ускорения схватывания.
Особенно критичен к воздействию калия карбоната трехкальциевый алюминат. Его схватывание и так начинается практически мгновенно, с момента затворения.
Отрегулировать длительность схватывания этого минерала помогает добавка гипса, вводимая при помоле.
Но в присутствии даже незначительных добавок поташа этот механизм нарушается – в присутствии поташа образуются гидрокарбоалюминаты кальция, которые обволакивают зерна S3A и снижают активность иона SO4 из состава гипса-замедлителя.
Причиной сокращения сроков схватывания силикатов кальция служит образование при взаимодействии калия карбоната с известью нерастворимого CaCO3 что способствует протеканию реакции в сторону образования извести, снова вступающей во взаимодействие с ионом CO3 с образованием CaCO3 и т.д.
Для замедления схватывания бетонов с добавками поташа были опробованы множество веществ-замедлителей – водорастворимые фосфаты, оксид цинка, муравьиная и бензойные кислоты, жирные кислоты, глицерин, глюкоза, технические лигносульфонаты.
По совокупности полученных результатов, в качестве эффективного замедлителя схватывания бетонов с добавкой поташа, было предложено использовать ЛСТ (технические лигносульфонаты). Помимо замедляющего эффекта ЛСТ оказывает на бетоны ярко выраженное пластифицирующее воздействие. Но в дозировке свыше 0.
3% от массы цемента их уже практически не используют – уж слишком сильно начинает сказываться наличие в ЛСТ примесей – редуцированных сахаров, которые сильно замедляют схватывание и твердение. В комплексе с таким эффективным ускорителем схватывания, как поташ становится вполне возможным повысить дозировки ЛСТ до 0.5% — т.
е. ускоритель (поташ) и замедлитель (ЛСТ) взаимно нивелируются, при этом пластичность бетона повышается.
Воздействие калия карбоната на основные минералы цементного клинкера на стадии твердения. Трехкальциевый силикат (C3S) – наиболее активный минерал цемента.
Он характеризуется высокой прочностью и быстрым её нарастанием.
Введение поташа интенсифицирует процесс твердения, но затем, начиная с 7-дневного возраста, и во все последующие сроки, прочность этого минерала, с добавкой поташа, становится несколько ниже, чем без добавки.
Калия карбонат резко ускоряет твердение двухкальциевого силиката (C2S). Увеличение прочности образцов по сравнению с контрольными пропорционально количеству добавки.
В дозировке 10 – 15% поташа, прочность образцов превышает прочность эталона в 2.5 – 4.
0 раза и, начиная с 3=месячного возраста, по абсолютным значениям приближается к прочности образцов трехкальциевого силиката, затворенных на чистой воде.
Затворение трехкальциевого алюмината (C3A) на растворах поташа приводит к значительному повышению прочности.
Изменение прочности четырехкальциевого алюмоферита (C4AF) зависит от количества вводимого вместе с водой затворения поташа. Наиболее оптимальной является добавка в 3%
В начальный период твердения наиболее эффективными являются повышенные дозировки добавки поташа. Но с увеличением возраста становятся оптимальными дозировки в 7% и менее.
Из-за ярко выраженной щелочной реакции следует остерегаться попадания поташа на кожу и особенно в глаза. Приготавливать и работать с водными растворами поташа следует в комбинезоне, очках, резиновых сапогах и перчатках, спецодежду хранить в специальных шкафах. В плохо вентилируемых помещениях необходимо использовать респираторы и противогазы.
Применение калия карбоната в пищевой промышленности
Пищевая добавка Е501 разрешена к применению в качестве стабилизатора в 10 стандартах на пищевые продукты в количестве 2,5 или 50 г/кг.
Кроме того Е501 разрешён к применению в продукты из какао и шоколада в количестве до 70 г/кг от сухого обезжиренного вещества в пересчете на карбонаты кальция; в сухое молоко и другие пищевые продукты; в качестве питательного вещества (подкормки) для дрожжей.
Применение калия карбоната для понижения титруемой кислотности сусел и вин
В отдельные годы из-за неблагоприятных климатических условий кислотность винограда значительно возрастает. Для получения вин с гармоническим вкусом из такого винограда виноделы применяют приемы по снижению титруемой кислотности вин.
Для приёма химического снижения кислотности используют карбонат калия (Е501i, поташ) и бикарбонат (гидрокарбонат) калия (Е501ii). Этот приём основан на нейтрализации избытка кислот сусла или молодого вина. При этом часть органических кислот превращается в труднорастворимые соли и выпадает в осадок, который можно отфильтровать.
Химическое кислотопонижение является сильно действующим средством, и такую обработку рекомендуется использовать только для сусел с кислотностью выше 13 г/л и для вин с кислотностью 10 г/л. При этом снижение кислотности, достигаемое за счет химической обработки, не должно быть больше 3 г/л.
Дозы реагентов, необходимые для понижения титруемой кислотности сусел и вин
| Реагент | Количество реагента для понижения кислотности на 1 г/л | |||
| Теоретически расчитанная доза | Практическая доза | |||
| Для сусел | Для вин | |||
| Столовых | Крепленных | |||
| карбонат калия (Е501i, поташ) | 0,92 | 0,80 | 0,50 | 0,70 |
| бикарбонат калия (Е501ii) | 1,33 | 1,00 | 0,65 | 0,95 |
Получение
В современной промышленности карбонат калия получается путем электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия.
Источник: http://himiya.gosstandart.info/slozhnye-veshchestva/soli/karbonat-kaliya/
Калий углекислый
- Химическая формула: K2CO3
- Международное название: POTASSIUM CARBONATE
- CAS No: 584-08-7
Квалификация: Имп. «ч», пр-во Ю.Корея
- Внешний вид: гранулы белого цвета
- Фасовка: мешки, 25 кг
- Условия хранения: в сухом, хорошо проветриваемом помещении, предохраняя от попадания влаги
Сделать заказ
Синонимы: карбонат калия, калий карбонат, поташ
Мы предлагаем Калий углекислый, Калий карбонат пр-ва Ю. Корея по привлекательным ценам с доставкой по всей России.
| Молекулярный вес | 138.21 |
| Плотность | 2.43 |
| Температура плавления | 891ºC |
| Растворимость в воде | 1120 г/л (20 ºC) |
| Спецификация (пр-во Ю.Корея) | % |
| Содержание основного вещества | 99,0 — 100 % (по факт.99,85%) |
| Содержание Fe | 0,0001 % |
| Содержание KOH | 0,19 % |
| Содержание Na2CO3 | 0,49 % |
| Содержание K2SO4 | 0,002 % |
| Содержание KCLO3 | 0,005 % |
| Содержание тяжелых металлов (Pb) | 0,0002 % |
| Нерастворимый в воде остаток | 0,0005 % |
- Для согласования условий оплаты, звоните нашим менеджерам по телефонам в Москве:
(495) 787-01-37, 36, 38
(495) 787-43-51
и Санкт- Петербурге: - (812) 309-38-06 (многоканальный)
Калий углекислый или Калий карбонат K2CO3 — средняя соль калия и угольной кислоты. Калий углекислый — белое кристаллическое вещество, хорошо растворимое в воде.
Старое название калия углекислого — поташ, отсюда английское наименование калия — potassium. Поташ — одна из наиболее древних солей, известных людям.
Получение
До XX века в Европе поташ или калий углекислый был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня.
Производство карбоната калия было сосредоточено в местах, богатых лесом — кое-где в Европе, но в основном в России и Северной Америке.
Карбонат калия, углекислый калий в промышленности, главным образом получают из солей калия или как побочный продукт переработки нефтелина на глинозем.
- Применение
Карбонат калия (углекислый калий, поташ) используется
• в строительстве (в качестве противоморозной добавки),
• в стекольной отрасли,
• в электровакуумной отрасли,
• в химической и других отраслей промышленности,
• применялся при изготовлении сукна, мыла, ценных сортов стекла, красок, выделке кож, - • в пищевой промышленности, фармацевтике и др.
- Выгодные цены Даже при изначально низких ценах, мы предоставляем значительные скидки в зависимости от объема закупаемой продукции
- Быстрая отгрузка Четкая работа нашего склада позволяет осуществить быструю отгрузку необходимой продукции
- Высокое качество Работая напрямую с производителями по всему миру, мы обеспечиваем наших клиентов продукцией высокого качества
- Доставка по России Ускоренная доставка продукции:
- автотранспортом;
- железнодорожными контейнерами, вагонами;
- авиатранспортом;
- через транспортные компании.
Источник: https://mcd-chemicals.ru/chemicals/descr37/
ПОТАШ
ПОТАШ – это карбонат калия K2CO3, образующий бесцветные кристаллы, плавящиеся при 891° С и хорошо растворимые в воде. Коэффициент растворимости K2CO3 (в г на 100 г воды) равен 111,0 при 20° С и 139,2 при 80° С, плотность – 2,428 г/см3.
В водных растворах карбоната калия сильнощелочная среда за счет гидролиза. При взаимодействии карбоната калия в водном растворе с избытком диоксида углерода СО2 получается гидрокарбонат калия KHCO3.
Нагревание кристаллического гидрокарбоната калия приводит к выделению газообразного диоксида углерода и паров воды и образованию исходного карбоната калия K2CO3.
Поташ стал известен людям много позднее соды. Минералов состава K2CО3 в природе нет, карбонат калия в виде примеси обычно сопровождает соду. Слово «поташ», видимо, произошло от немецких слов «потт» – горшок и «аш» – зола.
В России производили поташ, начиная с 16 в. В старых книгах сообщалось, что на поташных производствах боярина Морозова в 1672 было выработано 770 тонн поташа – это очень большое количество, по тогдашним меркам.
Главные потребители поташа – мыловарение, красильное дело и стекольное производство.
Когда в 1660 появилась угроза вторжения татар, Морозов написал в вотчины, чтобы поташ прятали и закапывали в ямы, «где б вода не была, на высоких местах», иначе хорошо растворимая соль уйдет в почву и будет потеряна.
Поташ в 17 в. изготавливали в России следующим способом: в деревянных корытах обрабатывали горячей водой древесную золу и полученным раствором поливали горящие в кирпичном очаге дрова – так, чтобы не потушить костер.
При этом раствор упаривался, и на дне очага плотным слоем кристаллизовался поташ. Затем его выламывали ломами и закупоривали в бочки. Процесс сжигания дров и их полива требовал особых приемов, от умения рабочих-«поливачей» зависели выход поташа и его качество.
Поэтому крестьянских детей отдавали в долгое обучение мастерству к «поливачам» еще подростками.
Для получения поташа жгли древесину только определенных пород – сосну, клен, березу, в которых содержание карбоната калия наибольшее. Из одного кубометра такой древесины получали около полукилограмма поташа. В те времена для получения поташа выжигали большие лесные площади, превращая эти места в пустоши и луга.
В наше время карбонат калия получают взаимодействием раствора гидроксида калия KOH с диоксидом углерода CO2:
2KOH + CO2 = K2CO3 + H2O
Зола растений, по-арабски «аль-кали», дала и название элемента «калий». И действительно, первым источником соединений этого элемента была древесная зола, содержащая карбонат калия – поташ. Интересно, что латинское и немецкое названия элемента «калиум» не совпадают с французским и английским «потассиум», образованным от слова «поташ».
Применяется K2CO3 в тех же областях, что карбонат натрия (производство стекла, моющих средств и т.д.). Однако, карбонат калия дороже, поэтому его используют, когда нужны те свойства, которых нет у карбоната натрия. Например, поташ служит сырьем для выработки оптического стекла,
Как обезвоживающий реагент, он лучше соды, поглощает из газовых смесей
сероводород. А гидрокарбонат калия служит компонентом жидких моющих средств.
Людмила Аликберова
Литература:
Карапетьянц М.Х., Дракин С.И.. Общая и неорганическая химия. М., «Химия», 1992Химические свойства неорганических веществ. – Учеб.пособие для вузов. М., «Химия», 1996
Проверь себя!
Ответь на вопросы викторины «Неизвестные подробности»
Какой музыкальный инструмент не может звучать в закрытом помещении?
Источник: https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/POTASH.html




