Презентация на тему: Формулы оксида азота 
Скачать эту презентацию
Получить код Наши баннеры 







Скачать эту презентацию
№ слайда 1
Описание слайда:
Кислородные соединения азота. Оксиды азота. 900igr.net
№ слайда 2
Описание слайда:
Что относится к кислородным соединениям? Оксиды Кислоты (кислородсодержащие) Оксиды азота и кислоты, содержащие азот
№ слайда 3
Описание слайда:
Оксиды азота Степени окисления азота +1 +2 +3 +4 +5 Оксиды азота N2O NO N2O3 NO2 N2O5
№ слайда 4
Описание слайда:
Формула название Физические свойства Применение Характер Взаимодействие с водой и щелочью
№ слайда 5
Описание слайда:
Оксид азота (I) оксид диазота закись азота веселящий газ N+12O-2 Группа 1 Школьникова Д. Осипов В.
№ слайда 6
Описание слайда:
Физические свойства При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом. Растворим в воде Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение.
№ слайда 7
Описание слайда:
Характер Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует.
№ слайда 8
Описание слайда:
Применение Средство для ингаляционного наркоза Малые концентрации закиси азота вызывают чувство опьянения (отсюда название — «веселящий газ») и лёгкую сонливость. При вдыхании чистого газа быстро развиваются состояние наркотического опьянения, а затем асфиксия.
В смеси с кислородом при правильном дозировании вызывает наркоз без предварительного возбуждения и побочных явлений.
В двигателях внутреннего сгорания В пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ.
№ слайда 9
Описание слайда:
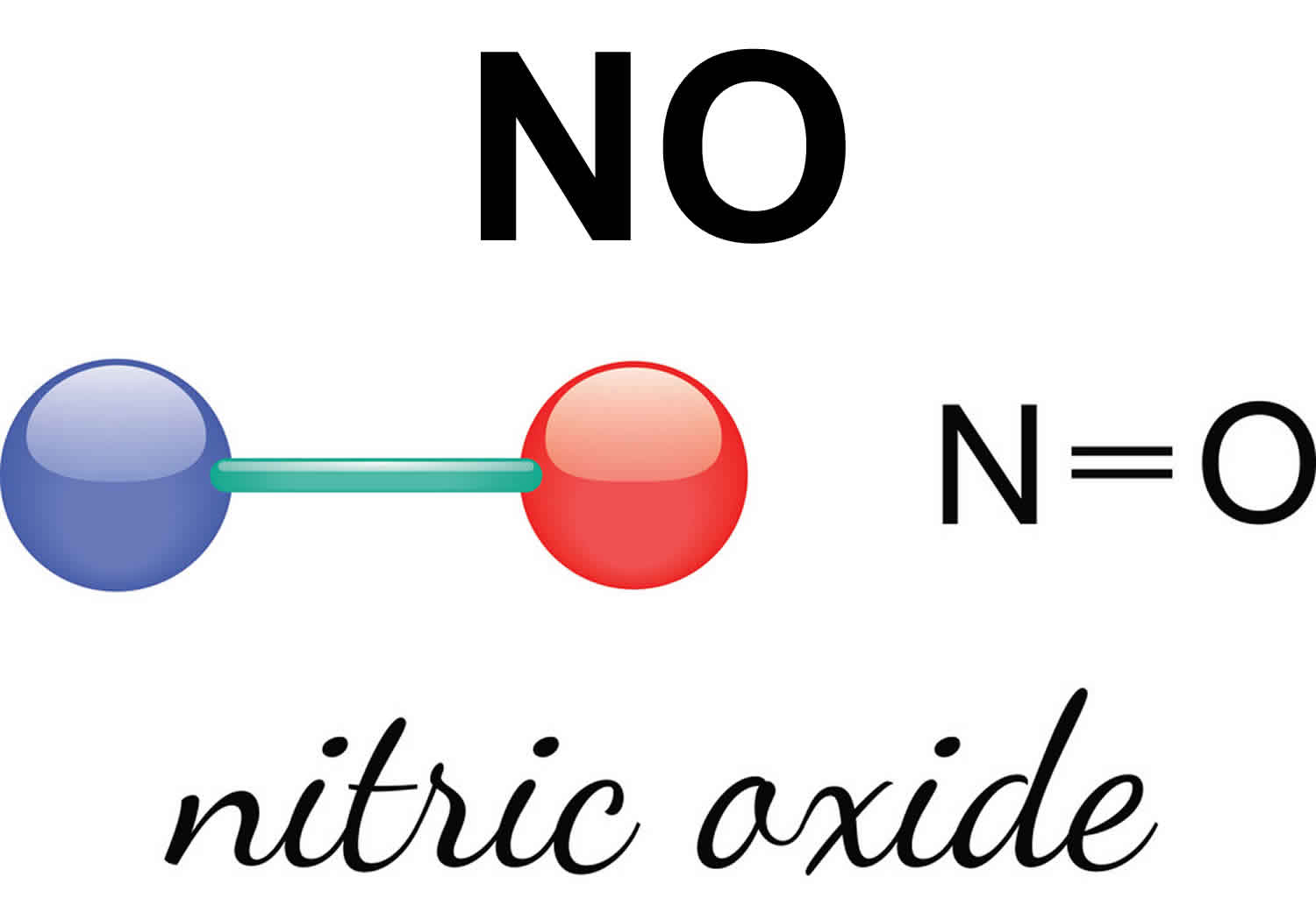
Оксид азота (II) монооксид азота окись азота N+2O-2 Группа 2 Акименко С. Светловская Д.
№ слайда 10
Описание слайда:
Физические свойства При нормальных условиях бесцветный газ, плохо растворимый в воде, сжижается с трудом, в жидком и твёрдом виде имеет голубой цвет.
№ слайда 11
Описание слайда:
Характер Не реагирует с водой, кислотами и щелочами Несолеобразующий
№ слайда 12
Описание слайда:
Применение Получение NO является одной из стадий получения азотной кислоты.
№ слайда 13
Описание слайда:
Оксид азота(III) азотистый ангидрид N2O3 Группа 3 Сидров И. Федотов Н.
№ слайда 14
Описание слайда:
Физические свойства Жидкость синего цвета (при н. у.), в твёрдом виде — синеватого цвета. Устойчив только при температурах ниже −4 °C. Без примесей NO2 и NO существует только в твёрдом виде. Высоко токсичен. Вызывает тяжёлые ожоги кожи.
№ слайда 15
Описание слайда:
Характер При взаимодействии с водой даёт азотистую кислоту, При взаимодействии с растворами щелочей образуются соответствующие нитриты, Солеобразующий кислотный оксид.
№ слайда 16
Описание слайда:
Применение Применяется в лаборатории для получения азотистой кислоты и её солей.
№ слайда 17
Описание слайда:
Оксид азота (IV) диоксид азота, бурый газ N+4O2-2 Группа 4: Иванова А. Ершова Н.
№ слайда 18
Описание слайда:
Физические свойства газ, красно-бурого цвета, с характерным острым запахом высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
№ слайда 19
Описание слайда:
Характер Реагирует с водой, кислотами и щелочами Солеобразующий, кислотный
№ слайда 20
Описание слайда:
Применение В производстве серной и азотной кислот, в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах.
№ слайда 21
Описание слайда:
«Лисий хвост» «Лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. «Лисий хвост» на Нижнетагильском металлургическом комбинате
№ слайда 22
Описание слайда:
Оксид азота(V) пентаоксид диазота, нитрат нитроила, азотный ангидрид N2O5
№ слайда 23
Описание слайда:
Физические свойства Бесцветные, очень летучие кристаллы. Крайне неустойчив.
№ слайда 24
Описание слайда:
Характер Солеобразующий кислотный оксид. Соответствует азотная кислота HNO3
№ слайда 25
Описание слайда:
Применение Применяется в лаборатории для получения азотной кислоты и её солей.
№ слайда 26
Описание слайда:
Спасибо за работу!
Скачать эту презентацию
Скачивание материала начнется через 60 сек. А пока Вы ожидаете, предлагаем ознакомиться с курсами видеолекций для учителей от центра дополнительного образования «Профессионал-Р» (Лицензия на осуществление образовательной деятельности
№3715 от 13.11.2013).
Получить доступ
Источник: https://ppt4web.ru/khimija/formuly-oksida-azota.html
Оксид азота (II)
Оксид азота (II), оксид (II) оксид, окись азота — неорганическое соединение состава NO. При обычных условиях является бесцветным, токсичным и негорючей газом. В жидком и твердом состояниях соединение димеризуеться с образованием оксида N 2 O 2.
Монооксид азота относится к несолетвирних оксидов: с водой он не образует кислоту или основание, а непосредственно реагируя с основами и с кислотами, не образует солей.
Физические свойства
Оксид азота NO при обычных условиях является бесцветным газом с очень низкой температурой кипения (-151,8 ° С) и температурой плавления (-163,6 ° С). В твердом состоянии, благодаря наличию неспаренного электрона, соединение полностью димеризуеться с образованием оксида N 2 O 2, а в жидком — примерно на четверть.
В воде растворяется трудно: при обычной температуре лишь около 5 см³ в 100 г воды.
Получение
Промышленный метод
В промышленных масштабах синтез оксида азота (II) является одной из стадий в получении азотной кислоты. Его получают окислением аммиака кислородом воздуха в присутствии катализаторов:
![]()
Количество преобразованного в NO аммиака составляет примерно 93-98%. Другими, побочными, реакциями является образование азота и оксида азота (I):
![]()
![]()
Кроме этого, может происходить частичное разложение конечного продукта, NO, а также его взаимодействие с аммиаком:
![]()
![]()
Согласно одной из самых распространенных теорий механизма окисления, предложенной Максом Боденштейном, аммиак окисляется атомарным кислородом, адсорбированным на катализаторе с образованием гидроксиламина, который постепенно разлагается с образованием NO:
![]()
![]()
![]()
![]()
Основными применяемыми катализаторами являются платина и, в меньшей степени, родий и палладий. Несмотря на их высокую стоимость, они имеют преимущество в высшем выходе реакции и меньшей склонности к отравлению.
Лабораторные методы
В лабораториях монооксид азота обычно добывают взаимодействием разбавленной азотной кислоты с медью при некотором нагревании по реакции:
Применяются также реакции восстановления нитритов в разведенной серной кислоте:
Полученный такими методами NO может быть загрязнен примесями (прежде всего, N 2 O), поэтому он требует дополнительной очистки.
Химические свойства
Наиболее характерной свойством монооксида азота является его способность легко сочетаться при обычных условиях с кислородом воздуха с образованием диоксида азота (реакция имеет большое значение при производстве азотной кислоты):
При высокотемпературном нагреве и в присутствии катализатора BaO, газообразные NO разлагается на простые соединения. Жидкий NO с течением времени может диспропорционуваты с образованием оксидов азота (I) и азота (III):
При взаимодействии с галогенами или серной кислотой (в присутствии кислорода), NO окисляется с образованием соединений нитрозила:
Аналогично он образует нитрозильни комплексы с металлами в водных растворах солей:
Оксид азота восстанавливается до свободного азота графитом, красным фосфором, неметаллическими соединениями-восстановителями, а также некоторыми металлами:
Роль в живых организмах
Роль оксида азота (II) как сигнальной молекулы в живых организмах была открыта в 1980-х годах, а в 1998 Роберт Ферчготт, Луис Игнарро и Ферид Мурад получили Нобелевскую премию по физиологии или медицине за выяснение его функций в сердечно-сосудистой системе.
Монооксид азота является паракринным фактором благодаря своей способности быстро диффундировать через мембраны клеток, однако из-за высокой реакционность расстояние такой диффузии ограничена 1 мм а время полжизни молекул NO составляет 5-10 секунд.
Азот мооноксид выполняет сигнальную функцию как у животных, так и у растений, даже некоторые бактерии могут чувствовать очень небольшие его концентрации и двигаться в сторону от источника этого соединения.
У млекопитающих NO задействован в ряде физиологических процессов, таких как регуляция артериального давления, передача нервных импульсов, свертывания крови и иммунный ответ.
Синтез оксида азота (II) осуществляется путем деаминирование аминокислоты аргинина и обеспечивается ферментом NO-синтазы (NOS), что у млекопитающих трех изоформы: нейрональная (nNOS), индуцибельной (iNOS) и эндотелиальной (eNOS). nNOS и eNOS экспрессируются в соответствующих типах клеток конститутивно и резко увеличивают свою активность в ответ на рост концентрации Ca 2+.
Зато активация iNOS осуществляется на уровне транскрипции под влиянием эндотоксинов или цитокинов воспаления, в частности в таких клетках как макрофаги и нейтрофилы, и не зависит от цитоплазматического уровня кальция.
Одной из мишеней монооксида азота в клетках млекопитающих, в том числе и гладких мышцах, является фермент гуанилатциклазы, в активном центре которого он присоединяется к атому железа и таким образом увеличивает энзиматическую активность. Циклический ГМФ, что является продуктом гуанилатциклазы, является вторичным посредником и запускает в клетке каскад реакций, обеспечивающих физиологическую ответ, в случае гладких мышц — их расслабление.
NO может действовать также и цГМФ-независимым путем, например изменять активность белков путем ковалентной нитрозилювання тиольных групп (-SH) специфических остатков цистеина в их составе.
Защитная функция монооксида азота
У растений NO участвует в защитных реакциях во время повреждений и инфекций. Также монооксид азота играет роль в функционировании иммунной системы животных.
Активированные макрофаги и нейрофилов (а также клетки эндотелия) производят его в больших количествах во время воспалительных процессов.
Вместе с NO они выделяют супероксид-он (O-2), эти два соединения соединяясь образуют очень токсичен пероксинитрит (OONO -) нужен для того, чтобы убить поглощены бактерии.
Медицинские препараты, влияющие на сигналювання NO
Из препаратов, влияющих на сигнальный путь монооксида азота, первым начал использоваться еще в XIX веке нитроглицерин для борьбы со стенокардией. Это соединение медленно расщепляется в организме и действует как источник NO длительное время.
NO в свою очередь обеспечивает расширение сосудов и уменьшения нагрузки на сердце. Такое действие нитроглицерина была открыта благодаря наблюдению, что больные стенокардией работники фабрик, на которых изготавливали это соединение, сильнее страдали от боли на выходных.
Врачи настолько часто слышали такие сообщения пациентов, обратили внимание на терапевтический эффект нитроглицерина. С тех пор было разработано много других нитровазодиляторив.
Сам NO не имеет терапевтического действия при стенокрадии, через очень небольшое время полжизни, однако его иногда используют в вдыхаемой форме для облегчения легочной гипертензии.
Существуют также препараты, имеющие другие мишени в сигнальном пути NO. Например, силденафил подавляет деятельность фосфодиэстеразы, которая расщепляет цГМФ, таким образом продолжая продолжительность действия сигнала.
Это соединение была впервые предложена для лечения стенокрадии, однако выяснилось, что она наиболее эффективно влияет на изоформу цГМФ-фосфодиэстеразы, експресуетсья в сосудах пениса, и вызывает их расширение и, соответственно, эрекцию.
Поэтому силденафил (под названием Виагра) стал использоваться для лечения эректильной дисфункции.
Токсичность
Оксид NO раздражает дыхательные пути и глаза. Симптомы отравления зьявляють только через определенный период задержки в несколько часов. Ими являются: раздражение горла, затрудненное дыхание, головная боль, тошнота. Дальнейшие осложнения при отсутствии лечебных мероприятий могут вызывать полную потерю сил, непостоянство дыхания, цианоз, а также смерть в результате отека легких.
Пораженного NO необходимо убрать из опасной территории, провентилировать легкие кислородом. Дальнейшие 72 часа необходимо обеспечить надзор и исключить любую физическую деятельность, поскольку это может привести к развитию отека легких. При попадании вещества в ое или на кожу, необходимо тщательно промыть пораженное место теплой водой и обратиться к врачу.
Мерами безопасности при работе с оксидом азота (I) является наличие защитных резиновых (тефлоновых) перчаток, герметичных очков, респиратора.
Источник: https://info-farm.ru/alphabet_index/o/oksid-azota-ii.html
Оксид азота (IV) (диоксид азота), свойства, получение, химические реакции
![]()
![]()
![]()
![]()
- Оксид азота (IV) (диоксид азота) – неорганическое вещество, имеет химическую формулу NO2.
- Краткая характеристика оксида азота (IV)
- Физические свойства оксида азота (IV)
- Получение оксида азота (IV)
- Химические свойства оксида азота (IV)
- Химические реакции оксида азота (IV)
- Применение и использование оксида азота (IV)
Краткая характеристика оксида азота (IV):
- Оксид азота (IV) – неорганическое вещество, ядовитый газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
- Оксид азота (IV) содержит один атом азота и два атома кислорода.
- Химическая формула оксида азота (IV) NO2.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4.
Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
- При температуре 140 °C оксид азота (IV) состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
- В точке кипения NO2 – +21,1 °C представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
- При температуре ниже +21°С – это бесцветная жидкость (или желтоватая из-за примеси мономера).
- При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
- Кислотный оксид.
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.)
|
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см3 | 1,491 |
| Плотность (состояние вещества – газ), кг/м3 | 2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание:
* — нет данных.
Получение оксида азота (IV):
Оксид азота (IV) в лаборатории получают в результате следующих химических реакций:
- 1. путем воздействия концентрированной азотной кислоты на медь:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O.
- 2. путем термического разложения нитрата свинца:
2Pb(NO3)2 → 2PbO + 4NO2 + O2 (t = 200-470 °C).
Химические свойства оксида азота (IV). Химические реакции оксида азота (IV):
Оксид азота (IV) относится к кислотным оксидам.
Химические свойства оксида азота (IV) аналогичны свойствам кислотным оксидов других неметаллов. Однако отличается высокой химической активностью. Реагирует с неметаллами. Сильный окислитель. Поэтому для него характерны следующие химические реакции:
1. реакция оксида азота (IV) и углерода:
2NO2 + 2С → 2СO2 + N2.
В результате реакции образуются углекислый газ и азот. Углерод сгорает в оксиде азота (IV).
2. реакция оксида азота (IV) и фосфора:
10NO2 + 8P → 4P2O5 + 5N2.
В результате реакции образуются оксид фосфора (V) и азот. Фосфор сгорает в оксиде азота (IV).
3. реакция оксида азота (IV) и серы:
2S + 2NO2 → 2SO2 + N2.
В результате реакции образуются оксид серы (IV) и азот. Сера сгорает в оксиде азота (IV).
- 4. реакция оксида азота (IV) и фтора:
- 2NO2 + 2F2 → 2NO2F.
- В результате реакции образуeтся фторид-диоксид азота (V).
- 5. реакция оксида азота (IV) и калия:
- NO2 + K → KNO2.
- В результате реакции образуется соль – нитрит калия.
- 6. реакция оксида азота (IV) и меди:
- 2NO2 + 4Cu → 4CuO + N2 (t = 500-600 °C).
- В результате реакции образуются оксид меди и азот.
- 7. реакция оксида азота (IV) и висмута:
- 6NO2 + Bi → Bi(NO3)3 + 3NO (t = 70-110 °C).
- В результате реакции образуются оксид висмута и оксида азота (II).
- 8. реакция оксида азота (IV) и цинка:
- 4NO2 + Zn → 2NO + Zn(NO3)2 (t = 500-600 °C).
В результате реакции образуются оксид азота (II) и нитрат цинка. При этом для проведения реакции используется жидкий оксид азота (IV) и цинк в виде порошка.
9. реакция оксида азота (IV) и натрия:
2NO2 + Na → NO + NaNO3.
В результате реакции образуются соль – нитрат натрия и оксид азота (II). При этом для проведения реакции используется жидкий оксид азота (IV).
- 10. реакция оксида азота (IV) и водорода:
- 2NO2 + 7H2 → 4H2O + 2NH3 (kat = Pt, Ni).
- В результате реакции образуются аммиак и вода.
- 11. реакция оксида азота (IV) и озона:
- 2NO2 + O3 → N2O5 + O2 (t = -78 оС).
- В результате реакции образуются оксид азота (V) и кислород.
- 12. реакция оксида азота (IV) с бромистым водородом (бромоводородом):
- NO2 + 2HBr → NO + Br + H2O (tо).
- В результате химической реакции получается оксид азота (II), бром и вода.
- 13. реакция оксида азота (IV) с йодоводородом:
- 2HI + NO2 → I2 + NO + H2O.
- В результате химической реакции получается оксид азота (II), йод и вода.
- 14. реакция оксида азота (IV) и воды:
- 2NO2 + H2O → HNO3 + HNO2,
- 3NO2 + H2O → 2HNO3 + NO (tо).
- В результате химической реакции в первом случае получается азотная кислота и азотистая кислота, во втором случае – поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются азотная кислота и оксид азота (II).
- 15. реакция оксида азота (IV), кислорода и воды:
- 4NO2 + 2H2O + O2 → 4HNO3.
- В результате химической реакции получается азотная кислота.
- 16. реакция оксида азота (IV) и гидроксида натрия:
- 2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O.
В результате химической реакции получается нитрат натрия, нитрит натрия и вода. Гидроксид натрия – разбавленный раствор.
- 17. реакция оксида азота (IV) и фосфористой кислоты:
- H3PO3 + NO2 → H3PO4 + NO (t = 30-50 оС).
- В результате химической реакции получается ортофосфорная кислота и оксид азота (II).
- 18. реакция термического разложения оксида азота (IV):
- 2NO2 → 2NO + O2 (t = 500 оС).
- В результате химической реакции получается кислород и оксид азота (II).
Применение и использование оксида азота (IV):
Оксид азота (IV) используется при производстве серной и азотной кислот, а также в качестве окислителя в жидком ракетном топливе.
Примечание: © Фото //www.pexels.com, //pixabay.com
-




- карта сайта
- оксид азота (IV) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида азота (IV)
реакции с оксидом азота (IV)
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/oksid-azota-iv-dioksid-azota-svoystva-poluchenie-himicheskie-reaktsii/
Оксид азота

Оксид азота или окись азота, а также известный как монооксид азота представляет собой молекулу с химической формулой NO. Это свободные радикалы, которые является важным промежуточным продуктом химических реакций.
В организмах млекопитающих и человека оксид азота является важной составляющей клеточных сигнальных молекул, участвующих во многих физиологических и патологических процессах. Это мощный вазодилататор с коротким, в несколько секунд, периодом полураспада в крови.
В конце 80-х годов было доказано, что особые ферментные системы организмов способны синтезировать газ оксида азота. Это происходит в результате окисления гуанидиновой группы аминокислоты L-аргинина с одновременным синтезом цитруллина.
Получение оксида азота
В лабораторных условиях получение оксида азота возможно путем проведения реакции разбавленной азотной кислоты с медью или восстановлением азотистой кислоты в виде нитрита натрия или нитрита калия.
Основным природным источником оксида азота являются электрические разряды молний в грозу. Оксид азота является побочным продуктом, возникающим при сгорании веществ в автомобильных двигателях и топлива на электростанциях.
Также получение оксида азота возможно из свободных элементов, для этого необходимо при температуре 1200-1300°C провести соединение азота с кислородом.
Применение оксида азота
Оксид азота используется в медицине для расширения кровеносных сосудов при ишемической болезни сердца путем уменьшения нагрузки на сердце.
Оксид азота используется при неотложной помощи для содействия капиллярному расширению легких для лечения первичной легочной гипертензии у новорожденных, связанной с врожденными дефектами. Терапия оксидом азота значительно повышает качество жизни и, в некоторых случаях, спасает жизнь детей с риском развития заболевания сосудов легких.
Оксид азота также вводится в виде спасительной терапии у больных с острой правожелудочковой недостаточностью, которая является вторичной по отношению к легочной эмболии.
В пищевой промышленности оксид азота известен под названием пищевая добавка Е942 и используется в качестве пропеллента и упаковочного газа.
Свойства оксида азота
Оксид азота – это бесцветный газ с температурой плавления -163,6°С и температурой кипения -151,7°С. Молекулярная формула оксида азота – NO, молярная масса – 30.01 грамм/моль, плотность – 1,3402 г дм, растворимость в воде – 74 см3/дм3, показатель преломления – 1.0002697.
Польза оксида азота

- Систему кровообращения – регуляторные свойства оксида азота оказывают влияние на циркуляцию крови по всему телу, увеличивают диаметр кровеносных сосудов и предотвращают образование тромбов. Он помогает эндотелиальным клеткам контролировать кровеносные сосуды. Оксид азота также повышает уровень кислорода внутри тела, понижает уровень артериального давления и помогает в оптимальном режиме функционировать сердцу;
- Иммунную систему – иммунные клетки в организме человека синтезируют оксид азота, чтобы уничтожать бактерии и вирусы, способные вызывать инфекции. Известно также свойство оксида азота предотвращать появление доброкачественных и злокачественных опухолей в клетках организма;
- Уровень выносливости — оксид азота повышает уровень выносливости мышечных клеток, что позволяет выдерживать более тяжелые нагрузки и с легкостью вести более активную деятельность;
- Повышение реакции нервных клеток – оксид азота действует как внутриклеточный посредник между различными клетками в организме, в том числе, нервными клетками. При достаточном содержании оксида азота в организме связь между нервными клетками становится быстрее, что приводит к быстроте реакции на внешние раздражители, увеличению фокуса и бдительности;
- Повышение сексуальной энергии – применение оксида азота стимулирует, бодрит и усиливает сексуальные механизмы реагирования в организме. Сенсорные и психические стимуляции, вызываемые нервными клетками под действием оксида азота, приводят к расслаблению мышц и притоку крови к пенису, благодаря чему происходит эрекция. Таким же образом процесс протекает и в женском организме, под действием оксида азота приток крови увеличивается в тканях влагалища;
- Облегчение боли – оксид азота обеспечивает долгосрочное облегчение от боли, связанной с артритом и воспалением суставов. Он способен активировать противовоспалительные механизмы в клетках организма, и способствует уменьшению воспаления;
- Увеличение мышечной массы – добавки содержащие оксид азота расширяют кровеносные каналы, улучшают кровообращение и увеличивают мышечную массу. При увеличении потока крови увеличивается количество питательных веществ в мышцах, что приводит к увеличению их размера;
- Внутриклеточные связи – оксид азота улучшает процесс связи между различными клетками в организме, в том числе, между нервными клетками и клетками мозга. Применение добавок содержащих оксид азота приводит к улучшению памяти, повышению уровня концентрации и способности к обучению.
Вред оксида азота
Применение оксида азота у большинства людей не вызывает побочных эффектов, однако, в случаях передозировки он приводит к диарее, слабости, тошноте, головной боли, учащению пульса и сердцебиения, задержкам воды, усталости, раздражениям на коже и сухости во рту.
Также побочными эффектами применения оксида азота являются проблемы с дыханием, сильная аллергия или сыпь, крапивница, зуд, одышка, опасные для жизни осложнения астмы, внезапный озноб, потливость, тремор, рвота и обмороки. В некоторых случаях применение оксида азота приводит к вспышкам герпеса, расширению сосудов и кровотечениям.
Источник: https://www.neboleem.net/oksid-azota.php
Оксиды азота. Общая характеристика, химические свойства. ✎ pangenes.ru
Задания по подготовке к ЕГЭ по химии 14 февраля 2019 г., 6:22 
Данный урок посвящен оксидам азота, которые при взаимодействии с водой образуют кислоты, и соответственно, являются солеобразующими, — NO2 и N2O5.
NO2 представляет собой типичный кислотный оксид, который обладает высокой химической активностью, и при взаимодействии с неметаллами (сера, фтор, водород) ведет себя как сильный окислитель; также применяется при производстве серной кислоты (нитрозный метод), окисляя сернистый газ в олеум (SO3), и азотистой кислоты (HNO2).
N2O5 — это высший оксид азота, очень летуч, взаимодействует с органическими веществами, поэтому его нужно хранить в стеклянной посуде (!Важно! плавиковая кислота (HF) наоборот хранится в полимерной таре по причине того, что разъедает стекло), легко разлагается до ядовитого NO2 со взрывом; используется при получении азотной кислоты (HNO3).
Важно знать, что все оксиды азота токсичны!
Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ.
| Солеобразующие оксиды азота | ||
| 1) Формула | NO2 | N2O5 |
| 2) Характеристика |
|
N2O5 (Dinitrogen pentoxide, пентаоксид азота) – бесцветные, летучие кристаллы, взрывчатые; Хорошо растворяется в воде; |
| 3) Получение в лаборатории | 1) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 (200-470 C); 2) Me + 4HNO3(к) = Me(NO3)2 + 2NO2 + 2H2O (Me= правее водорода); | 1) 2HNO3(к) + P2O5 = N2O5 + 2HPO3 (-10 C); 2) 4AgNO3 + 2Cl = 4AgCl + 2N2O5 + O2; |
| 4) Получение в промышленности | NO + O2 = NO2 (на воздухе — мгновенно); | 2NO2 + O3 = N2O5 (-78 C); |
| 5) Химические свойства |
2NO2 + 2KOH = KNO3 + KNO2 + H2O |
|
| 6) Применение |
|
1) Применение ограничено из-за взрывоопасной природы оксида азота (V); 2) Используется в качестве нитрующего агента (в органической химии). |
Следующее занятие будет посвящено задачам по этой теме.
Если возникнут вопросы, пиши в коменты)
Солеобразующие оксиды азота. Задачи с объяснениями.
pangenes.ru © 2020
Источник: https://pangenes.ru/post/oksidy-azota-obshchaya-harakteristika-himicheskie-svoystva.html
азота (I) оксид
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
азота закись веселящий газ бесцветн. газ вода: 0,257 (0°C) вода: 0,174 (10°C) вода: 0,125 (20°C) вода: 0,106 (25°C) диэтиловый эфир: растворим серная кислота концентрированная: растворим этанол: растворим вкус: сладкий 1. Получают разложением нитрата аммония. 0,0019778 (20°C, г/см3) 1,226 (-89°C, г/см3) 1 (-144°C) 10 (-129°C) 100 (-110°C) 1,00103 (25°C) 0,16 (20°C) 0,0137 (0°C) 0,0183 (100°C) 0,0225 (200°C) 0,0303 (400°C) 0,887 (25°C) 82 (г) 104,1 (г) 219,9 (г) 38,6 (г) 6,52 16,56
При применении в хирургической практике, при вдыхании закиси азота очень быстро, через 1-2 минуты, происходит потеря сознания и исчезает болевая чувствительность; наркоз наступает без стадии возбуждения; раздражения слизистых оболочек дыхательных путей не бывает.
Сколько-нибудь продолжительное вдыхание чистой закиси азота невозможно, так как она не способна поддерживать дыхание и развивается асфиксия (удушье).
Используются ее смеси с кислородом N2O : O2: 80:20 — неполная анальгезия, 86:14 — полная анальгезия, 89:11 — неполный наркоз, 94:6 — полный наркоз.
В крови закись азота находится в растворенном состоянии и в соединение с гемоглобином не вступает. Дыхание под влиянием закиси азота вначале несколько замедляется, а затем ускоряется; пульс слегка учащается, кровяное давление не изменяется, зрачки суживаются, их реакция на свет сохраняется, движения глаз также сохраняются.
Пробуждение после вдыхания закиси азота наступает сразу после прекращения поступления газа в организм. Последствий обычно не бывает. Выделяется закись азота через легкие в неизменном виде.
Симптомы острого отравления:
В высоких концентрациях вызывает удушье вследствие вытеснения кислорода из легких. В смеси с кислородом способна вызывать наркоз. В опытах in vitro отмечалось митотоксическое действие.
Воздействие смеси с кислородом (1:1 или 8:2) в течение 6 сут вызывает у крыс угнетение эритро- и лейкопоэза, гипоплазию костного мозга. В соотношении 1:1 нарушает развитие куриных эмбрионов. Наркоз сопровождается заметными гистохимическими сдвигами в печени крыс; 60 мг/м3 вызывают поражение альвеолярного эпителия и инфильтрацию периваскулярной ткани.
Воздействие 90 мг/м3 в течение 10 недель приводит к гибели части хомячков. Гистологически — нерезко выраженный отек легких, гиперплазия и гипертрофия легочной ткани. Воздействие с 1 по 19 дня беременности в концентрации 0,1% снижало у крыс количество плодов в помете, уменьшало краниокаудальные размеры плодов и увеличивало эмбриональную смертность.
В аварийной ситуации после 3-4 мин контакта с закисью азота 2 рабочих из 5 погибли, у оставшихся в живых — отек легких, гипоксемия, метаболический ацидоз и метгемоглобинемия.
Газовые смеси, содержащие 20, 30 и 50% оксида азота (I) избирательно ухудшают кратковременную память у водолазов, не влияя при этом на долговременную память, психомоторную активность и зрительные функции.
Примесь высших оксидов азота к используемому для наркоза N2O может вызвать поражения, характерные для этих соединений.
Критическая температура (в °C):
36,43
Критическое давление (в МПа):
7,255
Критическая плотность (в г/см3):
0,453
Дополнительная информация:
В жидком виде бесцветен.
Не поддерживает дыхания. Поддерживает горение фосфора, древесины.
- «Вредные химические вещества: Неорганические соединения элементов V-VIII групп» Справочник Л. 1989 стр. 31
- «Справочник химика» т.2, Л.-М.: Химия, 1964 стр. 12-13
- Закусов В.В. «Фармакология» М.:Медгиз, 1960 стр. 45-46
- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 50
- Спицын В.И., Мартыненко Л.И. «Неорганическая химия» ч.1 М., 1991 стр. 130
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я

Источник: http://www.xumuk.ru/spravochnik/332.html
Оксиды азота — Абросимова Елена Владимировна учитель химии и биологии
|
|
|
N+4O2ОКСИД АЗОТА (IV)ДВУОКИСЬ АЗОТА, ДИОКСИД АЗОТА |
|
Оксид азота (I) N2+1O закись
азота, «веселящий газ»
Физические свойства: газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С.
Анестезирующее средство. Несолеобразующий
- Получение: NH4NO3 –t°→ N2O + 2Н2O
- Химические свойства
- 1.
Разлагается при 700°C с выделением
кислорода: - 2N2+1O –t°→
2N20
+ O20 - поэтому он поддерживает горение и
является окислителем - 2.
С водородом: - N2+1O + H2 → N20 + Н2O
- Оксид азота (II) N+2O окись азота
Физические свойства: газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
- Получение:
- 1.
Каталитическое окисление аммиака (промышленный способ) - 4NH3 +5O2 → 4NO + 6H2O
2. 3Cu + 8HNO3(разб.) → 3Cu(NO3)2
+ 2NO + 4H2O
- 3. N2 + O2 → 2NO (в природе, во время грозы)
- Химические свойства:
- 1. Легко окисляется кислородом и галогенами
- 2NO + O2 → 2NO2
- 2NO + Cl2 → 2NOCl (хлористый
нитрозил) - 2. Окислитель
- 2N+2O + 2S+4O2 → 2S+6O3
+ N20 - 3. Несолеобразующий
- Оксид азота (III) N2+3O3
азотный ангидрид
Физические свойства: темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается
на NO и NO2. N2O3 соответствует
азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
NO2 + NO → N2O3
Химические свойства
- Все свойства кислотных оксидов.
- N2O3 + 2NaOH ® 2NaNO2(нитрит натрия) + H2O
- Оксид азота (IV) N+4O2 двуокись азота, диоксид азота
Физические свойства: бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
1.
2NO + O2 → 2NO2
2. Cu + 4HNO3(конц.) → Cu(NO3)2
+ 2NO2 + 2H2O
Химические свойства
1.
Кислотный оксид. Взаимодействие с водой
- 2NO2 + H2O → HNO3 + HNO2
- 4NO2 + 2H2O + O2 → 4HNO3
- 2. Взаимодействие с щелочами
- 2NO2 + 2NaOH → NaNO2 + NaNO3 +
H2O - 3.
Димеризация: - 2NO2(бурый газ) → N2O4(бесцветная жидкость)
- Оксид азота (V) N2+5O5 азотный ангидрид
- Физические свойства: Кристаллическое вещество, летучее, неустойчивое.
- Получение:
- 2NO2 + O3 → N2O5 + O2
- Химические свойства:
- 1.
Кислотный оксид: взаимодействие с водой - N2O5 + H2O → 2HNO3
- 2.
Легко разлагается (при нагревании — со взрывом): - 2N2O5 → 4NO2 + O2
Источник: https://www.sites.google.com/site/abrosimovachemy/materialy-v-pomos-ucenikam/distancionnoe-obucenie/9-klass/oksidy-azota
Оксид азота – формула вещества, химическая свзь — Помощник для школьников Спринт-Олимпиады
Известно десять оксидов азота, пять из которых находятся в стабильном состоянии. Атомы кислорода и азота во всех оксидах соединены ковалентной полярной химической связью.
Содержание
- Общее описание
- Химические свойства
- Что мы узнали?
Общее описание
Азот – это бесцветный двухатомный газ (N2). Атомы в молекуле азота удерживает прочная тройная связь, что обуславливает инертность элемента. Азот реагирует с другими элементами и соединениями под действием внешних факторов – высокой температуры, электричества, катализаторов.
Рис. 1. Строение молекулы азота.
Оксиды образуются из солей аммония и азотной кислоты. Формулы оксидов азота и краткая характеристика соединений приведены в таблице.
| Название | Формула | Получение | Особенности |
| Оксид диазота или оксид азота (I) – «веселящий газ» | N2O | – Нагревание нитрата аммония (опасность взрыва): NH4NO3 → N2O + 2H2O; – нагревание аминосульфоновой кислоты с разбавленной азотной кислотой: NH2SO2OH + HNO3 → N2O + H2SO4 + H2O | Бесцветный газ со сладковатым привкусом. Не горит, токсичен. Растворим в воде, серной кислота, спирте |
| Монооксид или оксид азота (II) | NO | Единственный оксид, получаемый непосредственным взаимодействием кислорода и азота при температуре 1200°С или при электрических разрядах: N2 + O2 → 2NO | Бесцветный ядовитый газ. На воздухе окисляется, приобретая коричневый цвет. Трудно сжижается. В жидком виде имеет голубой цвет |
| Триоксид диазота или оксид азота (III) | N2O3 |
|
При нормальных условиях – синяя жидкость. Может приобретать газообразное и твёрдое состояния. Сильно токсичен, вызывает ожоги кожи |
| Диоксид или оксид азота (IV) | NO2 | – При взаимодействии азотной кислоты и меди: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O; – при разложении нитрата свинца: 2Pb(NO3)2 → 2PbO + 4NO2 + O2 | Ядовитый газ бурого цвета с острым запахом. Легко сжижается при температуре ниже +21°С, превращаясь в желтоватую жидкость |
| Пентаоксид диазота или оксид азота (V) | N2O5 |
|
Бесцветное твёрдое кристаллическое соединение, крайне неустойчивое при нормальных условиях. Приобретает стабильную форму при температуре ниже +10°C |
Рис. 2. Диоксид или оксид азота (IV).
Помимо пяти стабильных оксидов азота известны ещё пять нестабильных соединений – NON3, NO2N3, N(NO2)3, нитратный радикал NO3 и димер, состоящий из двух простых молекул, диоксида азота (N2O4).
Химические свойства
Основные реакции оксидов азота с простыми и сложными веществами приведены в таблице.
| Оксиды | Реакции | Уравнения |
| N2O | При нагревании разлагается. Окисляет неметаллы. Проявляет свойства восстановителя с сильными окислителями. Реагирует с аммиаком и его производными. Не образует солей. Не реагирует с водой, щелочами, кислотами |
|
| NO | Окисляется до диоксида азота на воздухе при нормальных условиях. Взаимодействует с галогенами. В присутствии сильного восстановителя проявляет окислительные свойства. Не образует соли, плохо растворим в воде |
|
| N2O3 | Разлагается при нагревании. Реагирует с водой с образованием азотистой кислоты. Растворим в щелочах |
|
| NO2 | Реагирует с неметаллами, металлами, галогенами, водой. Окисляет оксиды серы. Растворяется в щелочах |
|
| N2O5 | Быстро разлагается с взрывом. Растворяется в воде, щелочах |
|
Рис. 3. Пентаоксид диазота или оксид азота (V).
Оксиды используются для получения азотной кислоты. N2O используется в качестве наркоза.
Что мы узнали?
Из темы урока узнали, что азот может образовывать пять стабильных оксидов, проявляя переменную валентность I, II, III, IV, V.
Только один оксид (NO) можно получить непосредственным взаимодействием азота и кислорода при нагревании или под воздействием электричества. Остальные оксиды выделяются из солей аммония и азотной кислоты.
Большинство оксидов – токсичные газы, способные сжижаться. Оксиды реагируют с металлами, неметаллами, щелочами, оксидами.
ПредыдущаяСледующая
Источник: https://Sprint-Olympic.ru/uroki/himija/17501-oksid-azota-formyla-veshestva-himicheskaia-svz.html




