- Углерод – химический элемент IV группы периодической системы химических элементов.
- На внешнем электронном слое атома углерода – 4 электрона, 2 спаренных и 2 не спаренных, поэтому углерод проявляет степени окисления
- +2, +4 и –4.


Он занимает ячейку номер 6.
Название «углерод» обозначает «рождающий уголь», поскольку природный каменный уголь представляет собой углерод почти на 100 %.
Углерод – один из самых распространённых элементов на Земле (0,3 % по массе). В земной коре он находится как в виде простого вещества, так и в соединениях.
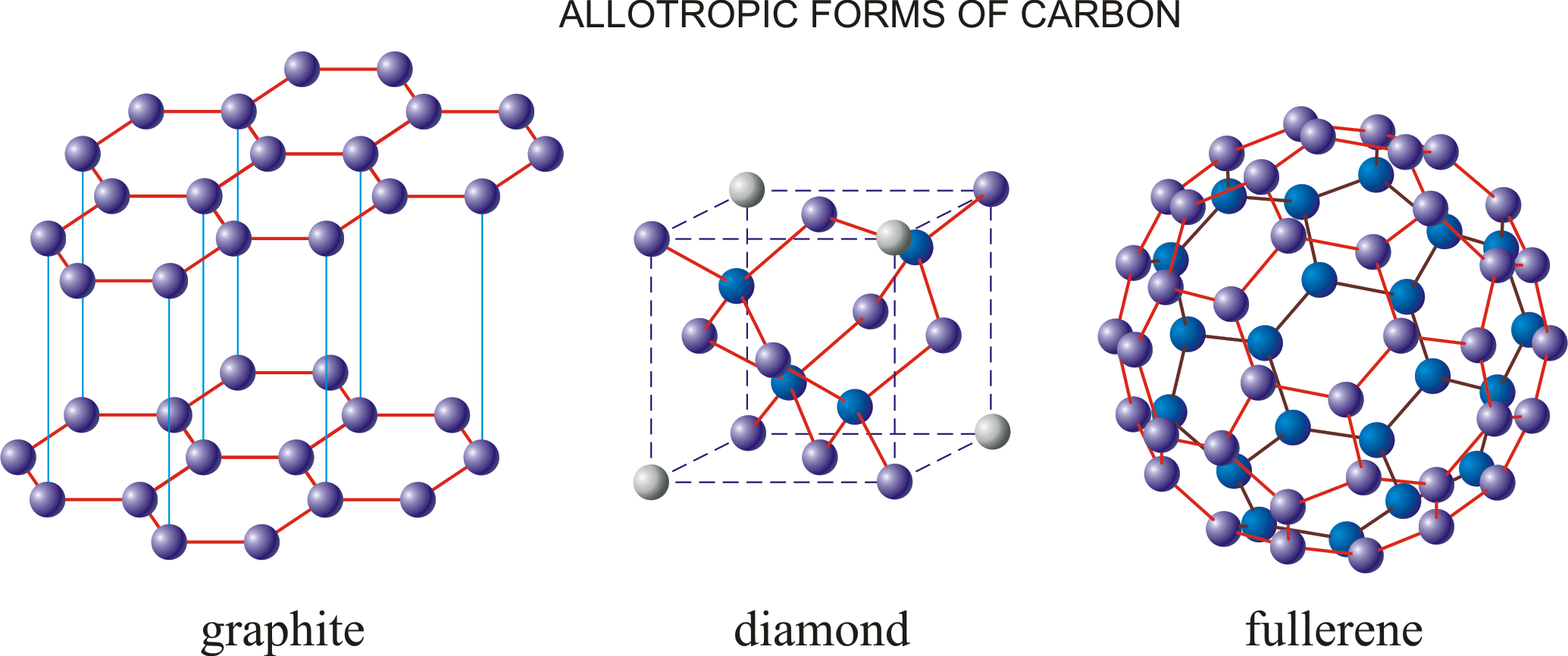
- В природе углерод образует две аллотропные модификации: алмаз и графит.
- Алмаз встречается очень редко в виде отдельных кристаллов.
- В России алмазы добывают в Якутии.
- Графит образует залежи каменного угля, бурого угля, сланцев.
- Кроме того, углерод является основной составляющей частью горючих полезных ископаемых: торфа, нефти, природного газа.

Углерод содержится в каждой клетке растений и животных. Именно на основе цепочек из атомов углерода построены все вещества, на которых основана жизнь – органические вещества.
- В виде органических и неорганических соединений он содержится в почвах.
- Из неорганических соединений наиболее распространены карбонаты:
- СаСO3– кальцит, известняк, мел, мрамор
- MgCO3– доломит
- (CuOH)2СO3– малахит
- Природные воды содержат гидрокарбонаты Са(НСO3)2и Mg(HCO3)2.
- В земной атмосфере находится 0,03% углекислого газа.

Наиболее распространённые аллотропные модификации углерода – алмаз и графит – имеют различное строение кристаллической решётки, поэтому они резко различаются по физическим свойствам
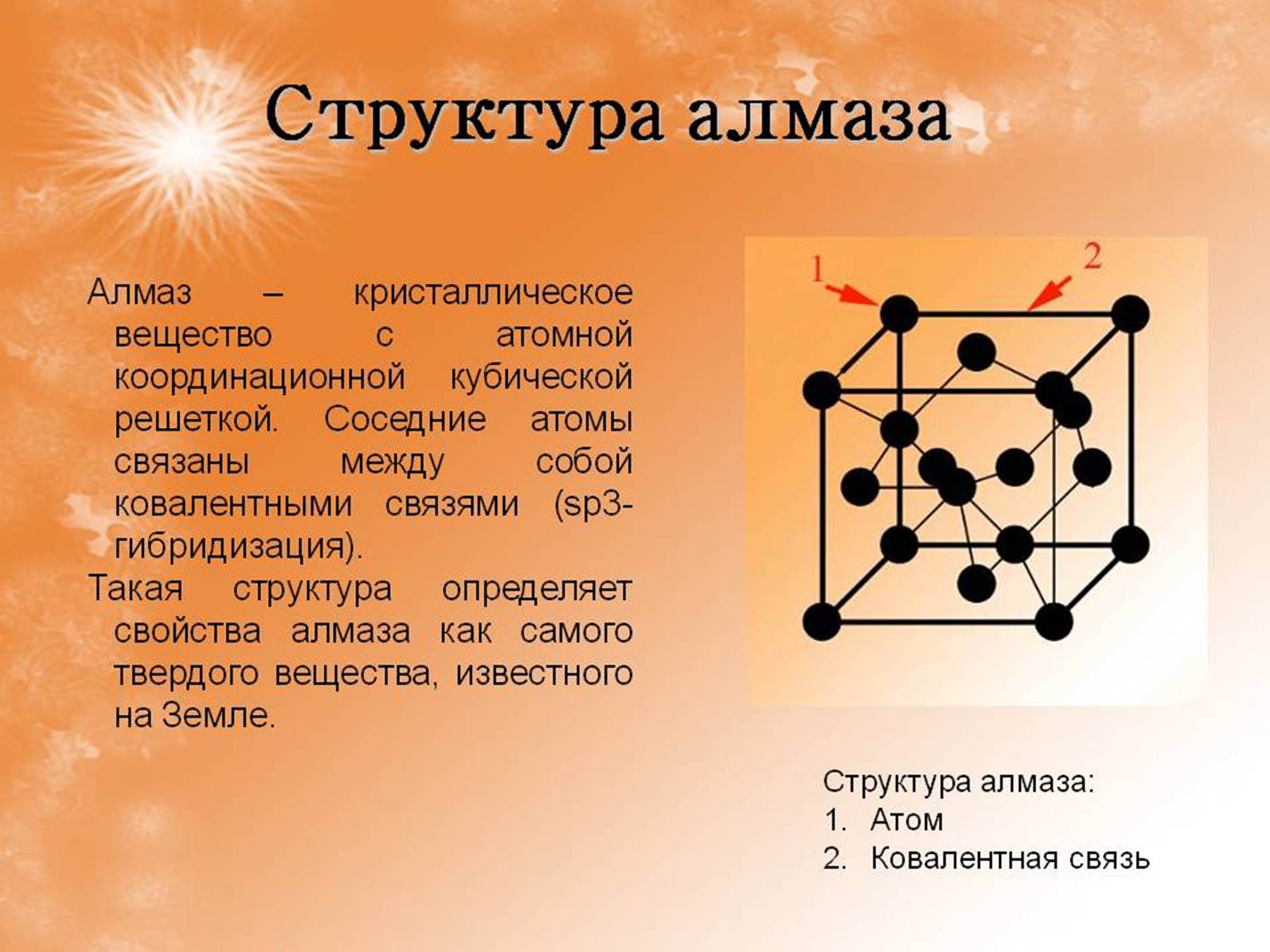
- Алмаз имеет атомную кристаллическую решётку.
- Все четыре электрона каждого атома углерода образуют прочные ковалентные связи с четырьмя соседними атомами углерода.
- Расстояние между атомами углерода одинаковое.
- Поэтому алмаз – самое твёрдое вещество, найденное в природе.
- Он не проводит электрический ток, так как в его кристаллической решётке отсутствуют свободные электроны.

- Графит – тёмно-серое вещество, жирное на ощупь, с металлическим блеском.
- В отличие от алмаза, в кристаллической решётке графита атомы углерода расположены слоями, состоящими из шестиугольников.
- Три электрона каждого атома углерода образуют прочные ковалентные связи с тремя соседними атомами, а четвёртый электрон остаётся свободным.
- Что интересно, графит, в противоположность алмазу, самое мягкое вещество.
- Графит химически очень устойчив и тугоплавок.
- Температура плавления его около 3700 °С – это самое тугоплавкое простое вещество.
- И даже наиболее тугоплавкие сложные вещества представляют собой соединения металлов именно с углеродом.
- Аллотропные модификации углерода взаимопревращаемы.
- При нагревании без доступа воздуха алмаз превращается в графит.
- При очень высоких давлении и температуре из графита получают алмаз.
- В настоящее время ученые получили множество модификаций углерода, представляющие собой различные формы графита: карбин, фуллерен, нанотрубки и некоторые другие.
- Эти формы углерода обладают уникальными свойствами: высокая твёрдость, большая прочность, полупроводниковые свойства и представляют большой интерес для современной техники.
Совсем недавно из графена и нанотрубок учёные получили аэрогель. Это вещество легче воздуха, по твердости близкое к алмазу, способное впитать в себя жидкость по объему в 900 раз больше себя самого.

- Природный уголь образовывался в земной коре миллионы лет путём постепенного испарения и вымывания веществ, состоящих из других химических элементов.
- Сейчас уголь получают и искусственно при нагревании углеродсодержаших соединений без доступа воздуха (чтобы предотвратить горение).
- Разложение органических веществ посредством нагревания без доступа воздуха называют сухой перегонкой.
- При обычных условиях углерод во всех модификациях химически не активен, но при повышенной температуре становится активным и реагирует со многими простыми и сложными веществами.
- Даже с самым сильным окислителем – фтором – углерод реагирует только при 900 °C.
- В химических реакциях он может проявлять как восстановительные, так и окислительные свойства.
- Но восстановительные свойства для него более характерны.
- Как восстановитель углерод взаимодействует с кислородом и оксидами металлов.
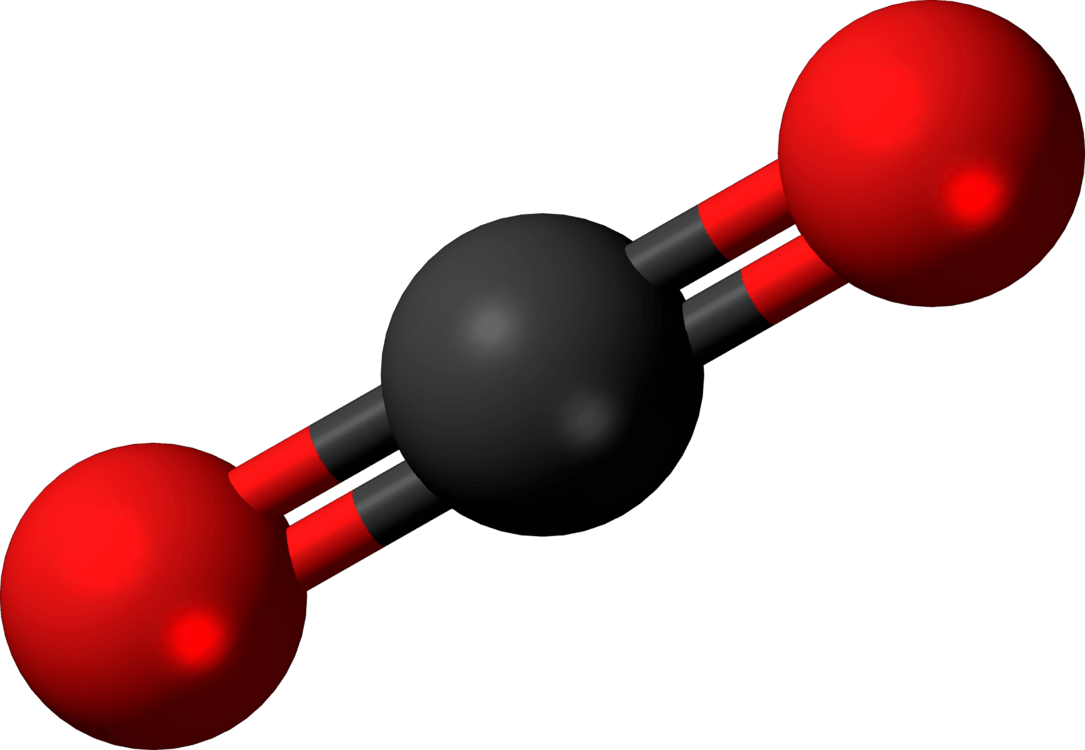
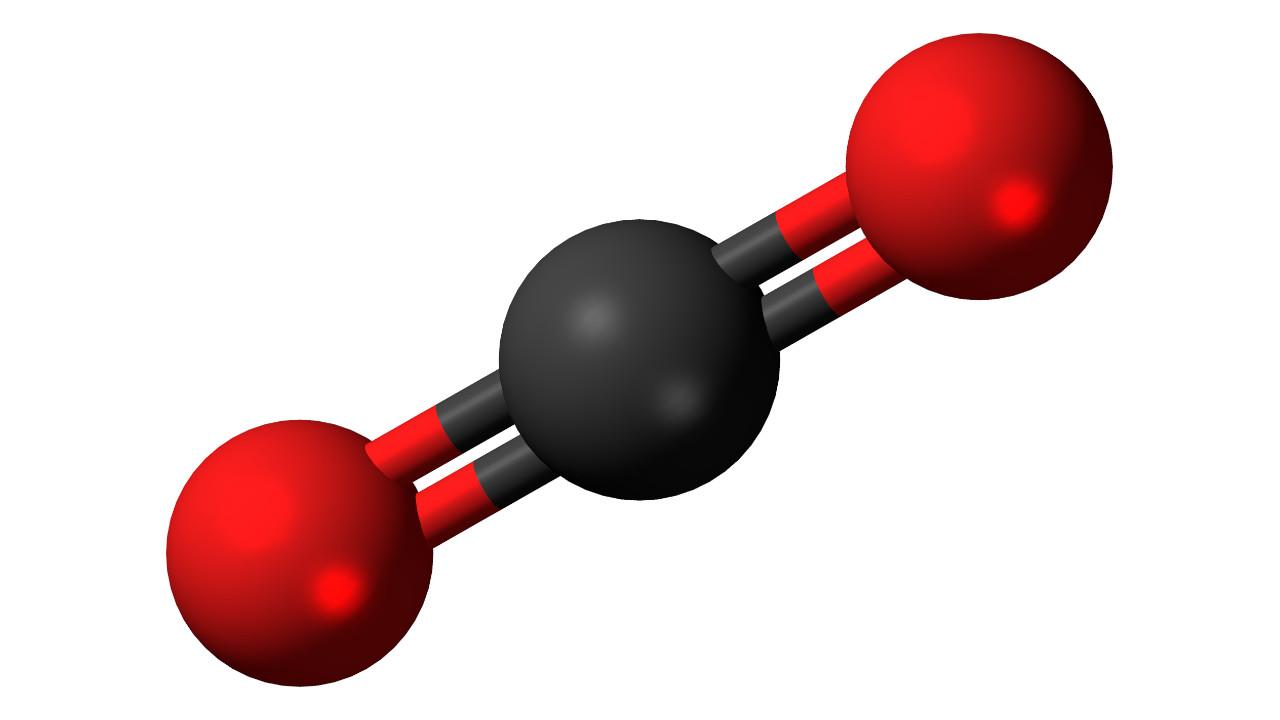
- Углерод горит на воздухе с образованием оксида углерода (IV) – углекислого газа:

- При недостатке кислорода образуется оксид углерода (II) – угарный газ СО.
- Углерод восстанавливает многие металлы из их оксидов, что широко используют в металлургии.
- Как окислитель углерод взаимодействует с металлами и водородом.
- С металлами он образует карбиды металлов:
С водородом образуется метан:
Углерод образует несколько оксидов, два из них: угарный газ СО и углекислый газ СO2 химически устойчивы.
Известен недооксид углерода С3O2– ядовитый газ с удушливым запахом.
Это вещество в малых количествах образуется во всех биологических процессах. Учёные считают, что полимер этого вещества способен защищать живые клетки от вредного воздействия ядов.
- Известны также вещества с формулами
- С12O12
- С12O9
- C5O2.
- Оксид углерода (II) – угарный газ – бесцветный газ без запаха, легче воздуха, нерастворим в воде.
- Это сильный яд!
Он прочно связывается с гемоглобином крови и кровь перестает доставлять кислород к тканям.
Угарный газ может образоваться при неполном сгорании топлива, в том числе автомобильного.
При работе с оксидом углерода (II) необходимо соблюдать особые меры предосторожности. Например, нельзя долго находиться в закрытом гараже с автомобилем при включенном двигателе.
- Угарному газу не соответствует никакая кислота, и он не образует солей.
- Поскольку для углерода наиболее характерна степень окисления +4, оксид углерода (II) является восстановителем.
- Он горит голубоватым пламенем, окисляясь до углекислого газа CO2.
- Углекислый газ CO2– оксид углерода (IV).
- Он образуется при горении угля в избытке кислорода, а также при термическом разложении карбонатов.
- Это бесцветный газ без запаха.
- Он хорошо растворим в воде, на этом основано его применение в изготовлении напитков.
- При растворении в воде он реагирует с ней, образуя очень слабую угольную кислоту H2CO3, которая существует только в виде солей (карбонатов) или в виде водного раствора углекислого газа.
- При обычной температуре и высоком давлении углекислый газ сжижается.
- При его испарении поглощается очень много теплоты и часть его превращается в снегообразную массу – «сухой лёд».
- Сухой лёд применяют для хранения скоропортящихся продуктов.
- Назван он так из-за того, что не плавится, а возгоняется, то есть сразу переходит в газообразное состояние.
- Углекислый газ не горит и не поддерживает горение, поэтому его используют для тушения пожаров.
- Углекислый газ – типичный кислотный оксид: взаимодействует с щелочами и основными оксидами.
- Карбонаты щелочных металлов хорошо растворимы в воде и термически устойчивы.
- Карбонаты всех остальных металлов нерастворимы в воде и при нагревании разлагаются.
- Из карбонатов наиболее широко применяют кристаллическую соду Na2CO3x10Н2О, кальцинированную соду Na2CO3– в стекольной и целлюлозно-бумажной промышленности.
- Питьевая сода – это гидрокарбонат натрия NaHCO3.
- Карбонат калия (поташ) – К2СO3– используют для получения мыла, при изготовлении тугоплавкого стекла.
- Карбонат кальция – CaCO3– известен как известняк, мел и мрамор.
Алмазы из-за своей твёрдости применяют для изготовления наконечников инструментов.
Излишне будет упомянуть, что шлифованные алмазы (бриллианты) очень высоко ценятся в ювелирном деле.
Электропроводность графита используют для изготовления электродов, которые дешевле металлических. Кроме того, графит используют для изготовления технической смазки.
- Уголь различается по своим свойствам в зависимости от природного месторождения и способа обработки.
- Важнейшие технические сорта угля: кокс, сажа, древесный уголь.
- Кокс получают сухой перегонкой природного каменного угля и применяют в качестве восстановителя в металлургии.
- Сажа (копоть) образуется при неполном сгорании многих органических веществ.
- Её применяют для приготовления чёрной краски.
- Добавка сажи к резине повышает прочность автопокрышек и увеличивает срок их службы.
- Древесный уголь получают сухой перегонкой древесины.
- Благодаря пористой поверхности древесный уголь обладает способностью поглощать газы и растворённые вещества.
- Для увеличения поглотительной способности древесный уголь обрабатывают водяным паром.
- Полученный таким способом уголь называют активированным.
- Активированный уголь хорошо поглощает различные газы и растворённые вещества, поэтому его применяют в различных областях техники для очистки.
- Русский химик Зелинский использовал активированный уголь в противогазах, чем спас тысячи жизней в период Первой мировой войны.
Пройти тест
Пройти тест и получить оценку можно после входа или регистрации
Источник: https://ladle.ru/education/himia/8class/uglerod
Углерод химические и физические свойства

Углерод – это, наверное, один из самых впечатляющих элементов химии на нашей планете, который обладает уникальной способностью образовывать огромное множество различных органических и неорганических связей.
Одним словом, углеродные соединения, которые обладают уникальными характеристиками – основа жизни на нашей планете.
Что такое углерод

В химической таблице Д.И. Менделеева углерод находится под шестым номером, входит в 14 группу и носит обозначение «С».
Физические свойства
Это водородное соединение, входящее в группу биологических молекул, молярная масса и молекулярная масса которого – 12,011, температура плавления составляет 3550 градусов.

- Степень окисления данного элемента может быть: +4, +3, +2, +1, 0, -1, -2, -3, -4, а плотность составляет 2,25 г/см3.
- В агрегатном состоянии углерод твердое вещество, а кристаллическая решетка атомная.
- Углерод имеет следующие аллотропные модификации:
- алмаз,
- графит,
- фуллерен,
- карбин.
Строение атома
Атом вещества имеет электронную конфигурацию вида 1S22S22P2. На внешнем уровне у атома 4 электрона, находящиеся на двух разных орбиталях.

Если же брать возбужденное состояние элемента, то его конфигурация становится 1S22S12P3.
К тому же атом вещества может быть первичным, вторичным, третичным и четвертичным.
Химические свойства

Пребывая в нормальных условиях, элемент инертен и во взаимодействие с металлами и неметаллами вступает при повышенных температурах:
- взаимодействует с металлами, вследствие чего образуются карбиды,
- вступает в реакцию с фтором (галоген),
- при повышенных температурах взаимодействует с водородом и серой,
- при повышении температуры обеспечивает восстановление металлов и неметаллов из оксидов,
- при 1000 градусах вступает во взаимодействие с водой,
- при повышении температуры горит.
Получение углерода
Углерод в природе можно найти в виде черного графита либо же, что очень редко, в виде алмаза. Ненатуральный графит получают с помощью реакции кокса с кремнеземом.

А ненатуральные алмазы получают, применяя тепло и давление вместе с катализаторами. Так металл расплавляется, а получившийся алмаз выходит в виде осадка.

Добавление азота приводит к получению желтоватых алмазов, а бора – голубоватых.
История открытия
Углерод использовался людьми с давних времен. Грекам был известен графит и уголь, а алмазы впервые нашлись в Индии. К слову, в качестве графита люди часто принимали схожие по виду соединения. Но даже несмотря на это, графит широко использовался для письма, ведь даже слово «графо» с греческого языка переводится как «пишу».

В настоящее время графит используется так же в письме, в частности его можно встретить в карандашах. В начале 18 века в Бразилии началась торговля алмазами, были открыты многие месторождения, а уже во второй половине 20 века люди научились получать ненатуральные драгоценные камни.
На настоящий момент ненатуральные алмазы используются в промышленности, а настоящие – в ювелирной сфере.
Роль углерода в организме человека
В тело человека углерод попадает вместе с пищей, в течение суток – 300 г. А общее количество вещества в человеческом организме составляет 21% от массы тела.

Из данного элемента состоят на 2/3 мышцы и 1/3 костей. А выводится из тела газ вместе с выдыхаемым воздухом либо же с мочевиной.
Стоит отметить: без этого вещества жизнь на Земле невозможна, ведь углерод составляет связи, помогающие организму бороться с губительным влиянием окружающего мира.
Таким образом, элемент способен составлять продолжительные цепи либо же кольца атомов, которые представляют собой основу для множества других важных связей.
Нахождение в природе углерода
Элемент и его соединения можно встретить повсюду. В первую очередь отметим, что вещество составляет 0,032% от общего количества земной коры.

Одиночный элемент можно встретить в каменном угле. А кристаллический элемент находится в аллотропных модификациях. Также в воздухе постоянно растет количество углекислого газа.
Большую концентрацию элемента в окружающей среде можно встретить в качестве соединений с различными элементами. Например, двуокись углерода содержится в воздухе в количестве 0,03%. В таких минералах как известняк или же мрамор, содержатся карбонаты.
Все живые организмы несут в себе соединения углерода с иными элементами. К тому же остатки живых организмов становятся такими отложениями, как нефть, битум.
Применение углерода
Соединения этого элемента широко используются во всех сферах нашей жизни и перечислять их можно бесконечно долго, поэтому мы укажем несколько из них:
- графит используется в грифелях карандашей и изготовлении электродов,
- алмазы нашли свое широкое применение в ювелирной сфере и в буровом деле,
- углерод используют как восстановитель для выведения таких элементов, как железная руда и кремний,
- активированный уголь, состоящий в основном из этого элемента, широко используется в медицинской области, промышленности и в быту.
Источник: https://tvercult.ru/nauka/uglerod-himicheskie-i-fizicheskie-svoystva
Формула углерода в химии
 Онлайн калькуляторы
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
 Справочник
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?! Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!

Атомная масса: 12,0107 а.е.м.
Электронная формула углерода
Электронная формула: 1s2 2s2 2p2
Электронно-графическая формула углерода
Электронно-графическая формула углерода в основном состоянии:
![]()
Углерод имеет два неспаренных электрона, проявляет валентность II.
Электронно-графическая формула углерода в возбужденном состоянии:
![]()
Углерод имеет четыре неспаренных электрона, проявляет валентность IV.
Углерод образует множество аллотропных модификаций, которые очень сильно различаются между собой по внешнему виду, твердости, электропроводности, химической активности и другим свойствам.
Модификации углерода
Среди аллотропных модификаций углерода выделяют кристаллические:

аморфные:
и кластерные формы:

При нормальных условиях термодинамически устойчивым является только графит, а алмаз и другие кристаллические формы – метастабильны.
Большинство аморфных аллотропных форм являются химическими соединениями с высоким содержанием углерода (обычно мелкодисперсного графита), а не чистой аллотропной формой углерода.
Содержание углерода в земной коре составляет 0,023% по массе. Свободный углерод встречается в природе в виде алмаза и графита. Углерод главным образом накапливается в верхней части земной коры, в биосфере.
Содержание углерода в живом веществе – 18%,в древесине – 50%, каменном угле – 80%, нефти – 85%, антраците – 96%. Большая часть углерода литосферы сосредоточена в виде карбонатов (известняков и доломитов).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-ugleroda/
Углерод
Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
История открытия углерода
Углерод был известен человечеству ещё с глубокой древности. Графит и уголь использовались ещё древними греками, а алмазы нашли применение в Индии. Правда, за графит частенько принимали похожие по внешнему виду соединения. Тем не менее, графит имел широкое применение в древности, в частности для письма.
Даже его название происходит от греческого слова «графо» — «пишу». Графит сейчас используется в карандашах. Алмазами начали впервые торговать в Бразилии в первой половине 18 века, с этого времени открыто множество месторождений, а в 1970 году была разработана технология получения алмазов искусственным путём.
Такие искусственные алмазы применяются в промышленности, натуральные же, в свою очередь, в ювелирном деле.
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…
 Круговорот углерода в природе
Круговорот углерода в природе
Аллотропные модификации углерода
Углерод — уникальный химический элемент, который образует так называемые аллотропные модификации, или, проще говоря, различные формы. Эти модификации подразделяются кристаллические, аморфные и в виде кластеров.
Кристаллические модификации имеют правильную кристаллическую решётку. К этой группе относятся: алмаз, фуллерит, графит, лонсдейлит, углеродные волокна и трубки. Подавляющее большинство кристаллических модификаций углерода на первых местах в рейтинге «Самые твёрдые материалы в мире» .
 Аллотропные формы углерода: a) лонсдейлит; б) алмаз;в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
Аллотропные формы углерода: a) лонсдейлит; б) алмаз;в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Аморфные формы образованы углеродом с небольшими примесями других химических элементов. Основные представители этой группы: уголь (каменный, древесный, активированный), сажа, антрацит.
Самыми сложными и высокотехнологичными являются соединения углерода в виде кластеров. Кластеры — это особая структура, при которой атомы углерода расположены таким образом, что образуют полую форму, которая заполнена изнутри атомами других элементов, например, воды. В этой группе не так уж и много представителей, в неё входят углеродные наноконусы, астралены и диуглерод.
 Графит — «тёмная сторона» алмаза
Графит — «тёмная сторона» алмаза
Применение углерода
Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле — природный газ и нефть. Соединения углерода широко применяются в химической и металлургической промышленности, в строительстве, в машиностроении и медицине.
Аллотропные модификации в виде алмазов используют в ювелирном деле, фуллерит и лонсдейлит в ракетостроении. Из соединений углерода изготавливаются различные смазки для механизмов, техническое оборудование и многое другое.
Промышленность в настоящее время не может обойтись без углерода, он используется везде!
Источник: http://www.alto-lab.ru/elements/uglerod/
Углерод C
Углерод в таблице менделеева занимает 6 место, в 2 периоде.
| Символ | C |
| Номер | 6 |
| Атомный вес | 12.0096000 |
| Латинское название | Carboneum |
| Русское название | Углерод |
Как самостоятельно построить электронную конфигурацию? Ответ здесь C: 1s2 2s2 2p2 Короткая запись:
C: 1s2 2s2 2p2
- Одинаковую электронную конфигурацию имеют атом углерода и N+1, O+2
- Порядок заполнения оболочек атома углерода (C) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Углерод имеет 6 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 2 электрона на 2p-подуровне
Степень окисления углерода
Атомы углерода в соединениях имеют степени окисления 4, 3, 2, 1, -1, -2, -4.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы углерода
C 0
Валентность C
Атомы углерода в соединениях проявляют валентность IV, III, II, I.
Валентность углерода характеризует способность атома C к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа C
Квантовые числа определяются последним электроном в конфигурации, для атома C эти числа имеют значение N = 2, L = 1, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif): 

Источник: https://k-tree.ru/tools/chemistry/periodic.php?element=C
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
| Абсолютная атомная масса химического элемента m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака (произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
- Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
- Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
- Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Химические формулы сложных веществ
- Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле.
При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
- Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
- Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
- Исключение составляют:
- некоторые соединения азота с водородом (например, аммиак NH3, гидразин N2H4);
- соли органических кислот (например, формиат натрия HCOONa, ацетат кальция (CH3COO)2Ca);
- углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
- Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
- алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
- Например:
- 2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
- При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
- в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
- Например:

Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере CaCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 1023 молекул CaCO3 |
| Относительная молекулярная масса вещества (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
| Молярная масса вещества (M) | М(CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе): | Состав карбоната кальция по массе:
|
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: | Молекула СаСО3 состоит из иона Са2+ и иона СО32- 1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионов СО32-; 1 моль (100г) карбоната кальция содержит 40г ионов Са2+ и 60г ионов СО32- |
| Молярный объем вещества при нормальных условиях (только для газов) |
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными.
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:
Метельский А.В. Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год Дата в источнике: 1999 год
Источник: https://mplast.by/encyklopedia/himicheskie-formulyi-veshhestv/
Формула углерода
ОПРЕДЕЛЕНИЕ
Углерод (химический символ — С) представляет собой химический элемент с серийным номером 6. Он расположен во втором периоде в основной подгруппе 4-й группы (в короткой версии периодической таблицы) или в 14-й группе согласно современной нумерации стандарты.
Атомная масса: 12 017 а.е.
E-углеродная формула
Электронная формула: 1s2 2s2 2p2
Электронная графическая углеродная формула
Электронно-графическая формула углерода в основном состоянии:
У углерода есть два неспаренных электрона, имеет валентность II.
Электронно-графическая формула углерода в возбужденном состоянии:
- У углерода есть четыре неспаренных электрона, имеет валентность IV.
- Углерод образует много аллотропных модификаций, которые сильно различаются по внешнему виду, твердости, электропроводности, химической активности и другим свойствам.
- Карбоновые модификации
- Среди аллотропных модификаций углерода испускают кристаллические:
аморфный:
Аморфные формы углерода
и кластерные формы:
В нормальных условиях только графит термодинамически устойчив, а алмаз и другие кристаллические формы метастабильны.
Большинство аморфных аллотропных форм представляют собой химические соединения с высоким содержанием углерода (обычно мелким графитом), а не чистой аллотропной формой углерода.
Содержание углерода в земной коре составляет 0,023% по весу. Свободный углерод встречается в природе в виде алмаза и графита. Углерод в основном накапливается в верхней части земной коры, в биосфере.
Содержание углерода в живом веществе — 18%, в древесине — 50%, каменный уголь — 80%, масло — 85%, антрацит — 96%. Большая часть углерода в литосфере сосредоточена в виде карбонатов (известняк и доломит).
- Примеры решения проблем
- ПРИМЕР 1
Для извлечения 240 г оксида магния потребовалось 80 г угля: каков процент чистого углерода в этом угле?
- Напишите уравнение реакции:
- (
M g O+C=M g+C O
) - Найдите количество вещества оксида магния:
- (
n(M g O)=m(M g O) / M(M g O)=240/40г/моль=6 моль
) - Согласно уравнению реакции
- (
n(C)=n(M g O)=6 моль ) - (
m(C)=n(C) cdot M(C)=6 моль cdot 12г/моль= 72г. ) - Рассчитайте массовую долю углерода в угле:
- (
omega(mathrm{C})=frac{m(mathrm{C})}{m} cdot 100=frac{72 cdot 100}{80}=90 \% )
- Уголь содержит 90% углерода.
- ПРИМЕР 2
Рассчитать, сколько метана (NU) можно получить из 1 тонны угля, массовое содержание углерода, в котором 85%. Выход реакции метана составляет 75% от теоретически возможного.
- Напишите уравнение реакции:
Найдите массу углерода, которая вступила в реакцию: - (
m(C)=frac{omega(C) cdot m}{100}=frac{85 cdot 10^{6}}{100}=8,5 cdot 10^{5} ) г - Рассчитайте количество углеродного вещества:
- (
n(C)=m(C) / M(C)=8,5 cdot 10^{5} г/моль — 7,08cdot 10^{5} моль ) - Согласно уравнению реакции
- (
nleft(C H_{4}
ight)=n(C)=7,08 cdot 10^{5}моль ) - Один моль газа в нормальных условиях составляет 22,4 литра. Вычислите теоретический объем полученного метана:
- (
Vleft(C H_{4}
ight)=nleft(C H_{4}
ight) cdot V_{m}=7,08 cdot 10^{5} мольcdot 22,4 л/моль = 1,587 cdot 10^{6} л=1587м^{3} ) - Найдите фактическое количество произведенного метана:
- (
ext { Vпракт }= ext { Vтеор } cdot eta / 100=1587 cdot 75 / 100=1190м^{3} )
Объем произведенного метана составляет 1190 м3.
Нужны оригинальность, уникальность и персональный подход? Закажи свою оригинальную работу УЗНАТЬ СТОИМОСТЬ
Источник: https://sciterm.ru/spravochnik/formula-ugleroda/
Углерод
Аллотропия углерода
- графит
- алмаз
- карбин
- лонсдейлит
- фуллерены
- углеродные нанотрубки
- графен
- аморфный углерод
уголь техуглерод сажа
Электронные орбитали атома углерода могут иметь различную геометрию, в зависимости от степени гибридизации его электронных орбиталей. Существует три основных геометрии атома углерода.
Тетраэдрическая — образуется при смешении одного s- и трех p-электронов (sp3-гибридизация).
Атом углерода находится в центре тетраэдра, связан четырьмя эквивалентными σ-связями с атомами углерода или иными в вершинах тетраэдра.
Такой геометрии атома углерода соответствуют аллотропные модификации углерода алмаз и лонсдейлит. Такой гибридизацией обладает углерод, например, в метане и других углеводородах.
Тригональная — образуется при смешении одной s- и двух p-электронных орбиталей (sp²-гибридизация). Атом углерода имеет три равноценные σ-связи, расположенные в одной плоскости под углом 120° друг к другу.
Не участвующая в гибридизации p-орбиталь, расположенная перпендикулярно плоскости σ-связей, используется для образования π-связи с другими атомами. Такая геометрия углерода характерна для графита, фенола и др.
Дигональная — образуется при смешении одного s- и одного p-электронов (sp-гибридизация). При этом два электронных облака вытянуты вдоль одного направления и имеют вид несимметричных гантелей. Два других р-электрона дают π-связи. Углерод с такой геометрией атома образует особую аллотропную модификацию — карбин.
Графит и алмаз
Основные и хорошо изученные кристаллические модификации углерода— алмаз и графит. При нормальных условиях термодинамически устойчив только графит, а алмаз и другие формы метастабильны.
При атмосферном давлении и температуре выше 1200 Kалмаз начинает переходить в графит, выше 2100 Kпревращение совершается за секунды. ΔН0 перехода— 1,898 кДж/моль. При нормальном давлении углерод сублимируется при 3780 K. Жидкий углерод существует только при определенном внешнем давлении.
Тройные точки: графит-жидкость-пар Т =4130 K, р =10,7 МПа. Прямой переход графита в алмаз происходит при 3000 Kи давлении 11—12 ГПа.
При давлении свыше 60 ГПа предполагают образование весьма плотной модификации С III (плотность на 15—20% выше плотности алмаза), имеющей металлическую проводимость. При высоких давлениях и относительно низких температурах (ок.
1200 K) из высокоориентированного графита образуется гексагональная модификация углерода с кристаллической решеткой типа вюрцита— лонсдейлит (а =0,252 нм, с =0,412 нм, пространственная группа Р63/ттс), плотность 3,51 г/см³, то есть такая же, как у алмаза.
Лонсдейлит найден также в метеоритах.
Ультрадисперсные алмазы (наноалмазы)
В 1980-е гг. в СССР было обнаружено, что в условиях динамического нагружения углеродсодержащих материалов могут образовываться алмазоподобные структуры, получившие название ультрадисперсных алмазов (УДА). В настоящее время всё чаще применяется термин «наноалмазы». Размер частиц в таких матералах составляет единицы нанометров.
Условия образования УДА могут быть реализованы при детонации взрывчатых веществ с значительным отрицательным кислородным балансом, например смесей тротила с гексогеном. Такие условия могут быть реализованы также при ударах небесных тел о поверхность Земли в присутствии углеродсодержащих материалов (органика, торф, уголь и пр.).
Так, в зоне падения Тунгусского метеорита в лесной подстилке были обнаружены УДА.
Карбин
Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=).
Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³).
Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно— окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу.
Карбин— линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В.В.Коршаком, А.М.Сладковым, В.И.
Касаточкиным и Ю.П.Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР .Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается.
На этом свойстве основано первое практическое применение— в фотоэлементах.
Фуллерены и углеродные нанотрубки
Углерод известен также в виде кластерных частиц С60, С70, C80, C90, C100 и подобных (фуллерены), а также графенов и нанотрубок.
Аморфный углерод
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь.
Нахождение в природе
Содержание углерода в земной коре 0,1% по массе. Свободный углерод находится в природе в виде алмаза и графита.
Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых— антрацит (94—97% С), бурые угли (64—80% С), каменные угли (76—95% С), горючие сланцы (56—78% С), нефть (82—87% С), горючих природных газов (до 99% метана), торф (53—56% С), а также битумы и др.
В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046% СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18%). В организм человека углерод поступает с пищей (в норме около 300 г в сутки).
Общее содержание углерода в организме человека достигает около 21% (15кг на 70кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина)
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др.
Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями.
Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов— в почву и в виде СО2— в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
Химические свойства
При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Химическая активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4, −4, редко +2 (СО, карбиды металлов), +3 (C2N2, галогенцианы); сродство к электрону 1,27 эВ; энергия ионизации при последовательном переходе от С0 к С4+ соответственно 11,2604, 24,383, 47,871 и 64,19 эВ.
Неорганические соединения
Углерод реагирует со многими элементами с образованием карбидов.
Продукты горения— оксид углерода CO и диоксид углерода СО2. Известен также неустойчивый оксид С3О2 (температура плавления −111°C, температура кипения 7°C) и некоторые другие оксиды. Графит и аморфный углерод начинают реагировать с Н2 при 1200°C, с F2— соответственно 900°C.
CO2 с водой образует слабую угольную кислоту— H2CO3, которая образует соли— Карбонаты. На Земле наиболее широко распространены карбонаты кальция (мел, мрамор, кальцит, известняк и др. минералы) и магния (доломит).
Графит с галогенами, щелочными металлами и др. веществами образует соединения включения. При пропускании электрического разряда между угольными электродами в среде N2 образуется циан, при высоких температурах взаимодействием углерода со смесью Н2 и N2 получают синильную кислоту.
С серой углерод дает сероуглерод CS2, известны также CS и C3S2. С большинством металлов, бором и кремнием углерод образует карбиды. Важна в промышленности реакция углерода с водяным паром: С +Н2О =СО +Н2 (Газификация твердых топлив).
При нагревании углерод восстанавливает оксиды металлов до металлов, что широко используется в металлургии.
Органические соединения
Благодаря способности углерода образовывать полимерные цепочки, существует огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др.
Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25%, по массовой доле— около 18%.
Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях.
Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м•К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров.
Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области. В фармакологии и медицине широко используются различные соединения углерода— производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения.
Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей)— для лечения кожных заболеваний; радиоактивные изотопы углерода— для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод— основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды.
В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа пожирают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела.
Биологический цикл углерода заканчивается либо окислением и возврашением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ)— один из важнейших источников энергии для человечества.
Токсическое действие
Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней.
Углерод поступает в окружающую среду в виде сажи в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др.
Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5— 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)•109 Бк/сут 14СО2.
Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания— в основном антракоз и пылевой бронхит.
В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³.
Токсическое действие 14С, вошедшего в состав молекул белков (особенно в ДНК и РНК), определяется радиационным воздействием бета частиц и ядер отдачи азота (14С (β) → 14N) и трансмутационным эффектом— изменением химического состава молекулы в результате превращения атома С в атом N. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0•104 Бк/л, предельно допустимое поступление через органы дыхания 3,2•108 Бк/год.
Дополнительная информация
Источник: http://himsnab-spb.ru/article/ps/c




