Платина – редкий блестящий металл серебристого цвета. Занимает особое место среди остальных благородных металлов, являясь обычно более дорогим, чем золото и серебро.
Это обусловлено тем, что добыча платины – крайне трудоемкий процесс и этот металл встречается очень редко. К примеру, для получения одной унции золота достаточно очистить три тонны руды, а, чтобы извлечь аналогичное количество платины, нужно обработать до десяти тонн породы.
История использования металла
Платина была известна еще до нашей эры. Ее использовали в Древнем Египте для изготовления разнообразных украшений. Также она была распространена в племенах инков, но со временем была забыта. На фото можно увидеть платиновые изделия, обнаруженные археологами:

Только спустя долгое время открытие этого вещества произошло благодаря испанским путешественникам, осваивавшим Южную Америку. Изначально ее не оценивали по достоинству, что видно из названия. «Platina» в переводе с испанского можно сформулировать как «маленькое серебро».
Соответственно и ценилась платина намного меньше, чем драгоценные металлы. Нередко ее даже считали недозревшим золотом или неправильным серебром (благодаря цвету) и попросту выбрасывали. Она отличается тугоплавкостью и высокой плотностью.
Поэтому считалась непригодной для какого-либо использования.
Однако потом было обнаружено интересное свойство – этот драгоценный металл имеет способность легко сплавляться с золотом. Ювелиры взяли это на вооружение и активно стали примешивать платину в золотые изделия, понижая тем самым стоимость их изготовления.
Причем делалось это настолько искусно, что обнаружить подделку было практически нереально. Из-за высокой плотности платины даже малый ее объем увеличивал вес готового изделия, но это компенсировалось добавлением в сплав некоторого количества серебра, что не влияло на цвет.
Такое мошенничество было все же распознано, и ввоз драгоценного металла в Европу на некоторое время был запрещен законом.
В качестве самостоятельного химического элемента платина была признана лишь в середине восемнадцатого столетия. Тщательное изучение ее качеств позволило найти первое применение этого металла.
Физические и эксплуатационные свойства платины, особенно сопротивление различным воздействиям и высокая плотность, послужили основой для того, чтобы изготавливать из нее полезное оборудование. В частности, платиновые реторты успешно применялись для концентрирования едкой серной кислоты.
Делались такие сосуды изначально с помощью ковки либо прессования, так как в те времена научный прогресс не мог обеспечить необходимую температуру в печах для плавления. К концу девятнадцатого века удалось расплавить платину, применив для этого пламя, возникающее при горении гремучего газа.
Платина в России
История этого благородного металла в России берет свое начало в 1819 году, когда он был впервые найден на Урале, недалеко от Екатеринбурга. Через пять лет залежи платины были найдены в Нижнетагильском округе. Россыпи оказались такими обильными, что Россия стремительно стала лидером по добыче во всем мире.
- На фото можно увидеть крупнейший самородок, добытый на этих месторождениях:

- Его вес составлял 12 кг (к сожалению, позднее он был переплавлен).
Уральская платина активно выкупалась иностранными компаниями, особенно возрос экспорт после того, как был разработан промышленный метод очистки ее от примесей и создания чистых слитков серебристого цвета. Изначально за рубежом она пользовалась огромным спросом в Англии и Франции, позднее к ним присоединились США и Германия.
В процессе исследований ученые обнаружили некоторые элементы, входящие в состав самородной платины. Первыми пополнили периодическую таблицу Менделеева палладий и родий, позже были выделены иридий и осмий. И заключительным элементом, входящим в платиновую группу, стал рутений, обнаруженный в 1844 году.
В связи с тем, что объемы добываемой платины на Урале были чрезвычайно высоки и большая часть металла просто не находила достойного применения, в 1828 году было принято решение о выпуске платиновых монет. На фото изображены первые монеты из этого драгоценного металла российского производства.

К тому времени уже был найден способ изготавливать различные изделия высокого качества. Этот метод, получивший название порошковой металлургии, широко используется и в наши дни. На данный момент русские монеты 19 века из платины имеют колоссальную ценность. Стоимость одного экземпляра может доходить до 5000 долларов США.
Для изготовления ювелирных изделий большая часть добытой платины использовалась вплоть до середины двадцатого столетия, после чего ее стали употреблять чаще в технических целях. Она применяется в следующих отраслях:
- Автомобилестроение (для изготовления катализаторов);
- Электротехника (создание элементов для электропечей, подвергающихся воздействию высоких температур);
- Нефтехимический и органический синтез;
- Синтез аммиака.
Также она применяется в изготовлении деталей стекловаренных печей, разнообразного лабораторного оборудования, аппаратуры для производств, где необходимо сопротивление химическим и температурным воздействиям.
Основные свойства
Нередко можно услышать мнение, что платина и белое золото – одно и то же. Но на самом деле такое утверждение в корне неверно, они схожи лишь цветом.
Платина – химический элемент таблицы Менделеева (естественной классификации элементов по электронной структуре атомов), со своими характерными свойствами. Хотя на фото можно заметить некоторое сходство с белым золотом по внешнему виду.
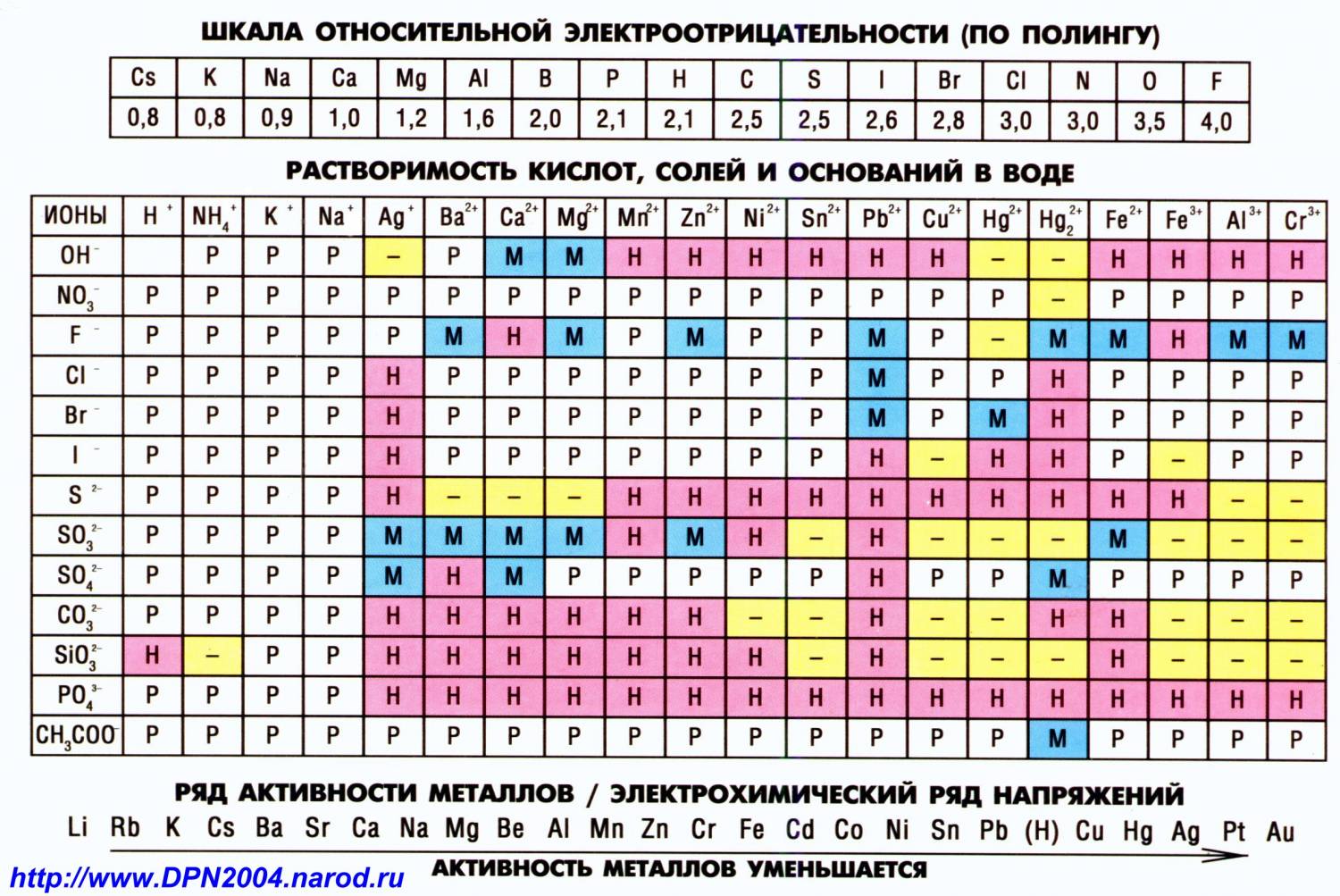
Она представляет собой драгоценный металл серебристого цвета, но выглядит все же несколько иначе, нежели серебро. Отличается от других также своими характеристиками и способами применения.
Физические и химические свойства платины
Этот элемент является тугоплавким металлом с высокой плотностью, для ее плавления необходима температура 1769 градусов по Цельсию, а для закипания – 3800 градусов, что обусловлено низкой удельной теплопроводностью.
Также это один из самых тяжелых металлов в таблице Менделеева. По этому показателю его превосходят лишь два других элемента платиновой группы – осмий и иридий. Плотность в обычных условиях составляет 21,45 грамма на квадратный дециметр. Удельный вес – 21,45 грамма на кубический сантиметр. Этот показатель выше, чем у золота и практически в два раза превосходит удельный вес серебра.
Твердость платины – это еще одно качество, благодаря которому она получила свое применение в промышленности и ювелирном деле. Сопротивление различным внешним воздействиям делает процесс обработки и изготовления изделий более трудоемким, но ее эксплуатационные свойства с лихвой компенсируют такие неудобства.
К примеру, ювелирные украшения могут быть выполнены целиком из чистой платины, в то время как золото и серебро требуют в составе примесей иных материалов для обеспечения прочности.
Также стоит отметить высокую пластичность этого металла. Из него можно изготовить тончайший лист фольги или легкую проволоку, при этом не потеряв основных свойств.
Платина входит в состав группы благородных металлов, так как не имеет способности к окислению и оказывает сопротивление коррозии. Высокая инертность металла не позволяет взаимодействовать с кислотами или щелочами. Может быть растворена только в «царской водке» и жидком броме, подвержена растворению при длительном воздействии горячей серной кислоты.
При нагревании данного вещества возрастает возможность взаимодействия с иными химическими элементами, веществами и сплавами. Увеличение температуры позволяет получить оксид платины, образующийся на поверхности металла. Существует несколько его разновидностей, которые легко отличить по цвету.
Самыми известными являются:
- Черный PtO (темно-серого цвета);
- Оксид платины PtO2 (коричневого цвета);
- Оксид PtO3 (красно-коричневого цвета).
Быстрота и степень окисления этого металла напрямую зависит от того, насколько свободно кислород поступает к поверхности и каково его давление. Препятствием к окислению могут послужить иные металлы, расположенные на поверхности платины. Поэтому наибольшее окисление следует ожидать от чистого металла без каких-либо примесей.
В зависимости от конкретного соединения платина может демонстрировать различную степень окисления. Этот показатель варьируется от 0 до +8.
Обладая достаточно низким удельным сопротивлением, этот металл является неплохим проводником, уступая в этом свойстве алюминию, меди и серебру. Показатель удельного сопротивления близок к железу.
Соответственно, удельная проводимость платины (величина, обратная удельному сопротивлению) занимает аналогичное положение среди других элементов таблицы Менделеева.
Так как она является проводником, ее удельное сопротивление возрастает по мере нагрева, а удельная проводимость, наоборот, падает.
Такое свойство обусловлено тем, что частицы в составе платины начинают двигаться в хаотичном порядке при возрастании температуры. А это, в свою очередь, создает препятствия для прохождения электрического тока.
Одним из наиболее важных качеств, которое широко используется в производстве, является свойство этого благородного металла выступать в качестве катализатора многочисленных химических реакций. Обычно применяется в сплаве с родием либо как платиновая чернь – тонкий порошок характерного черного цвета, получаемый в результате восстановления соединений.
Довольно широко распространены в настоящее время платиновые термометры сопротивления (проиллюстрированы на фото).
Это обусловлено тем, что это вещество практически не подвержено коррозии, имеет высокую степень пластичности, инертности и дает возможность использовать чистый металл для производства.
Немаловажную роль играют и такие качества, как высокое удельное сопротивление и значительный температурный коэффициент сопротивления.
Вывод
Большинство людей представляют себе платину как очень дорогой металл серебристо-белого цвета, который используется для изготовления ювелирных изделий. Однако благодаря своим многочисленным свойствам она получила широкое распространение в различных сферах деятельности человека, от медицины до автомобилестроения.
Хотя за всю историю эксплуатации платины она никогда не использовалась в качестве денег, инвестиции в платину считаются достаточно выгодным видом вложений. Одна унция этого металла превосходит в стоимости аналогичное количество золота на 270$. Если постоянно следить за курсом драгоценных металлов, то можно получить неплохую прибыль.
Источник: http://golden-inform.ru/prochee/chto-takoe-platina/
Химия платины и ее соединений
Московский Государственный Университет им. М. В. Ломоносова
- Химический факультет
- Кафедра общей химии
- Курсовая работа
- Студента 2 курса 226 группы
- Янюшина Александра Михайловича
- ХИМИЯ ПЛАТИНЫ И ЕЕ СОЕДИНЕНИЙ
- Москва – 2002
ОГЛАВЛЕНИЕ
- Введение 2
- Основные свойства 3
- Простые вещества 4
- Соединения Pt (0) 5
- Соединения Pt (II) 5
- Соединения Pt (IV) 8
- Соединения Pt (VI) 10
- Заключение 12
- Список литературы 13
Введение
Платина – один из самых ценных благородных металлов, обладающий рядом важных свойств, благодаря которым используется не только в ювелирной промышленности, но и во многих отраслях промышленности. Использование платины во многих химических технологиях делает актуальным более глубокое исследование ее физических и химических свойств.
Платина — один из самых важных элементов из всего платинового ряда из-за максимальной среди них химической инертности, а также из-за ценнейших свойств платины как мощного катализатора многих химических процессов.
Основные свойства
Платина – серовато-серый металл, относительно мягкий, очень тягучий, ковкий, тугоплавкий. В особых условиях образует губчатую платину (с сильно развитой поверхностью), платиновую чернь (тонкодисперсный порошок) и коллоидную платину.
Благородный металл – занимает последнее (самое электроположительное) место в электрохимическом ряду напряжений. Легко сплавляется с платиновыми металлами (кроме рутения и осмия), а также с Fe, Co, Ni, Cu, Au и другими, с трудом сплавляется с Sb, Bi, Sn, Pb, Ag.
Химически весьма пассивный – не реагирует с водой, кислотами (за исключением «царской водки»), щелочами, гидратом аммиака, монооксидом углерода. Переводится в водный раствор хлороводородной кислотой, насыщенной Cl2. При нагревании окисляется кислородом, галогенами, серой, при комнатной температуре – тетрафторидом ксенона.
Губчатая платина и платиновая чернь активно поглощают значительно количество H2, He, O2. В природе встречается в самородном виде (в сплавах с Ru, Rh, Pd, Os, Ir).
Платина Pt характеризуется следующими константами:
Атомная масса……………………………………….. 195,09
Валентные электроны ……………………………… 5d96s1
Металлический радиус атома, им ….. ……….. 0,138
Условный радиус иона, нм:
Э2+………………………………………………… 0,090
Э4+ ……………………………………………….. 0,064
Энергия ионизации Э0 Э+, эВ …………….. 8,9
Содержание в земной коре, % (мол. доли)… 5*10-8
Для платины наиболее характерна степень окисления +4. Известны также соединения Pt (VI). Для платины наиболее устойчивы координационные числа 4 (тетраэдр или квадрат) и 6 (октаэдр). Степени окисления элемента и отвечающие им пространственные конфигурации комплексов приведены в табл. 1.
Таблица 1. Степени окисления и структурные единицы платины
| Степень окисления | Координационное число | Структурная единица | Примеры соединений |
| 0 | 4 | Тетраэдр | Pt(O2)[Р(С6Н5)3]2 |
| +2 | 4 | Тетраэдр | |
| +2 | 4 | Квадрат | [Pt(NH3)4]2, [Pt(CN)4]2-, [PtCl4]2-, [Pt(NH3)2 Cl2 ]°, PtO |
| +2 | 6 | Октаэдр | |
| +4 | 6 | Октаэдр | Pt(NH3)6]4+, [PtCl6]2-, [Рt(NН3)2Сl4]° |
| +6 | 6 | Октаэдр | PtF6 |
Платина относится к числу редких элементов, встречается в медно-никелевых рудах, а также в самородном состоянии в виде сплавов с небольшим содержанием других металлов (Ir, Pd, Rh, Fe, иногда Ni, Сu и др.). Важным источником платины металлов являются сульфидные полиметаллические медно-никелевые руды.
Простые вещества
- В виде простых веществ платина — блестящий белый металл с серебристым оттенком, кристаллизуется в кубической гранецентрированной решетке.
- Важнейшие константы Pt представлены ниже:
- Пл., г/см3 ………………………………… 21,46
Т. пл., оС ………………………………… 1772
Т. кип., оС ………………………………… ~3900
Электрическая проводимость (Hg=1)…… 10
Hовозг,298 , кДж/моль …………………….. 556
Sо298 , Дж/(К*моль) ……………………… 41,5
о 298 Э2+ + 2е = Э, В …………………….. +1,19
По сравнению с другими платиновыми металлами платина несколько более реакционноспособна. Однако и она вступает в реакции лишь при высокой температуре (часто при температуре красного каления) и в мелкораздробленном состоянии. Получающиеся при этом соединения обычно малостойки и при дальнейшем нагревании разлагаются.
Для платины наиболее характерно поглощение кислорода. Большое значение платина имеет как катализатор окисления кислородом аммиака (в произвол HNO3), водорода (для очистки О2 от примеси Н2) и в других процессах каталитического окисления.
- В электрохимическом ряду напряжений платина расположена после водорода и растворяется при нагревании лишь в царской водке:
- 0 +4
- 3Pt + 4HNO3 + 18НСl = ЗН2[РtCl6] + 4NO + 8H2O
- При сплавлении с щелочами, цианидами и сульфидами щелочных металлов в присутствии окислителей (даже O2) платина переходит в соответствующие производные анионных комплексов.
Платина используется для изготовления коррозионностойкой лабораторной посуды, аппаратов и приборов химических производств, для термометров сопротивления и термопар, а также электрических контактов. Из платины изготавливают нерастворимые аноды, например, для электрохимического производства надсерной кислоты и перборатов. Платина применяются в ювелирном деле.
Соединения Pt (0)
Как и у других d-элементов, нулевая (а также отрицательная) степень окисления у платины проявляется в соединениях с лигандами -донорного и -акцепторного типа: СО, PF3, CN-. При этом при электронной конфигурации центрального атома d10 строение комплексов с лигандами сильного поля чаще всего отвечает структуре тетраэдра.
Для платины, как элемента VIII группы (при электронной конфигурации d8 – d10 ) известны комплексы, в которых роль лигандов играет молекула О2, например Pt(O2)[Р(С6Н5)3]2 .
Молекула О2 — лиганд -типа (подобно CN-, CO, N2, NO). Его присоединение к комплексообразователю реализуется за счет донорно-акцепторного и дативного взаимодействия М—О2 участием -, - и *-орбиталей молекулы O2.
Такие соединения по аналогии с нитрогенильными и карбонильными соединениями можно назвать оксигенильными. Оксигенильные соединения — хорошие передатчики кислорода и катализаторы; за счет активации О2 являются хорошими окислителями уже при обычных условиях. Так, Pt[Р(С6Н5)3]4 поглощает кислород:
- Pt[Р(С6Н5)3]4 + О2 = Pt(O2)[Р(С6Н5)3]2 + 2Р(С6Н5)3
- а образовавшийся Pt(O2)[Р(С6Н5)3]2 является окислителем, например:
- 0 +2
- Pt(O2)[Р(С6Н5)3]2 + 2NO2 = Pt(NO3)2[Р(С6Н5)3]2
- при гидролизе дает пероксид водорода.
Активация молекулярного кислорода за счет комплексообразования имеетбольшое биохимическое значение. Классическим примером является присоединение кислорода к гемоглобину.
Соединения Pt (II)
Для Pt (II) типичны диамагнитные плоскоквадратные комплексы, что объясняется значительной величиной параметра расщепления , как у любого d-элемента 5-го и 6-го периодов.
При большом значении в октаэдрическом комплексе два электрона оказываются на сильно разрыхляющих молекулярных *d-орбиталях.
Поэтому энергетически выгодней становится потеря этих электронов и переход Pt (II) в степень окисления +4 либо перерождение октаэдрического комплекса в плоскоквадратный.
Распределение восьми электронов на орбиталях плоскоквадратного комплекса оказывается энергетически выгоднее, чем на молекулярных орбиталях октаэдрического комплекса. Сосредоточение восьми электронов на четырех молекулярных орбиталях определяет диамагнетизм комплексов плоскоквадратного строения.
Соединения Pt (II) интенсивно окрашены. Структурной единицей соединений Pt (II) является квадрат. Так, в кристаллах PtO (рис. 1) атомы Pt окружены четырьмя атомами кислорода по вершинам четырехугольника. Эти квадраты соединены сторонами в цепи, которые перекрещиваются под углом 90°. Аналогично построены кристаллы PtS.
 Рис. 1. Структура PtO и PtS
Рис. 1. Структура PtO и PtS
Дихлорид платины имеет совершенно другое строение. Красно-черные кристаллы PtCl2 состоят из октаэдрических кластерных группировок Pt6Cl12.
- Хлориды платины могут быть получены прямым синтезом:
- Pt + Cl2 = PtCl2 (t = 500 0C)
- Pt + 2Cl2 = PtCl4 (t = 250 0C)
- Дихлорид PtCl2 можно получить и диссоциацией PtCl4, а также нагреванием платинохлористоводородной кислоты:
- (Н3О)2РtCl6*nH2O = PtCl2 + НС1 + (n + 2)Н2О + Cl2 (t > 300 0C)
- Генетическую связь безводных хлоридов платины передает следующая схема:
- 370 C 475 C 581 C 583 C
- PtCl4 РtC13 PtCl2 PtCl Pt
Обращает на себя внимание очень малая величина температурного интервала, разделяющего области существования хлоридов платины различного состава. Это одно из специфических свойств соединений Pt, имеющих в своей основе высококовалентную кинетически инертную химическую связь.
Оксиды и гидроксиды Pt (II) черного цвета, в воде не растворяются; PtO устойчив также по отношению к кислотам. PtS в кислотах не растворяется.
Из катионных комплексов Pt (II) очень устойчивы и легко образуются амминокомплексы [Pt(NH3)4]2+
PtCl2 + 4NH3 = [Pt(NH3)4]Cl2
Известно также большое число производных катионных комплексов Pt (II) с органическими лигандами. Еще более устойчивы тетрацианидоплатинат (II) [Pt(CN)4]2—иoны (для последнего 4=1*1041). Известен также H2[Pt(CN)4]*3H2O; в водных растворах —это двухосновная сильная кислота (называемая платиносинеродистой).
Платинаты (II) очень многообразны и устойчивы. Например, комплексные галогенйды Pt (II) характеризуются следующими константами устойчивости:
Источник: https://studizba.com/files/show/doc/168502-1-kursovik_platina.html
Соединения палладия и платины
Соединения
со степенью окисления +2.
Степень окисления +2 наиболее характерна
для соединений палладия. Оксиды и
гидроксиды палладия(II) и платины(II)
черного цвета, нерастворимые в воде,
PtO также устойчив к действию кислот. Их
сульфиды, в отличие от сульфидов никеля,
в кислотах не растворяются.
Известны
галогениды палладия(II) и платины(II) и
ограниченное число солей катиона Pd2+:
PdSO4·2H2O,
Pd(NO3)2·2H2O,
PdCl2·2H2O.
Кроме того металлы в этой степени
окисления образуют многочисленные
координационные соединения, например,
М2+1[Э(CN)4],
М2+1[ЭСl4],
[Э(NH3)4]Сl2,
[Э(NH3)4][ЭСl4],
[Э(NH3)2Сl2]
и др.
Координационное число катионов
Pd2+
и Pt2+
равно 4, геомерия координационного
полиэдра – плоский квадрат.
Соединения
со степенью окисления +4. Степень
окисления +4 характерна для платины,
которая образует бинарные соединения
(коричневый оксид PtO2,
сульфид и галогениды) а также амфотерный
гидроксид — PtO2nH2O
с преобладанием кислотных свойств.
- Pt(ОН)4 + 2NaOH = Na2[Pt(ОН)6]; Pt(ОН)4 + 6HCl = H2[PtCl6] + 4H2O
- Платина(IV)
образует большое число координационных
соединений, координационное число
катиона Pt4+
равно 6, например, [Pt(NH3)4Сl2],
[Pt(NH3)6]Сl4. - Производные
палладия(IV) малочисленны и являются
окислителями.
Лекция № 11. Элементы ib- и iib-подгрупп
11.1 Элементы ib-подгруппы (подгруппы меди)
Медь, серебро и золото — полные электронные аналоги с общей электронной формулой
(n-1)d10ns1
при ожидаемой (n-1)d9ns2.
Изменение электронной формулы вызвано
провалом электрона и образованием
завершенного d-подуровня. Вследствие
устойчивости конфигурации d10
для элементов подгруппы меди типичной
является степень окисления +1. Кроме
этого, возможно проявление более высоких
степеней окисления: +2 для меди и +3, +5 для
золота.
Медь
— довольно распространенный элемент
земной коры (0,0036 мол.%), содержание серебра
и золота незначительно, 1,610-6
и 510-8
мол.% соответственно.
Основные минералы
меди: медный колчедан (халькопирит) —
CuFeS2,
медный блеск — Cu2S,
куприт — Cu2O,
малахит CuСО3·Cu(ОН)2.
Серебро и золото образуют сульфидные
минералы, а также встречаются в самородном
состоянии. Важнейшие минералы.
содержащие
серебро и золото: Ag2S
— аргентит, AgCl — кераргирит, AuTe2
— калаверит.
- Для
получения меди применяются пиро- и реже
гидрометаллургические процессы.
Пирометаллургический способ основан
на частичном окислении сернистых руд
до оксидов меди, которые затем
восстанавливаются, реагируя с остатком
сульфида: - 2Cu2O + Cu2S = 6Cu + SО2
- Пирометаллургический
процесс извлечения меди из халькопирита
можно выразить следующим суммарным
уравнением реакций: - 2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SО2
- Для
получения меди высокой степени чистоты
проводится рафинирование при электролизе
раствора СuSO4
с медным анодом.
Серебро
обычно получают в сплаве со свинцом при
переработке полиметаллических руд.
Затем экстрагируют расплавленным
цинком, в котором свинец не растворяется.
Далее цинк отгоняют под вакуумом.
Лучшим
методом отделения золота от пустой
породы является цианидный метод,
основанный на растворении золота в
растворе цианида натрия в присутствии
кислорода. Образующееся координационное
соединение Na[Au(CN)2]
восстанавливают цинком:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au
Медь
имеет красную окраску, серебро — белый
металл, золото — металл желтого цвета.
Медь, серебро и особенно золото отличаются
высокой пластичностью, тепло- и
электропроводностью.
| Свойства | Cu | Ag | Au |
| Плотность, г/см3 | 9,94 | 10,5 | 19,3 |
| Т.пл., С | 1085 | 961 | 1047 |
Медь
широко применяется в электротехнике
для изготовления проводов, печатных
плат и контактов, в металлургии для
получения разнообразных сплавов (латунь,
бронза, монетные сплавы), в химической
промышленности в качестве катализатора.
Медь является биометаллом, входит в
состав гемоцианина — переносчика
кислорода в крови моллюсков. Известно
около 30 белков и ферментов, в состав
которых входит катион меди.
Значительная
часть серебра и золота в виде сплавов
идет на изготовление монет и ювелирных
изделий.
Кроме этого, серебро и золото
широко применяются в радиотехнике и
электронике для изготовления контактов.
Серебро применяется при изготовлении
химической аппаратуры для работы в
агрессивных средах.
Коллоидное серебро
используется в некоторых медицинских
препаратах. Золото — основной валютный
металл.
- Химические
свойства. Медь
— довольно инертный металл, хотя при
нагревании реагирует с кислородом,
серой и галогенами: - t t t
- 2Cu + O2 = 2CuO; Cu + Cl2 = CuCl2 2Cu + S = Cu2S
- При
высокой температуре медь реагирует
также с фосфором, мышьяком, кремнием,
углеродом с образованием соединений
нестехиометрического и переменного
состава (бертолидов). - В
ряду стандартных электродных потенциалов
медь стоит после водорода, поэтому с
кислотами, не являющимися окислителями,
не реагирует. Однако в присутствии
кислорода растворяется в концентрированной
хлороводородной кислоте: - 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O
- Металлическая
медь растворяется в азотной и
концентрированной серной кислоте. Легко
растворяется медь также в растворах
цианидов, в аммиаке и растворах солей
железа(III): - 4Cu + 8NaCN + 2H2O + O2 = 4Na[Cu(CN)2] + 4NaOH
- 4Cu + 8NH3 + 2H2O + O2 = 4[Cu(NH3)2](OH)
- Cu + 2FeCl3 = CuCl2 + 2FeCl2
Серебро
и золото — химически весьма инертны.
Серебро при нагревании реагирует с
галогенами, серой, фосфором и углеродом
с образованием AgHal, Ag2S,
Ag3P,
Ag4C.
Во влажном воздухе уже при комнатной
температуре серебро реагирует с
сероводородом:
- 4Ag + 2H2S + O2 = 2Ag2S + 2H2O
- Золото легко реагирует
с галогенами (с хлором в присутствии
влаги уже на холоду): - H2O
- 2Au + 3Cl2 2AuCl3
- С
кислородом, серой, азотом и бором золото
не реагирует, при нагревании вступает
во взаимодействие с теллуром и фосфором,
образуя AuTe2,
Au3P4. - Серебро
растворимо в азотной и концентрированной
серной кислотах. Золото — в царской водке
(смесь концентрированных азотной и
соляной кислот в соотношении 1:3): - Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
- Серебро
и золото легко растворяются в растворах
цианидов щелочных металлов в присутствии
окислителей: - 4Au + O2 + 8KCN + 2H2O = 4K[Au(CN)2] + 4KOH
Источник: https://studfile.net/preview/2277422/page:40/
Платина
ПЛАТИНА, Pt (исп. platina, уменьшит. от plata — серебро *а. platinum; и. Platin; ф. platine; и. platino), — химический элемент VIII группы периодической системы Менделеева, атомный номер 78, атомная масса 195,09. Платина первый в группе платиновых металлов.
В природе 5 стабильных изотопов: 192Pt(0,78%), 194Pt(32,3%), 195Pt(33,8%), 196Pt (25,2%), 198Pt (7,19%). Изотопы 190Pt слабо а-радиоактивен с периодом полураспада Т1/2 6,9•1011 лет. Известно также свыше 20 искусственных изотопов платины с массовыми числами от 173 до 201. Платина известна с древнейших времён (Египет, Эфиопия и др.
), описана как самостоятельный металл в 1752, в чистом виде получена впервые в 1803 английским учёным У. Х. Волластоном.
Свойства платины
Платина — серебристо-белый металл, в чистом виде обладает значительной ковкостью и тягучестью, хорошо прокатывается в тонкие листы, протягивается и штампуется. Кристаллизуется в гранецентрированной кубической решётке (а=0,3916 нм).
Физические свойства: плотность 21 460 кг/м3; t плавления 1772°С; t кипения около 3900°С; теплоёмкость 25,8 Дж/(моль•К); температурный коэффициент линейного расширения 9•10-6 К-1; удельное электрическое сопротивление (при 0°С) 9,81•10-4 Ом•м; модуль упругости 169,94 ГПа; твердость по Бринеллю 460,91 ГПа; предел прочности при растяжении 140,24 МПа; относительное удлинение 31%. Платина парамагнитна. Степень окисления +2, +4, реже +1, +3, +5 и +6.
Платина химически малоактивна. При комнатной температуре устойчива ко всем реагентам, кроме царской водки и брома. Медленно реагирует с горячей концентрированной HNO3 и с кипящей Н2SO4.
Расплавленные щёлочи корродируют платину, аналогично действуют расплавленные оксиды, цианиды и сульфиды щелочных металлов. Платину активно поглощает водород, хотя и в гораздо меньшей степени, чем Pd. С галогенами реагирует при нагревании, с S, Se, Te, R, As, Si, С — при температуре красного каления.
Известны оксиды Pt(II), Pt(III), Pt(IV). PtO разлагается при нагревании с выделением металлической платины.
Содержание платины в природе
Платина — очень редкий элемент, среднее содержание в земной коре 5•10-7% (по массе), в каменных метеоритах 2•10-4 %, в ультраосновных породах 2•10-5%, средних — 1•10-5 %. Платина встречается в виде самородного металла (см. Платина самородная) и его сплавов, а также в виде минералов сульфидов, важнейшие из которых — поликсен, палладистая платина, ферроплатина, сперрилит, куперит.
Получение платины
Для получения чистой платины исходные материалы — самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), концентраты платиновых металлов, полученные обогащением руд, лом — подвергают гидрометаллургической переработке и восстановлению водородом при повышенной температуре. Полученную губку спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты.
Применение платины
В химической промышленности из платины и её сплавов изготовляют детали приборов и аппаратов, непосредственно контактирующие с агрессивными веществами или подвергающиеся воздействию высоких температур. Платина исключительно стойка к действию фторсодержащих соединений при высоких температурах.
Больше всего платины расходуется для приготовления катализаторов, особенно для каталитического риформинга на нефтеперерабатывающих заводах. Платиновые сплавы применяют в стекольной промышленности. В электротехнике платиновые сплавы используют для изготовления контактов.
Широко применяются покрытые платиной электроды. Некоторые сплавы платины с Со и с Sm, обладающие сильными ферромагнитными свойствами, используются для изготовления постоянных магнитов. Для ювелирных изделий применяют сплавы платины с 5-10% Jr или 5% Ru.
Из наиболее чистой платины изготовляют термометры сопротивления и термопары для измерения температур, превышающих 1000°С.
Источник: http://www.mining-enc.ru/p/platina/
Составление координационных формул комплексных соединений
Задание 301Определите заряд комплексного нона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, К2[PtCl6], К[Аg(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах.Решение:Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку.
Координационное число комплексообразователя равно числу лигандов, координированных вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисения всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О,NH3) равны нулю.
Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда:
Заряд иона Координ. число Степень окисл.
- а) [Cu(NH3)4]SO4 2+ 4 +2б) К2[PtCl6] 2- 6 +4в) К[Аg(CN)2] 1- 2 +1
- Комплексные соединения диссоциируют как сильные электролиты необратимо:
- а) [Cu(NH3)4]SO ⇔ [Cu(NH3)4]2+ + SO42-;б)К2[PtCl6] ⇔ 2К+ + [PtCl6]2-;в) К[Аg(CN)2] ⇔ К+ + [Аg(CN)2]-
- Задание 302Составьте координационные формулы следующих комплексных соединений платины:
РtCl4 . 6NH3; РtCl4 . 4NH3; РtCl4. 2NH3. Координационное число платины (IV) равно шести. Напишите уравнение диссоциации этих соединений в водных растворах. Какое из соединений является комплексным неэлектролитом?Решение:
Формулы комплексных соединений:
а) РtCl4 . 6NH3: [Pt(NH3)6]Cl4 – хлорид гексаамминплатины(IV);б)4NH3; РtCl4: [Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины(IV);в) РtCl4. 2NH3: [Pt(NH3)2Cl4] – тетрахлородиамминплатина.
- Уравнения диссоциации этих комплексных соединений:
- а) [Pt(NH3)6]Cl4 ⇔ [Pt(NH3)6]4+ + 4Сl-;б) [Pt(NH3)4Cl2]Cl2 ⇔ [Pt(NH3)4Cl2]2+ + 2Cl-;в) [Pt(NH3)2Cl4] – данное соединение является неэлектролитом.
- Задание 303Составьте координационные формулы следующих комплексных соединений кобальта:
СоCl3 . 6NH3; СоCl3 . 5NH3; СоCl3 . 4NH3. Координационное число кобальта (III) равно шести .Напишите уравнения диссоциации этих соединений в водных растворах.
Решение:Формулы комплексных соединений:
а) СоCl3 . 6NH3: [Со(NH3)6]Cl3 – хлорид гексаамминкобальта(III);б) СоCl3 . 5NH3: [Co(NH3)5Cl]Cl2 – хлорид хлоропентаамминкобальта(III);в) СоCl3 . 4NH3: [Со(NH3)4Cl2]Cl – хлорид дихлоротетрамминкобальта(III).
Уравнения диссоциации этих комплексных соединений:
а) [Со(NH3)6]Cl3 ⇔ [Со(NH3)6]3+ + 3Сl-;б) [Co(NH3)5Cl]Cl2 ⇔ [Co(NH3)5Cl]2+ + 2Cl-;в) [Со(NH3)4Cl2]Cl ⇔ [Со(NH3)4Cl2]+ + Cl-
Источник: http://buzani.ru/zadachi/khimiya-shimanovich/957-kompleksnye-soedineniya-zadachi-301-303
Большая Рнциклопедия Нефти Рё Газа
Cтраница 3
В соответствии с той же мыслью об ординарности всех химических явлений, в том числе и каталитических, Ходнев критикует и теорию катализа Либиха. В этом случае он прибегает к относительно простому примеру окисления платины азотней кислотой в присутствии серебра. [31]
В соответствии с той же мыслью об ординарности всех химических явлений, в том числе и каталитических, Ходнев критикует и теорию катализа Либиха. В этом случае он прибегает к относительно простому примеру окисления платины азотнвй кислотой в присутствии серебра. [32]
Комплексные роданиды получены для всех платиновых металлов Рё золота ( РєСЂРѕРјРµ РѕРѕРјРёСЏ) РїСЂРё взаимодействии комплексных хлоридов этих металлов СЃ избытком роданидов Щелочных металлов. Поскольку РЎР«5 — — РёРѕРЅ — восстановитель, комплексные роданиды образуются преимущественно Сѓ низших степеней окисления платины, рутения Рё РёСЂРёРґРёСЏ. Соли щелочных металлов комплексных роданидов, Р·Р° исключением роданидов золота, хорошо растворимы РІ РІРѕРґРµ Рё РІ спирте. [33]
Комплексные ( роданиды получены для всех платиновых металлов Рё золота ( РєСЂРѕРјРµ РѕСЃРјРёСЏ) РїСЂРё взаимодействии комплексных хлоридов этих металлов СЃ избытком роданидов Щелочных металлов. Поскольку РЎР«5 — — — РёРѕРЅ — восстановитель, комплексные роданиды образуются преимущественно Сѓ низших степеней окисления платины, рутения Рё РёСЂРёРґРёСЏ. Соли щелочных металлов комплексных роданидов, Р·Р° исключением роданидов золота, хорошо растворимы РІ РІРѕРґРµ Рё РІ спирте. [34]
Гринберг и Птицын предложили объемный метод определения платины ( II) титрованием комплексов раствором перманганата калия.
При наличии во внутренней сфере пиридина наблюдается завышенный расход КМпО4 по сравнению с тем, сколько его должно пойти лишь на окисление платины.
В комплексах платины ( IV) пиридин не окисляется перманга-натом. В свободном состоянии пиридин также не окисляется.
Аналогично пиридину ведут себя алифатические амины и аминосульфоновая кислота. [35]
Одной из реакций образования диоксигенильных соединений является взаимодействие PtFe с кислородом.
Фторид платины так сильно притягивает электроны, что отрывает их даже от кислорода и получается соединение О2 ( PtFe) -, в котором степень окисления платины равна пяти. [37]
Встречаются комплексы, в которых окисляется как центральный ион, так и лиганды независимо друг от друга.
Так, например, СЃ помощью потенциометрического титрования установлено, что РїСЂРё окислении оксалатов платины ( II) получаются РґРІР° потенциала: РѕРґРёРЅ РёР· РЅРёС… отвечает окислению платины, Р° РґСЂСѓРіРѕР№ — оксалат-ионам. Таким образом, течение окислительно-восстановительных реакций комплексных соединений зависит РѕС‚ РїСЂРёСЂРѕРґС‹ СЃРІСЏР·Рё различных лигандов СЃ центральным РёРѕРЅРѕРј. [38]
В настоящей работе была сделана попытка получить экспериментальное подтверждение возможности окислительного процесса на платиновом электроде при потенциалах области двойного слоя. Возникающие при этом трудности связаны с тем, что сложно получить поверхность электрода, полностью свободную от адсорбированных кислорода и водорода, а также с малой скоростью окисления платины и возможностью адсорбции водорода в области изучаемых потенциалов. [39]
Универсальность этой формулы определяется только степенью независимости величин-удельной хемссорбции х и у от типа исследуемых образцов Pt-катализаторов.
Р’РѕРїСЂРѕСЃ Рѕ зависимости удельной хемосорбции кислорода РЅР° платине O / Pta РѕС‚ условий измерения ( Рў, Р , С‚) Рё типа образца РїРѕРґСЂРѕР±РЅРѕ рассматривался РІ начале раздела, РіРґРµ, РІ частности, указаны оптимальные условия проведения окисления платины. Предельное заполнение поверхности Pt РІРѕРґРѕСЂРѕРґРѕРј, отвечающее yH / Pta-2 согласно [6], можно получить РїСЂРё охлаждении Pt РІ среде Рќ2 РѕС‚ 100 — 200 РґРѕ — 196 РЎ. [40]
�з табл. 2.10 видно, что при обработке воздухом отработанного алюмоплатинового катализатора дисперсность платины возрастает весьма, незначительно.
В отличие от кислорода, воздействие хлора на платину в инертной среде значительно сильнее.
Увеличение степени окисления платины при ее хлорировании не зависит от размера кристаллитов. [41]
К 0 5 г тораис-дигидроксиламиндинитроплатины, получаемой по методу �. �.
Черняева [2] из соли Александера ( NH2OH) 2Gl2Pt действием на холоду на ее насыщенный раствор рассчитанного количества нитрита натрия, добавляют небольшое количество воды.
Через образовавшуюся взвесь пропускают газообразный хлор.
При этом происходит окисление платины с одновременным окислением гидроксиламина ( до элементарного азота) и замещением его на хлор.
Продуктом окисления является ( N02) 2Cl4PtH2, которая переходит РІ раствор, окрашивая его РІ желтый цвет. После прекращения выделения азота пропускают хлор еще 2 — 3 РјРёРЅ. Осадок отфильтровывают, промывают 2 — 3 раза холодной РІРѕРґРѕР№, Р° затем спиртом Рё эфиром. Соль кристаллизуется без РІРѕРґС‹. [42]
РќРѕ, РєРѕРіРґР° речь идет РѕР± элементе в„– 78 Рё его аналогах, почти так же, как валентность, важна другая характеристика — координационное число.
Оно означает, сколько атомов ( или групп атомов), лигандов, может расположиться вокруг центрального атома в молекуле комплексного соединения.
Наиболее характерная степень окисления платины РІ ее комплексных соединениях — 2 Рё 4; координационное число РІ этих случаях равно соответственно четырем или шести. [43]
РќРѕ, РєРѕРіРґР° речь идет РѕР± элементе в„– 78 Рё его аналогах, почти так же, как валентность, важна другая характеристика — координационное число.
Оно означает, сколько атомов ( или групп атомов), лигандов, может расположиться вокруг центрального атома в молекуле комплексного соединения.
Наиболее характерная степень окисления платины в ее комплексных соединениях 2 и 4; координационное число в этих случаях равно соответственно четырем или шести. [44]
Введение РІ реакционную среду молекулярного хлора ( также РіРёРїРѕ-хлорита) дает возможность получить гексаммин РёР· разнообразных производных РґРІСѓС… — Рё четырехвалентной платины.
Ртот СЃРїРѕСЃРѕР± ведения реакции, РЅРµ будучи приспособленным для использования РІ качестве метода получения гексаммина, представляет интерес для вскрытия механизма его образования.
Механизм этот состоит в многократном попеременном восстановлении и окислении платины, сопровождающимися переходом от октаэдрической конфигурации к плоскостной и обратно.
[45]
Страницы: 1 2 3 4
Источник: https://www.ngpedia.ru/id207104p3.html




