

Время на чтение: 12 минут 
Химические и физические свойства
Согласно данным британского Королевского химического общества, кремний является седьмым по распространенности элементом во вселенной и вторым на Земле после кислорода. Кремний (силициум) составляет около 25 процентов земной коры и является очень полезным элементом, жизненно важным для многих отраслей промышленности.
Химические и физические свойства:

- Атомный номер (количество протонов в ядре): 14.
- На внешнем энергетическом уровне вещества находится 4 электрона.
- Атомный символ (в периодической таблице элементов): Si.
- Плотность: 2,33296 грамма на кубический сантиметр.
- Атомный вес (молярная масса атома): 28.09.
- Состояние при комнатной температуре: твердое.
- Точка кипения: 3265 градусов Цельсия (5,909 градуса по Фаренгейту).
- Количество изотопов (атомов одного и того же элемента с разным количеством нейтронов): 24.
- Температура плавления: 1414 градусов по Цельсию (2577 градусов по Фаренгейту).
- Наиболее распространенный изотоп: Si-28 (природное содержание — 92%).
- Электронная формула кремния — 1s 22s 22p 63s 23p2.
- Параметр кристаллической решетки кремния равен 0,54307 нм.
- Является 14-м элементом таблицы Менделеева.
В природе кремний не встречается сам по себе. Обычно он связывается с двумя молекулами кислорода, в результате чего обнаруживается в виде диоксида кремния, иначе называемого кремнеземом, из которого состоит кварц.
Качества вещества

Силиций был впервые выделен в 1824 году шведским химиком Йенсом Якобом Берцелиусом, который также обнаружил церий, селен и торий, согласно Фонду химического наследия. Ученый нагревал кремнезем с калием, чтобы очистить кремний. Сегодня процесс получения выглядит иначе — происходит нагревание углерода с кремнеземом в форме песка, чтобы изолировать элемент.
Кремний не является ни металлом, ни неметаллом: это металлоид, элемент, который находится где-то посередине. Эта категория — серая область, нет четкого определения того, каким требованиям она отвечает.
Но металлоиды обычно имеют свойства как металлов, так и неметаллов. Кремний является полупроводником, это означает, что он проводит электричество.
Однако, в отличие от типичного металла, он лучше проводит ток при повышении температуры (металлы же ухудшают проводимость повышенных температурах).

Кремний находит применение и в производстве низкотехнологичных творений, таких как кирпичи и керамика. При присоединении водорода к оксиду силиция образуется гидроксид. Гидрозоли кремниевых кислот применяют в фототехнике, а также в качестве адсорбентов.
Но высокотехнологичные изделия — сфера, где элемент действительно оставляет видимый след.
В качестве полупроводника кремний используется для изготовления транзисторов, которые усиливают или переключают электрические токи и являются основой электроники от радиоприемников до смартфонов.
Кремний по-разному используется в солнечных элементах и компьютерных микросхемах, одним из примеров является полевой транзистор с оксидом металла и полупроводника, основной переключатель во многих электронных устройствах. Создавая пространства из чистого силиция, инженеры получают зазор, в котором электроны не могут течь — это как переключатель в положении «выключено».
Для включения металлическая пластина, подключенная к источнику питания, помещается рядом с кристаллом. Когда электричество течет, пластина становится положительно заряженной.
Электроны с отрицательным зарядом притягиваются к положительному заряду, что позволяет им совершать прыжок через сегмент чистого кремния. (Другие полупроводники, кроме кремния, также могут использоваться в транзисторах.)
Кремниевые формы жизни
Группа IV Периодической таблицы элементов содержит углерод C, силициум (кремний) Si и несколько тяжелых металлов. Это значит, что степень окисления кремния равна +4.
Углерод, конечно, является строительным материалом жизни, какой мы ее знаем. Но теоретики альтернативной биохимии предполагают, что населенная живыми существами планета может существовать в какой-то другой солнечной системе.
У такой формы жизни кремний якобы может заменять углерод.

Многие научно-фантастические произведения рассказывают о кремниевых формах жизни — чувствительные кристаллы, живые золотые песчинки и даже существа, чьими следами являются кирпичи из кремнезема. Это интересно, но неправильно. Кремний может превратиться во множество реалистичных структур, но его химические свойства делают маловероятной возможность стать основой для инопланетных форм жизни.

Действительно, углерод и силиций имеют много общих характеристик. Валентность кремния равна четырем, это означает, что отдельные атомы образуют четыре связи с другими элементами при образовании химических соединений. И силиций, и углерод связываются с кислородом.
Оба образуют длинные цепи, называемые полимерами. В простейшем случае углерод дает полимер под названием полиацеталь, пластик, используемый в синтетических волокнах и оборудовании.
Кремний дает полимерные силиконы, которые используются для водонепроницаемой ткани или смазки металлических и пластиковых деталей.
Но когда углерод окисляется — или соединяется с кислородом, скажем, во время горения — он становится газообразным углекислым газом; силиций же окисляется до твердого диоксида, называемого кремнеземом. Кремний окисляется до твердого вещества. Это одна из основных причин того, почему он не может поддерживать жизнь.

Кремнезем или песок — это твердое вещество, диоксид кремния образует решетку, в которой один атом силиция окружен четырьмя атомами кислорода. Силикатные соединения, содержащие SiO4−4, также существуют в ряде минералов — полевых шпатах, слюде, цеолитах, тальке. И эти твердые системы создают проблемы в том, что касается утилизации энергии для живой системы.
Жизненная форма нуждается в некотором способе сбора, хранения и использования энергии. Она должна исходить из окружающей среды. После поглощения энергия должна высвобождаться именно там, где это необходимо, и в то время, когда это нужно. В противном случае вся она может высвобождать тепло одновременно, сжигая жизненную форму.
В мире на основе углерода основным элементом накопления являются углеводы, которые окисляются до воды и углекислого газа. Форма жизни на основе углерода «сжигает» энергию контролируемыми шагами, используя регуляторы скорости, называемые ферментами.
Интересные факты о кремнии
Этот элемент чрезвычайно распространен и очень широко используется. Но есть вещи, которые про него знают далеко не все:

- Когда астронавты Аполлона-11 приземлились на Луну в 1969 году, они оставили белый мешочек с кремниевым диском. Микроскопическим шрифтом там написано 73 сообщения на разных языках. Они выражают пожелания мира.
- Кремний может быть опасным. При вдыхании в течение длительных периодов времени это может вызвать заболевание легких, известное как силикоз.
- Переливчатость опала — результат присутствия кремния. Этот драгоценный камень — форма кремнезема, связанная с молекулами воды.
- Карбид кремния (SiC) почти такой же твердый, как алмаз. Он оценивается 9−9,5 по шкале твердости по Моосу, лишь немного меньше, чем самое крепкое вещество, которое имеет 10 баллов твердости.
- Растения используют кремний для укрепления клеточных стенок. Элемент является важным питательным веществом, которое помогает придать устойчивость к болезням. Об этом говорится в статье 1994 года, опубликованной в журнале Proceedings.
- Кремниевая долина получила свое название от вещества, используемого в компьютерных чипах. Название это впервые появилось в 1971 году в газете Electronic news. Своя Кремниевая долина есть не только в США, но и во многих других странах.
- Аморфная форма вещества также используется в радиоэлектронной технике.
- У некоторых минералы и полудрагоценных камней строение основывается на диоксиде кремния. Они различаются плотностью и цветом:
- Аметист.
- Морион.
- Цитрин.
- Горный хрусталь.
- Опал.
- Агат.
- Сердолик.
- Яшма.
И другие камни.
Современные исследования
Сегодняшние разработки в области кремниевых технологий выглядят чуть ли не фантастично: в 2006 году исследователи объявили, что создали компьютерный чип, в котором кремниевые компоненты смешаны с клетками мозга.
Это было действительно сенсационное открытие. Электрические сигналы от клеток мозга могут передаваться на электронные кремниевые компоненты чипа и наоборот.
Есть надежда, что со временем получится создать устройства для лечения неврологических расстройств.
Исследование 2018 года, опубликованное в журнале Nature, было посвящено тестированию нового типа устройства из кремния, квантовых компьютеров, которые могут когда-нибудь стать обычной вещью, превосходя при этом современные компьютерные технологии в возможностях выполнять большое количество вычислений параллельно. Создание этих технологий с использованием тех же методов для изготовления традиционных кремниевых чипов может ускорить разработку этих устройств. Это может привести к новому этапу использования квантовых устройств.
Ученые также обещают создать невероятно маленькие лазеры, называемые наноиглами, которые могут использоваться для передачи данных быстрее и эффективнее, чем традиционные оптические кабели.
Сверхпроводниковые лазеры выделяют тепло гораздо легче, чем стеклянные, кремниевые лазеры могут похвастаться большей мощностью, чем традиционные, так заявляет Джон Баддинг, ученый-химик из Университета Пенсильвании.
Специалисты также работают над созданием оптических волокон следующего поколения, которые объединяют сверхпроводники, а не просто стекловолокно, так написано в журнале Live Science.
В радиоэлектронной технике распространено применение силана, который получают при разложении силицида магния при помощи кислоты.
Традиционные кремниевые чипы изготавливаются путем нанесения слоев элемента на плоскую поверхность, обычно начиная с газа-прекурсора силан (SiH4), поэтому новые разработки оптических волокон не потребуют нового дорогостоящего оборудования.
Источник: https://nauka.club/khimiya/khimicheskiy-element-kremniy.html
Электронное строение атома кремния и химические свойства свободного кремния
Задача 960.Дать краткую характеристику кремния, указав: а) электронное строение атома и его валентные возможности; б) химические свойства свободного кремния.
Решение: а) Кремний – элемент с порядковым номером 14, расположен в третьем периоде в главной подгруппе IV-ой группы периодической системе химических элементов Д. И. Менделеева.
Атом кремния содержит 14 электронов на трёх энергетических уровнях, на валентном уровне — 4 электрона; заряд ядра равен +14 (14 протонов и 14 нейтронов). Следовательно, электронную формулу кремния можно записать так: 1s22s22p63s23p2.
На внешнем валентном уровне атом кремния содержит четыре электрона, из которых два расположены на 3s-подуровне и два неспаренных на 3р-подуровне. Графически строение атома кремния можно представить так:

Так как на внешнем электронном слое атом кремния содержит два неспаренных электрона, то его валентность (ковалентность) равна 2 в основном состоянии. При возбуждении атома кремния один из 3s-электронов перейдёт на свободную 3d-орбиталь. Что можно представить электронной формулой 2s22p23d0 или графически:
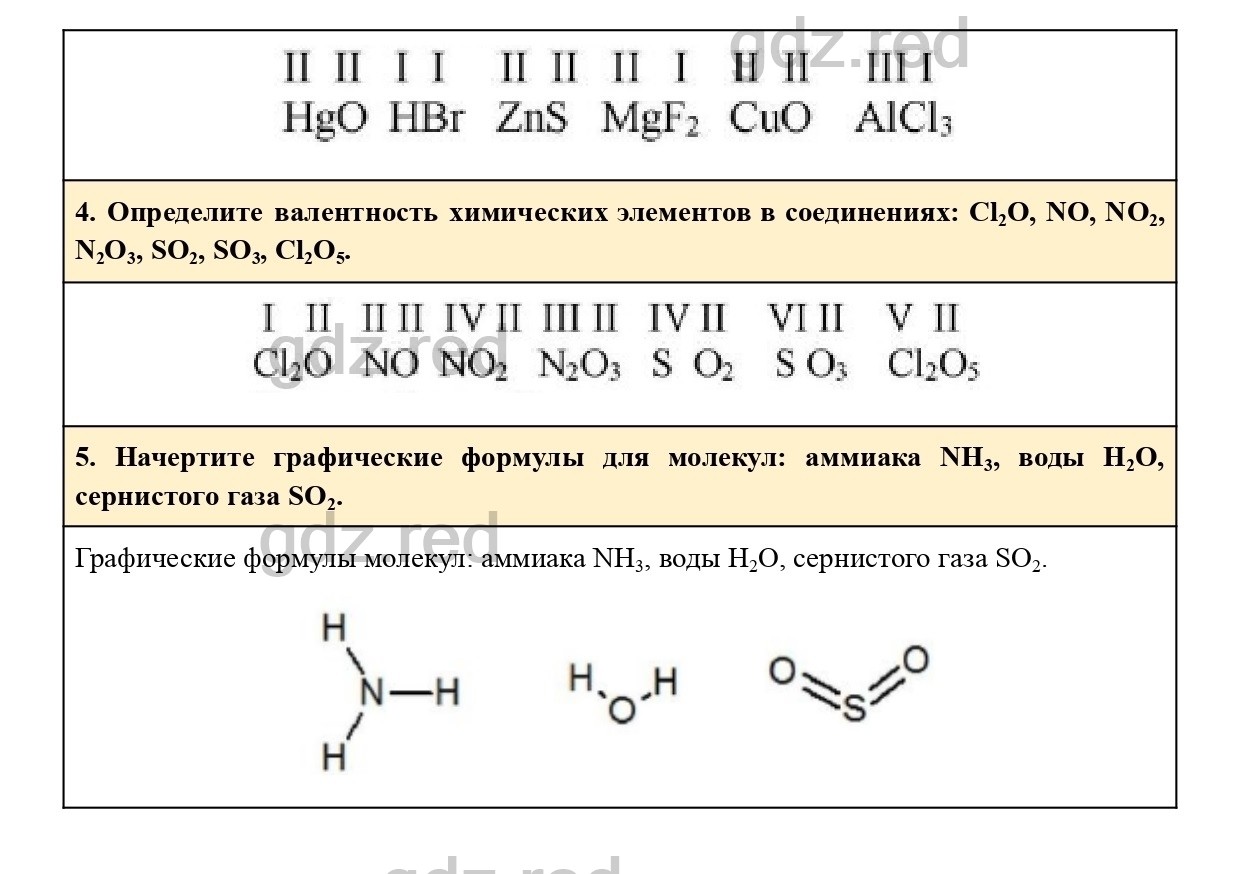
- Следовательно, в возбуждённом состоянии атом кремния (или четыре неспаренных электрона) будет проявлять валентность (или ковалентность) равную 4. б) При обычных условиях свободный кремний химически инертен и реагирует только с фтором с образованием тетрафторида кремния:
- Si + 2F2 = SiF4.
- От взаимодействия с кислородом даже при нагревании кремний защищает оксидная плёнка:
- Si + O2 SiO2
- При температуре выше 400 0С кремний реагирует также с парами серы, азотом, фосфором, углеродом и бором:
- Si + C = SiC;Si + 2S = SiS2; Si + 4B = B4Si.
- С металлами кремний образует силициды:
- Si + 4Li = Li4Si.
- С водородом и кислотами кремний не реагирует. Исключение составляет смесь азотной и фтороводородной кислот; кремний растворяется в щелочах:
- Si + 2NaOH + H2O = Na2SiO3 + H2↑.
Задача 961. Охарактеризовать физические и химические свойства диоксида кремния, его отношение к воде, кислотам и щелочам.
Решение: Диоксид кремния SiO2 – бесцветное соединение, которое может существовать в кристаллической, аморфной и стеклообразной форме.
В кристаллической форме SiO2 образует несколько модификаций, различающиеся особенностями взаимного расположения структурных единиц – кремнекислородных тетраэдров состава SiO4:
Взаимные превращения кристаллических модификаций диоксида кремния сопровождается изменением объёма и плотности.
Модификации SiO2: α — кварц (горный хрусталь) – бесцветное кристаллическое вещество с сильным двойным лучепреломлением, очень твёрдое и тугоплавкое вещество. Кристаллический кварц химически очень инертен.
При обычных условиях он взаимодействует только с F2 и с водным раствором плавиковой кислоты:
- SiO2 + 4HF = SiF4 + 2H2O.
- С водой SiO2(к) не взаимодействует, но аморфный при обычных условиях, а микрокристаллический – при температуре выше 150 0С и высоком давлении – очень медленно растворяется в воде с образованием ортокремниевой кислоты:
- SiO2 + 2Н2О H4SiO4.
- В растворах щелочей растворение SiO2 происходит гораздо быстрее, чем в воде, и тем быстрее, чем выше концентрация гидроксид-иона ОН– и выше температура:
- SiO2 + 2NaOH = Na2SiO3 + H2O.
- Обычно же кремнекислые соли получают сплавлением диоксида кремния со щелочами или карбонатами:
- SiO2 + Na2CO3 Na2SiO3 + CO2↑.
- При прокаливании SiO2 с углем в электрической печи до 2000 0С образуется карбид кремния (карборунд):
- SiO2 + 3С SiC + 2CO↑.
Источник: http://buzani.ru/zadachi/khimiya-glinka/1314-stroenie-i-svojstva-kremniya-zadachi-960-961
Кремний — общая характеристика элемента и химические свойства
На внешнем энергетическом уровне атома углерода содержится 4 электрона, которые имеют электронную конфигурацию 3s2 3p2. Кремний проявляет степени окисления -4, +2, +4. Кремний – типичный неметалл, в зависимости от типа превращения элемент может быть окислителем и восстановителем.
Аллотропия кремния
Кристаллический кремний – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; t°пл. 1415°C; t°кип. 2680°C.
Имеет алмазоподобную структуру (sp3— гибридизация атомов кремния) и образует прочные ковалентные σ- связи. Инертен.
Аморфный кремний — бурый порошок, гигроскопичен, более реакционноспособен.
Получение кремния
1) 2С + Si+4O2 –t°→ Si0 + 2CO
2) 2Mg + Si+4O2 –t°→ 2MgO + Si0
Нахождение кремния в природе
 Кремний – второй по распространенности элемент на Земле после кислорода.Его содержание в земной коре составляет 27,6 % (мас.). Встречается только в виде соединений.
Кремний – второй по распространенности элемент на Земле после кислорода.Его содержание в земной коре составляет 27,6 % (мас.). Встречается только в виде соединений.
Оксид кремния образует большое количество природных веществ – горный хрусталь, кварц, кремнезем. Составляет основу многих полудрагоценных камней – агат, аметист, яшма и др.
Также кремний входит в состав породообразующих минералов – силикатов и алюмосиликатов – полевых шпатов, глин, слюд и др.
Химические свойства Si
- Типичный неметалл средней активности.
- Как восстановитель:
1) С кислородом - Si0 + O2 –t°→ Si+4O2
- 2) С галогенами, со фтором без нагревания.
Si0 + 2F2 → SiF4 - 3) С углеродом
Si0 + C –t°→ Si+4C - (SiC — карборунд –твёрдый, используется для шлифовки)
- 4) С азотом
- 3Si + 2N2 –t°→ Si3N4.
- 5) С кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O - 6) Со щелочами (при нагревании):
Si0 + 2NaOH + H2O → Na2Si+4O3+ 2H2 - Как окислитель:
- 6) С металлами (образуются силициды):
Si0 + 2Mg –t°→ Mg2Si-4 - Разложением силицидов металлов кислотой получают силан (SiH4)
Mg2Si + 2H2SO4 → SiH4 + 2MgSO4 - 7) С водородом не взаимодействует.
Источник: http://himege.ru/kremnij-ximicheskie-svojstva/
Валентность кремния
В соединениях с другими химическими элементами проявляется II или IV валентность кремния. Проявление валентности зависит от состояния атома. Об образовании валентности в соединениях кремния читайте ниже.

Высшая валентность кремния определяется по группе периодической таблицы Менделеева. Кремний находится в IV группе, значит, имеет четвёртую высшую валентность.
Разностью между числом восемь и номером группы определить низшую валентность кремния нельзя. Чтобы понять, почему низшая валентность кремния II, а не IV, следует обратиться к более подробному строению атома кремния.
Элемент находится под 14 номером, в третьем периоде. Это значит, что вокруг ядра атома на трёх энергетических уровнях находится 14 электронов. Электронная конфигурация атома кремния – 1s22s22p63s23p2.
Число валентных электронов зависит от состояния атома. В обычном состоянии два спаренных электрона находится на s-подуровне и два неспаренных электрона – на p-подуровне.
Эти два неспаренных электрона указывают на низшую валентность – II. В возбуждённом состоянии один электрон с s-подуровня распаривается и переходит на p-подуровень.
В результате образуется четыре неспаренных электрона, определяющих высшую валентность IV.
Рис. 1. Расположение электронов на внешнем уровне в обычном и возбуждённом состояниях.
Для определения валентности в соединениях необходимо ориентироваться на нижние индексы формул элемента.
Кремний (Si) – хрупкий неметалл, не встречающийся в природе в чистом виде. Простое вещество можно получить промышленным или лабораторным путём. В этом случае степень окисления элемента будет равна нулю.
Рис. 2. Простое вещество.
Кремний может образовывать бинарные соединения с простыми веществами. Степень окисления в соединениях, как и валентность, зависит от состояния атома кремния. Элемент быстро переходит в возбуждённое состояние, поэтому степень окисления чаще всего равно +4 или -4.
Соединения, образующиеся при окислении металлов атомами кремния, называются силицидами. В этом случае кремний является окислителем и имеет отрицательную степень окисления -4:
- 2Mg + Si → Mg2Si-4;
- 6MnO + 5Si → 2Mn3Si-4 + 3SiO2;
- 2Ca + Si → Ca2Si-4.
В соединениях с галогенами и неметаллами (кислородом, серой, азотом, углеродом, водородом) кремний проявляет степень окисления +4:
- Si+4Cl4;
- Si+4Br4;
- Si+4O2;
- Si+4H4;
- Si+43N4;
- Si+4C;
- H2Si+4O3.
Степень окисления +2 кремний проявляет редко. Например, в монооксиде SiO, который не встречается в природе и получается только искусственным путём.
Рис. 3. Монооксид кремния.
Выяснили валентные возможности кремния. Элемент имеет две валентности – II и IV. Вторая валентность проявляется в обычном состоянии. Четвёртная валентность характерна для кремния в возбуждённом состоянии, когда один электрон переход с s- на p-подуровень. От состояния атома также зависит степень окисления.
Кремний проявляет степени окисления +2, +4, -4. С галогенами и неметаллами кремний имеет +4 степень окисления. В реакциях с металлами элемент выступает в роли окислителя и имеет -4 степень окисления. В редких случаях кремний имеет степень окисления +2. Например, она проявляется в монооксиде кремния SiO.
Средняя оценка: 4.2. Всего получено оценок: 137.
Источник: https://obrazovaka.ru/himiya/valentnost-kremniya-vozmozhnosti.html
Большая Рнциклопедия Нефти Рё Газа
Cтраница 2
 |
Молекула бензола.| Молекула пиридина. [16] |
О будет больше расстояния Si-О, мы этой разницей пренебрегаем и считаем алюминий входящим в алюмокремнекислород-ный мотив по той причине, что он в структуре играет одинаковую роль с кремнием, имеет ту же тетраэдриче-скую координацию, размеры его и валентность несильно отличаются от размеров и валентности кремния. Таким образом, положив в основу классификации структурных типов минимальные расстояния между атомами, необходимо учитывать при этом размер атомов ( ионов) и их валентность. [17]
Р’ табл. 31 — 1 приведены основные типы кремнийорганических производных; там же приведены соответствующие соединения углерода.
Валентность кремния, так же как Рё углерода, обычно равна четырем; кремний образует сравнительно прочные СЃРІСЏР·Рё СЃ РґСЂСѓРіРёРјРё атомами кремния, СЃ углеродом, РІРѕРґРѕСЂРѕРґРѕРј, галогенами, кислородом Рё азотом. Важно заметить, что СЃРІСЏР·Рё Si — Si слабее, чем СЃРІСЏР·Рё РЎ — РЎ, почти РЅР° 30 ккал / молъ, тогда как СЃРІСЏР·Рё Si — Рћ прочнее, чем СЃРІСЏР·Рё РЎ — Рћ, более чем РЅР° 22 ккал / моль. Рто различие РІ энергиях связей объясняет СЂСЏРґ различий РІ химических свойствах углерода Рё кремния. [19]
Р’ табл. 31 — 1 приведены основные типы кремнийорганических производных; там же приведены соответствующие соединения углерода.
Валентность кремния, так же как Рё углерода, обычно равна четырем; кремний образует сравнительно прочные СЃРІСЏР·Рё СЃ РґСЂСѓРіРёРјРё атомами кремния, СЃ углеродом, РІРѕРґРѕСЂРѕРґРѕРј, галогенами, кислородом Рё азотом. Важно заметить, что СЃРІСЏР·Рё Si-Si слабее, чем СЃРІСЏР·Рё РЎ-РЎ, почти РЅР° 30 ккал / моль, тогда как СЃРІСЏР·Рё Si-Рћ прочнее, чем СЃРІСЏР·Рё РЎ-Рћ, более чем РЅР° 22 ккал / моль. Рто различие РІ энергиях связей объясняет СЂСЏРґ различий РІ химических свойствах углерода Рё кремния. [21]
Такая связь обеспечивает и высокие диэлектрические свойства соединений.
Остальные валентности кремния насыщаются углеводородными радикалами.
Поэтому длинные цепи, состоящие только из атомов кремния, подобные углеродным цепям, не образуются. [22]
Все жидкости являются полимерами с цепью, образованной из чередующихся атомов кремния и кислорода. Часть валентностей кремния замещены метильными, фенильными или этилышми радикалами. [23]
По своей структуре галлуазит представляет интерес как редкий пример силиката, в котором с кремнием непосредственно связана гидроксильная группа. Обычно в силикатах все валентности кремния насыщаются кислородом. [24]
Какова формула этого соединения и валентность кремния в нем. [25]
Кремнийорганические смолы — полимеры, основная цепь которых состоит РёР· атомов кремния Рё кислорода.
РџСЂРё замещении РІ цепи РґРІСѓС… валентностей кремния алкильными или арильными радикалами получаются так называемые полиорганосилоксано-вые смолы, хорошо растворимые РІ органических растворителях. РџСЂРё нагревании РѕРЅРё отверждаются, переходя РІ нерастворимое Рё неплавкое состояние. Рти смолы отличаются повышенной термостойкостью ( 200 — 400 РЎ) Рё РґСЂСѓРіРёРјРё положительными свойствами. [26]
Кремнийорганические смолы — полимеры, основная цепь которых состоит РёР· атомов кремния Рё кислорода.
РџСЂРё замещении РІ цепи РґРІСѓС… валентностей кремния алкильными или арильными радикалами получаются так называемые полиорганосилоксановые смолы, хорошо растворимые РІ органических растворителях. РџСЂРё нагревании РѕРЅРё отверждаются, переходя РІ нерастворимое Рё неплавкое состояние. Рти смолы отличаются повышенной термостойкостью ( 200 — 400 РЎ) Рё РґСЂСѓРіРёРјРё положительными свойствами. [27]
Кремнийорганические смолы — полимеры, основная цепь которых состоит РёР· атомов кремния Рё кислорода.
РџСЂРё замещении РІ цепи РґРІСѓС… валентностей кремния алкильными или арильными радикалами получают так называемые полиорганосилоксановые смолы, хорошо растворимые РІ органических растворителях. РџСЂРё нагревании РѕРЅРё отверждаются, переходя РІ нерастворимое Рё неплавкое состояние. Рти смолы отличаются повышенной термостойкостью ( 200 — 400 РЎ) Рё РґСЂСѓРіРёРјРё ценными свойствами. [28]
В зависимости от вида кремнекислородного иона валентность кремния изменяется и может быть равна нулю, единице и двум, причем остальные доли связи, чтобы в сумме степень окисления кремния была равна четырем, осуществляются ковалентно. [29]
Таких соединений известно значительное число.
Они гораздо более похожи на соответствующие соединения углерода, чем кремневодороды, и не воспламеняются на воздухе.
Если все четыре валентности кремния насыщены различными радикалами, то соединения проявляют оптическую активность. [30]
Страницы: 1 2 3
Источник: https://www.ngpedia.ru/id313165p2.html
Кремний
Кремний второй элемент по распространенности на Земле после кислорода. Масса земной коры (литосферы) более чем на четверть (27.6 %) состоит из кремния. Известно более 400 минералов это разнообразные силикатные породы, основу которых составляет диоксид кремния.
Наиболее часто встречаются формы кремнезема (SiO2nH2O) с различным содержанием воды. Академик А.Е.
Ферсман писал: “Самые разнообразные предметы — прозрачный шар, сверкающий на солнце чистотой холодной ключевой воды, красивый, пестрого рисунка агат, яркой игры многоцветный опал, чистый песок на берегу моря, тонкая, как шелковинка, нитка из плавленого кварца или жаропрочная посуда из него, красиво ограненные груды горного хрусталя, таинственный рисунок фантастической яшмы, наконечник стрелы древнего человека. Все это одно и то же химическое соединение элементов кремния и кислорода”.
Атом кремния в основном состоянии имеет два спаренных s- электрона, два неспаренных p-электрона, одну вакантную р-орбиталь и пять вакантных d-орбиталей. Электронно-графические формулы валентного слоя кремния в основном и валентно-возбужденном состояниях имеют следующий вид:
Рис. 2
Благодаря своему электронному строению кремний может проявлять валентности II, IV и VI, и имеет характерные степени окисления в соединениях -4, +2, +4. Элемент может быть четырехвалентным за счет увеличения числа неспаренных электронов в валентно-возбужденном состоянии.
Вакантные d-орбитали кремния определяют возможность образования связей по донорно-акцепторному механизму, что приводит к увеличению валентности и координационного числа до 6.
В соединениях кремния наиболее характерными являются sp3 и sp3d2 типы гибридизации, в то время как соединения кремния в sp и sp2 гибридном состоянии не устойчивы из-за малой прочности -связей, образующихся перекрыванием р-орбиталей.
Поэтому химия кремния лишь незначительно напоминает химию углерода. Так для кремния не характерно образование кратных связей Si=Si и SiSi, что свойственно углероду, зато кремний легко образует комплексные фториды:
SiF4 + 2HF = H2[SiF6].
Элементарный кремний. Несмотря на распространенность в природе, этот элемент был открыт сравнительно поздно. В 1825 г. выдающийся шведский химик и минералог Йенс Якоб Берцелиус сумел выделить не очень чистый аморфный кремний в виде коричневого порошка при восстановлении газообразного тетрафторида кремния металлическим калием:
- SiF4 + 4K Si + 4KF.
- В современной промышленности кремний получают восстановлением SiO2 углем в электрических печах:
- SiO2 + C CO2 + Si.
- Для получения более чистого кремния технический продукт хлорируют:
- Si + 2Cl2 SiCl4,
- и после очистки SiCl4 ректификацией восстанавливают цинком или водородом при высокой температуре:
- SiCl4 + 2Zn Si + 2ZnCl2.
Для получения особо чистого кремния, широко применяемого в качестве полупроводникового материала, его подвергают зонной плавке. В этом процессе один конец кремниевого стержня нагревают, так что образуется узкая зона расплава кремния.
Так как примеси более растворимы в расплаве, чем в твердом веществе, они концентрируются в расплаве, а затем передвижением нагревателя расплавленную зону заставляют медленно продвигаться вдоль стержня кремния. Таким образом, примеси перемещаются в другой конец стержня. Вводя в сверхчистый кремний те или иные легирующие добавки, в нем создают проводимость электронного (n) или дырочного (p) типа.
Добавки элементов третьей группы таблицы Д.И. Менделеева (например, Ga и In) ведут к созданию дырочной проводимости, а пятой (например, Sb и As) — электронной.
Чистый кремний кристаллическое сине-серое вещество с металлическим блеском, встречается в структурной форме, которая подобна алмазу (температура плавления 1415оС).
В узлах кристаллической решетки находятся атомы Si в sp3 гибридном состоянии с координационным числом 4, наиболее характерным для кремния. В таком состоянии он валентно-насыщен, поэтому относительно инертен.
При комнатной температуре кристаллический кремний обладает малой реакционной способностью и реагирует только с фтором:
- Si + 2F2 SiF4.
- Взаимодействие с другими элементами, в том числе с кислородом и галогенами, протекает только при нагревании до 500-600С:
- Si + 2Cl2 SiCl4
- Образование диоксида SiO2 является экзотермической реакцией и сопровождается выделением значительного количества теплоты:
Si + O2 SiO2 (кр.); ?H0 = 911 кДж/моль.
- Кремний при высоких температурах обладает большим сродством к кислороду и проявляет сильные восстановительные свойства (по отношению к кислородсодержащим соединениям). Например:
- 2H2O (г) + Si (кр) SiO2 (кр) +2H2 (г).
- При спекании смеси кремния с более электроположительными элементами, главным образом металлами, он выступает в роли окислителя и образует силициды:
- 2Mg + Si Mg2Si.
- Соединения кремния.
- Силан SiH4.
Бесцветный газ, ядовит, t°пл. = -185°C, t°кип. = -112°C.
- Получение.
- Mg2Si + 4HCl ®> 2MgCl2 + SiH4.
- Химические свойства.
- 1) SiH4 + 2O2 ®> SiO2 + 2H2O.
- 2) SiH4 ®> Si + 2H2.
- Оксид кремния (IV) (SiO2)n
- SiO2 — кварц, горный хрусталь, аметист, агат, яшма, опал, кремнозём (основная часть песка)
- Al2O3 * 2SiO2 * 2H2O — каолинит (основная часть глины).
- K2O * Al2O3 * 6SiO2 — ортоклаз (полевой шпат).
- Физические свойства.
Твёрдое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C.
- Кислотный оксид.
- При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
- 1) С основными оксидами:
- SiO2 + CaO ®> CaSiO3.
- валентный кремниевый изомер таутометрия
- 2) Со щелочами:
- SiO2 + 2NaOH ® >Na2SiO3 + H2O.
- 3) С водой не реагирует.
- 4) С солями:
- SiO2 + CaCO3 ®> CaSiO3 + CO2.
- SiO2 + K2CO3 ® >K2SiO3 + CO2.
- 5) С плавиковой кислотой:
- SiO2 + 4HF ® >SiF4 + 2H2O,
- SiO2 + 6HF ® >H2[SiF6](гексафторкремниевая кислота) + 2H2O,
- (реакции лежат в основе процесса травления стекла).
- Кремниевые кислоты.
- x * SiO2 * y H2O
- x = 1, y = 1 H2SiO3 — метакремниевая кислота
x = 1, y = 2 H4SiO4 — ортокремниевая кислота и т.д.
- H2SiO3 — очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
- Получение:
- Na2SiO3 + 2HCl ®> 2NaCl + H2SiO3Ї.
- При нагревании разлагается:
- H2SiO3 > -t°® H2O + SiO2
- Соли кремниевой кислоты — силикаты.
- Выветривание горных пород (разрушение минералов):
- (K2O * Al2O3 * 6SiO2)(полевой шпат) + CO2 + 2H2O ® (Al2O3 * 2SiO2 * 2H2O)(каолинит (глина)) + 4SiO2(кремнезём (песок)) + K2CO3.
Источник: https://studwood.ru/2024609/matematika_himiya_fizika/kremniy
Кремний и его соединения
Кремний 14Si является аналогом углерода, находится в главной подгруппе IV группы, в 3-м периоде. Как и углерод, кремний является неметаллом и проявляет в своих соединениях и положительные и отрицательные степени окисления, наиболее характерными из которых являются +4 и -4.
14Si 1s22s22p63s23p2
Аr = 28,0855
Изотопы: 28Si (92.27 %); 29Si (4.68 %); 30Si (3,05 %)
ЭО = 1,8
Кремний — второй после кислорода по распространенности в земной коре элемент (27,6 % по массе). В свободном состоянии в природе не встречается, находится преимущественно в виде SiO2 или силикатов.
Соединения Si токсичны; вдыхание мельчайших частиц SiO2 и др. соединений кремния (например, асбеста) вызывает опасную болезнь — силикоз
В основном состоянии атом кремния имеет валентность = II, а в возбужденом состоянии = IV.
Наиболее устойчивой степенью окисления Si является +4. В соединениях с металлами (силицидах) С.О. -4.
Способы получения кремния
Самым распространенным природным соединением кремния является кремнезем (диоксид кремния) SiО2. Он является основным сырьем для получения кремния.
- 1) Восстановление SiO2 углеродом в дуговых печах при 1800'С: SiO2 + 2С = Si + 2СО
- 2) Высокочистый Si из технического продукта получают согласно схеме:
- a) Si → SiCl2 → Si
- б) Si → Mg2Si → SiH4 → Si
Физические свойства кремния. Аллотропные модификации кремния
1) Кристаллический кремний — вещество серебристо — серого цвета с металлическим блеском, кристаллическая решетка типа алмаза; т. пл. 1415'С, т. кип. 3249'С, плотность 2,33 г/см3; является полупроводником.
2) Аморфный кремний — порошок бурого цвета.
Химические свойства кремния
- При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает.
- 1. С кислородом взаимодействует при Т выше 400°С:
- Si + О2 = SiO2 оксид кремния
- 2.
С фтором реагирует уже при комнатной температуре:
- Si + 2F2 = SiF4 тетрафторид кремня
- 3. С остальными галогенами реакции идут при температуре = 300 — 500°С
- Si + 2Hal2 = SiHal4
- 4.
С парами серы при 600°С образует дисульфид:
- Si + 2S = SiS2
- 5. Реакция с азотом происходит выше 1000°С:
- 3Si + 2N2 = Si3N4 нитрид кремния
- 6.
При температуре = 1150°С реагирует с углеродом:
- SiO2 + 3С = SiС + 2СО
- По твердости карборунд близок к алмазу.
7. С водородом кремний непосредственно не реагирует.
8. Кремний стоек к действию кислот. Взаимодействует только со смесью азотной и фтороводородной (плавиковой) кислот:
- 3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O
- 9. реагирует с растворами щелочей с образованием силикатов и выделением водорода:
- Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
- 10. Восстановительные свойства кремния используют для выделения металлов из их оксидов:
- 2MgO = Si = 2Mg + SiO2
- Кремний образует силициды с s-металлами и большинством d-металлов.
Состав силицидов данного металла может быть различен. (Например, FeSi и FeSi2; Ni2Si и NiSi2.) Один из наиболее известных силицидов — силицид магния, который можно получать прямым взаимодействием простых веществ:
2Mg + Si = Mg2Si
Силан (моносилан) SiH4
Силаны (кремневодороды) SinH2n + 2, (ср. с алканами), где п = 1-8. Силаны — аналоги алканов, отличаются от них неустойчивостью цепей -Si-Si-.
- Моносилан SiH4 — бесцветный газ с неприятным запахом; растворяется в этаноле, бензине.
- Способы получения:
- 1. Разложение силицида магния соляной кислотой: Mg2Si + 4HCI = 2MgCI2 + SiH4
- 2. Восстановление галогенидов Si алюмогидридом лития:
SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3 - Химические свойства.
- Силан — сильный восстановитель.
- 1.SiH4 окисляется кислородом даже при очень низких температурах:
- SiH4 + 2O2 = SiO2 + 2Н2О
- 2. SiH4 легко гидролизуется, особенно в щелочной среде:
- SiH4 + 2Н2О = SiO2 + 4Н2
- SiH4 + 2NaOH + Н2О = Na2SiO3 + 4Н2
Оксид кремния (IV) (кремнезем) SiO2
Кремнезем существует в виде различных форм: кристаллической, аморфной и стеклообразной. Наиболее распространенной кристаллической формой является кварц. При разрушении кварцевых горных пород образуются кварцевые пески. Монокристаллы кварца — прозрачны, бесцветны (горный хрусталь) или окрашены примесями в различные цвета (аметист, агат, яшма и др.).
Аморфный SiO2 встречается в виде минерала опала: искусственно получают силикагель, состоящий из коллоидных частиц SiO2 и являющийся очень хорошим адсорбентом. Стеклообразный SiO2 известен как кварцевое стекло.
Физические свойства
В воде SiO2 растворяется очень незначительно, в органических растворителях также практически не растворяется. Кремнезем является диэлектриком.
Химические свойства
- 1. SiO2 — кислотный оксид, поэтому аморфный кремнезем медленно растворяется в водных растворах щелочей:
- SiO2 + 2NaOH = Na2SiO3 + Н2О
- 2. SiO2 взаимодействует также при нагревании с основными оксидами:
- SiO2 + К2О = K2SiO3;
- SiO2 + СаО = CaSiO3
- 3. Будучи нелетучим оксидом, SiO2 вытесняет углекислый газ из Na2CO3 (при сплавлении):
- SiO2 + Na2CO3 = Na2SiO3 + CO2↑
- 4. Кремнезем реагирует с фтороводородной кислотой, образуя кремнефтористоводородную кислоту H2SiF6:
- SiO2 + 6HF = H2SiF6 + 2Н2О
- 5. При 250 — 400°С SiO2 взаимодействует с газообразным HF и F2, образуя тетрафторсилан (тетрафторид кремния):
- SiO2 + 4HF (газ.) = SiF4 + 2Н2О
- SiO2 + 2F2 = SiF4 + O2
Кремниевые кислоты
- Известны:
- — ортокремниевая кислота H4SiО4;
- — метакремниевая (кремниевая) кислота H2SiO3;
- — ди- и поликремниевые кислоты.
- Все кремниевые кислоты малорастворимы в воде, легко образуют коллоидные растворы.
Способы по-лучения
- 1. Осаждение кислотами из растворов силикатов щелочных металлов:
- Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
- 2. Гидролиз хлорсиланов: SiCl4 + 4Н2О = H4SiO4 + 4HCl
Химические свойства
- Кремниевые кислоты — очень слабые кислоты (слабее угольной кислоты).
- При нагревании они дегидратируются с образованием в качестве конечного продукта кремнезема
- H4SiО4 → H2SiO3 → SiO2
Силикаты — соли кремниевых кислот
- Поскольку кремниевые кислоты чрезвычайно слабые, их соли в водных растворах сильно гидро лизованы:
- Na2SiO3 + Н2О = NaHSiO3 + NaOH
- SiO32- + Н2О = HSiO3- + ОН- (щелочная среда)
- По этой же причине при пропускании углекислого газа через растворы силикатов происходит вытеснение из них кремниевой кислоты:
- K2SiO3 + СO2 + Н2О = H2SiO3↓ + K2СO3
- SiO3 + СO2 + Н2О = H2SiO3↓ + СO3
- Данную реакцию можно рассматривать как качественную реакцию на силикат-ионы.
- Среди силикатов хорошо растворимыми являются только Na2SiO3 и K2SiO3, которые называются растворимым стеклом, а их водные растворы — жидким стеклом.
Стекло
Обычное оконное стекло имеет состав Na2O • СаО • 6SiO2, т. е. является смесью силикатов натрия и кальция. Его получают сплавлением соды Na2CO3, известняка СаСO3 и песка SiO2;
Na2CO3 + CaCO3 + 6SiO2 = Na2O • СаО • 6SiO2 + 2СO2↑
Цемент
Порошкообразный вяжущий материал, образующий при взаимодействии с водой пластичную массу, превращающуюся со временем в твердое камневидное тело; основной строительный материал.
Химический состав наиболее распространенного портланд-цемента (в % по массе) — 20 — 23% SiO2; 62 — 76 % СаО; 4 — 7 % Al2O3; 2-5% Fe2O3; 1- 5% МgО.
Источник: http://examchemistry.com/content/lesson/neorgveshestva/kremnyi.html
ПОИСК
Решение. Составляем электронную формулу атома кремния Валентными орбиталями в этом атоме являются орбитали внешнего (третьего) электронного слоя. т. е. 3 -. Зр- и незаполненные Зй-орбитали. Графически схема заполнения электронами этих орбиталей имеет следующий вид [c.
42]
Кристаллический кремний имеет такую же структуру, как и алмаз. Следовательно, в кристалле кремния валентная зона укомплектована полностью. Однако ширина запрещенной зоны в этом случае составляет всего SE = 1,12 эВ. Следовательно, при небольшом возбуждении валентные электроны могут переходить в зону проводимости, т. е.
кремний — полупроводник. [c.117]
Некоторые электрофизические свойства кремния. Валентная зона кремния имеет структуру, совершенно аналогичную структуре германия (см. рис. 42). В кремнии существуют два вида дырок т = 0,49/и и/Пл = 0,16 т. Экспериментально дырки со средним значением массы не наблюдаются, поскольку соответствующая им полоса энергии опущена на 0,035 эв по сравнению с энергией легких и тяжелых дырок. Максимальное энергетическое расстояние между дном зоны проводимости и потолком валентной зоны (ширина запрещенной зоны) соответствует расстояниям, лежащим в разных точках зоны Бриллюэна (см. рис. 42). [c.111]
Кристаллический кремний имеет такую же структуру, как и алмаз. Следовательно, в кристалле кремния валентная зона укомплектована полностью. Однако ширина запрещенной зоны в этом случае составляет всего АЕ=, 2 эв. Следовательно, при небольшом возбуждении [c.149]
В кристалле алмаза, как и в кристалле кремния, валентная зона, образованная зр гибридными орбиталя ми, полностью заполнена Однако в кристалле алмаза, в отличие от кристалла кремния, ближайшая по энергии к валентной зона может быть образована только за счет перекрывания 5 и р орбиталей третьего слоя Вследствие большой разности в энергии электронов второго и третьего слоя ширина запрещенной зоны у алмаза равна 5,7 эВ Вещества, у которых ширина запрещенной зоны превышает 4 эВ, относятся к изоляторам [c.86]
Каждый ион кремния в силикатном расплаве должен быть окружен четырьмя ионами кислорода, если его валентность полностью насыщена. В некоторые моменты часть связей Si—О из-за термических колебаний разрывается, так что у части ионов кремния валентность не насыщена.
Предполагается, что доля таких ионов в гомогенном расплаве из-за большой величины отношения O/Si должна быть меньше, чем в обогащенной кремнеземом фазе гетерогенного расплава. Таким образом, в однофазном расплаве для ионов кремния окружение атомов наиболее благоприятно.
Тенденция к расслаиванию появляется при [c.131]
Поскольку кремний является ближайшим соседом углерода в IV группе периодической системы, по ряду свойств он аналогичен углероду.
Подобно атомам углерода, атомы кремния способны сравнительно легко образовывать друг с другом ковалентные связи следовательно, могут возникнуть молекулы, содержащие цепи из атомов кремния, аналогичные цепям из атомов углерода в органических молекулах.
Однако, в отличие от углерода, в атоме кремния валентные электроны отделены от ядра не одним, а двумя электронными слоями (стр. 48), и поэтому ковалентные связи 5 — 51 гораздо менее прочны, чем связи С — С. [c.325]
Сокращение длины связей 81—О и 81—С1 можно объяснить исходя из валентных возможностей атомов кремния, хлора и кислорода. Известно, что атом кремния, валентное состояние которого описывается Ззр -гибридизацией, обладает акцепторными свойствами. У него все Зй-орбитали вакантны. Атомы кислорода и хлора обладают донорными свойствами. Они имеют неподеленные пары электронов.В процессе образования ЗЮЦ, 81(ОСгН5)4 и других подобных молекул неподеленная пара электронов донора переходит на Зй-орбиталь акцептора, которая становится общей как для донора, так и для акцептора. В результате этого возникает дополнительная связь между ними. Логично считать, что в подобных молекулах ковалентные связи атома 81 с атомами О или С1 усилены донорно-акцепторным взаимодействием. При такой двоесвязности сумма атомных радиусов близка к экспериментальному значению. Таким образом, наблюдаемое укорочение связей 81—0, 51—С1 и 81—С теоретически обосновано. Эти примеры показывают, что предсказать заранее значение той или иной длины связи не всегда возможно. Следовательно, экспериментальное определение геометрических параметров молекул является задачей весьма актуальной. С другой стороны, при интерпретации опытных значений длин связей необходим учет всех валентных возможностей взаимодействующих атомов. [c.212]
При окружении углерода четырьмя атомами получается структура всегда тетраэдрическая, при окружении тремя атомами — этиленовая плоская (НСНО, КСОК, КСООН), при двух окружающих атомах — ацетиленовая линейная (КСМ).
В кремнийорганических соединениях, имеющих также ковалентные связи, в которых основным связующим элементом будет кремний, валентные углы в различных соединениях находятся в пределах от 109 до 168°. [c.
31]
Кристаллический кремний имеет такую же структуру, как и алмаз. Следовательно, в кристалле кремния валентная зона также укомплектована полностью.
Поскольку в изолированном атоме (Зх Зр Зй ) имеется энергетически близкое к ЗхЗр свободное Зй-состояние, то и при образовании кристалла возникает близкая к валентной свободная зона Зй(. Ширина запрещенной зоны в этом случае составляет всего Ке =1,12 эв.
Следовательно, при небольшом возбуждении валентные электроны могут переходить в зону проводимости, т. е. кремний — полупроводник. [c.135]
Смотреть страницы где упоминается термин Кремний валентность: [c.305] [c.146] [c.153] Курс неорганической химии (1963) — [ c.449 ]
Силивоны (1950) — [ c.184 ]
Курс неорганической химии (1972) — [ c.402 ]
© 2019 chem21.info Реклама на сайте
Источник: https://www.chem21.info/info/478725/




