Общее
число электронов равно заряду ядра атома, числу протонов в нем и соответственно
атомному номеру элемента.

Например,
у водорода атомный номер один, значит заряд ядра атома тоже плюс один, а
протонов и электронов по одному.

Распределение
электронов происходит в зависимости от энергии по энергетическим уровням,
письменное выражение которых называется электронной формулой или электронной
конфигурацией атома.
Например,
у лития, элемента с атомным номером три, электронная конфигурация один эс два
два эс один.

В
этой конфигурации цифрой слева записывается номер энергетического уровня, затем
следует буква, обозначающая подуровень, и, наконец, цифра вверху справа
указывает число электронов на этом подуровне.
Схематически
электронное строение атома изображается с помощью электронно-графической схемы.
Электронно-графическая схема атома лития:

Орбитали
обозначаются клеточками, а электроны стрелочками. На первом энергетическом
уровне на эс орбитали находятся два спаренных электрона, а на втором уровне на
эс орбитали только один неспаренный электрон.
По
принципу минимальной энергии, электрон занимает тот энергетический уровень,
тот подуровень или ту атомную орбиталь, которым соответствует минимальный запас
энергии. Это значит, что вначале заполняются те уровни, подуровни и
орбитали, которые находятся ближе к ядру.
Например,
у атома азота вначале заполняется одна эс орбиталь первого энергетического
уровня двумя электронами, а затем второго энергетического уровня два эс
орбиталь – двумя электронами и два пэ орбиталь того же уровня – тремя электронами.

Орбитали
в атомах элементов первых трех периодов заполняются электронами в порядке
увеличения их энергии.
В атоме не может быть двух электронов, у которых все
четыре квантовых числа охарактеризованы одинаковыми значениями, так гласит
принцип австрийского ученого Вольфганга Эрнста Паули.

Хотя
бы одним значением квантового числа электроны должны отличаться. Из этого
принципа следует следствие: на каждой орбитали максимально может находиться
не более двух электронов, причём с противоположными спинами.
В
качестве примера рассмотрим электронную формулу атома гелия – один эс два. Главное
квантовое число, которого равняется одному, значит, побочное квантовое число
будет равняться нулю, и соответственно всего один подуровень эс и одна орбиталь
в форме сферы.
Магнитное орбитальное квантовое число также равно нулю, так как
оно равно сумме значений положительного отношения один к двум и отрицательного
отношения один к двум. А эс подуровень атома гелия заполняется всего двумя
электронами.
Поскольку на первом электронном слое могут находиться максимально только
два электрона, то этот слой в атоме гелия является завершённым и,
следовательно, очень устойчив.

У
атомов элементов второго периода начинает заполняться второй энергетический
уровень, на котором может находиться максимально восемь электронов.
Так
у атомов лития и бериллия электронами заполняется только два эс орбиталь.
А
у атома бора пятый электрон уже занимает одну из трёх два пэ орбиталей. Вот так
выглядят электронная и электронно-графическая формулы атома бора.

Подуровень
два пэ изображён вплотную к подуровню два эс, но несколько выше. Тем самым
подчёркивается его принадлежность к одному и тому же уровню и одновременно больший
запас энергии.
По
правилу немецкого учёного Генриха Хунда в пределах определённого
подуровня электроны располагаются таким образом, чтобы суммарный спин был
максимальным.
Электроны
сначала заполняют все пустые орбитали одного подуровня по одному, а если число
электронов больше, чем число орбиталей, то по два. Однако в атоме имеются
атомные орбитали с одинаковым запасом энергии, но расположенные на различных
энергетических уровнях.
- В
таком случае применяем правило русского ученого Всеволода Маврикиевича Клечковского:
энергия электронов в атоме определяется суммой значений главного и побочного
квантовых чисел, поэтому, сначала заполняются электронами те энергетические
уровни и подуровни, для которых сумма значений главного и побочных квантовых чисел
минимальна. - Рассмотрим
первый элемент четвертого периода – калий.
У
него появляется четвёртый электронный слой, открывающийся эс подуровнем. Однако
в третьем периоде был только завершен подуровень пэ у аргона.
Возникает
вопрос: вначале будет заполняться три дэ или четыре эс подуровень? На три дэ
подуровне сумма главного и побочного чисел равна пяти.
А сумма главного и квантового чисел четыре эс подуровня равна четырем. Приходим к выводу, что четыре меньше пяти.
Значит
энергия подуровня четыре эс несколько меньше, чем подуровня три дэ.
Заполняется
первым четыре пэ подуровень или три дэ подуровень, если значения сумм главного
и побочного квантовых чисел на двух подуровнях равны пяти? Вспомним принцип
минимальной энергии: энергия на три дэ подуровне меньше, чем на четыре пэ,
следовательно, вначале будет заполняться три дэ подуровень.
Поэтому
в этом случае только после того как заполнился четыре эс подуровень, начинает
заполняться электронами дэ подуровень третьего, теперь уже предвнешнего,
энергетического уровня.
В
атоме каждый электрон располагается так, чтобы его энергия была минимальной,
что отвечает наибольшей связи его с ядром. А энергетические уровни и
подуровни выражаются общей формулой распределения, но необходимо не забывать
при заполнении все правила и принципы электронной конфигурации атомов.
- Рассмотрим,
как происходит заполнение электронами атомов элементов второго и третьего
периодов. - У
элементов второго периода согласно принципу минимальной энергии, вначале
заполнится первый энергетический уровень, а затем будет заполняться по принципу
Паули, правилу Хунда – второй энергетический уровень. - На
втором энергетическом уровне максимально может находиться только восемь
электронов,
поэтому электронный слой атома неона является завершенным и очень устойчивым.
В
атомах элементов третьего периода начинает формироваться третий электронный
слой. Сначала заполняется электронами эс подуровень у натрия и магния, а затем
пэ подуровень у алюминия, кремния, хлора и аргона. В атоме аргона на внешнем
электронном слое находится восемь электронов.
Следовательно,
он завершён, так как в атоме любого элемента на внешнем энергетическом уровне
максимально может находиться не более восьми электронов.
Застраивание третьего
электронного слоя этим не исчерпывается.
В соответствии с формулой число
электронов на уровне равно произведению два на эн в квадрате максимально на нём
может находиться 18 электронов: восемь на эс и пэ-подуровнях и десять на дэ
подуровне.
В
зависимости от того, на какой атомной орбитали находится последний электрон,
химические элементы можно разделить на следующие семейства: эс, пэ, дэ, эф.
Принадлежность
химического элемента к тому или иному электронному семейству можно определить
по электронной конфигурации, которая показывает расположение электронов на
энергетических уровнях и орбиталях атомов. Записать такую формулу можно с
помощью периодической системы Дмитрия Ивановича Менделеева.
Для элементов малых
периодов, состоящих только из главных подгрупп, это совсем не сложно. Например,
сера, элемент номер 16 расположенный в третьем периоде, главной подгруппе
шестой группы. Следовательно, ядро ее атома имеет заряд плюс 16, на электронной
оболочке, которой располагается 16 электронов.
На первом уровне 2 электрона на
один эс орбитали, на втором уровне два электрона на два эс орбитали и 6
электронов на два пэ орбитали. На третьем уровне два электрона на три эс
орбитали, четыре электрона на три пэ орбитали.
Значит сера — это элемент,
относящийся к пэ семейству, потому что последний ее электрон располагается на три
пэ орбитали.
Для
элементов побочных подгрупп следует учитывать тот факт, что у атомов этих
элементов строится не внешний уровень. На нем, как правило, будут находиться не
два эс электрона, а дэ орбитали предвнешнего уровня. На них может
поместиться не более десяти электронов.
Например, строение электронной оболочки элемента номер 22 титана,
который расположен в четвертом периоде побочной подгруппы IV группы Периодической системы
Дмитрия Ивановича Менделеева.
Следовательно, ядро его атома имеет заряд плюс 22 и на электронной
оболочке находятся 22 электрона: на первом уровне два электрона на один эс
орбитали, на втором уровне восемь электронов, на два эс орбитали два
электрона и шесть электронов на два пэ орбитали.
На внешнем, четвертом – два эс
электрона как у элемента побочной подгруппы, и остальные 10 электронов – на
третьем уровне (два на три эс орбитали, шесть на три пэ орбиталях и оставшиеся
два на три дэ орбиталях).
Значит титан это дэ элемент, так как последний
электрон в его атоме располагается на незавершенной – три дэ орбитали.
Распределение
электронов в атоме по энергетическим уровням, подуровням и орбиталям отображают
с помощью электронных конфигураций и электронно-графических схем. Для
правильного заполнения атомных орбиталей электронами необходимо применять
принцип минимальной энергии, принцип Паули, правило Хунда и правило
Клечковского.
Источник: https://videouroki.net/video/3-ehlektronnye-konfiguracii-atomov.html
Электронное строение атома — Основы электроники
Любое вещество состоит из очень маленьких частиц, называемых атомами. Атом—это наименьшая частица химического элемента, сохраняющая все его характерные свойства. Чтобы представить себе размеры атома, достаточно сказать что если бы их удалось уложить вплотную один к другому, то один миллион атомов занял бы расстояние всего в 0,1 мм.
Дальнейшее развитие науки о строении вещества показало, что атом также имеет сложное строение и состоит из электронов и протонов. Так возникла электронная теория строения вещества.
В глубокой древности было обнаружено, что существуют два рода электричества: положительное и отрицательное. Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Было также установлено опытным путем, что одноименные заряды отталкиваются, а разноименные притягиваются.
Рассмотрим электронное строение атома. Атомы состоят из еще более мелких частиц, чем они сами, называемых электронами.
ОПРЕДЕЛЕНИЕ:Электрон — это мельчайшая частица вещества, имеющая наименьший отрицательный электрический заряд.
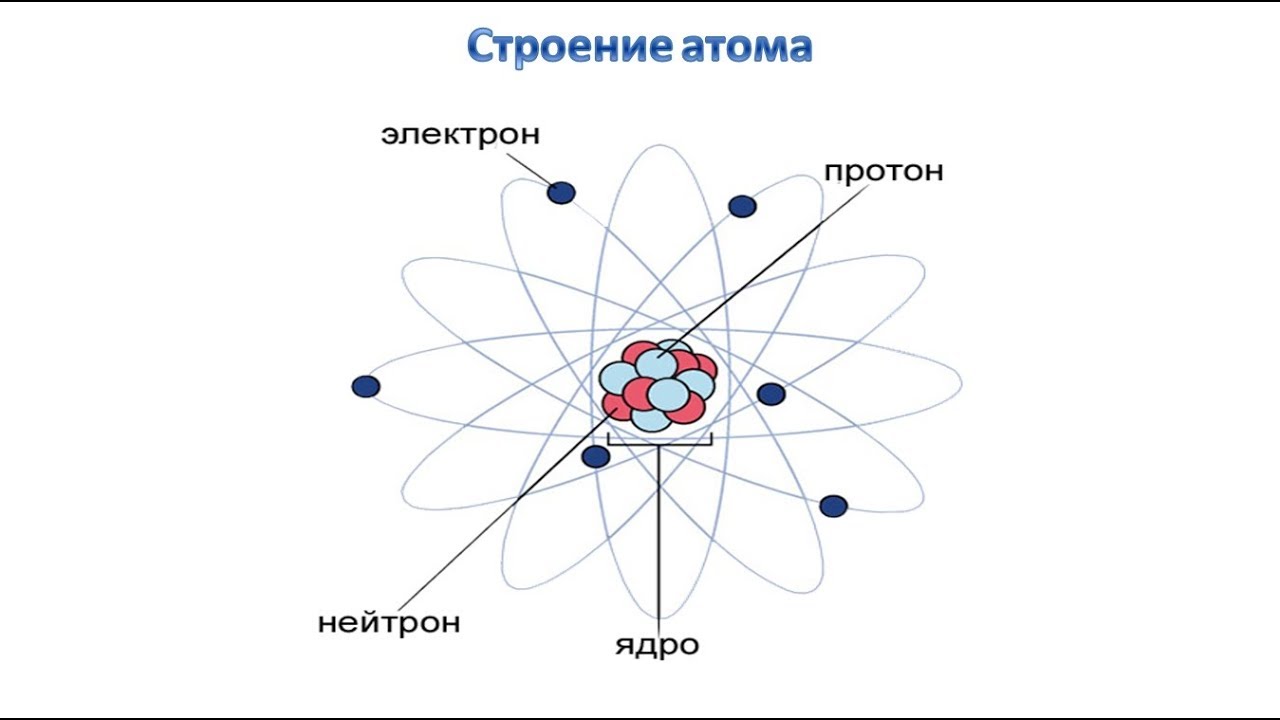
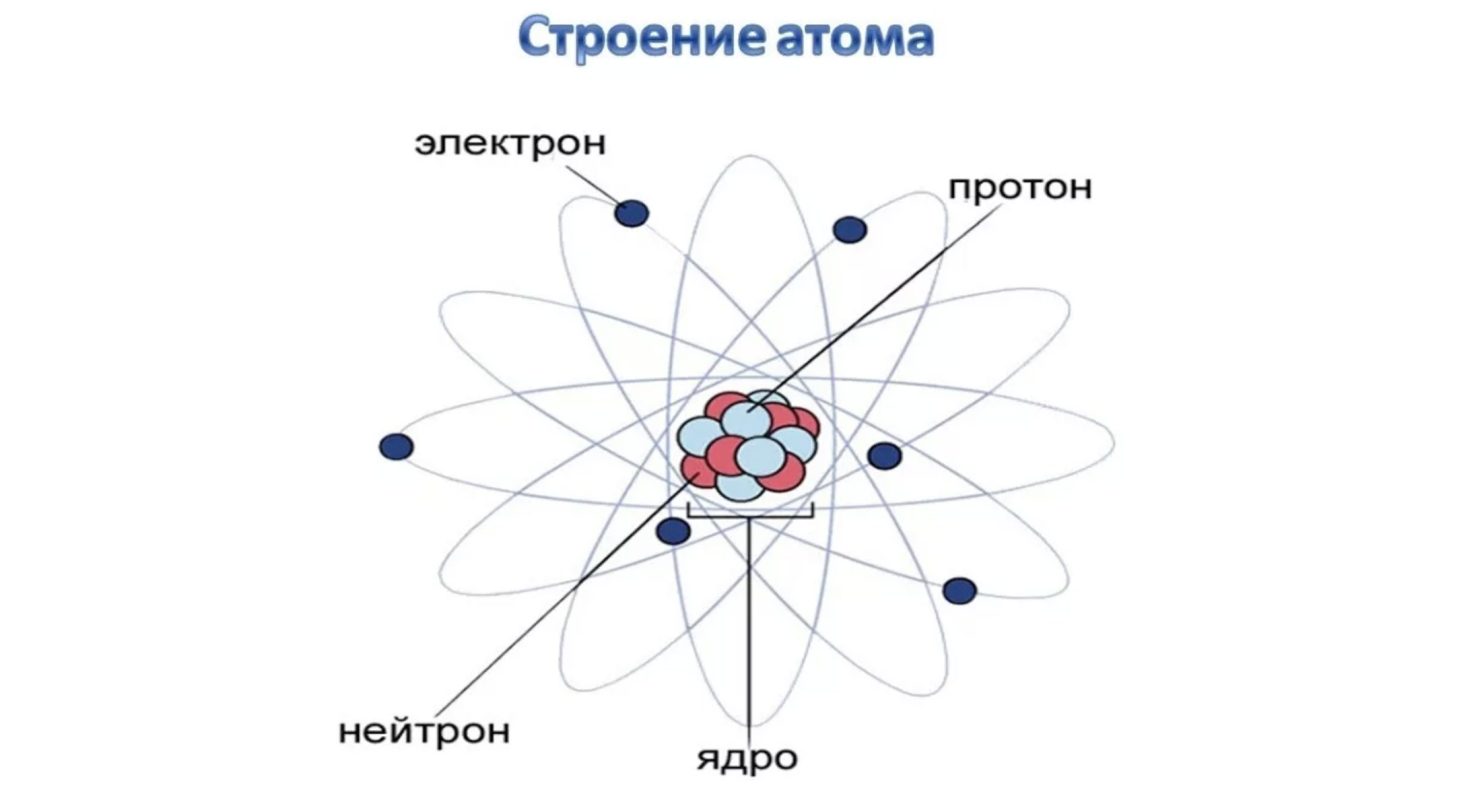
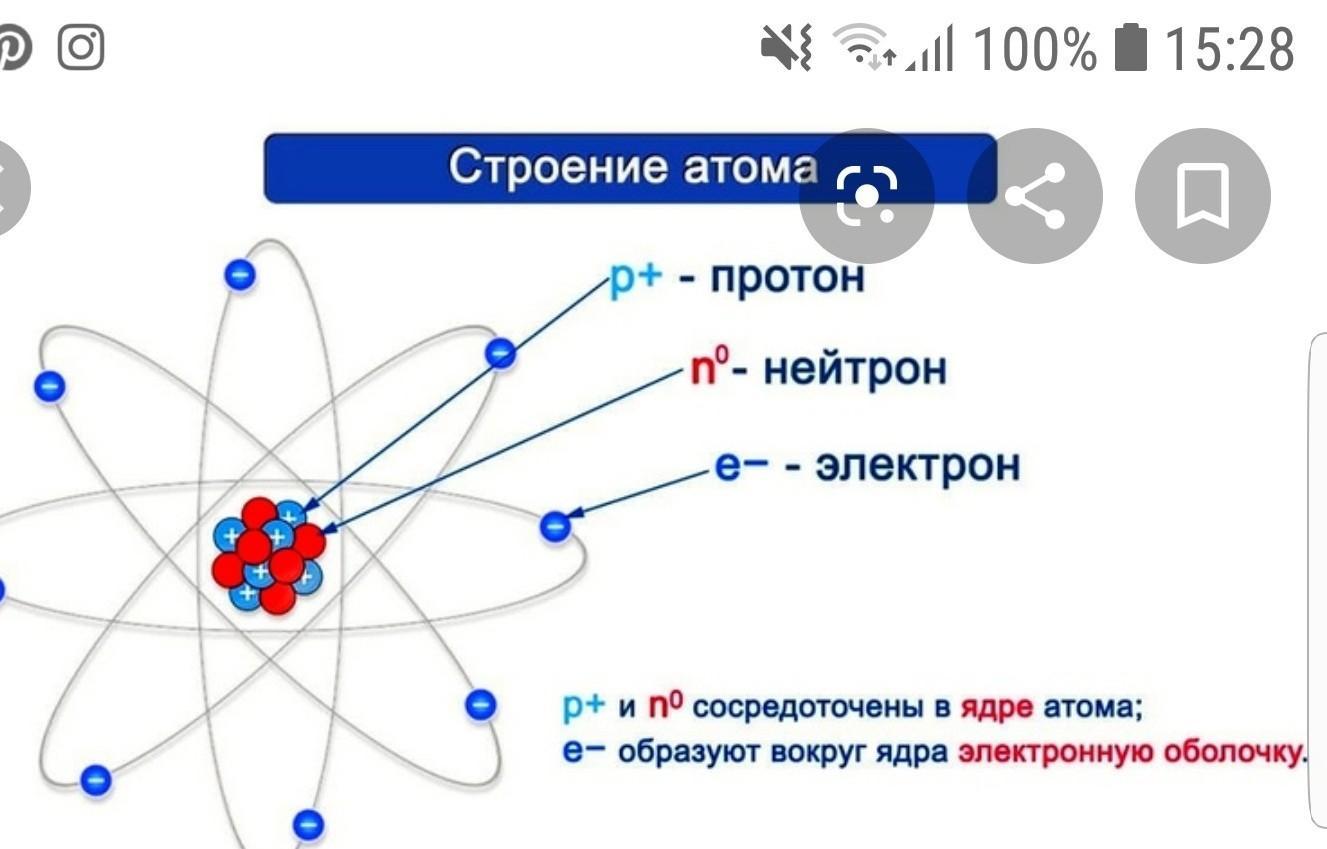
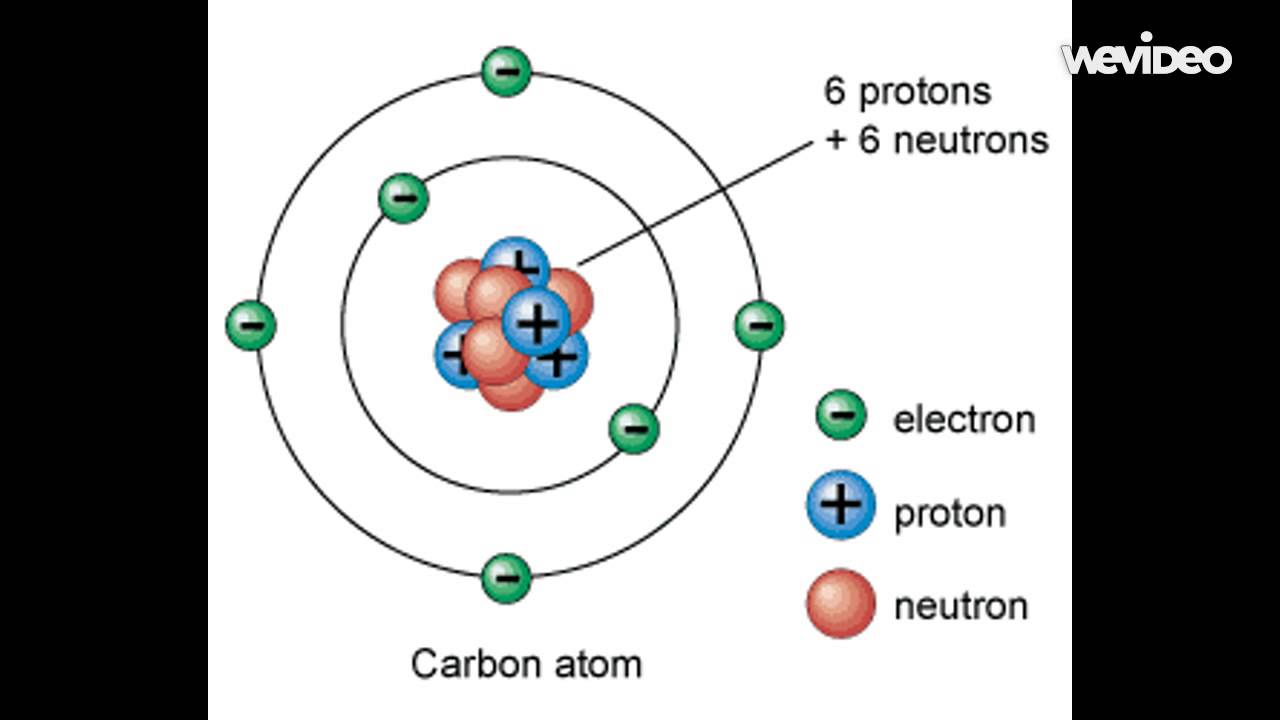
Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов, по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны — положительными, а нейтроны — нейтральными (рисунок 1.1).

ОПРЕДЕЛЕНИЕ: Протон — мельчайшая частица вещества, имеющая наименьший положительный электрический заряд.
Существование электронов и протонов не вызывает никакого сомнения. Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Было также установлено, что масса электрона зависит от скорости его движения и что электрон не только поступательно движется в пространстве, но и вращается вокруг своей оси.
Наиболее простым по своему строению является атом водорода (рис. 1.1). Он состоит из ядра-протона и вращающегося с огромной скоростью вокруг ядра электрона, образующего внешнюю оболочку (орбиту) атома. Более сложные атомы имеют несколько оболочек, по которым вращаются электроны.
Эти оболочки последовательно от ядра заполняются электронами (рисунок 1.2).
Теперь разберем строение электронных оболочек атомов. Самая внешняя оболочка называется валентной, а число электронов, содержащееся в ней, называется валентностью.
Чем дальше находится от ядра валентная оболочка, следовательно, тем меньшую силу притяжения испытывает каждый валентный электрон со стороны ядра.
Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.Электроны внешней оболочки могут получать энергию.
Если электроны находящиеся в валентной оболочке получат необходимый уровень энергии от внешних сил, они могут оторваться от нее и покинуть атом, то есть стать свободными электронами. Свободные электроны способны произвольно перемещаться от одного атома к атому. Те материалы, в которых содержится большое число свободных электронов, называются проводниками.
Изоляторы, есть противоположность проводникам. Они препятствуют протеканию электрического тока. Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов.
Промежуточное положение между изоляторами и проводниками занимают полупроводники, но о них мы поговорим позжеРассмотрим свойства атома. Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион.
Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
ПОНРАВИЛАСЬ СТАТЬЯ? ПОДЕЛИСЬ С ДРУЗЬЯМИ В СОЦИАЛЬНЫХ СЕТЯХ!
Источник: http://www.sxemotehnika.ru/elektronnoe-stroenie-atoma.html
Конспект урока по химии ""Строение электронных оболочек атома
Учитель химии: Түктібаева А.Қ.
- Дата:_______________________
- План урока по химии для 10 ___классa
- Тема урока:
- «Строение электронных оболочек атомов».
- Цель урока:
- Рассмотрение модели строения атома.
- Введение понятия «электронное облако», «электронная орбиталь» , «движение без траектории».
- Рассмотрение модели энергетических состояний атома.
Задачи урока:
- Образовательные: формирование представления об электронной оболочке атома и энергетических уровнях, рассмотрение электронного строения некоторых элементов, развитие умений по составлению электронных формул атомов, определению элементов по их электронным формулам, определение состава атома.
- Воспитательные: рассмотрение значимости работы русского химика Д.И.Менделеева;
- Развивающие: формирование умений работать с периодической системой, логически мыслить и оформлять результаты логических операций, проводить параллели между химическими понятиями, изучаемыми в теме.
План урока
-
Организационный момент 4 мин
-
Объяснение нового материала 25 мин
-
Закрепление и подведение итогов урока 12 мин
-
Информация о домашнем заданий 4 мин
Ход урока
-
-
Организационный момент 4 мин
-
Учитель: Доброе утро, ребята, Нам сегодня вместе предстоит продолжить постигать тайны и загадки, которыми полна наука «химия». Тема нашего урока «Строение электронных оболочек атомов» ( запишем в тетрадях).
Ребята, вам хочется увидеть атомы, электроны?…Можно ли это сделать?…
Можно….в воображении. Давайте попробуем. Итак, в путь!
Наша общая задача на уроке – продолжить изучение темы «Атомы химических элементов», нам предстоит актуализировать знания о строении атома и познакомиться со строением электронных оболочек атомов.
-
-
Объяснение нового материала 25 мин
-
- Поэт В.Брюсов в 1922 году под впечатлением от удивительных открытий физиков написал:
- Быть может, эти электроны-
- Миры, где пять материков,
- Искусства, знанья, войны, троны
- И память сорока веков!
- Еще, быть может, каждый атом-
- Вселенная, где сто планет;
- Там – все, что здесь, в объеме сжатом,
- Но также то, чего здесь нет.
- Учитель: Как вы понимаете эти строки?
- Учащиеся: Может быть… Сходство электронов и атомов с астрономическими объектами пока не подтвердилось, но того, «чего здесь нет», оказалось более чем достаточно, и об этом вы будете узнавать на уроках химии и физики.
Учитель: Науке потребовалось более 2000 лет, чтобы определить, на что он похож. И даже сейчас он все еще остается для нас загадкой.Предлагаю вам заполнить анкету от имени атома.
- Анкета.
- 1. Имя Атом
- 2. Место обитаниялюбое тело в газообразном, жидком, твердом агрегатном состоянии
- 3. Поразительные
- качестваневероятная малость
- 4. Строение атома
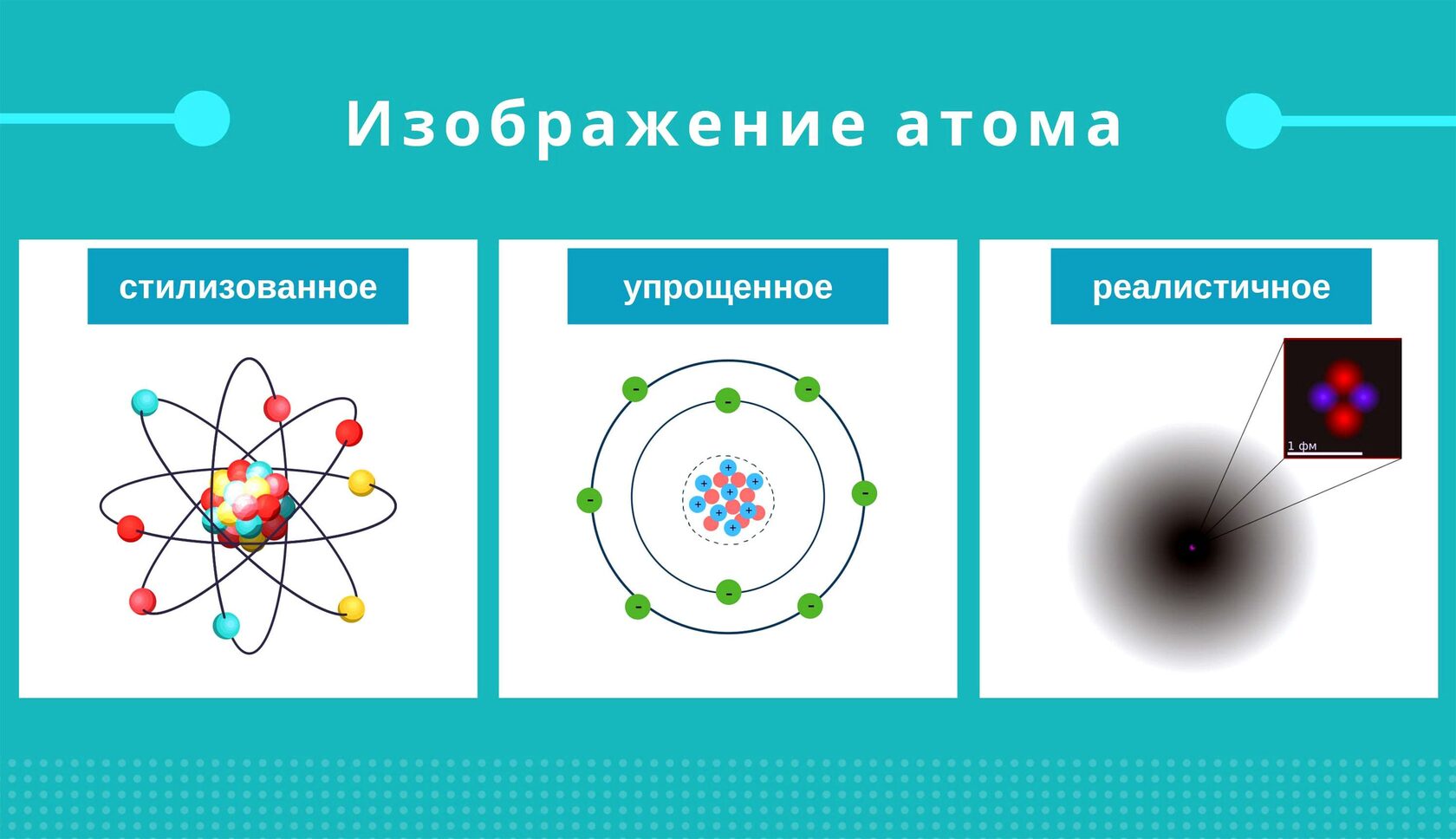
- Учитель: А из чего состоит атом? (схема)
- Учащиеся: Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов
- Учитель: А из чего состоит ядро атома?
- Учащиеся: Из протонов и нейтронов
- Учитель:А движущиеся вокруг ядра электроны образуют электронную оболочку.
Учитель: В начале ХХ в. была принята планетарная модель строения атома, согласно которой вокруг ядра движутся электроны, как планеты вокруг солнца. Следовательно, в атоме есть траектории, по которым движется электрон.
Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон.
Это уже не орбита, а орбиталь.
Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
Совокупность всех электронов, окружающих ядро, называется электронной оболочкой (записываем определение)
Учитель: Давайте выясним, как движутся электроны вокруг ядра?
Учитель: Беспорядочно или в определенном порядке? Оказывается, движение электронов происходит в определенном порядке.
Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии.
По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра.
Так образуются электронные слои в электронной оболочке атома.
- Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями.
- Электронный слой, состоящий из электронов с близкими значениями энергии, называется энергетическим уровнем. ( записываем определение)
- Учитель: А как же определить , сколько слоев ( энергетических уровней) в атоме того или иного элемента?
- Учащиеся:Число уровней определяется номером периода, в котором располагается элемент.
- Учитель:Например:
У Na -2 энергетических уровня, т.к. он находиться во 2 периоде
- У N – 3, 3 период
- У Fe – 4 , 4 период
- Учитель: А сколько электронов может находиться на каждом энергетическом уровне?
Принцип Паули 1925г, согласно которому в атоме не могут быть два электрона с одинаковыми квантовыми силами, т.е. на каждой орбитали может находиться не более двух электронов, с противоположными спинами.
Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле N = 2n2, где N— максимальное число электронов на уровне; n– номер энергетического уровня.
- Например:
- 1 энергетический уровень, n=1, N=2
- n=2, N=8 Каждый уровень вмещает не больше рассчитанного количества электронов.
Если электронный слой содержит максимально возможное число электронов, то его называют завершенным или спаренным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными или неспаренным.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.( записываем определение)
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех.
Первый энергетический уровень имеет один подуровень (s), второй- два (s,p), третий – три (s,p,d) и т.д.
Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга.
Электроны разных подуровней одного и того же уровня имеют разную форму
электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию.
S— орбиталь— это просто шарик. Путь электрона по ней напоминает путь нитки, которую наматывают на клубок. С нее начинается каждый уровень
P – орбиталь похожа на объемную восьмерку или перекрученную сосиску, и вместе перекрутки расположено ядро. Таких орбиталей на каждом энергетическом уровне -3, они располагаются под углом 90 – как оси координат.
- D— орбиталь – это две p-орбитали , соединенные центрами – как объемная четырехлепестковая ромашка, их на подуровне может быть 5.
- F – орбиталь имеет более сложную форму, ее трудно описать словами.
- Представьте путь своей мысли при решении системы уравнений с 3 неизвестными – это примерно такой же сложности.
- Каждая орбиталь вмещает максимум 2 электрона с противоположными спинами.
Спин — это условное направление движения электрона вокруг своей оси – оно может быть либо по часовой стрелке, либо против. Только электроны с разными спинами уживаются на одной орбитали, т.к. отталкивание их из-за одноименных зарядов частично гасится.
В.М.Клечковским 1951г, сформулировал правило: заполнение электронных подуровней осуществляется в порядке возрастания суммы(n+l) – в порядке возрастания числа n.
- Составим схему последовательного заполнения электронами энергетических уровней.
- 2ē 8ē 18ē
- n=1 n=2 n=3
- s s p s p d
- 2ē 2ē 6ē 2ē 6ē 8ē
- Теперь мы можем составить схему строения электронных оболочек атомов:
-
Определяем общее число электронов на оболочке по порядковому номеру элемента.
-
Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
-
Определяем число электронов на каждом энергетическом уровне.
-
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами.
- Пример:
- Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Свойства элементов изменяются периодически. У всех атомов семейств элементов (щелочные металлы, галогены, благородные газы) на внешнем энергетическом уровне одинаковое число электронов.У щелочных металлов – 1 электрон. У галогенов – 7 электронов. У благородных газов – внешний уровень их атомов завершен, 8 электронов.
Вывод: свойства химических элементов периодически (через определенные промежутки – периоды) повторяются потому, что периодически повторяется одинаковое строение внешних энергетических уровней их атомов.
-
-
ЗАКРЕПЛЕНИЕ И ПОДВЕДЕНИЕ УРОКОВ 12 мин
-
Вариант 1
-
Заряд ядра атома АЗОТА равен
а)7 б)13 в)4 г)26 д)11
-
Число протонов в ядре атома КРИПТОНА равно
- а)36 б)17 в)4 г)31 д)6
- 3.Число нейтронов в ядре атома ЦИНКА равно
- а)8 б)35 в)11 г)30 д)4
- 4.Число электронов в атоме ЖЕЛЕЗА равно
- а)11 б)8 в)56 г)26 д)30
- Вариант 2
-
Максимальное число электронов на 4 энергетическом уровне
а) 32 б)36 в)16 г)24
-
Число электронных уровней у атома кальция равно
- а)1 б)2 в)3 г)4
- 3.Число электронов на внешнем уровне атома БРОМА равно
- а) 7 б) 6 в)5 г)4
- 4.Общее число s-электронов у атома ЛИТИЯ равно
- а) 1 б)2 в)3 г)4
-
Электронная формула внешнего уровня 2s2 2p6 соответствует атому
- а) кислорода б) серы
- в) фтора г) неона
- Далее учащиеся меняются вариантами с соседями по парте, и проверяют по образцу на экране (взаимопроверка).
Учитель: Давайте подведем итоги урока. Что мы сегодня узнали нового?
-
Электрон не имеет траектории и движение его происходит по орбитали.
-
По схеме последовательного заполнения электронами энергетических уровней научились составлять электронные формулы элементов.
-
Научились по электронным формулам определять химический элемент.
- 4 ИНФОРМАЦИЯ О ДОМАШНЕМ ЗАДАНИЙ 4 мин: записи в тетради, 8, упр. по карточкам
- 1. Изобразите строение атомов следующих элементов:
- 1 вариант фосфора
- 2 вариант магния
- 2. Сравните строение атомов
- 1 вариант бора и фтора
- 2 вариант кислорода и серы
- 3. По данным о распределении валентных электронов найдите элемент:
- а) 2s1 б) 2s22p4 в) 3s23p6 г) 3d104s1 д) 4s24p3 е) 4s24p5
- ж) 3s23p4
Источник: https://infourok.ru/konspekt-uroka-po-himii-stroenie-elektronnih-obolochek-atoma-520945.html
Электронное строение атома, схема и примеры
Понятие «атом» знакомо человечеству ещё со времен Древней Греции. Согласно высказыванию древних философов, атом представляет собой мельчайшую частицу, входящую в состав вещества.
Электронное строение атома
Атом состоит из положительно заряженного ядра внутри которого находятся протоны и нейтроны. Вокруг ядра по орбитам движутся электроны, каждый из которых можно охарактеризовать набором из четырех квантовых чисел: главного (n), орбитального (l), магнитного (ml) и спинового (ms или s).
Главное квантовое число определяет энергию электрона и размеры электронных облаков.
Энергия электрона главным образом зависит от расстояния электрона от ядра: чем ближе к ядру находится электрон, тем меньше его энергия.
Другими словами, главное квантовое число определяет расположение электрона на том или ином энергетическом уровне (квантовом слое). Главное квантовое число имеет значения ряда целых чисел от 1 до бесконечности.
Орбитальное квантовое число характеризует форму электронного облака. Различная форма электронных облаков обусловливает изменение энергии электронов в пределах одного энергетического уровня, т.е. расщепление её на энергетические подуровне. Орбитальное квантовое число может имеет значения от нуля до (n-1), всего n значений. Энергетические подуровни обозначают буквами:
| Значение l | 1 | 2 | 3 | 4 | 5 |
| Обозначение | s | p | d | f | h |
| Форма | шар | объемная восьмерка | более сложная форма |
Магнитное квантовое число показывает ориентацию орбитали в пространстве. Оно принимает любое целое числовое значение от (+l) до (-l), включая нуль. Число возможных значений магнитного квантового числа равна (2l+1).
Электрон, двигаясь в поле ядра атома, кроме орбитального момента импульса обладает также собственным моментам импульса, характеризующим его веретенообразное вращение вокруг собственной оси.
Это свойства электрона получило название спина. Величину и ориентацию спина характеризует спиновое квантовое число, которое может принимать значения (+1/2) и (-1/2).
Положительное и отрицательное значения спина связаны с его направлением.
До того, как все вышеописанное стало известно и подтверждено экспериментально существовало несколько моделей строения атома. Одна из первых моделей строения атома была предложена Э.
Резерфордом, который в опытах по рассеянию α-частиц показал, что почти вся масса атома сосредоточена в очень малом объеме – положительно заряженном ядре.
Согласно его модели, вокруг ядра на достаточно большом расстоянии движутся электроны, причем их число таково, что в целом атом электронейтрален.
Развивать модель строения атома Резерфорда стал Н. Бор, который в своем исследовании также объединил учения Эйнштейна о световых квантах и квантовую теорию излучения Планка. Завершили начатое и представили миру современную модель строения атома химического элемента Луи де Бройль и Шредингер.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/elektronnoe/
Строение атома. Как расположены электроны внутри атома
- Атомы различных простых веществ, химических элементов, отличаются друг от друга лишь числом электронов, находящихся в электронных оболочках и количеством протонов, образующих ядра атомов.
- Как устроен атом — читаем здесь.
- Что такое электрон — читаем здесь.
- Что должен знать каждый о строении атома — читаем здесь.
Как расположены протоны и нейтроны внутри атома достоверно пока неизвестно. Но строение внешней оболочки атома, состоящей из движущихся вокруг ядра электронов исследовано физиками и химиками достаточно хорошо.
Количество электронов в оболочках атомов колеблется в диапазоне примерно от 1 до 100 электронов.
User:Murkt — Image:Helium_atom_QM.svg, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=3511620
Электроны распределяются в атоме как бы по слоям. причем, и это важно!!!, на каждый слой может уместиться строго определенное число электронов.
Первый слой — 2 электрона,
второй — 8 электронов,
третий — 18 электронов и т.д.
Давайте посмотрим на примеры. Возьмем всем известный кислород. Порядковый номер кислорода в таблице Менделеева — 8, значит в ядре у него 8 протонов, а около ядра движется 8 электронов.
Значит у кислорода электроны распределены по двум оболочкам: на первой находятся 2 электрона, а на второй — 6. А максимально на второй оболочке может быть 8 электронов.
значит электронный слой у кислорода заполнен не полностью, есть два вакантных местечка для свободных электронов.
Еще пример — натрий. Порядковый номер — 11. Электронов — 11.
- 1 слой- 2,
- 2 слой — 8,
- 3 слой — 1 электрон.
В таблице Менделеева эта закономерность строго прослеживается. В первом столбце таблицы у всех элементов: лития, калия, натрия, и т.д по 1 электрону вво внешней электронной оболочке. Во втором столбце у всех элементов по 2 электрона на внешнем слое и т.д.
Если рассматривать модель натрия, то черное пятно — это ядро и заполненные электронные оболочки по 2 и 8 электронов каждая соответственно, а размытое пятно создает единственный внешний электрон.
Спасибо за внимание. Ставьте лайкосы, подписывайтесь! Всегда с Вами канал «НАУКА, ТЕХНИКА, ЛЮДИ».
Источник: https://zen.yandex.ru/media/id/5a630d2c9b403c5442578563/5b092a999e29a2941ae631bb




