

История открытия
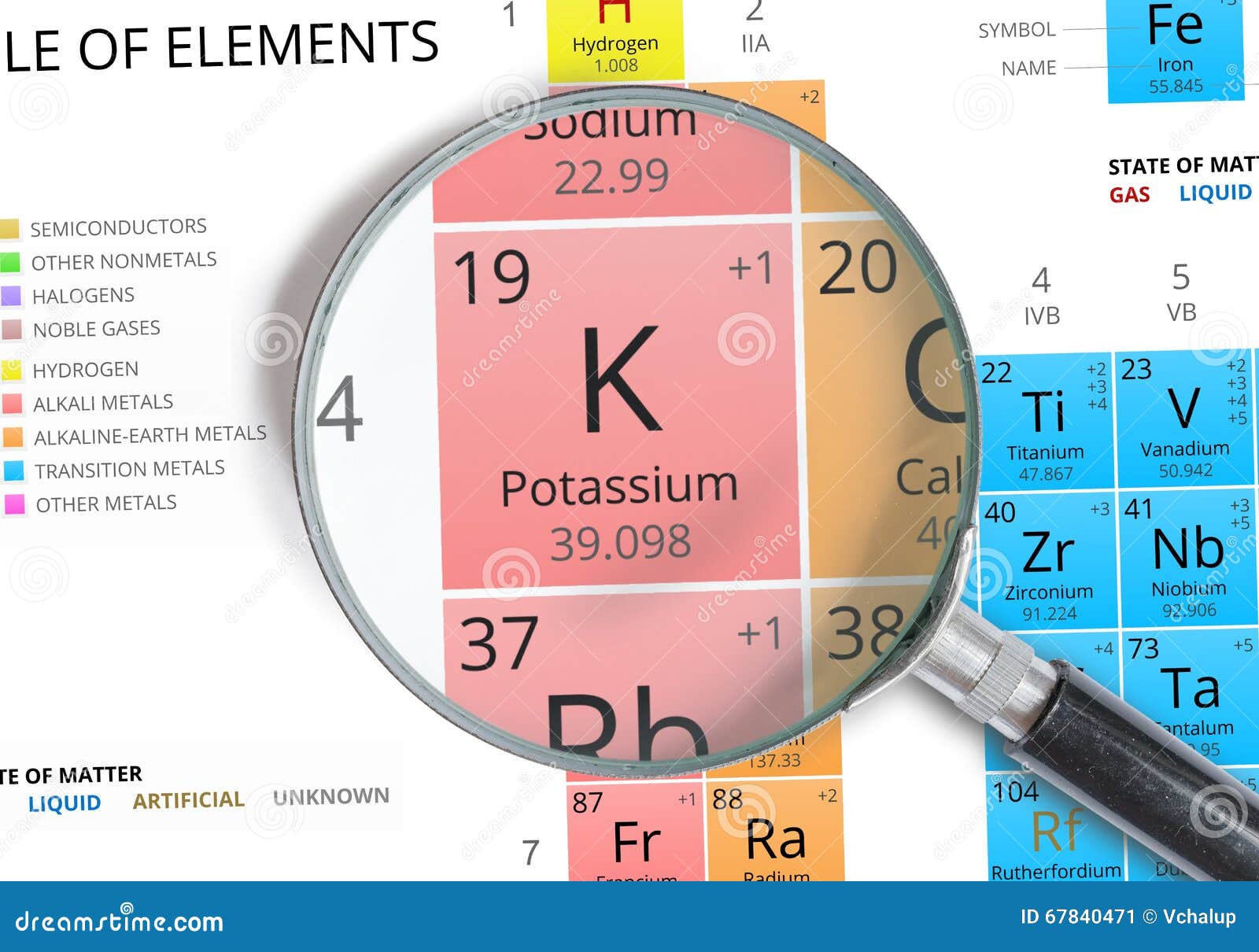
- Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева.
- Примерная молярная масса 39,1 г/моль.
- Электронная конфигурация калия 1s22s22p63s23p64s1

Единственная возможная степень окисления +1 (плюс один).
На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1.
Кристаллическая решётка простого вещества кубическая объёмно-центрированная.
В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум). Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений».
И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И.
Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
Калий в природе

После многолетних поисков выяснилось, что в природе калий не находится в чистом виде. Он один из десяти элементов, которые составляют большую часть окружающего мира.
Калий — неотъемлемый элемент в составе клеток живых организмов. Также большое количество содержится в минералах и морской воде. Минералы, формулы которых могут «похвастаться» большим содержанием этого элемента:
- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Способы получения
- Современные условия позволяют учёным получать калий несколькими способами.
- Уравнение взаимодействия с жидким натрием расплавленного основания при 380−450°C или хлорида при 760- 890 °C: Na + KOH = NaOH + K
- Электролиз расплава хлорида в смеси с карбонатом калия при температуре около 700 °C:
- 2KCl = 2K + Cl 2.
Физические свойства
Легкоплавкий металл серебристого цвета. При надрезе быстро образует оксидную плёнку после нескольких секунд контакта с кислородом, что объясняет требования особых условий содержания в помещениях. Хранится только в посуде с керосином, силиконами или бензином. Обладает хорошей растворимостью при соединении со ртутью. Образует амальгамы.
На соединение с водой реагирует взрывом. При поднесении горелки окрашивает пламя в розово-фиолетовый цвет.
Химические характеристики

Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды

- При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
- Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними.
Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C.
Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.
Сфера применения

Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Особые соединения калия

- Бромид используется в фармацевтике для изготовления успокоительных лекарств.
- Карбонат, хлорид и нитрат пользуются популярностью у садоводов, так как представляют собой удобрения, обогащённые большим количеством полезных микроэлементов.
- Перманганат применяется в химических лабораториях для получения кислорода, а также ранее широко применялся в быту благодаря своим антисептическим свойствам.
- Пероксид и супероксид обеспечивают регенерацию воздуха на подводных лодках и противогазах, благодаря своей способности поглощать углекислый газ и выделять кислород.

Из описания характеристик калия с другими элементами становится понятно, что это крайне важная составляющая организма, которая должны взаимодействовать с другими металлами и неметаллами, чтобы обеспечить гармоничный рост и развитие организма. Норма потребления этого элемента для человека — 2040 мг в сутки.
Роль этого металла и реакций организма, в которых он принимает участие, имеют большое значение для строения клеток, из которых состоит любой живой организм. Благодаря образованию различных химических связей, калий помог человечеству добиться новых вершин в кораблестроении, садоводстве, фармацевтической промышленности.
Повсеместное нахождение в природе позволяет добывать металл и его соединения беспрерывно, а благодаря успехам учёных в области химии возможно регулировать плотность содержания калия в препаратах. При соблюдении правильных пропорций и составлении схем алгоритмов можно предугадать пользу или вред.
Калий может быть полезным, но также он способен обрекать людей на тяжкие мучения, такие как: ожоги рук, раздражение слизистых оболочек. Об этом следует помнить всем, кто стремится узнать больше о свойствах этого металла. Прежде чем начинать работу с опасными веществами, лучше узнать всё о многолетнем опыте предшественников, чтобы избежать печальных и необратимых последствий.
Источник: https://nauka.club/khimiya/kaliy.html
Калий
| Атомный номер | 19 |
| Внешний вид простого вещества |  |
| Атомная масса (молярная масса) | 39,0983 а. е. м. (г/моль) |
| Радиус атома | 235 пм |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 4s1 |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность (по Полингу) | 0,82 |
| Электродный потенциал | −2,92 В |
| Степени окисления | 1 |
| Плотность | 0,856 г/см³ |
| Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| Теплопроводность | 79,0 Вт/(м·K) |
| Температура плавления | 336,8 K |
| Теплота плавления | 102,5 кДж/моль |
| Температура кипения | 1047 K |
| Теплота испарения | 2,33 кДж/моль |
| Молярный объём | 45,3 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,332 Å |
| Отношение c/a | — |
| Температура Дебая | 100 K |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках).
В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ).
Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей.
Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %).
При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор: K+ + e− → K 2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: 4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH.
Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли.
В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
![]()
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
![]()
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
![]()
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия.
Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
- В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
- Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
- Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.

Электронная оболочка
Изотопы калия
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет.
В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт).
В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия Щелочные металлы Натрий, по химическим свойствам очень схожий с калием
Источник: http://himsnab-spb.ru/article/ps/k
Калий (K, Kalium)
Калий был открыт осенью 1807 года английским химиком Дэви при электролизе твёрдого едкого кали.
Увлажнив едкий кали, ученый выделил металл, которому дал название потассий, намекая на производство поташа (необходимого ингредиента для изготовления моющих средств) из золы.
Своё привычное название металл получил через два года, в 1809г, инициатором переименования вещества стал Л.В. Гильберт, предложивший название калий (от арабского аль-кали – поташ).

Общая характеристика калия
Калий (лат. Kalium) является мягким щелочным металлом, элементом главной подгруппы I группы, IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 19 и обозначение – К.
Нахождение в природе
Калий в свободном состоянии в природе не встречается, он входит в состав всех клеток. Достаточно распространённый металл, занимает 7-е место по содержанию в земной коре (calorizator). Основными поставщиками калия являются Канада, Белоруссия и Россия, имеющие крупные месторождения данного вещества.
Физические и химические свойства
Калий – легкоплавкий металл серебристо-белого цвета. Имеет свойство окрашивать открытый огонь в яркий фиолетово-розовый цвет.
Калий имеет высокую химическую активность, это сильный восстановитель. При реакции с водой происходит взрыв, при длительном нахождении на воздухе полностью разрушается. Поэтому калий требует определённых условий для хранения – его заливают слоем керосина, силикона или бензина, для исключения вредных для металла контактов с водой и атмосферой.
Продукты питания богатые калием
Основными пищевыми источниками калия являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград, все зелёные овощи с листьями, листья мяты, семечки подсолнуха. Калия достаточно много в рыбе и молочных продуктах. Вообще, калий входит в состав почти всех растений. Яблочный уксус и мёд – чемпионы по содержанию калия.

Суточная потребность в калии
Суточная потребность организма человека в калии зависит от возраста, физического состояния и даже места проживания. Взрослым здоровым людям нужно 2,5г калия, беременным женщинам – 3,5г, спортсменам – до 5-ти грамм калия ежедневно. Количество необходимого калия для подростков рассчитывается по весу – 20 мг калия на 1 кг массы тела.
Полезные свойства калия и его влияние на организм
Калий вместе с натрием регулирует водный баланс в организме и нормализует ритм сердца, поддерживает концентрацию и физиологические функций магния.
Калий участвует в процессе проведения нервных импульсов и передачи их на иннервируемые органы. Способствует лучшей деятельности головного мозга, улучшая снабжение его кислородом.
Оказывает положительное влияние при многих аллергических состояниях. Калий необходим для осуществления сокращений скелетных мышц.
Калий регулирует содержание в организме солей, щелочей и кислот, чем способствует уменьшению отёков.
Калий содержится во всех внутриклеточных жидкостях, он необходим для нормальной жизнедеятельности мягких тканей (мышц, сосудов и капилляров, желез внутренней секреции и т.д.)
Усвояемость калия
Калий всасывается в организм из кишечника, куда поступает с пищей, выводится с мочой обычно в таком же количестве. Излишний калий выводится из организма тем же путём, не задерживается и не накапливается. Препятствиями для нормального всасывания калия могут послужить чрезмерное употребление кофе, сахара, алкоголя.
Взаимодействие с другими
Калий работает в тесном контакте с натрием и магнием, при росте концентрации калия из организма стремительно выводится натрий, а уменьшение количества магния может нарушить усвоение калия.

Признаки нехватки калия
Нехватка калия в организме характеризуется мышечной слабостью, быстрой утомляемостью, снижением иммунитета, сбоями в работе миокарда, нарушениями показателей артериального давления, учащённым и затруднённым дыханием.
Кожные покровы могут шелушиться, повреждения плохо заживают, волосы становятся очень сухими и ломкими. Происходят сбои в работе желудочно-кишечного тракта – тошнота, рвота, расстройства желудка вплоть до гастрита и язвы.
Признаки избытка калия
Переизбыток калия наступает при передозировке препаратов, содержащих калий и характеризуется нервно-мышечными расстройствами, повышенной потливостью, возбудимостью, раздражительностью и плаксивостью. Человек постоянно испытывает чувство жажды, которое приводит к частым мочеиспусканиям. Желудочно-кишечный тракт реагирует кишечными коликами, чередованием запоров и поносов.
Применение калия в жизни
Калий в виде основных соединений находит широкое применение в медицине, сельском хозяйстве и промышленности. Калийные удобрения необходимы для нормального роста и вызревания растений, а всем известная марганцовка, это не что иное, как перманганат калия, испытанный временем антисептик.
Источник: http://www.calorizator.ru/element/k
Калий в организме человека, его роль, продукты богатые калием,
Калий выполняет чрезвычайно важные функции в человеческом организме. Продукты, богатые калием, необходимы для поддержания нормальной нервной и мышечной работы, хорошей работы сердца и сосудов. Разберем, в чем важность этого микроэлемента для организма и какие источники могут его восполнить.
Общая характеристика калия
Калий – мягкий щелочной металл. В таблице Менделеева ему присвоен номер 19 и обозначение K. В свободном состоянии это вещество не встречается в природе, однако входит в состав многих элементов. В частности, является необходимым макроэлементом для работы клеток живого организма. В почве содержание калия оценивается на седьмом месте по содержанию элементов.
Значение калия для живых клеток трудно переоценить. Основа нормального существования живой клетки – поддержание внутриклеточного давления при помощи регуляции ионного баланса мембраны. Роль калия заключается в том, что его ионы, наряду с натрием (Na), обеспечивают работу «калий-натриевого насоса», который и регулирует оптимальное давление внутриклеточной среды.
Кроме того, калий в организме, является щелочным металлом, входит в состав жидких сред организма, поддерживая их кислотно-щелочной баланс. Стабильность этого баланса необходима для протекания всех обменных реакций в организме.
Нервные импульсы в своей химической составляющей также регулируются содержанием калия. От содержания его ионов зависит быстрота и стабильность протекания нервной деятельности. Это влияет не только на умственные способности человека, но и на его физические реакции: способность к сокращению мышц, быстрота рефлексов и т.д.
Импульсы нервной системы в организме касаются не только сознательной и двигательной деятельности. Гладкая мускулатура внутренних органов и поперечнополосатая мускулатура сердечной мышцы также нуждаются в стабильном проведении импульсов. Таким образом, калий регулирует и сердечный ритм, и вегетативную систему, выполняя роль основного макроэлемента в организме.

Полезные свойства калия и его влияние на организм
Из общих свойств понятно, что функции калия в организме человека можно назвать витальными. Выполнение важнейших функций в здоровье человека напрямую зависит от содержания этого элемента в организме. Кровоснабжение, внутренняя секреция, обмен веществ также зависят от проведения импульсов и кислотно-щелочного баланса среды.
Разберемся, для чего нужен калий в каждой из систем организма. В нервной системе этот щелочной металл, за счет его непосредственного влияния на проводимость нервных импульсов и метаболизм в тканях, улучшает кровоснабжение и стабилизирует работу мозга.
На практике это означает улучшение памяти, увеличение скорости реакции и концентрации внимания, улучшение настроения.
Кроме того, препараты макроэлемента используются в психиатрии в лечении депрессии и устранении психозов: как раз за счет свойства металла улучшать работу мозга и нормализовать реакции.

В сердечно-сосудистой системе калий нормализует сокращение сердечных мышц. Он позволяет укрепить сердце, избежать развития аритмии. За счет благотворного влияния на стенки сосудов улучшает снабжение тканей кислородом и другими питательными веществами.
Польза калия наблюдается так же у людей со склонностью к аллергии. Волосы, ногти и кожа улучшаются при регулярном приеме солей этого металла.
Макроэлемент входит в состав витаминов для будущих мам. Калий при беременности позволяет избежать судорог как у самой матери, так и является профилактикой патологии нервной системы у плода. Важно, однако, контролировать содержание металла в течение беременности. Его избыток может повлечь за собой формирование патологий у плода.
Несмотря на все перечисленные позитивные воздействия, влияние калия на организм человека может быть и отрицательным при нарушении обменных процессов или поступлении избыточного количества вещества. В частности, при отравлении калием могут развиться следующие состояния:
- повышенная возбудимость;
- паралич группы мышц;
- потливость;
- нарушение сердечного ритма;
- почечная недостаточность – отеки, учащенное мочеиспускание, боль в области поясницы.
Избыток калия может развиваться при употреблении его препаратов без контроля врача, физиологическом нарушении обмена в организме, а также при недостатке инсулина. Длительный избыток макроэлемента в организме может в конечном счете привести к развитию сахарного диабета.
Продукты с наибольшим содержанием минерала
Калий в продуктах можно найти без труда. Во многих компонентах нашего ежедневного рациона его содержится достаточно, чтобы не страдать от его дефицита, и при этом не применять различные хитрости в готовке.
- Первый источник калия, который многие игнорируют в рационе – это картофель. В средней неочищенной картофелине содержится до 900 мг калия. Таким образом, одна печеная картофелина на обед восполняет более пятой части суточной нормы вещества. Чтобы избежать негативных последствий для фигуры, рекомендуем готовить картофель без масла и не заправлять его жирными соусами вроде сметаны или майонеза.
- Для тех, кто не приемлет крахмала в рационе, будет интересно узнать — в каких еще продуктах много калия. Отличный вариант – вяленые томаты и органическая томатная паста без консервантов и обилия сахара. Лучше всего эти продукты приготовить самостоятельно. В стакане вяленых помидоров содержится до 1800 мг калия, что составляет около 40% от суточной нормы. Помимо этого, томаты содержат клетчатку, комплекс витаминов и минералов, и минимум калорий.
- Красная и белая фасоль. В этих бобовых культурах может содержаться от 600 до 1000 мг калия (из расчета на стакан продукта). Идеально добавлять фасоль в плотные супы или использовать в качестве дополнения к гарниру.
- Курага – любимица веганов и сыроедов. Сладкая, сытная и полезная — идеальный перекус или дополнением к десерту. Что касается калия, его там содержится практически 1200 мг (из расчета на 100 г сушеного абрикоса). Дуэтом к кураге часто выступает чернослив. Калия в нем около 700 мг на 100 г продукта, а помимо этого – комплекс витаминов для укрепления костей и красоты кожи.
- В таблицах с содержанием калия одно из самых почетных мест традиционно занимает авокадо. И не зря. В одном фрукте его содержится до 1000 мг, а также комплекс микроэлементов для нормальной работы сердца и сосудов, красивой кожи и стройной фигуры. А главное – авокадо можно добавлять в любые рецепты: в плотные крем-супы, в пасты, в смузи и коктейли, салаты и десерты. Суперфуд на все случаи жизни!
- Любителям морских даров придется по вкусу лосось. В 100 г рыбы содержится около 630 мг калия, что гораздо больше, чем в любой другой рыбе. Помимо этого, лосось содержит также витамин D и омега-3, которые улучшают состояние костей, волос и ногтей. Кроме того, регулярное присутствие лосося в рационе питания сокращает риск смертности от болезней сердца практически на треть.
- Продолжая список зеленых продуктов, содержащих калий в большом количестве, нельзя проигнорировать шпинат. Постоянный ингредиент детокс-смузи и отличный гарнир к любой рыбе или птице содержит в 100 г продукта примерно 560 мг калия. Диетологи рекомендуют сделать шпинат постоянным ингредиентом ежедневного рациона: листовые салаты с содержанием зелени включают максимум пользы и минимальное количество калорий.
- Завершает список тыква. Немногие используют этот продукт постоянно, и совершенно зря: в 100 г термически обработанной тыквы содержится более 400 мг калия, а в зимней – почти 450. Тыква отлично чувствует себя в десертах, пряных напитках, теплых салатах и в качестве гарнира к мясу.

Резюмируя тему о полезных продуктах, стоит отметить, что калий содержит капуста (как свежая, так и квашеная), свежий и сушеный инжир, грибы лисички (предпочтительно свежие), свежие овощи, цельное зерно. Во многих крупах и зерновых продуктах, где используются цельные злаки, также высокий процент содержания калия.
Калий в медицинских препаратах
Витамины калия в таблетках усваиваются чуть хуже, чем из продуктов питания. Особенно снижается вероятность усвоения калия при болезни желудка у пациента. Содержание калия в витаминах различно в зависимости от целей, выполняемых витаминным комплексом.
Относительно низкое соотношение макроэлемента в комплексных составах, выше – в моносоставах, предназначенных для профилактики и лечения сердечных и нервных болезней.
Детские витамины, обогащенные калием, содержат небольшую концентрацию, достаточную для веса детей.
Если целью приема калия является комплексное лечение заболевания или намеренное употребление в целях улучшения спортивных показателей, следует проконсультироваться с врачом по вопросу рекомендованной дозировки.
Бесконтрольный прием препарата может привести к отравлению.
Также при приеме препаратов калия необходимо отслеживать его содержание в крови, чтобы избежать повышенных концентраций.
Суточная норма
Согласно последним данным исследований, для мужчин суточная норма калия составляет 2,5 г. Для спортсменов эта доза может быть увеличена до 5 г, учитывая интенсивность их нагрузок и вес тела.
Суточная норма дневного потребления калия для женщин составляет около 2-2,3 г, для беременных – около 3,5 г. Детям и подросткам норма потребления рассчитывается по формуле: 20 мг вещества на 1 кг веса.
Взаимодействие с другими веществами
Витамины с калием обычно представляют собой либо минеральные комплексы для добавки к пище, либо специализированные препараты для лечения дефицита этого макроэлемента в организме. В составе витаминных комплексов его концентрация достигает примерно 2%, больше — в специализированных препаратах.
Витамины калия и магния применяются специально для профилактики и в составе лечения сердечно-сосудистых заболеваний. Для самостоятельного применения эти препараты не рекомендуются, т.к. могут вызвать избыток вещества в организме.
Человеку без диагностированной нехватки калия в организме принимать специализированные препараты не стоит. Этот макроэлемент прекрасно усваивается из продуктов питания, которые могут составить большую долю ежедневного рациона. Для баланса элементов в организме достаточно пересмотреть свое меню и предпочесть натуральные продукты, таблеткам и биодобавкам.
Овощи и фрукты, которые можно употреблять без термической обработки, лучше есть сырыми или в составе смузи. Для прочих лучше выбрать способ приготовления на пару или запекать без масла.
При высокой интеллектуальной или физической нагрузке лучше внести в рацион как можно больше продуктов, в которых больше всего калия.
Во многих фруктах, ягодах и сухофруктах также содержится калий – из них предпочтительно составлять десерты и перекусы.
Источник: https://vitaminic.ru/vitaminy-i-mineraly/produkty-s-kaliem
Характеристика химического элемента КАЛИЯ

Калий — обозначается символом K — химический элемент I группы периодической системы Менделеева;
- атомный номер 19,
- атомная масса 39,098;
Калий — серебристо-белый, очень легкий, мягкий и легкоплавкий металл.
Элемент состоит из двух стабильных изотопов — 39K (93,08%), 41K (6,91%) и одного слабо радиоактивного 40K (0,01%) с периодом полураспада 1,32·109 лет.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так: +19К: 2ё; 8ё; 8ё; 1ё.
Исходя из строения атома, можно предсказать степень окислени С1 калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.

- Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Nа к Rb.
- Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
- К2O + 2НСl = 2КСl +H2O;
- К2O +SO3 = К2SO4
- В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
- КОН+НNОз = КNO3+Н2O;
- 2КОН+H2O5 = 2KNO3+Н2O.
- Летучего водородного соединения калий не образует, а образует гидрид калия КН
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
Источник: https://kratkoe.com/harakteristika-himicheskogo-elementa-kaliya/
Калий и его характеристики
Калий не встречается в природе в свободном состоянии. Наиболее важными минералами калия являются: сильвин KCl, сильвинит NaCl×KCl, карналлит KCl×MgCl2×6H2O, каинит KCl×MgSO4×3H2O.
В виде простого вещества калий представляет собой блестящий серебристо-серый металл (рис. 1) с объемно-центрированной кристаллической решеткой. Исключительно реакционноспособный металл: на воздухе быстро окисляется, образуя рыхлые продукты взаимодействия.

Рис. 1. Калий. Внешний вид.
Атомная и молекулярная масса калия
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии калий существует в виде одноатомных молекул K, значения его атомной и молекулярной масс совпадают. Они равны 39,0983.
Изотопы калия
Известно, что в природе калий может находиться в виде двух стабильных изотопов 39Kи 41K. Их массовые числа равны 39 и 41 соответственно. Ядро атома изотопа калия 39K содержит девятнадцать протонов и двадцать нейтронов, а изотопа 41K – такое же количество протонов идвадцать два нейтрона.
Существуют искусственные изотопы калия с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 40K с периодом полураспада равным 1,248×109 лет.
Ионы калия
На внешнем энергетическом уровне атома калия имеется один электрон, который является валентным:
1s22s22p63s23p64s1.
В результате химического взаимодействия калий отдает свой единственный валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
К0-1e → Л+.
Молекула и атом калия
В свободном состоянии калий существует в виде одноатомных молекул Л. Приведем некоторые свойства, характеризующие атом и молекулу калия:
| Энергия ионизации атома, эВ | 4,34 |
| Относительная электроотрицательность | 0,82 |
| Радиус атома, нм | 0,235 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/kalij-i-ego-xarakteristiki/
Свойства калия
Калием называется элемент, находящийся в периодической системе Менделеева под 19-ым номером. Вещество принято обозначать заглавной буквой К (от латинского Kalium). В русской химической номенклатуре настоящее название элемента появилось благодаря Г.И. Гессу в 1831 году.
Изначально калий называли «аль-кали», что в переводе с арабского означает «зола растений». Именно едкий кали стал материалом для самого первого получения вещества. Едкий кали, в свою очередь, добывался из поташа, который являлся продуктами горения растений (карбонат калия). Его первооткрывателем стал Х.
Дэви. Стоит отметить, что карбонат калия является прототипом современного моющего средства. Позже он использовался для удобрений, используемых в сельском хозяйстве, в производстве стекла и других целей.
В настоящее поташ – это пищевая добавка, прошедшая официальную регистрацию, а калий научились добывать совершенно другими путями.
В природе калий можно обнаружить только в виде соединений с другими элементами (например, морская вода, или минералы), свободный его вид не встречается вообще. Он способен в достаточно короткий промежуток времени окисляться на открытом воздухе, а также вступать в химические реакции (например, при взаимодействии калия с водой, образуется щелочь).
| 1 | 2 | 3 | 4 | 5 |
| Россия | 19118 | 3658 | 31,4 | 17,8 |
| Европа | 3296 | 2178 | 18,5 | — |
| Беларусь | 1568 | 1073 | 9,1 | 16 |
| Великобритания | 30 | 23 | 0,2 | 14 |
| Германия | 1200 | 730 | 6,2 | 14 |
| Испания | 40 | 20 | 0,2 | 13 |
| Италия | 40 | 20 | 0,2 | 11 |
| Польша | 10 | 10 | 0,1 | 12 |
| Украина | 375 | 292 | 2,5 | 11 |
| Франция | 33 | 10 | 0,1 | 15 |
| Азия | 2780 | 1263 | 10,8 | – |
| Израиль | 600 | 44 | 0,4 | 1,4 |
| Иордания | 600 | 44 | 0,4 | 1,4 |
| Казахстан | 102 | 54 | 0,5 | 8 |
| Китай | 320 | 320 | 2,7 | 12 |
| Таиланд | 150 | 75 | 0,6 | 2,5 |
| Туркменистан | 850 | 633 | 5,4 | 11 |
| Узбекистан | 159 | 94 | 0,8 | 12 |
| Африка | 179 | 71 | 0,6 | – |
| Конго | 40 | 10 | 0,1 | 15 |
| Тунис | 34 | 19 | 0,2 | 1,5 |
| Эфиопия | 105 | 42 | >0,4 | 25 |
| Америка | 14915 | 4548 | 38,7 | — |
| Аргентина | 20 | 15 | 0,1 | 12 |
| Бразилия | 160 | 50 | 0,4 | 15 |
| Канада | 14500 | 4400 | 37,5 | 23 |
| Мексика | 10 | — | 12 | |
| США | 175 | 73 | 0,6 | 12 |
| Чили | 50 | 10 | 0,1 | 3 |
| Итого: | 40288 | 11744 | 100 | — |
Описание калия
Калий в виде простого вещества представляет собой щелочной металл. Для него характерен серебристо-белый окрас. На свежей поверхности моментально появляется блеск. Калий является мягким металлом, легко поддающимся плавлению. Если вещество или его соединения поместить в пламя горелки, то огонь приобретет розово-фиолетовый цвет.

Физические свойства калия
Калий очень мягкий металл, который легко разрезать обычным ножом. Его твердость по Бринеллю составляет 400 кн/м2 (или 0,04 кгс/мм2). Он имеет объемноцентрированную кубическую кристаллическую решетку (5=5,33 А). Его плотность составляет 0,862 г/см3 (200С). Вещество начинает плавиться при температуре в 63,550С, закипать – при 7600С.
Имеет коэффициент термического расширения, который равняется 8,33*10-5 (0-500С). Его удельная теплоемкость при температуре в 200С составляет 741,2 дж/(кг*К) или же 0,177 кал/(г*0С). При той же температуре имеет удельное электросопротивление, равное 7,118*10-8ом*м. Температурный коэффициент электросопротивления металла составляет 5,8*10-15.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Калий является щелочным металлом. В связи с этим, металлические свойства калия проявляются типично, так же, как и других подобных металлов.
Элемент проявляет свою сильную химическую активность, а кроме этого, также выступает в роли сильного восстановителя Как уже говорилось выше, металл активно вступает в реакцию с воздухом, о чем свидетельствует появление пленок на его поверхности, в результате чего его цвет становится тусклым.
Данную реакцию можно наблюдать невооруженным глазом. Если калий на протяжении достаточно длительного времени контактирует с атмосферой, то есть вероятность его полного разрушения. При вступлении в реакцию с водой, происходит характерный взрыв.
Это связано с выделяющимся водородом, который воспламеняется характерным розовато-фиолетовым пламенем. А при добавлении в воду, реагирующую с калием фенолфталеина, она приобретает малиновый цвет, который свидетельствует о щелочной реакции образующегося гидроксида калия (КОН).
При взаимодействии металла с такими элементами, как Na, Tl, Sn, Pb, Bi, образуются интерметаллиды
Указанные характеристики калия говорят о необходимости соблюдений определенных правил безопасности и условий во время хранения вещества. Так, вещество следует покрывать слоем бензина, керосина или силикона. Это делается для полного исключения его контакта с воздухом или водой.
Стоит отметить, что в условиях комнатной температуры металл вступает в реакцию с галогенами. Если его немного нагреть, то он легко взаимодействует с серой. В случае же увеличения температуры, калий способен соединяться с селеном и теллуром.
Если повысить температуру более 2000С в атмосфере водорода, то образуется гидрид КН, который способен воспламеняться без посторонней помощи, т.е. самостоятельно.
Калий совершенно не взаимодействует с азотом, даже если для этого создать надлежащие условия (повышенные температуру и давление). Однако, контактировать эти два вещества можно заставить, повлияв на них электрическим разрядом.
В данном случае получится азид калия KN3 и нитрид калия K3N. Если нагреть вместе графит и калий, то в результате получатся карбиды KC8 (при 300 °С) и KC16 (при 360 °C).
При взаимодействии калия и спиртов получаются алкоголяты. Кроме этого, калий делает существенно быстрее процесс полимеризации олефинов и диолефинов. Галогеналкилы и галогенарилы вместе с девятнадцатым элементом в результате дают калийалкилы и калийарилы.
| Свойства атома | |
| Название, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 0; +1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 336,8К; 63,65 °C |
| Температура кипения | 1047К; 773,85 °C |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | Кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
Электронное строение атома калия
Калий имеет положительно заряженное ядро атома (+19). В середине этого атома присутствуют 19 протонов и 19 нейтронов, которые окружаются четырьмя орбитами, где в постоянном движении находятся 19 электронов. Электроны распределены на орбиталях в следующем порядке:
1s22s22p63s23p64s1.
На внешнем энергетическом уровне атома металла находится всего 1 валентный электрон. Это объясняет тот факт, что абсолютно во всех соединениях калий имеет валентность 1.
В отличие от лития и натрия, данный электрон располагается на более удаленном расстоянии от ядра атома. Это является причиной повышенной химической активностью калия, чего нельзя сказать об упомянутых двух металлах.
Таким образом, внешняя электронная оболочка калия представлена следующей конфигурацией:
4s1.
Не смотря на присутствие вакантных 3p— и 3d-орбиталей, возбужденное состояние отсутствует.
Источник: http://mining-prom.ru/gorn/kaliy/svoystva-kaliya/




