Архив уроков › Химия 8 класс
В уроке 40 «Химические свойства солей» из курса «Химия для чайников» рассмотрим реакции солей с металлами, кислотами, со щелочами и другими солями.

Для большинства солей характерны реакции замещения и обмена, а для некоторых — еще и реакции разложения.
Реакции с металлами
Соли реагируют с металлами по общей схеме:

Образующиеся в этих реакциях менее активные металлы осаждаются на поверхности более активных металлов в виде рыхлой корочки. Если менее активным металлом является жидкая ртуть, она выделяется в виде сплошной блестящей пленки.
На этом ее свойстве основан очень интересный опыт «Серебрение монеты». В раствор соли ртути Hg(NO3)2опускают медную монету и практически сразу же ее поверхность становится блестящей, как серебро.
Этот блеск никак не связан с серебром, он обусловлен выделением блестящей ртути:

Следует помнить, что ртуть и ее соли сильно ядовиты! Поэтому данный опыт ни в коем случае нельзя пытаться выполнить самостоятельно.
Реакции с кислотами
Вы изучили химические свойства кислот и уже знаете, что в водных растворах они реагируют с солями, образуя новые кислоты и новые соли.
А можно ли сказать, что соли реагируют с кислотами с образованием тех же продуктов? Конечно, можно! Вы ведь уже хорошо знаете, как можно применить в химии математическое правило «от перемены мест слагаемых сумма не меняется».
Действительно, если кислоты реагируют с солями, то почему бы солям не реагировать с кислотами.
Итак, в водных растворах соли реагируют с кислотами по общей схеме:
Реакции этого типа относятся к реакциям обмена, поскольку участвующие в них исходные вещества обмениваются своими составными частями.
Изучив химические свойства оснований, вы узнали, что щелочи (растворимые основания) реагируют с солями, образуя новые основания и новые соли.
Будет совершенно правильным, если вы теперь скажете: «Эти же продукты образуются и при взаимодействии солей с основаниями».
Уже в который раз мы с вами убеждаемся в том, что из одних и тех же исходных веществ, независимо от порядка их смешивания, образуются одни и те же продукты.
Итак, соли реагируют с щелочами по общей схеме:

Реакции с другими солями
Соли в водных растворах вступают в реакции обмена с другими солями по общей схеме:

Термическое разложение
Соли некоторых кислородсодержащих кислот разлагаются с образованием основного и кислотного оксидов по общей схеме:

В ходе таких реакций всегда образуется газообразный кислотный оксид. Он соответствует той кислоте, остаток которой содержится в исходной соли. Вы помните, что угольной кислоте H2CO3 соответствует кислотный оксид CO2. Поэтому при разложении соли, содержащей остаток угольной кислоты, образуется указанный кислотный оксид:

По приведенной схеме разлагаются и некоторые соли сернистой кислоты H2SO3, которой соответствует кислотный оксид SO2:

Краткие выводы урока:
- Соли реагируют с металлами, кислотами, основаниями и другими солями.
Надеюсь Урок 40 «Химические свойства солей» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-40-himicheskie-svojstva-solej.html
Свойства солей: физические и химические :: SYL.ru
Каждый день мы сталкиваемся с солями и даже не задумываемся, какую роль они играют в нашей жизни. А ведь без них и вода была бы не такой вкусной, и пища не приносила бы удовольствия, и растения не росли, да и жизнь на земле не могла бы существовать, не будь в нашем мире соли. Так что же это за вещества и какие свойства солей делают их незаменимыми?
Что такое соли
По своему составу это самый многочисленный класс, отличающийся разнообразием. Еще в 19 веке химик Й. Верцелиус дал определение соли — это продукт реакции между кислотой и основанием, при которой водородный атом заменяется металлическим. В воде обычно соли диссоциируют на металл или аммоний (катион) и кислотный остаток (анион).

Получить соли можно следующими способами:
- путем взаимодействия металла и неметалла, в этом случае она будет бескислородная;
- при взаимодействии металла с кислотой получается соль и выделяется водород;
- металл может вытеснять другой металл из раствора;
- при взаимодействии двух оксидов — кислотного и основного (еще их называют оксидом неметалла и оксидом металла соответственно);
- при реакции оксида металла и кислоты получаются соль и вода;
- реакция между основанием и оксидом неметалла также дает соль и воду;
- с помощью реакции ионного обмена, при этом могут реагировать разные растворимые в воде вещества (основания, кислоты, соли), но протекать реакция будет, если образуется газ, вода или соли слаборастворимые (нерастворимые) в воде.
Только от химического состава свойства солей и зависят. Но для начала разберемся в их классах.
Классификация
В зависимости от состава выделяют следующие классы солей:
- по содержанию кислорода (кислородсодержащие и бескислородные);
- по взаимодействию с водой (растворимые, малорастворимые и нерастворимые).
Такая классификация отражает все многообразие веществ не полностью. Современная и наиболее полная классификация, отражающая не только состав, но и свойства солей, представлена в следующей таблице.
| Нормальные | Кислые | Основные | Двойные | Смешанные | Комплексные |
| Водород полностью замещен | Атомы водорода замещены на металл не полностью | Группы оснований замещены на кислотный остаток не полностью | В составе два металла и один кислотный остаток | В составе один металл и два кислотных остатка | Сложные вещества, состоящие из комплексного катиона и аниона или катиона и комплексного аниона |
| NaCl | KHSO4 | FeOHSO3 | KNaSO4 | CaClBr | [Cu(NH3)4]SO4 |
Физические свойства
Как бы ни был широк класс этих веществ, но общие физические свойства солей выделить возможно. Это вещества немолекулярного строения, с ионной кристаллической решеткой.

Очень высокие точки плавления и кипения. При нормальных условиях все соли не проводят электричество, но в растворе большинство из них прекрасно проводит ток.
Цвет может быть самым разным, он зависит от иона металла, входящего в ее состав. Сульфат железа (FeSO4) — зеленый, хлорид железа (FeCl3) — темно-красный, а хромат калия (K2CrO4) красивого ярко-желтого цвета. Но большинство солей все-таки бесцветные или белые.

Растворимость в воде также бывает различной и зависит от состава ионов. В принципе, все физические свойства солей имеют особенность. Они зависят от того, ион какого металла и какой кислотный остаток включены в состав. Продолжим рассматривать соли.
Химические свойства солей
Здесь тоже есть важная особенность. Как и физические, химические свойства солей зависят от их состава. А также от того, к какому классу они относятся.

Но общие свойства солей можно все-таки выделить:
- многие из них разлагаются при нагревании с образованием двух оксидов: кислотного и основного, а бескислородные — металла и неметалла;
- взаимодействуют соли и с другими кислотами, но реакция идет, только если в составе соли кислотный остаток слабой или летучей кислоты или в результате получается нерастворимая соль;
- взаимодействие со щелочью возможно, если катион образует нерастворимое основание;
- возможна реакция и между двумя разными солями, но только если одна из вновь образовавшихся солей не растворяется в воде;
- может происходить и реакция с металлом, но она возможна, только если брать металл, расположенный правее в ряду напряжения от металла, содержащегося в соли.
Химические свойства солей, относящихся к нормальным, рассмотрены выше, другие же классы реагируют с веществами несколько иначе. Но отличие идет только по продуктам на выходе. В основном все химические свойства солей сохраняются, как и требования к протеканию реакций.
Источник: https://www.syl.ru/article/281093/new_svoystva-soley-fizicheskie-i-himicheskie
Соли — классификация, получение и свойства
 Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Общая формула соли МnAcm, где М – металл, Ас – кислотный остаток, n – число атомов металла, равное заряду иона кислотного остатка, m – число ионов кислотного остатка, равное заряду иона металла.
Средними солями называют продукты полного замещения атомов водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Например, H3PO4 – Na3PO4;
Cu(OH)2 – CuSO4.
Кислыми солями называют продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например, H2SO4 – NaHSO4,
H3PO4 – Na2HPO4 – NaH2PO4.
Основными солями называют продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками.
Например, Ca(OH)2 – CaOHCl;
Fe(OH)3 – Fe(OH)2Cl – FeOHCl2.



- Кислые соли вступают в реакции с щелочами с образованием средних солей.
KHCO3 + KOH = K2CO3 + H2O - Некоторые кислые соли, например, угольной кислоты разлагаются под действием более сильных кислот:
KHCO3 + HCl = KCl + CO2 + H2O - Основные соли вступают в реакции с кислотами:
Cu(OH)Cl + HCl = CuCl2 + H2O
Свойства комплексных солей (способы разрушения комплексных солей)
1) Комплексные соли реагируют с сильными кислотами, продукты реакции зависят от соотношения между реагентами. При действии избытка сильной кислоты получается две средних соли и вода. При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода, например:
- K3[Al(OH)6] + 3HCl = 3KCl + Al(OH)3↓ + 3H2O
- K3[Al(OH)6] + 6HClизб = 3KCl + AlCl3 + 6H2O
- K2[Zn(OH)4] + 2HBr = 2KBr + Zn(OH)2↓ + 2H2O
- K2[Zn(OH)4] + 4HBr изб = 2KBr + ZnBr2 + 4H2O
- K3[Cr(OH)6] + 6HNO3 изб. = 3KNO3 + Cr(NO3)3 + 6H2O
- 2) При нагревании комплексные соли теряют воду:
- K[Al(OH)4] = KAlO2 + 2H2O
- K3[Cr(OH)6] = KCrO2 + 2H2O + 2KOH
- 3) При действии углекислого газа, сернистого газа или сероводорода получается соль активного металла и амфотерный гидроксид:
- Na[Al(OH)4] + CO2 = NaHCO3 + Al(OH)3↓
- K3[Cr(OH)6]+ 3SO2 = 3KHSO3 + Cr(OH)3↓
- Na[Al(OH)4] + H2S = NaHS + Al(OH)3↓+ H2O
- 4) При действии солей, образованных катионами Fe3+, Al3+ и Cr3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла:
- 3Na[Al(OH)4] + FeCl3 = 3Al(OH)3↓ + Fe(OH)3↓ + 3NaCl
- K3[Cr(OH)6] + Al(NO3)3 = Al(OH)3↓ + Cr(OH)3↓+ 3KNO3
Источник: http://himege.ru/soli-klassifikaciya-poluchenie-i-svojstva/
Соли: виды, свойства и применение
-
 — получаемые в результате взаимодействия кислот и оснований;— состоящие из кислотных остатков и ионов металлов.
— получаемые в результате взаимодействия кислот и оснований;— состоящие из кислотных остатков и ионов металлов.
Кислотные остатки могут быть связаны не с атомами металлов, а с ионами аммония (NH4)+, фосфония (РН4)+, гидроксония (Н3О)+ и некоторыми другими.
Виды солей
— Кислотные, средние, оснóвные. Если в кислоте все протоны водорода заменены ионами металла, то такие соли называют средними, например, NaCl. Если водород замещен лишь частично, то такие соли — кислые, напр. KHSO4 и NaH2PO4. Если гидроксильные группы (OH)– основания замещены кислотным остатком не полностью, то тогда соль — оснóвная, напр. CuCl(OH), Аl(OH)SO4.
 — Простые, двойные, смешанные. Простые соли состоят из одного металла и одного кислотного остатка, например, K2SO4. В двойных солях два металла, например KAl(SO4)2. В смешанных солях два кислотных остатка, напр. AgClBr.
— Простые, двойные, смешанные. Простые соли состоят из одного металла и одного кислотного остатка, например, K2SO4. В двойных солях два металла, например KAl(SO4)2. В смешанных солях два кислотных остатка, напр. AgClBr.
— Органические и неорганические.— Комплексные соли с комплексным ионом: K2[BeF4], [Zn(NH3)4]Cl2 и другие.— Кристаллогидраты и кристаллосольваты.
— Кристаллогидраты с молекулами кристаллизационной воды. CaSO4*2H2O.
— Кристаллосольваты с молекулами растворителя. Например, LiCl в жидком аммиаке NH3 дает сольват LiCl*5NH3.— Кислородосодержащие и не содержащие кислород.
— Внутренние, иначе называемые биполярными ионами.
Свойства
Большинство солей — твердые вещества с высокой температурой плавления, не проводящие ток. Растворимость в воде — важная характеристика, на ее основании реактивы делят на водорастворимые, малорастворимые и не растворимые. Многие соли растворяются в органических растворителях.
Соли реагируют:— с более активными металлами;
— с кислотами, основаниями, другими солями, если в ходе взаимодействия получаются вещества, в дальнейшей реакции не участвующие, например, газ, нерастворимый осадок, вода. Разлагаются при нагревании, гидролизируются в воде.
В природе соли широко распространены в виде минералов, рассолов, залежей солей. Их добывают также из морской воды, горных руд.
Соли необходимы человеческому организму. Соли железа нужны для пополнения гемоглобина, кальция — участвуют в образовании скелета, магния — регулируют деятельность желудочно-кишечного тракта.
Применение солей
Соли активно используются в производстве, быту, сельском хозяйстве, медицине, пищепроме, химическом синтезе и анализе, в лабораторной практике. Вот лишь некоторые сферы их применения:
— Нитраты натрия, калия, кальция и аммония (селитры); кальций фосфорнокислый,  хлорид калия — сырье для производства удобрений.— Хлорид натрия необходим для получения пищевой поваренной соли, применяется в химпроме для производства хлора, соды, едкого натра.
хлорид калия — сырье для производства удобрений.— Хлорид натрия необходим для получения пищевой поваренной соли, применяется в химпроме для производства хлора, соды, едкого натра.
- — Гипохлорит натрия — популярный отбеливатель и средство для обеззараживания воды.
- — Многие соли используются в качестве фиксаналов для определения химического состава веществ, качества воды, уровня кислотности и пр.
- В нашем магазине в широком ассортименте представлены соли, как органические так и неорганические.
— Соли уксусной кислоты (ацетаты) используются в пищевой индустрии как консерванты (калий и кальций уксуснокислый); в медицине для изготовления лекарств, в косметической отрасли (натрий уксуснокислый), для многих других целей.— Алюмокалиевые и хромокалиевые квасцы востребованы в медицине, пищепроме; для окрашивания тканей, кож, мехов.
Источник: https://pcgroup.ru/blog/soli-vidy-svojstva-i-primenenie/
Химические и физические свойства солей
ОПРЕДЕЛЕНИЕ
- Соли представляют собой электролиты, диссоциация которых образует катионы металлов (ион аммония или сложные ионы) и анионы кислотных остатков:
- ( mathrm{NaNOZ} mapsto mathrm{Na}++mathrm{NOZ}_{-} );
- ( mathrm{NH} 4 mathrm{NO} 3 leftrightarrow mathrm{NH} 4++mathrm{NO} 3_{-} );
- ( mathrm{KAl}(mathrm{SO} 4) 2 leftrightarrow mathrm{K}++mathrm{Al} 3++2 mathrm{SO} 42- );
- ( [mathrm{Zn}(mathrm{NH} 3) 4] mathrm{Cl} 2[mathrm{Zn}(mathrm{NH} 3) 4] 2++2 mathrm{Cl} ).
Соли обычно делят на три группы: средний (( mathrm{NaCl} )), кислый (( mathrm{NaHCO} 3 )) и основной (( mathrm{Fe}(mathrm{OH}) mathrm{Cl} )). Кроме того, имеются двойные (смешанные) и сложные соли. Двойные соли образуются двумя катионами и одним анионом. Они существуют только в твердой форме.
- Химические свойства солей
- а) кислотные соли
- Кислотные соли при диссоциации дают катионы металлов (ион аммония), ионы водорода и анионы кислотного остатка:
- ( mathrm{NaHCO} 3+mathrm{Na}++mathrm{H}++mathrm{CO} 32 ).
- Кислотные соли представляют собой продукты неполной замены атомов водорода соответствующей кислотой атомами металла.
- Кислые соли термически нестабильны и при нагревании разлагаются с образованием средних солей:
- ( mathrm{Ca}(mathrm{HCO} 3) 2=mathrm{CaCOZ} downarrow+mathrm{CO} 2 uparrow+mathrm{H} 2 mathrm{O} ).
- Реакции нейтрализации с щелочами характерны для кислотных солей:
- ( mathrm{Ca}(mathrm{HCO} 3) 2+mathrm{Ca}(mathrm{OH}) 2=2 mathrm{Ca} mathrm{CO} 3 downarrow+2 mathrm{H} 2 mathrm{O} ).
- б) основные соли
- Во время диссоциации основные соли дают катионы металлов, кислотные анионы и OH-ионы:
- ( mathrm{Fe}(mathrm{OH}) mathrm{Cl}
ightarrow mathrm{Fe}(mathrm{OH})++mathrm{Cl}-+mathrm{Fe} 2++mathrm{OH}-+mathrm{Cl} ). - Основными солями являются продукты неполной замены гидроксильных групп соответствующего основания кислотными остатками.
- Основные соли, а также кислая, термически нестабильны и разлагаются при нагревании:
- ( [mathrm{Cu}(mathrm{OH})] 2 mathrm{CO} 3=2 mathrm{CuO}+mathrm{CO} 2+mathrm{H} 2 mathrm{O} ).
- Реакции нейтрализации с кислотами характерны для основных солей:
- ( mathrm{Fe}(mathrm{OH}) mathrm{Cl}+mathrm{HCl} & ext { bull; } mathrm{FeCl} 2+mathrm{H} 2 mathrm{O} ).
- c) средняя соль
Во время диссоциации средние соли дают только катионы металлов (ион аммония) и анионы кислотного остатка (см. Выше). Средние соли являются продуктами полной замены атомов водорода соответствующей кислоты атомами металла.
- Большинство средних солей термически нестабильны и разлагаются при нагревании:
- ( mathrm{CaCO} 3=mathrm{CaO}+mathrm{CO} 2 );
- ( mathrm{NH} 4 mathrm{Cl}=mathrm{NH} 3+mathrm{HCl} );
- ( 2 mathrm{Cu}(mathrm{NO} 3) 2=2 mathrm{CuO}+4 mathrm{NO} 2+mathrm{O} 2 ).
- В водном растворе солевые соли подвергаются гидролизу:
- ( mathrm{Al} 2 mathrm{S} 3+6 mathrm{H} 2 mathrm{O} 2 mathrm{Al}(mathrm{OH}) 3+3 mathrm{H} 2 mathrm{S} );
- ( mathrm{K} 2 mathrm{S}+mathrm{H} 2 mathrm{O}
ightarrow mathrm{KHS}+mathrm{KOH} ); - ( mathrm{Fe}(mathrm{NO} 3) 3+mathrm{H} 2 mathrm{O}
ightarrow mathrm{Fe}(mathrm{OH})(mathrm{NO} 3) 2+mathrm{HNO} 3 ). - Средние соли входят в обменные реакции с кислотами, основаниями и другими солями:
- ( mathrm{Pb}(mathrm{NO} 3) 2+mathrm{H} 2 mathrm{S}=mathrm{PbS} downarrow+2 mathrm{HNO} 3 );
- ( mathrm{Fe} 2(mathrm{SO} 4) 3+3 mathrm{Ba}(mathrm{OH}) 2=2 mathrm{Fe}(mathrm{OH}) 3 downarrow+3 mathrm{BaSO} 4downarrow );
- ( mathrm{CaBr} 2+mathrm{K} 2 mathrm{CO} 3=mathrm{CaCO} 3 downarrow+2 mathrm{KBr} ).
- Физические свойства солей
Чаще всего соли представляют собой кристаллические вещества с ионной кристаллической решеткой. Соли имеют высокие температуры плавления. Когда n. соли являются диэлектриками. Растворимость солей в воде различна.
- Получение солей
- а) кислотные соли
- Основными методами получения кислотных солей являются неполная нейтрализация кислот, влияние избыточных оксидов кислот на основания и действие кислот на соли:
- ( mathrm{NaOH}+mathrm{H} 2 mathrm{SO} 4=mathrm{NaHSO} 4+mathrm{H} 2 mathrm{O} );
- ( mathrm{Ca}(mathrm{OH}) 2+2 mathrm{CO} 2=mathrm{Ca}(mathrm{HCO} 3) 2 );
- ( mathrm{CaCO} 3+mathrm{CO} 2+mathrm{H} 2 mathrm{O}=mathrm{Ca}(mathrm{HCO} 3) 2 ).
- б) основные соли
- Основные соли получают путем осторожного добавления небольшого количества щелочи в раствор солевой соли или под действием солей слабых кислот на средних солях:
- ( mathrm{AICl} 3+2 mathrm{NaOH}=mathrm{Al}(mathrm{OH}) 2 mathrm{Cl}+2 mathrm{NaCl} );
- ( 2 mathrm{MgCl} 2+2 mathrm{Na} 2 mathrm{CO} 3+mathrm{H} 2 mathrm{O}=[mathrm{Mg}(mathrm{OH})] 2 mathrm{CO} 3 downarrow+mathrm{CO} 2+2 mathrm{NaCl} ).
- c) средняя соль
- Основными методами получения солей среды являются реакция взаимодействия кислот с металлами, основными или амфотерными оксидами и основаниями, а также реакция взаимодействия оснований с кислотными или амфотерными оксидами и кислотами, реакция взаимодействия кислоты и основные оксиды и реакция обмена:
- ( mathrm{Mg}+mathrm{H} 2 mathrm{SO} 4=mathrm{MgSO} 4+mathrm{H} 2 );
- ( mathrm{Ag} 2 mathrm{O}+2 mathrm{HNO} mathbf{3}=2 mathrm{AgNO} mathbf{3}+mathrm{H} 2 mathrm{O} );
- ( mathrm{Cu}(mathrm{OH}) 2+2 mathrm{HCl}=mathrm{CuCl} 2+2 mathrm{H} 20 );
- ( 2 mathrm{KOH}+mathrm{SO} 2=mathrm{K} 2 mathrm{SO} 3+mathrm{H} 20 );
- ( mathrm{CaO}+mathrm{SO} 3=mathrm{CaSO} 4 );
- ( mathrm{BaCl} 2+mathrm{MgSO} 4=mathrm{MgCl} 2+mathrm{BaSO} 4downarrow ).
- Примеры решения проблем
- ПРИМЕР 1
Определить массу хлорида аммония, которая образуется при взаимодействии 5,9 г аммиака с 5,6 л (н.О.) хлористого водорода.
- Запишем уравнение образования хлорида аммония из аммиака и хлористого водорода:
( mathrm{NH} 3+mathrm{HCl}=mathrm{NH} 4 mathrm{Cl} ). - Определите, какое из веществ находится в избытке и которое находится в дефиците:
- ( mathrm{v}(mathrm{NH} 3)=mathrm{m}(mathrm{NH} 3) / mathrm{M}(mathrm{NH} 3)=5,6 / 17=0,33 ) моль;
- ( mathrm{v}(mathrm{HCl})=mathrm{V}(mathrm{HCl}) / mathrm{Vm}=5,6 / 22,4=0,25 ) моль.
- Расчет производится на веществе, которое находится в дефиците — на соляной кислоте. Рассчитайте массу хлорида аммония:
- ( mathrm{v}(mathrm{HCl})=mathrm{v}(mathrm{NH} 4 mathrm{Cl})=0,25 ) моль;
- ( (mathrm{NH} 4 mathrm{Cl})=0,25 imes 53,5=13,375 mathrm{г} ).
- Масса хлорида аммония — 13,375 г.
- ПРИМЕР 2
Определить количество вещества, объема (н.у.к.) и массы аммиака, необходимое для получения 250 г сульфата аммония, используемого в качестве удобрения.
Запишем уравнение для реакции получения сульфата аммония из аммиака и серной кислоты:
( 2 mathrm{NH} 3+mathrm{H} 2 mathrm{SO} 4=(mathrm{NH} 4) quad 2 mathrm{SO} 4 ).
Молярная масса сульфата аммония, рассчитанная с использованием таблицы химических элементов D.I. Менделеева — 132 г / моль. Затем количество сульфатата аммония:
- ( mathrm{v}((mathrm{NH} 4) quad 2 mathrm{SO} 4)=mathrm{m}((N H 4) 2 S 04) / M((N H 4) 2 S 04) )
- ( mathrm{v}((mathrm{NH} 4) quad 2 mathrm{S} 04)=250 / 132=1,89 ) моль
- Согласно уравнению реакции ( mathrm{v}((mathrm{NH} 4) quad 2 mathrm{S} 04) : mathrm{v}(mathrm{NH} 3)=1 : 2 ), поэтому количество аммиака равно:
- ( mathrm{v}(mathrm{NH} 3)=2 imes mathrm{v}((mathrm{NH} 4) 2 mathrm{SO} 4)=2 imes 1,89=3,79 ) моль.
- Определим объем аммиака:
- ( mathrm{V}(mathrm{NH} 3)=mathrm{v}(mathrm{NH} 3) imes mathrm{V}_{mathrm{m}} );
- ( V(N H 3)=3,79 imes 22,4=84,8 л ).
Молярная масса аммиака, рассчитанная с использованием таблицы имических элементов Д.И. Менделеева – 17 г/моль. Тогда, найдем массу аммиака:
- ( mathrm{m}(mathrm{NH} 3)=mathrm{v}(mathrm{NH} 3) imes mathrm{M}(mathrm{NH} 3) );
- ( mathrm{m}(mathrm{NH} 3)=3,79 imes 17=64,43 mathrm{г} ).
Количество вещества аммиака — 3,79 моль, объем аммиака — 84,8 л, масса аммиака — 64,43 г.
Источник: https://sciterm.ru/spravochnik/himicheskie-i-fizicheskie-svojstva-solej/
2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка)
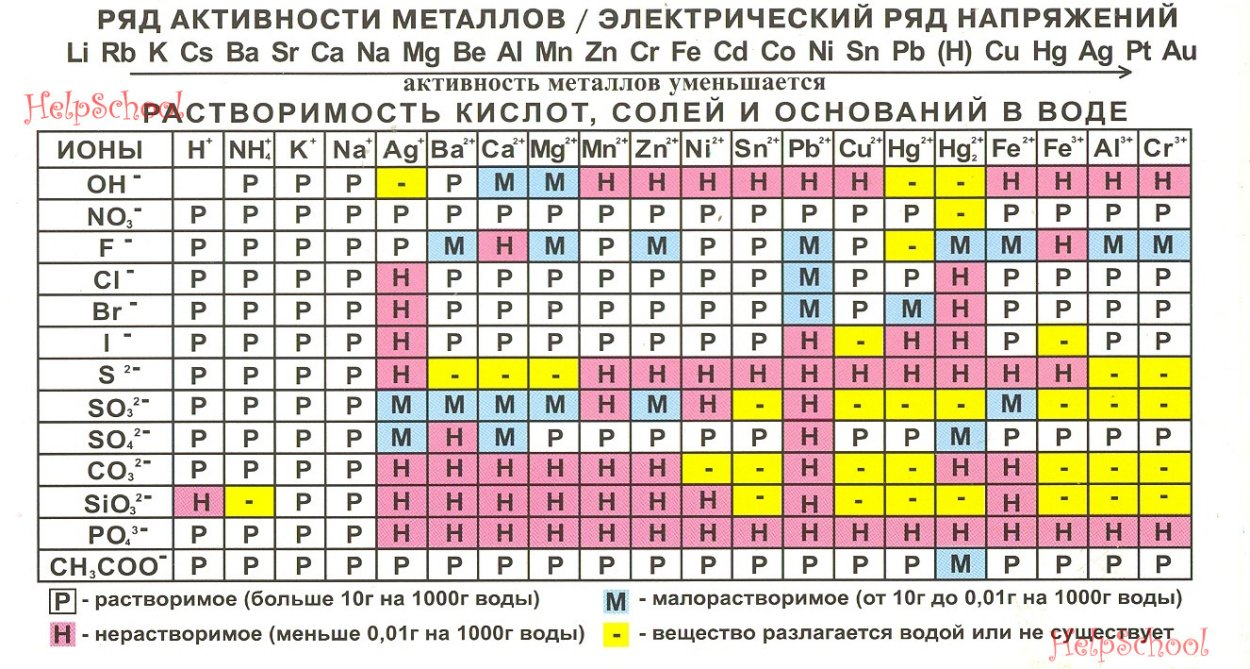
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок.
Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида.
Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
- Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
- Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
- В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
- Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
- Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
- Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
- а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
- Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
- Также следует отметить специфику разложения нитрата аммония:
Разложение солей аммония
- Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
- В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
- Кислые соли реагируют с щелочами.
При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
- Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
- так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
- Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
- Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
- Основные соли всегда реагируют со всеми сильными кислотами.
При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
- Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
- В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
- Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
- Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
- Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
- При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
- Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
- В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
- В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
- При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/himicheskie-svojstva-solej
Химические свойства солей
Урок на тему «Химические свойства солей»
Степанова Т.Н., учитель химии
- Методическая разработка
- 2019
- Методическая разработка на тему урока « Химические свойства солей»
- Цель: Изучить химические свойства солей.
- Задачи:
Образовательная: Закрепить знания о солях. Рассмотреть химические свойства солей. Продолжить формировать умения работать самостоятельно с учебником.
Развивающая: Развивать познавательный интерес, умение сравнивать, анализировать, обобщать, делать выводы.
Воспитательная: Воспитывать умение работать в группе, желание помогать друг другу. Прививать интерес к предмету химии.
Оборудование: мультимедийная презентация, реактивы, красные,желтые,синие карточки для рефлексии.
Ход урока
- Мотивация учебной деятельности
-Здравствуйте! Садитесь. Я рада вас видеть на сегодняшнем уроке. Надеюсь, что наша совместная работа будет полезной и интересной.
-Я бы хотела начать наш урок с конкурса «Химический чемоданчик».
Конкурс “ Химический чемоданчик”
В чемодане находится вещество, которое необходимо угадать, как в игре ЧТО? ГДЕ? КОГДА?
1.В ее честь названы многие города, реки и озера.
- Она необходима организму человека каждый день. Ее недостаток в пище пагубно сказывается на здоровье.
3.В средние века она ценилась дороже серебра и золота. У всех народов она – символ гостеприимства, верности, радушия.
Как вы думаете, о каком веществе идет речь?(Поваренная соль).
-К какому классу неорганических соединений она относится. Правильно, соли, эту тему вы начали изучать еще на прошлых уроках.
- Актуализация знаний и фиксация затруднений в пробном действии
-Я хочу предложить вам отгадать загадки, в которых речь идет также о солях. Что это за соли вы ответите мне через несколько минут, когда их разгадаете.
- -Первая загадка.
- Он может быть цветной и белый, Им дети любят рисовать, Художник он, в руках умелых, Картины может создавать! Выводит им слова учитель, Детишкам в школе на доске, Кто он, загадки этой житель,
- Живущий в маленьком куске?
Ответ готов? Верно, это мел СаСО3.
-Вторая загадка.
Эта соль- главный конструкционный материал для построения внутреннего скелета позвоночных: костей, зубов. Она содержится в мышцах, нервах, особенно необходима для построения скелета ребёнка. Нехватка этой соли в организме человека и животных приводит к заболеванию рахитом.
Назовите эту соль. Са3(РО4)
— Мы сейчас с вами вели разговор о солях. О СаСО3 меле – которым мы пишем на доске. И о Са3(РО4)2-соли так необходимой нашему организму.
-Что же между ними общего? (Сложные вещества, состоят из атомов металла и кислотного остатка.
— Молодцы! Мы вспомнили с вами определение солей.
- -А сейчас выполните следующее задание:
- С какими из веществ будут реагировать представленные соли:
- Соли Вещества
1.CaCO3 А. NaOH
2.СuCl2 Б. H2SO4
- Г. MgО
- Д. Na2S
- Ключ : 1-Б,Д 2-А, Б, В,Д
- Выявление места и причин затруднения
-Вы справились с заданием ? Да. Частично.
— С какой частью работы вы легко справились? ( С той, что касается взаимодействия солей с кислотами и с основаниями.)
— Где возникли затруднения? ( Не знаем точно, будут ли соли реагировать с металлами и оксидами. Что необходимо для выполнения задания? (Необходимо знать химические свойства солей)
-Какую цель мы перед собой поставим? Изучить химические свойства солей.
-Какую тему мы сегодня с вами будем изучать? Химические свойства солей и генетическая связь между классами неорганических соединений.
- На уроке мы будем решать проблему: «Почему соли часто называют классом веществ, связывающим между собой другие классы неорганических соединений.»
- Давайте запишем число и тему урока в тетрадь.
- -А теперь составим план действий.
- Изучить :
- а) взаимодействие солей с металлами, образуется новая соль и металл.
- б)взаимодействие солей с кислотами, образуется новая кислота и новая соль
- в)взаимодействие солей с щелочами, образуется нерастворимое основание и соль
- г)взаимодействие солей с солями, образуются новые соли
- д)разложение некоторых солей при нагревании
- 4.Изучение нового материала
- На доске появляется алгоритм действий:
- 1.Соль1 + Ме1 = соль2 +Ме2
- Запомни:Соли взаимодействуют с металлами более активными, чем металл образующий соль.
- 2.Соль1+кислота1 = соль2+ кислота2
- Запомни:Соли взаимодействуют с кислотами, если образуются газ или осадок
- Соль1+ щелочь= соль2 +основание
Запомни:Соли взаимодействуют с растворами щелочей, если образуется нерастворимое основание
- Соль1+ соль2 = соль3 + соль4
Запомни:Соли взаимодействуют с солями, если образуются осадок или газ.
- Соль = основной оксид + кислотный оксид
Запишем уравнения реакций:
- CuSO4 + Zn = Cu↓ + ZnSO4
- Na2CO3 (ТВ.) + 2 HCl = NaCl + H2O + CO2↑
- CuС12 + 2NaOH = Cu (OH)2↓ + NaС1
- BaCl2 + K2SO4 = 2KCl + BaSO4↓
- Na2CO3 =t= Na2O + CO2↑
Рассмотрим некоторые реакции подробнее,а точнее последние три свойства солей.
- Вы это уравнение уже записали ,но посмотрите как протекает эта реакция.
CuС12 + 2NaOH = Cu (OH)2↓ + NaС1
- . Взаимодействие солей друг с другом ( хирург без ножа)
FeC13 + 3 KSCN = Fe(SCN)3 + 3 KC1
- Разложение солей при нагревании( вулкан)
- (NH4)2Cr2O7 = Cr2O3 + N2 +4 H2O
- Некоторые соли (щелочных и щелочноземельных металлов) окрашивают пламя в разные цвета, рассмотрим их.
- Генетические связи -это связи между разными классами ,основанные на их взаимопревращениях.
Генетический ряд – ряд веществ- представителей разных классов, являющихся соединениями одного химического элемента,связанных взаимопревращениями и отражающих превращения данных веществ. В основу этих рядов положен один и тот же элемент.
- Задание.Написать уравнения реакций с помощью которых можно осуществить превращения
- Zn → ZnO → ZnCl2 →Zn(OH)2→ ZnO → Zn
- 1) 2Zn + O2 = 2ZnO реакция соединения
- 2) ZnO + 2HCl = ZnCl2 + H2O реакция обмена
- 3) ZnCl2 + 2KOH = Zn(OH)2 + 2KCl реакция обмена
- 4) Zn(OH)2 = ZnO + H2O реакция разложения
- 5) ZnO + H2 = Zn + H2O реакция замещения
- Ca → Ca(OH)2→ CaSO4 → BaSO4
- 1) Ca + 2H2O = Ca(OH)2 + H2↑реакция замещения
- 2) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O реакция обмена
- 3) CaSO4 + BaCl2 = BaSO4↓ + CaCl2реакция обмена
- S → SO2 → SO3 → H2SO4 → Na2SO4
- 1) S + O2 = SO2 реакция соединения
- 2) 2SO2 + O2 = 2SO3 реакция соединения
- 3) SO3 + H2O = H2SO4 реакция соединения
- 4) Na2O + H2SO4 = Na2SO4 + H2O реакция обмена
- 5.Закрепление
- «Химический цветок»
В нашей лаборатории расцвёл цветок необычайной красоты – на его лепестках – формулы веществ. Вспомним о лете. Летом вы, наверное, гадали на ромашке «любит – не любит», так и сегодня мы погадаем «взаимодействует – не взаимодействует» данное вещество с сульфатом меди? (На лепестках формулы: Аu, Zn, CuO, CO2 , NaOH, KCl, , HCI, Mg). Зачеркните ненужные лепестки. Что осталось?
Проверьте по слайду правильность выполнения задания (остаются: Zn, NaOH, Mg).
6.Домашнее задание:
7.Рефлексия.
«Сигнальные карточки»
- Зеленая – «Мне было интересно»
- Красная– «Я усвоил новую информацию»
- Оранжевая – «Мне было сложно»
- синяя– «Я ничего не понял»
Источник: https://pedsovet.org/publikatsii/himiya/himicheskie-svoystva-soley




