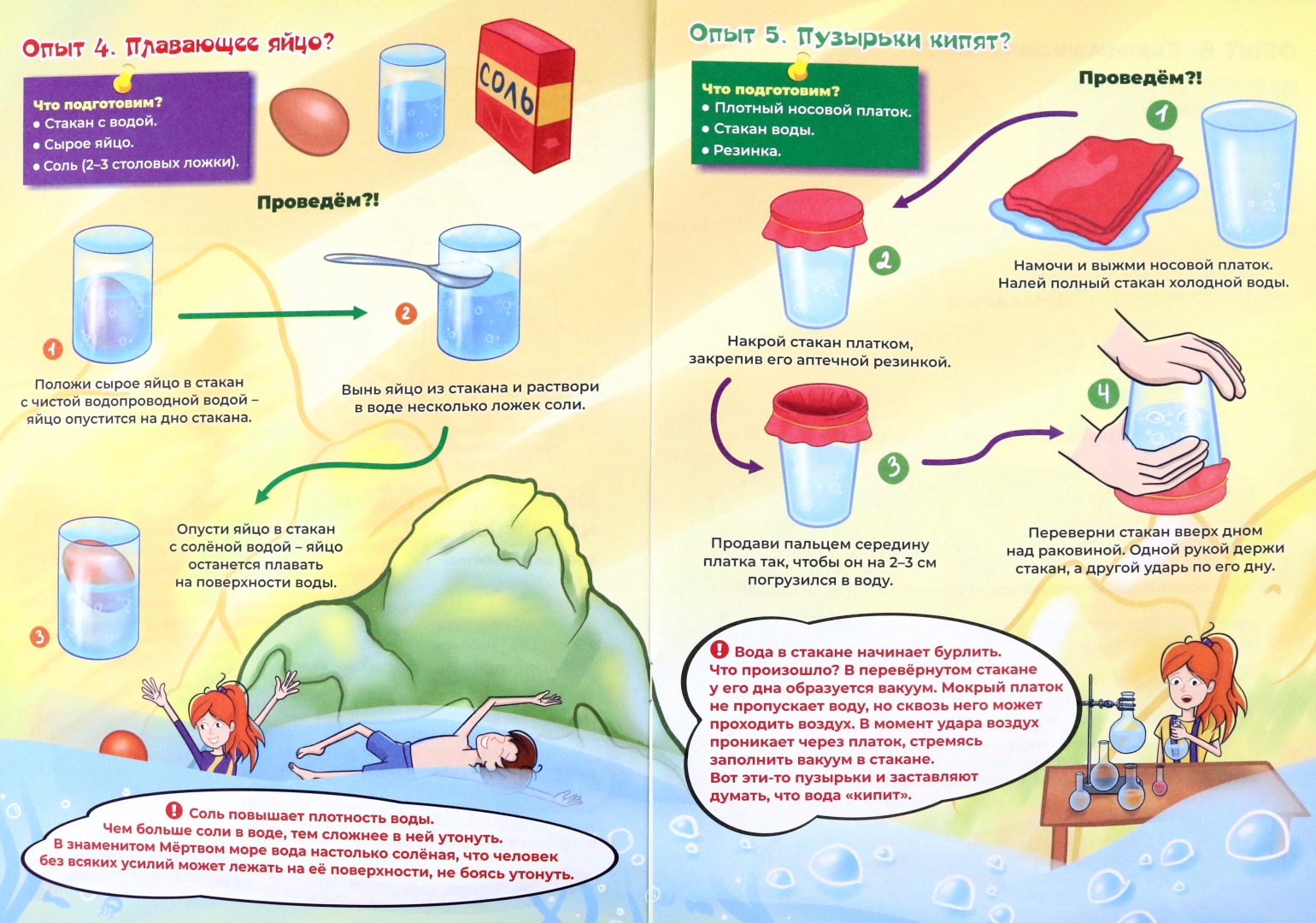
Архив уроков › Химия 8 класс
В уроке 27 «Состав и физические свойства воды» из курса «Химия для чайников» узнаем, что из себя представляет вода, выясним её состав, а также физические свойства.

Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений.
Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана.
Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.

Состав и строение воды
Как вы уже знаете, молекула воды состоит из трех атомов — двух атомов водорода и одного атома кислорода (рис. 105). Относительная молекулярная масса воды равна:
Следовательно, молярная масса воды равна:
![]()
Вода — это вещество с молекулярным строением. В твердом (рис. 106) и жидком агрегатных состояниях молекулы воды прочно связаны друг с другом. Этим во многом объясняется целый ряд удивительных физических свойств воды.

Физические свойства воды
При комнатных условиях вода представляет собой жидкость без вкуса и запаха. В тонком слое вода не имеет цвета. Однако при толщине более 2 м она имеет голубой цвет. Совершенно чистая вода очень плохо проводит электрический ток.
На заметку: По тому, как проводит электрический ток вода, можно судить о ее чистоте — чем ниже электропроводность, тем чище вода.
У большинства веществ в твердом состоянии плотность выше, чем в жидком. В отличие от них вода в твердом агрегатном состоянии (лед) имеет более низкую плотность, чем в жидком. При 0 °С плотность льда равна примерно 0,92 г/см3, а плотность жидкой воды — примерно 1,00 г/см3.
Это означает, что лед легче воды, поэтому он не тонет в ней (рис. 107). Такая особенность воды объясняет, почему водоемы начинают замерзать не со дна, а с поверхности и очень редко промерзают до самого дна. Это защищает живые организмы, обитающие в реках и морях, от гибели.
У воды высокая теплоемкость, поэтому она медленно нагревается, но и медленно остывает. Это позволяет морям и океанам накапливать тепло летом (и днем) и высвобождать его зимой (и ночью), что предотвращает резкие колебания температуры воздуха на нашей планете в течение года (и суток). Моря и океаны служат своеобразными аккумуляторами тепла на нашей планете.

При нормальном давлении (101,3 кПа) температура кипения воды равна 100 °С. При понижении давления температура кипения воды понижается.
Например, в горах на высоте около 5000 м давление существенно ниже нормального (примерно в два раза), поэтому вода закипает в этих условиях при температуре около 84 °С. Понятно, что варить продукты до готовности в горах необходимо более длительное время.
И наоборот, в скороварке, где создается высокое давление, вода закипает при температуре выше 100 °С, что позволяет быстрее приготавливать пищу.
Вода как растворитель
С совершенно чистой водой, не содержащей никаких других веществ, большинство людей никогда не встречается. Такая вода используется только в специальных целях.
Почти все жидкости, с которыми мы сталкиваемся в повседневной жизни и деятельности, представляют собой растворы различных веществ.
Раствор — это однородная смесь двух и более веществ.
Одно из веществ, входящих в состав раствора, называется растворителем, а остальные — растворенными веществами. Очень часто растворителем является вода. Вода может растворять твердые, жидкие и газообразные вещества.
Все природные воды содержат растворенные соли. Их легко обнаружить экспериментально, выпарив воду на часовом стекле. Кроме солей, вода может растворять различные газы. Их присутствие (правда, не всегда) можно обнаружить экспериментально.
Например, поместив пробирку с холодной водой из-под крана в теплое место, через некоторое время можно заметить у стенок пробирки пузырьки.
Это растворенные газы (преимущественно кислород) выделяются из раствора при его нагревании до комнатной температуры (рис. 108).

Многие жидкости также хорошо растворимы в воде. Например, серная кислота и спирт неограниченно растворяются в воде. В таком случае говорят, что вещество смешивается с водой в любых соотношениях. Из-за хорошей растворимости многих веществ в воде ее иногда называют универсальным растворителем.
Краткие выводы урока:
- Вода не имеет вкуса, цвета (в тонком слое) и запаха, кипит при 100 °С, а переходит в твердое состояние при 0 °С.
- Плотность твердой воды меньше, чем жидкой.
- Раствор — это однородная смесь двух и более веществ.
- Вода является универсальным растворителем — она хорошо растворяет многие твердые, жидкие и газообразные вещества.
Надеюсь урок 27 «Состав и физические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-27-sostav-i-fizicheskie-svojstva-vody.html
Физические и химические свойства, формула воды: строение и какова критическая температура
Основное вещество, которое позволяет существовать жизни на планете – это вода. Она необходима в любом состоянии. Изучение свойств жидкости привело к образованию целой науки – гидрологии.
Предмет изучения большинства ученых – это физические и химические свойства воды.
Они понимают под этими свойствами: критические температуры, кристаллическую решетку, примеси и другие индивидуальные особенности химического соединения….
Изучение
Формула воды известна каждому школьнику. Это три простых знака, но содержатся они в 75% от общей массы всего на планете.
Н2О – это два атома водорода и один кислорода. Структура молекулы имеет эмпирическую форму, поэтому свойства жидкости такие многообразные, несмотря на простой состав. Каждая из молекул находится в окружении соседей. Они связаны одной кристаллической решеткой.
Простота строения позволяет жидкости существовать в нескольких агрегатных состояниях. Ни одно вещество на планете не может этим похвастаться. Н2О очень подвижна, она уступает в этом свойстве лишь воздуху.
Каждый осведомлен о круговороте воды, о том, что после испарения ее с поверхности земли, где-то далеко проходит дождь или снег.
Климат регулируется именно благодаря свойствам жидкости, которая может отдавать тепло, а сама при этом практически не изменяет свою температуру.
Физические свойства
Н2О и ее свойства зависят от многих ключевых факторов. Основные из них:
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. В космосе она будет геометрически правильной формы.
- Реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно, что температура кипения 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Есть эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Интересно! Н2О, очищенная от примесей (дистиллированная), не может проводить ток. Это свойство оксида водорода появляется лишь при наличии растворенных в нем солей.

Другие особенности
Лед – это уникальное состояние, которое свойственно оксиду водорода. Он образует рыхлые связи, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, делая плотность льда намного ниже жидкости. Это позволяет водоемам не промерзать полностью в зимний период, сохраняя жизнь под слоем льда. Ледники – большой запас пресной воды.
Интересно! У Н2О есть уникальное состояние, которое называется явлением тройной точки. Это когда она находится сразу в трех своих состояниях. Возможно это условие, лишь при температуре 0,01 градус и давлении 610 Па.
Химические свойства
Основные химические свойства:
- Разделяют воду по жесткости, от мягкой и средней до жесткой. Этот показатель зависит от содержания солей магния и калия в растворе. Есть также такие металлы, которые находятся в жидкости постоянно, а от некоторых можно избавиться кипячением.
- Окисление и восстановление. Н2О влияет на процессы, изучаемые в химии, происходящие с другими веществами: одни она растворяет, с другими вступает в реакцию. Исход любого эксперимента зависит от правильного выбора условий, при которых он проходит.
- Влияние на биохимические процессы. Вода основная часть любой клетки, в ней как в среде, происходят все реакции в организме.
- В жидком состоянии впитывает в себя газы, которые неактивны. Их молекулы располагаются между молекулами Н2О внутри полостей. Так образуются клатраты.
- При помощи оксида водорода образуются новые вещества, которые не связаны с окислительно-восстановительным процессом. Речь идет о щелочах, кислотах и основаниях.
- Еще одна характеристика воды это способность образовывать кристаллогидраты. Оксид водорода при этом остается в неизменном виде. Среди обычных гидратов можно выделить медный купорос.
- Если через соединение пропустить электрический ток, то можно разложить молекулу на газы.

Важность для человека
Очень давно люди поняли неоценимое значение жидкости для всего живого и планеты в целом. Без нее человек не может прожить и недели. Какого же полезное действие от этого самого распространенного на Земле вещества?
- Самое главное применение это наличие в организме, в клетках, где проходят все важнейшие реакции.
- Образование водородных связей благоприятно сказывается на живых существах, ведь при изменении температуры жидкость в теле не замерзает.
- Человек давно применяет Н2О в бытовых нуждах, кроме приготовления пищи, это: стирка, уборка, купание.
- Ни один промышленный завод не может работать без жидкости.
- Н2О – источник жизни и здоровья, она является лекарством.
- Растения используют ее на всех этапах своего развития и жизни. С ее помощью они производят кислород, такой необходимый для жизни живых существ, газ.
Кроме самых очевидных полезных свойств, их имеется еще очень много.

Критическая температура
У Н2О, как и у всех веществ, есть температура, которая называется критической. Критическая температура воды определяется методом ее нагрева.
До 374 градусов по Цельсию жидкость называют паром, она еще может превратиться обратно в привычное жидкое состояние, при определенном давлении.
Когда температура вышей этой критической отметки, то вода как химический элемент, превращается в газ безвозвратно.
Применение в химии
Большой интерес у химиков Н2О вызывает благодаря основному своему свойству – умению растворять. Часто ученые ею очищают вещества, чем создают благоприятные условия для проведения экспериментов.
Во многих случаях она является средой, в которой можно провести опытные испытания. Кроме того, Н2О сама участвует в химических процессах, влияя на тот или иной химический эксперимент.
Она соединяется с неметаллическими и металлическими веществами.
Три состояния
 Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
Вода предстает перед людьми в трех состояниях, называемых агрегатными. Это жидкость, лед и газ. Вещество одно и то же по составу, но разное по свойствам. У
мение перевоплощаться – очень важная характеристика воды для всей планеты, таким образом, происходит ее круговорот.
Сравнивая все три состояния, человек чаще видит химическое соединение все же в жидком виде. Вода не имеет вкуса и запаха, а то, что ощущается в ней, это из-за наличия примесей, растворенных в ней веществ.
Основные свойства воды в жидком состоянии это: огромная сила, позволяющая точить камни и рушить скалы, а также возможность принимать любую форму.
Мелкие частицы при замерзании сокращают скорость своего движения и увеличивают дистанцию, поэтому структура льда пористая и по плотности ниже жидкости. Лед применяется в холодильных установках, для различных бытовых и промышленных целей. В природе лед несет лишь разрушения, выпадая в виде града или лавины.
Газ – еще одно состояние, который образуется, когда не достигается критическая температура воды. Обычно при температуре больше 100 градусов, или испаряясь с поверхности. В природе это облака, туманы и испарения. Большую роль искусственное газообразование сыграло в техническом прогрессе в 19 веке, когда были изобретены паровые двигатели.
Количество вещества в природе
75% такая цифра покажется огромной, но это вся вода на планете, даже та, которая находится в разных агрегатных состояниях, в живых существах и органических соединениях. Если же учесть лишь жидкое, то есть воду, находящуюся в морях и океанах, а также в твердую – в ледниках, то процент становится 70,8%.
Распределение процентного содержания примерно такое:
- моря и океаны – 74,8%
- Н2О пресных источников, распределенная неравномерно по планете, в ледниках составляет 3,4%, а в озерах, болотах и реках лишь 1,1%.
- На подземные источники приходится примерно 20,7% от всего количества.
Характеристика тяжелой воды
Природное вещество – водород встречается в виде трех изотопов, в таком же количестве форм есть и кислород. Это позволяет выделять кроме обычной питьевой воды еще дейтериевую и тритиевую.
Дейтериевая имеет самую устойчивую форму, она встречается во всех природных источниках, но в очень малом количестве. Жидкость с такой формулой обладает рядом отличий от простой и легкой.
Так, образование кристаллов в ней начинается уже при температуре 3,82 градуса. А вот температура кипения немного выше 101,42 градуса Цельсия. У нее больше плотность и способность к растворению веществ значительно снижена.
Кроме того, ее обозначают другой формулой (D2O).
Живые системы реагируют на такое химическое соединение плохо. Лишь некоторые виды бактерий смогли в нем приспособиться к жизни. Рыбы и вовсе не выдержали такого эксперимента. В организме человека, дейтерий может находиться несколько недель, а после выводится, не причиняя вреда.
Важно! Пить дейтериевую воду – нельзя!
Уникальные свойства воды. Химия – просто.
- Химические свойства воды
Вывод
Широкое применение тяжелая вода нашла в ядерной и атомной промышленности, а обычная в повсеместном.
Источник: https://tvercult.ru/nauka/harakteristika-glavnoy-zhidkosti-na-zemle-fizicheskie-i-himicheskie-svoystva-vodyi
Свойства воды: физические и химические
Благодаря своим уникальным физическим и химическим
свойствам, часто аномальным, вода сделала возможной жизнь на Земле. Так в чем
состоят эти уникальные характеристики?
Физические свойства воды
Вода имеет высокую удельную теплоемкость, т.е. ей нужно
много тепла, чтобы нагреться, и потребуется много времени, чтобы потерять
накопленное тепло и остыть.
Вот почему она используется в системах охлаждения
(например, в автомобильных радиаторах или для охлаждения промышленного
оборудования).
Эта характеристика объясняет также то, почему в прибрежных (или
озерных) регионах температура воздуха мягче: в этих местах, когда времена года
меняются, температура воды «смягчает» температуру воздуха, так как она уменьшается
или увеличивается медленнее.

При ответе на вопрос: какие физические свойства воды
определяют ее особое биологическое значение, первым делом нужно вспомнить, что
она имеет высокое поверхностное натяжение.
Это означает, что после наливания на
гладкую поверхность она имеет тенденцию образовывать сферические капли, а не
растекаться в тонкую пленку. И это свойство во многом объясняет высокую
биологическую активность воды. Без гравитации капля ее была бы совершенно
сферической.
Поверхностное натяжение позволяет растениям поглощать воду,
содержащуюся в почве, через корни. И поверхностное натяжение делает кровь такой
«проникающей» через ткани нашего организма.
Вода обычно находится в жидком состоянии, но может легко
стать твердой или газообразной.
Чистая вода переходит из жидкой в твердую, то
есть замерзает при 0° С, а на уровне моря она кипит при 100 ° С (чем выше
уровень, тем ниже температура, при которой вода начинает кипеть).
Значения
кипения и замерзания воды берут в качестве контрольной точки для калибровки
термометров: в градусах Цельсия 0 ° по шкале Цельсия — это точка замерзания, а
100 ° — это точка кипения.
При замерзании вода расширяется, то есть ее плотность
уменьшается, а объем остается неизменным: поэтому лед плывет по поверхности или
лопается бутылка, наполненная водой и помещенная в морозильник.

Вода является особым природным ресурсом, поскольку она
является единственным на Земле веществом, которое можно найти во всех трех
физических состояниях в зависимости от температуры окружающей среды: жидкой,
твердой (лед) и газообразной (пар).
Химические свойства воды
Химическая формула молекулы воды — H2O: два атома водорода
(H2) связаны с одним атомом кислорода (O). Электроны атома (частицы с
отрицательным зарядом) устанавливают связи между собой.
Кислород способен
держать их ближе к нему, чем водород. Молекула эта оказывается заряженной
отрицательно вблизи атома кислорода и положительно вблизи атомов водорода.
Поскольку противоположности притягиваются, молекулы воды имеют тенденцию
соединяться вместе, как магниты.
Вода может растворять многие вещества
Воду называют универсальным растворителем, поскольку она
может растворять больше веществ, чем любая другая жидкость.
И нам очень с этим
повезло: если бы не это химическое свойство, мы не могли бы выпить чашку
горячего подслащенного чая, потому что сахар остался бы на дне чашки.
Вот
почему воды рек, ручьев, озер, морей и океанов, которые выглядят чистыми на
первый взгляд, на самом деле содержат огромное количество растворенных
элементов и минералов, выделяемых камнями или атмосферой.
Везде, где течет вода, над землей, под землей или внутри
нашего тела, вода растворяет в себе и несет чрезвычайно большое количество
различных веществ. Таким образом, она выполняет драгоценную задачу: переносить
иногда на большие расстояния вещества, с которыми она сталкивается на своем
пути. Причем, с водой при обычных климатических условиях не реагирует
большинство этих веществ.

Чистая вода, как и дистиллированная вода, имеет рН 7
(средний). Морская вода в основном щелочная, имеет рН около 8. Чистая вода
реагирует с немногими веществами, например, серой, некоторыми солями и
металлами. Также возможен гидролиз (распад) воды при реакции с какими-то
химическими веществами.
Вода может содержать огромное количество взвешенных частиц
разных веществ, в т.ч. и радиоактивных. Именно этим и объясняется превращение
чистой воды в радиоактивную. И в наш век вездесущей атомной энергетики глубокая
и своевременная дезактивация воды – уже глобальная проблема.
Физико-химические свойства воды
То, какими свойствами обладает чистая вода, во многих
случаях зависит от водородных связей внутри ее молекул. При сравнении этих
свойств со свойствами атомов или не связанных с водородом молекулярных
жидкостей с аналогичными размерами молекул некоторые особенности воды
заслуживают внимания:
- Точка плавления льда исключительно высока среди гидридов шестой основной группы.
- Во время таяния льда при атмосферном давлении объем вещества уменьшается на 8,2%. Это аномальное сокращение объема, ведь большинство веществ расширяется во время плавления. Снижению температуры замерзания способствует увеличение давления.
- Зависимость молярного объема жидкой воды от давления и температуры показывает крайности. Плотность жидкой воды имеет максимум при 3,98 ° С.
- Коэффициент теплового расширения α жидкой воды на порядок меньше по сравнению с другими молекулярными жидкостями. Изотермическая сжимаемость χT показывает, что для молекулярной жидкости вода довольно несжимаема.
- Динамическая вязкость воды выше, чем у сопоставимых, не связанных водородом жидкостей. Более того, зависимость вязкости от давления аномальна: вязкость уменьшается с давлением и достигает минимума около 60 МПа (это давление эквивалентно толще воды в 6 км).
- Поверхностное натяжение воды выше, чем у других жидкостей, включая большинство других жидкостей, связанных водородом. В диапазоне температур от 0 до 130°С вода жидкая.
- Теплопроводность увеличивается с ростом температуры. Жидкая вода обладает высокой удельной теплоемкостью при постоянном давлении, которое изменяется незначительно до 100°C.
- Энтальпия испарения воды аномально высока. Аналогично удельной теплоемкости, она почти в четыре раза выше, чем для других сопоставимых жидкостей, не связанных с водородом. Эта разница приписывается водородной связи. Кроме того, энтальпия испарения воды очень велика по сравнению с энтальпией таяния.
Тот факт, что вода увеличивается в объеме при замерзании,
приводит ко многим последствиям в природе. Именно вода и ее свойство легко
проникать в расщелины скал, когда она замерзает, приводит к разрушению скал.
Постепенно происходит физическое и химическое выветривание скальных пород. И, в
конечном итоге, физические свойства и химические функции воды сформировали
почву на нашей планете.
Тот факт, что вода имеет самую высокую плотность при 4°С, а
не в точке замерзания, имеет важное значение для термического расслоения и
циркуляции воды в природе. Это химико-физическое свойство воды приводит к
замерзанию водоемов от их поверхности в направлении дна.
Это важно не только
для жизни внутренних водоемов, но и для океанов. Если бы самые холодные районы
океанов должны были замерзать снизу-вверх, то солнечной энергии, полученной за
время лета, было бы достаточно только для оттаивания самого верхнего слоя.
Так
осуществляется круговорот энергии и материи, которая опирается на циркуляции
океанов частично или даже полностью.
Огромная удельная теплоемкость воды ответственна за его
способность хранить огромное количество энергии. Таким образом, водные потоки,
например, Гольфстрим, способны нести огромное количество тепла из более теплых
климатических зон в более холодные. Таким образом, океаны работают как огромные
термостаты.
Не только климат Земли, но и температурное регулирование живых
организмов зависит от высокой теплоемкости воды. Это способствует, например,
поддержанию постоянной температуры тела у теплокровных организмов.
Кроме того,
относительно высокая теплопроводность воды предотвращает серьезные локальные
колебания температуры.
Абсолютно чистая вода имеет электрическую проводимость 0,03
мкСм / см это связано с автопротолизом. Электропроводность, однако, на реальных
водоемах значительно выше, из-за растворенных ионных компонентов.
Вода, будучи
сильным диэлектриком (водный диэлектрик – константа), является одним из самых
лучших растворителей для солей и газов, которые способны к сольволизу с
последующей диссоциацией (например, CO2).
Еще одна особенность воды, которая важна для
гидрологического цикла — ее энтальпия испарения. С этим тесно связана летучесть
воды. Она определяет количество воды, которое переходит в газовую фазу и может
транспортироваться в атмосферу.
Таким образом, можно сделать вывод, что вода уникальна в
физическом и химическом плане. Особые свойства воды сделали ее колыбелью и
абсолютным условием жизни на Земле. Зная основные характеристики этого
вещества, можно делать вывод: благодаря каким своим химическим и физико-химическим
свойствам вода стала жидкой основой жизни.
Источник: https://VodaVoMne.ru/svojstva-vody/svojstva-vody
Особенности физических свойств воды — урок. Химия, 8–9 класс
При обычных условиях вода — прозрачная жидкость без вкуса и запаха. В тонком слое она бесцветна, а при толщине более (2) м имеет голубой оттенок.
Плотность жидкой воды максимальна при (4) °С и равна (1) г/см³ ((1000) г/дм³). В отличие от других веществ твёрдая вода (лёд) легче жидкой. Плотность льда при (0) °С составляет (0,92) г/см³. Поэтому айсберги плавают по поверхности океанов, а пресноводные водоёмы зимой не промерзают до дна, и обитающие в них организмы выживают во время сильных морозов.
Температура плавления воды равна (0) °С, а температура кипения — (100) °С. Это аномально высокие значения для вещества с такой низкой молекулярной массой.
Эта и другие особенности свойств воды обусловлены образованием агрегатов из полярных молекул воды за счёт межмолекулярных водородных связей.
Водородная связь — это взаимодействие между положительно заряженными атомами водорода одной молекулы и отрицательно заряженными атомами кислорода, фтора или азота другой молекулы.
Эта связь слабее ковалентной. Но благодаря ей значительно повышаются температуры плавления и кипения веществ.
Водородными связями объясняется также способность воды образовывать при замерзании снежинки разной формы.

Из всех жидких и твёрдых веществ у воды самая высокая теплоёмкость. Она медленно нагревается и так же медленно остывает. Благодаря такому свойству вода влияет на климат Земли, сглаживая колебания температуры. Моря и океаны накапливают тепло в тёплое время, а в холодное — его освобождают.
У воды высокие значения теплоты плавления и теплоты парообразования. Поэтому процессы таяния льда и снега, испарения воды происходят постепенно и приводят к медленной смене сезонов года: зима — весна — лето — осень.
Ещё одна особенность воды — высокое поверхностное натяжение. Поверхностное натяжение обуславливает капиллярные явления, собирает воду в капли, создаёт поверхностную плёнку и позволяет некоторым насекомым перемещаться по ней.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/voda-159651/re-b30ed431-6931-48fa-b0ab-92832497b90c
Уникальные свойства воды: кратко. Интересно и познавательно
Утверждение, что вода играет основополагающую роль в жизнедеятельности всего живого на нашей планете, совершенно обоснованно, поскольку:
- поверхность Земли на 70 % состоит из воды;
- 70 % воды содержится и в организме человека;
- поразительно, однако, находясь на стадии эмбриона, человек практически полностью состоит из воды — более 95 %;
- в теле младенца треть воды;
- в организме взрослого человека — 60 % воды. И только когда человек находится в преклонном возрасте, уровень воды в организме начинает активно снижаться.
Все эти факты и цифры как нельзя лучше подтверждают уникальные свойства воды.
Уникальные свойства воды: кратко
Вода является прозрачной, безвкусной жидкостью, которая не имеет никакого запаха, но при этом основные её характеристики поистине поразительны:
- показатель молекулярной массы равен 18,0160;
- уровень плотности — 1 г/см³;
- вода является уникальным растворителем: она окисляет практически все известные виды металла и способна разрушить любую твёрдую горную породу;
- сферическая капля воды отличается наименьшей (оптимальной) поверхностью объёма;
- коэффициент поверхностного натяжения равен 72,75*10‾³Н/м;
- вода превосходит большинство веществ по степени удельной теплоёмкости;
- удивительно и то, что вода способна поглощать огромное количество тепла и при этом сама очень мало нагревается;
- вода отличается и полимеризационными способностями. В таком случае свойства её становятся несколько иными, например, кипение полимеризованной воды происходит при более высоких температурах (порядка 6–7 раз выше), чем обычной.
Уникальные физические свойства воды
Уникальные свойства воды находятся в прямой зависимости от способности её молекул к образованию межмолекулярных ассоциатов. Такую возможность обеспечивают водородные связи, а также ориентационные, дисперсионные и индукционные взаимодействия (взаимодействия Ван-дер-Ваальса).
Молекулы воды — это продукт как ассоциативных образований (которые, по сути, лишены организованной структуры), так и кластеров (которые как раз таки и отличаются наличием упорядоченной структуры). Под кластером (англ. cluster) принято понимать интеграцию нескольких идентичных по составу элементов.
Такая интеграция становится самостоятельной единицей и характеризуется наличием определённых свойств. Если речь идёт о состоянии жидкости, то тогда интегрированные соседствующие молекулы воды способны к образованию непостоянных и быстротечных структур.
Когда же речь заходит о состоянии замороженном, то отдельная молекула имеет прочную связь с четырьмя другими такими же молекулами.
В этом смысле к впечатляющим выводам пришёл доктор биологических наук С.В. Зенин. Он обнаружил константные кластеры, которые способны на долгое существование. Выяснилось, что вода — это не что иное, как иерархически упорядоченные объёмные структуры. В основе таких структур положены кристаллообразные соединения.
Каждое такое соединение — это совокупность 57-ми самостоятельных молекул. Естественно, это ведёт к образованию структурных объединений в виде шестигранника, которые, в свою очередь, характеризуются как более сложные и высокие. Каждый такой шестигранник состоит из 912-ти самостоятельных молекул воды.
Акциденция кластера — это соотношение кислорода и водорода, которые выступают на поверхность. Форма такого образования даёт реакцию на любое воздействие извне, а также на появление примесей. Все грани элементов каждого кластера подвержены влиянию кулоновских сил напряжения.
Именно этот факт и даёт возможность идентифицировать упорядоченное состояние воды как особую информационную матрицу. Внутри этих образований молекулы воды взаимодействуют между собой по схеме комплементарности зарядов. Данная схема широко известна в ДНК-исследованиях.
В отношении воды касательно принципа комплементарности можно утверждать, что структурные элементы жидкости собираются в клатраты, или ячейки.
Уникальные физико-химические свойства воды
Для того чтобы ещё раз убедиться в уникальных свойствах воды, необходимо рассмотреть более подробно принцип комплементарности. Итак, молекулярная биология определяет комплементарность как взаимность соответствия элементов.
Такое соответствие обеспечивает связь структур, которые дополняют друг друга, — это могут быть и радикалы, и макромолекулы, и молекулы — а также определяется их химическими свойствами. Что касается клатратов (от лат.
сlathratus ‘защищённый решёткой’), то они определяются как самостоятельные соединения, или включения. Образуются клатраты в результате молекулярных включений.
Проще говоря, это «гости» в полости кристаллических каркасов, в составе которых — решётчатые клатраты или молекулы иного рода (это «хозяева»). Кроме того, включения могут происходить и в полость молекулярных клатратов, которые представляют собой одну большую молекулу-хозяина.
Вывод напрашивается сам собой: информационная матрица ДНК-синтеза — это вода, а это значит, что она же и является информационной основой жизни во всей Вселенной. Взяв во внимание статистические расчёты, в которых принимали активное участие д. х. н. В. И. Слесарев, И. Н. Серова, д. б. н. А. В. Каргополова, д. м. н. А. В. Шабров, обычная вода имеет в своём составе:
- 60 % самостоятельных молекул и ассоциатов (деструктурированная часть);
- 40 % кластеров (структурированная часть).
Тот факт, что вода способна к образованию кластеров, в структуру которых положена закодированная информация относительно взаимодействий, является аргументированной почвой для утверждения того, что вода обладает некой памятью. Вода — это открытая, самоорганизующаяся и динамичная система. Внутри этой системы при каждом внешнем воздействии происходит смещение стационарного равновесия.
Какие уникальные свойства есть у воды
На сегодняшний день существует множество техник, которые позволяют получать структурированную воду:
- намагничивание;
- электролитический способ разделения воды на «мёртвую» (анолит) и «живую» (католит);
- заморозка воды с её последующим таянием естественным путём.
Другими словами, можно изменять свойства воды, при этом химический способ исключён, меняются волновые (полевые) характеристики.
Японский исследователь, Масару Эмото, доказал, что вода, подвергаясь различным внешним воздействиям, способна менять свою кристаллическую структуру. И изменения эти зависят, в первую очередь, от той информации, которая была внесена, а не от степени загрязнённости самой среды.
Удивительно, но вода — это неотъемлемый атрибут обрядов многих мировых культур:
- таинство крещения в православии;
- омовение в Ганге у индусов;
- обряды очищения в язычестве.
По всей видимости, представители этих культур, инициировавшие эти обряды, были осведомлены об информационных свойствах воды, тогда сам собой напрашивается вопрос: откуда им пришло это знание? Или они всё-таки уповали на чудо?
Имена всех удивительных людей, так или иначе, имеют «водную» составную. Так может быть, все учёные нашей современности бьются в попытках выяснить то, что уже давно известно древним поколениям?
Примечательно, что Род — это древнейший славянский бог. Не вдаваясь в подробности правочтения древних рун, можно утверждать, что исследователи старины так и не сошлись в едином мнении, как правильно произносить: «Род» или «Вод».
Это значит, что обе версии имеют право на существование. Бог один, просто имена разные. Бог (Род или Вод) — это безоговорочное следование принципу двойственности, или «бинерности».
А ведь и вода, как мы знаем, двойственна: в её составе и кислород, и водород.
В наш век высоких технологий, когда миром правит информация, мы не можем не знать, что все точные науки, как всемирная паутина, имеют в своём основании информационный бинер — «ноль и единичку».
Если взглянуть на жизнь человека более пространственно, то откроется истина — всё наше бытие основано на бинере. Основополагающий принцип Рода (Бога) — это начало самого мелкого и одновременно основа всей Вселенной.
Вод (Род) является основой (информационной матрицей) всего, что есть на Земле.
Вне всяких сомнений, Род представляет собой живую бесконечную сущность. На сегодняшний день научные исследователи вплотную подошли к выводу, что именно вода — это живая матрица жизни. Теперь человечеству предстоит исследовать полевую (волновую) суть воды.
Дальнейшее изучение уникальных свойств воды становится невозможным без философских обоснований, которые носят герметический характер. Поскольку без актуальности современной парадигмы научный подход выстроить невозможно.
А может это всё-таки парадигма древности? На сегодняшний день, те учёные, которые мыслят свободно и пытаются найти ответы скорее иррациональным способом, приходят к тому, что вглядываться необходимо именно в древность.
Все мы знаем, что молекулы воды состоят из двух целых (атомы) водорода и одной целой кислорода. Учёные-математики (в частности можно обратиться к работам А.
Корнеева) доказали, что все фрактальные формулы имеют в своей основе математическую конструкцию следующего вида: [2+1]. Данная формула признана изначальным математическим принципом фрактальных (голографичных) развёртываемостей.
Эта закономерность лежит в основе Вселенной. Наличие фрактального кода Вселенной подтверждено рунами и арканами полевого генома.
Уникальные свойства воды в природе были известны издревле, вот почему представители тех малочисленных народов, которые до настоящего времени прибегают к методам шаманизма, с удивительным почтением относятся и к природе в целом, и к воде в частности.
Только вдумайтесь в этимологию слова «природа»: это то, что находится при Роде! Это значит, что, относясь пренебрежительно к воде, мы относимся соответствующим образом к самому Богу.
Современное общество — это общество потребителей, его члены потребительски относятся друг к другу, что уж там говорить о какой-то воде, а зря…
К слову сказать, многие философские учения приходят к тому, что между отношением человека к воде и его здоровьем на генетическом уровне — самая непосредственная связь. Значит, и судьба в том числе, зависит от того, как мы относимся к воде. Это легко объясняется, поскольку то, что вода обладает памятью — факт.
Это значит, что все наши мысли и эмоции — позитивные и негативные — оказывают сильнейшее влияние на воду, которая находится внутри нас (как мы помним, воды в нашем организме 60 %). Вода представляет собой живую сущность, информационную матрицу бытия, она способна поглощать, запоминать и отдавать информацию.
Не удивляйтесь, однако поставленный перед вами стакан воды очень тонко реагирует на ваше внутреннее состояние, мысли, эмоции. А запоминая эти мысли и эмоции, выстраивает геометрические (в том числе и полевые, и волновые) структуры. Вариантов таких структур — огромное количество.
Другими словами, вы можете сделать из этого стакана воды как лекаря, так и отравителя. Вода — это символ нашего
подсознания (бессознательного), не зря ведь карты Таро содержат изображение «вод подсознания». Наверное, уже ни у кого не осталось сомнений, что вода является информационным источником, хранителем и распространителем.
Несколько слов о психолингвистике
То, что между человеческим духом и рассудком — прямая связь, объяснять не надо. Не подвергается сомнению и понятийность человеческого мышления. Как следствие, качественный уровень нашего мышления находится в прямой зависимости от того языка, на котором мы думаем. Может быть, поэтому и возникает непонимание между народами, разговаривающими на разных языках?
Например, исконно русское мышление носит характер голографичности, поскольку русский/славянский язык, а вместе с ним и азбука, основываются на принципе фрактальности. Вот почему одно и то же слово может быть записано самостоятельными рунами или их сочетаниями, относящимися к разным участкам цепей генома.
Опять же рассмотрим слово «вода»: если записать его рунами получится вercana-dagaz. Совокупность второго и четвёртого арканов — это понятийная формула [И + Э] («информация + энергия в информации»). А это уже элемент, относящийся к уравнению Троицы. Попробуем расшифровать: вода — это «со-общение (с-ведение) + энергетика прироста».
На языке простого обывателя такое понятийное сочетание звучит как «информация к действию».
Русская душа, русский дух — это энигма для иноземцев, загадка, которую им вряд ли когда-то удастся разгадать. Мы думаем парадоксально, живём эмоциями, совершаем безрассудные поступки. Широта нашей души не подлежит никаким логическим объяснениям для иностранцев.
Мы иронизируем относительно себя самих — достаточно открыть сказки про Иванушку-дурачка — а на самом деле мировоззрение внутри нас не имеет ничего общего с плоской расчётливостью. Но для многих других национальностей это является чем-то вроде другого измерения.
К сожалению, за суетой повседневных дел и забот, мы не вслушиваемся в собственную речь, не вдумываемся в её сакральное значение.
Современные молодые люди и вовсе недооценивают богатство и многогранность своей родной культуры, старясь показательно использовать модные иностранные фразы.
Может быть, пора нам уже перестать портить свой собственный язык иностранными словечками, а пользоваться тем, что нам подарено древностью. Ведь в нашем РОДном языке столько Бога!
Источник: https://www.oum.ru/literature/raznoe/unikalniesvoistvavodi/
Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды
Билет № 15
1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной воды
Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества):
2H2O = 2H2↑ + O2↑
Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105°:
O — H
|
H
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода — частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами — это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см3 при температуре около 4° С. При дальнейшем понижении температуры плотность воды снижается.
Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности.
Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства:
- Вода разлагается при пропускании электрического тока* на водород и кислород:
2H2O = 2H2↑ + O2↑ - Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия):
2Na + 2HOH = 2NaOH + H2↑ - Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть
даже причиной пожара. Образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2 + Q - Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий.
Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы.
Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
* Для электролиза воды используются растворы солей
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей
- Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
- CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
- или, в ионном виде:
- CO32− + 2H+ = H2O + CO2↑
- Доказать, что выделяется именно оксид углерода (IV), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
- CO2 + Ca(OH)2 = CaCO3↓ + H2O
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-15.htm




