Слово этилен английскими буквами(транслитом) — etilen
Слово этилен состоит из 6 букв: е и л н т э
Значения слова этилен. Что такое этилен?
Этилен
ЭТИЛЕН (этен) СН2 = СН2, мол. м. 28,05; бесцв. газ со слабым запахом; т. пл. -169,15 °С, т. кип. -103,71 °С; 0,566; tкрит 9,2 °С, ркрит 5,042 МПа; (жидкости) 0,161 мПа х с; (жидкости) 16,4 мН/м; давление пара (кПа): 4110 (0 °С), 2200 (-25 °С), 151…
Химическая энциклопедия
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином), изологом этана. При нормальных условиях — бесцветный горючий газ со слабым запахом.
ru.wikipedia.org
- Этилен, этен, H₂C=CH₂, ненасыщенный углеводород, первый член гомологического ряда олефинов, бесцветный газ со слабым эфирным запахом; tnл — 169,5°С, tkип — 103,8°С, плотность 0,570 г/см³(при tkип); практически нерастворим в воде, плохо — в спирте…
- БСЭ. — 1969—1978
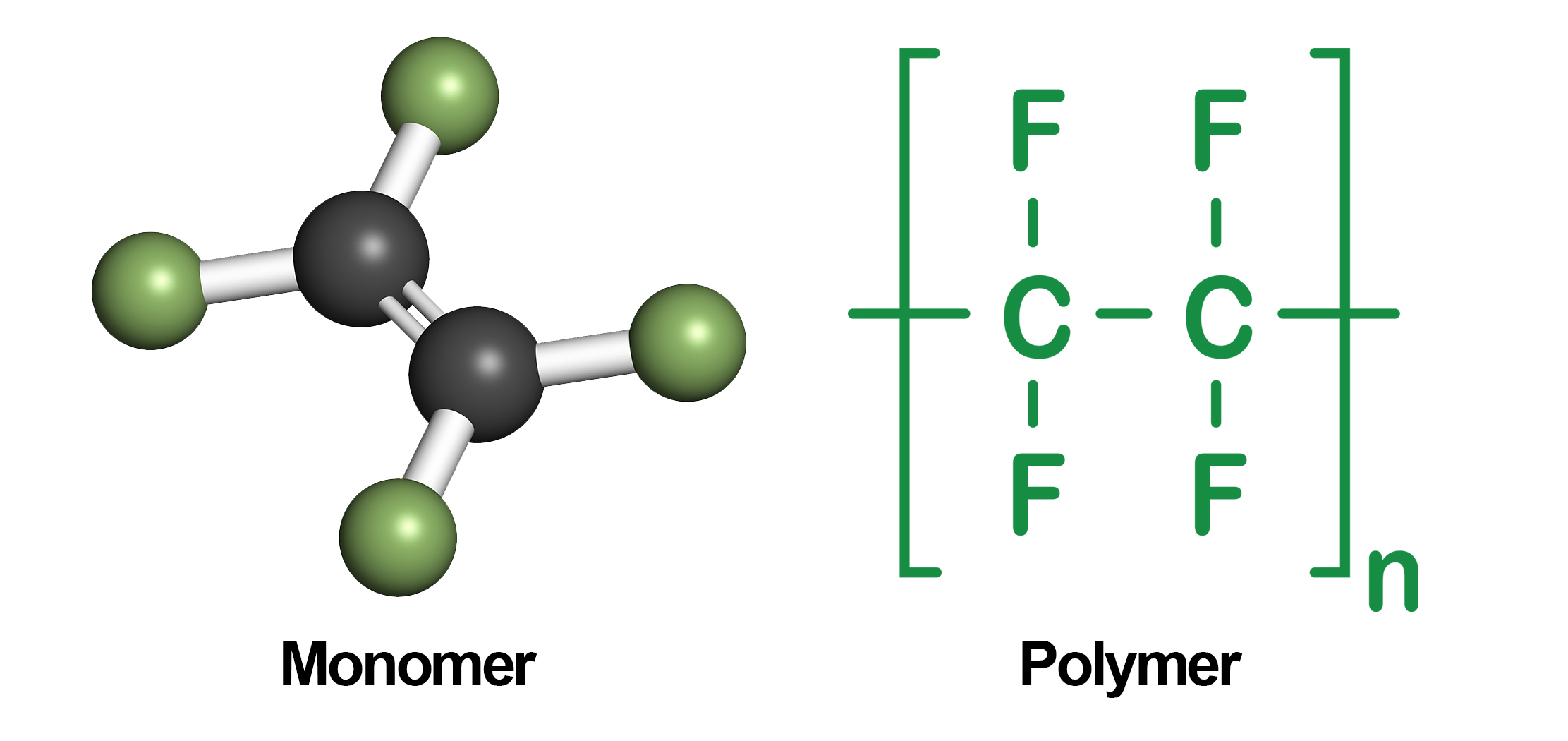
- Полиэтилен
ПОЛИЭТИЛЕН (петротен, алкатен, хостален LD, стафлен юнипол, карлон, хостален G, хей-жекс и др.) (—СН2СН2—)n, твердый белый полимер; термопласт.
- В зависимости от способа получения различают полиэтилен высокого давления, или низкой плотности…Из полиэтилена удаляют непрореагировавший этилен, расплав охлаждают до 180-190°С и гранулируют.
- Гранулы, охлажденные водой до 60-70 °С, подсушивают теплым воздухом и упаковывают в мешки.
- Химическая энциклопедия
Полиэтиле́н — термопластичный полимер этилена. Является органическим соединением и имеет длинные молекулы …—CH2—CH2—CH2—CH2—…, где «—» обозначает ковалентные связи между атомами углерода. Самая распространённая в мире пластмасса.
ru.wikipedia.org
Полиолефины, высокомолекулярные соединения общей формулы.. образующиеся при полимеризации или сополимеризации ненасыщенных углеводородов — олефинов (R, R'=H, CH₃, C₂H₅ и т.п.).Из производимых промышленностью П. наряду с полиэтиленом и полипропиленом большое значение имеют также их сополимеры — этилен-пропиленовые каучуки.
БСЭ. — 1969—1978
Этилен сернистый
Этилен сернистый представляет собой простой эфир дитиогликоля CH2(HS).CH2(HS). Известен только в виде полимеров C4H8S2 или (C2H4S)3, а может быть даже более сложного, получаемых при действии водного или спиртового раствора K2S на бромистый этилен.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Этилен цианистый
Этилен цианистый CN.CH2.CH2CN3— представляет собой нитрил янтарной кислоты. Получается при нагревании бромистого этилена со спиртовым раствором KCN; твердое с неясно выраженной кристалличностью тело; темп. пл. 51° — 52°…
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Этилен (Ethylene)
Этилен (Ethylene) легко воспламеняющийся горючий газ;иногда применяется в ингаляциях в качестве анестетика. Обычно не оказывает никакого токсического воздействия…
Медицинские термины. — 2000 ЭТИЛЕН (ethylene) — легко воспламеняющийся горючий газ;иногда применяется в ингаляциях в качестве анестетика. Обычно не оказывает никакого токсического воздействия, однако после его вдыхания у больных часто развивается тошнота и рвота.
vocabulary.ru
ЭТИЛЕНА СОПОЛИМЕРЫ
ЭТИЛЕНА СОПОЛИМЕРЫ, продукты, получаемые сопо-лимеризацией этилена с др. мономерами, а также прививкой разл. мономеров к макромолекуле полиэтилена или этилена к макромолекуле др. полимера.
Химическая энциклопедия
ЭТИЛЕНА СОПОЛИМЕРЫ — продукты, получаемые сопо-лимеризацией этилена с др. мономерами, а также прививкой разл. мономеров к макромолекуле полиэтилена или этилена к макромолекуле др. полимера.
- Химическая энциклопедия. — 1988
- Окись этилена
- О́кись этиле́на (этиленокси́д, оксира́н, 1,2-эпоксиэтан) — органическое вещество, имеющее формулу C2H4O. Этот бесцветный газ со сладковатым запахом является производным этилена и представляет собой простейший эпоксид — трёхчленный гетероцикл с…
ru.wikipedia.org
Окись этилена (oxyde d'éthylène, äthylenoxyd, хим.) — получена впервые Вюрцем при действии концентрированного раствора едкого кали на хлоргидрин гликоля (см.): ClH 2С.CH 2(ОН) — HCl = (CH 2) 2O…
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Этилена окись, этиленоксид, оксиран,., простейший представитель эпоксидов (циклических простых эфиров с a-окисным трёхчленным кольцом), бесцветный газ с эфирным запахом; tпл — 111,3°С, tkип 10,7°С, плотность 0,891 г/см³ (4°С).
БСЭ. — 1969—1978
Этилен-N,N»-динитрамин
Этилен-N,N'-динитрамин (этилендинитрамин, ЭДНА, гейлеит) — химическое соединение C2H6O4N4 группы N-нитраминов, взрывчатое вещество (ВВ). Кристаллическое вещество белого цвета, кристаллы блестящие ромбической формы.
ru.wikipedia.org
Этилен-пропиленовые каучуки
ЭТИЛЕН-ПРОПИЛЕНОВЫЕ КАУЧУКИ, сополимеры этилена с пропиленом или терполимеры этих двух мономеров с несопряженным диеном. В качестве диена, вводимого для облегчения вулканизации в кол-ве 0,5-3 мол.
Химическая энциклопедия Этилен-пропиленовые каучуки — это синтетические эластомеры. Международное обозначение EPDM. Содержат 40-70 мол. % этиленовых звеньев. Выпускают также тройные сополимеры (СКЭПТ) с 1-2 мол. % диена, например 2-этилиден-5-норборнена, дициклопентадиена.
ru.wikipedia.org
- Этилен-пропиленовые каучуки, синтетические каучуки, продукты сополимеризации этилена с пропиленом или двух этих мономеров с диолефином, содержащим несопряженные двойные связи (например, с 1,4-гексадиеном CH₂=CH— CH₂— CH=CH— CH₃).
- БСЭ. — 1969—1978
- Русский язык
- Этиле́н, -а.
- Орфографический словарь. — 2004
Примеры употребления слова этилен
Это создание комплекса по переработке газа Северного Каспия в этилен, полиэтилен и полипропилен, создание регионального индустриального парка в городе Невинномысске, металлургический завод СтавСталь и завод по производству лекарственных форм антибиотиков.
Применение этилена. Свойства этилена
Этилен является простейшим из органических соединений, известных как алкены. Это бесцветный горючий газ, имеющий сладковатый вкус и запах.
Природные источники включают природный газ и нефть, он также является естественным гормоном в растениях, в которых он ингибирует рост и способствует созреванию плодов. Применение этилена является распространенным явлением в промышленной органической химии.
Он производится путем нагревания природного газа, температура плавления составляет 169,4 °С, кипения — 103, 9 °С.
Этилен: особенности структуры и свойства
Углеводороды представляют собой молекулы, содержащие водород и углерод. Они сильно различаются с точки зрения количества одинарных и двойных связей и структурной ориентации каждого компонента. Одним из простейших, но биологически и экономически выгодных углеводородов является этилен. Он поставляется в газообразном виде, является бесцветным и легковоспламеняющимся.
Он состоит из двух двойных скрепленных атомов углерода с атомами водорода. Химическая формула имеет вид C2H4. Структурная форма молекулы является линейной из-за наличия двойной связи в центре.Этилен имеет сладковатый мускусный запах, который позволяет легко идентифицировать вещество в воздухе.
Это касается газа в чистом виде: запах может исчезать при смешивании с другими химическими веществами.
Этилен используют в двух основных категориях: в качестве мономера, из которого построены большие углеродные цепи, и в качестве исходного материала для других двух-углеродных соединений. Полимеризации — это повторяющиеся объединения множества мелких молекул этилена в более крупные. Этот процесс происходит при высоких давлениях и температурах.
Области применения этилена многочисленны. Полиэтилен – это полимер, который используется особенно массово в производстве упаковочных пленок, проволочных покрытий и пластиковых бутылок. Еще одно применение этилена в качестве мономера касается формирования линейных α-олефинов.
Этилен является исходным материалом для приготовления ряда двух-углеродных соединений, таких как этанол (технический спирт), окись этилена (антифриз, полиэфирные волокна и пленки), ацетальдегида и винил хлорида. Кроме этих соединений, этилен с бензолом образует этилбензол, который используется в производстве пластмасс и синтетического каучука.
Рассматриваемое вещество является одним из простейших углеводородов. Однако свойства этилена делают его биологически и хозяйственно значимым.
Коммерческое использование
Свойства этилена дают хорошую коммерческую основу для большого количества органических (содержащих углерод и водород) материалов. Одиночные молекулы этилена могут быть соединены вместе для получения полиэтилена (что означает много молекул этилена).
Полиэтилен используется для изготовления пластмасс. Кроме того, он может быть использован для изготовления моющих средств и синтетических смазочных материалов, которые представляют собой химические вещества, используемые для уменьшения трения.
Применение этилена для получения стиролов актуально в процессе создания резины и защитной упаковки. Кроме того, он используется в обувной промышленности, особенно это касается спортивной обуви, а также при производстве автомобильных покрышек.
Применение этилена является коммерчески важным, а сам газ является одним из наиболее часто производимых углеводородов в глобальном масштабе.
Этилен представляет опасность для здоровья прежде всего потому, что он является легковоспламеняющимся и взрывоопасным. Он также может действовать как наркотик при низких концентрациях, вызывая тошноту, головокружение, головные боли и потерю координации движения.
При более высоких концентрациях он действует как анестетик, вызывая потерю сознания, нечувствительность к боли и другим раздражителям. Все эти негативные моменты могут быть причиной для беспокойства в первую очередь для людей, непосредственно работающих с газом.
Количество этилена, с которым большинство людей сталкивается в повседневной жизни, как правило, сравнительно небольшое.
Реакции этилена
1) Окисление. Это добавление кислорода, например, при окислении этилена до окиси этилена. Он используется в производстве этиленгликоля (1,2-этандиола), который применяется в качестве незамерзающей жидкости и в производстве полиэфиров путем конденсационной полимеризации.
2) Галогенирование — реакции с этиленом фтора, хлора, брома, йода.
3) Хлорирование этилена в виде 1,2-дихлорэтана и последующая конверсия 1,2-дихлорэтана в винилхлорид мономер. 1,2-дихлорэтан является полезным органическим растворителем, а также является ценным предшественником в синтезе винилхлорида.
4) Алкилирование — добавление углеводородов по двойной связи, например, синтез этилбензола из этилена и бензола с последующим преобразованием в стирол. Этилбензол является промежуточным для производства стирола, одного из наиболее широко используемых виниловых мономеров.
Стирол — мономер, используемый для производства полистирола.
5) Горение этилена. Газ получается путем нагревания этилового спирта и концентрированной серной кислоты.
6) Гидратация – реакция с добавлением воды к двойной связи. Наиболее важным промышленным применением этой реакции является превращение этилена в этанол.
Этилен и горение
Этилен – это газ без цвета, который плохо растворяется в воде. Горение этилена в воздухе сопровождается образованием углекислого газа и воды. В чистом виде газ горит световым диффузионным пламенем.
Смешанный с небольшим количеством воздуха, он дает пламя, состоящее из трех отдельных слоев – внутреннего сердечника — несгоревшего газа, сине-зеленого слоя и внешнего конуса, где частично окисленный продукт из предварительно перемешанного слоя сгорают в диффузионном пламени.
Результирующее пламя показывает сложную серию реакций, а если к газовой смеси добавляется больше воздуха, постепенно диффузионный слой исчезает.
Полезные факты
- 1) Этилен является природным растительным гормоном, он влияет на рост, развитие, созревание и старение всех растений.
- 2) Газ не вреден и не токсичен для человека в определенной концентрации (100-150 мг).
- 3) Он используется в медицине в качестве обезболивающего средства.
- 4) Действие этилена замедляется при низких температурах.
- 5) Характерным свойством является хорошая проникающая способность через большинство веществ, например через картонные упаковочные коробки, деревянные и даже бетонные стены.
6) В то время как он имеет неоценимое значение благодаря своей способности инициировать процесс созревания, он также может быть очень вредным для многих фруктов, овощей, цветов и растений, ускоряя процесс старения и снижая качество продукта и его срок годности.
Степень повреждения зависит от концентрации, продолжительности воздействия и температуры.
- 7) Этилен взрывоопасен при высоких концентрациях.
- 8) Этилен используется в производстве стекла специального назначения для автомобильной промышленности.
- 9) Изготовление металлоконструкций: газ используется в качестве кислородно-топливного газа для резки металла, сварки и высокой скорости термического напыления.
- 10) Нефтепереработка: этилен используется в качестве хладагента, особенно на производстве по сжижению природного газа.
11) Как уже говорилось ранее, этилен является очень реактивным веществом, кроме того, он еще и очень легко воспламеняется. Из соображений безопасности, его обычно транспортируют по специальному отдельному газопроводу.
12) Одним из самых распространенных продуктов, изготовленных непосредственно из этилена, является пластмасса.
Источник: https://himya.ru/etilen.html
Этилен — структурная формула, химические свойства, применение
1 Апреля 2020 г.
Поделитесь: VK | FB | OK | TW
Содержание:
Этилен является простейшим из органических соединений, известных как алкены. Это бесцветный горючий газ, имеющий сладковатый вкус и запах.
Природные источники включают природный газ и нефть, он также является естественным гормоном в растениях, в которых он ингибирует рост и способствует созреванию плодов. Применение этилена является распространенным явлением в промышленной органической химии.
Он производится путем нагревания природного газа, температура плавления составляет 169,4 °С, кипения — 103, 9 °С.

6) Гидратация – реакция с добавлением воды к двойной связи. Наиболее важным промышленным применением этой реакции является превращение этилена в этанол.
Важно! В молекуле этилена невозможно свободное вращение sp2-гибридизованных углеродных атомов друг относительно друга без разрыва пи-связи.
5) Характерным свойством является хорошая проникающая способность через большинство веществ, например через картонные упаковочные коробки, деревянные и даже бетонные стены.
Этилен (этен), получение, свойства, химические реакции
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях — бесцветный горючий газ легче воздуха со слабым сладковатым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.

Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Этилен — самое производимое органическое соединение в мире[1]; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год[2].
Этилен обладает наркотическим действием. Класс опасности — четвёртый[3].
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид.
После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство сначала в Великобритании, а позднее и в других странах.
Дегидрохлорирование этиленхлоргидрина или его производныхПра?
6) В то время как он имеет неоценимое значение благодаря своей способности инициировать процесс созревания, он также может быть очень вредным для многих фруктов, овощей, цветов и растений, ускоряя процесс старения и снижая качество продукта и его срок годности. Степень повреждения зависит от концентрации, продолжительности воздействия и температуры.
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
И для этилена, и для бензола характерны 1) реакция гидрирования 3) sp2-гибридизация атомов углерода в молекулах 6) горение на воздухе
Электронное строение молекулы этилена
Атомы углерода находятся во втором валентном состоянии (sp2-гибридизация).
В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Молярная масса (молекулярная масса одного моль) этанола, вычисленная с помощью таблицы химических элементов Д.И. Менделеева – 46 г/моль. Найдем количество вещества этанола:
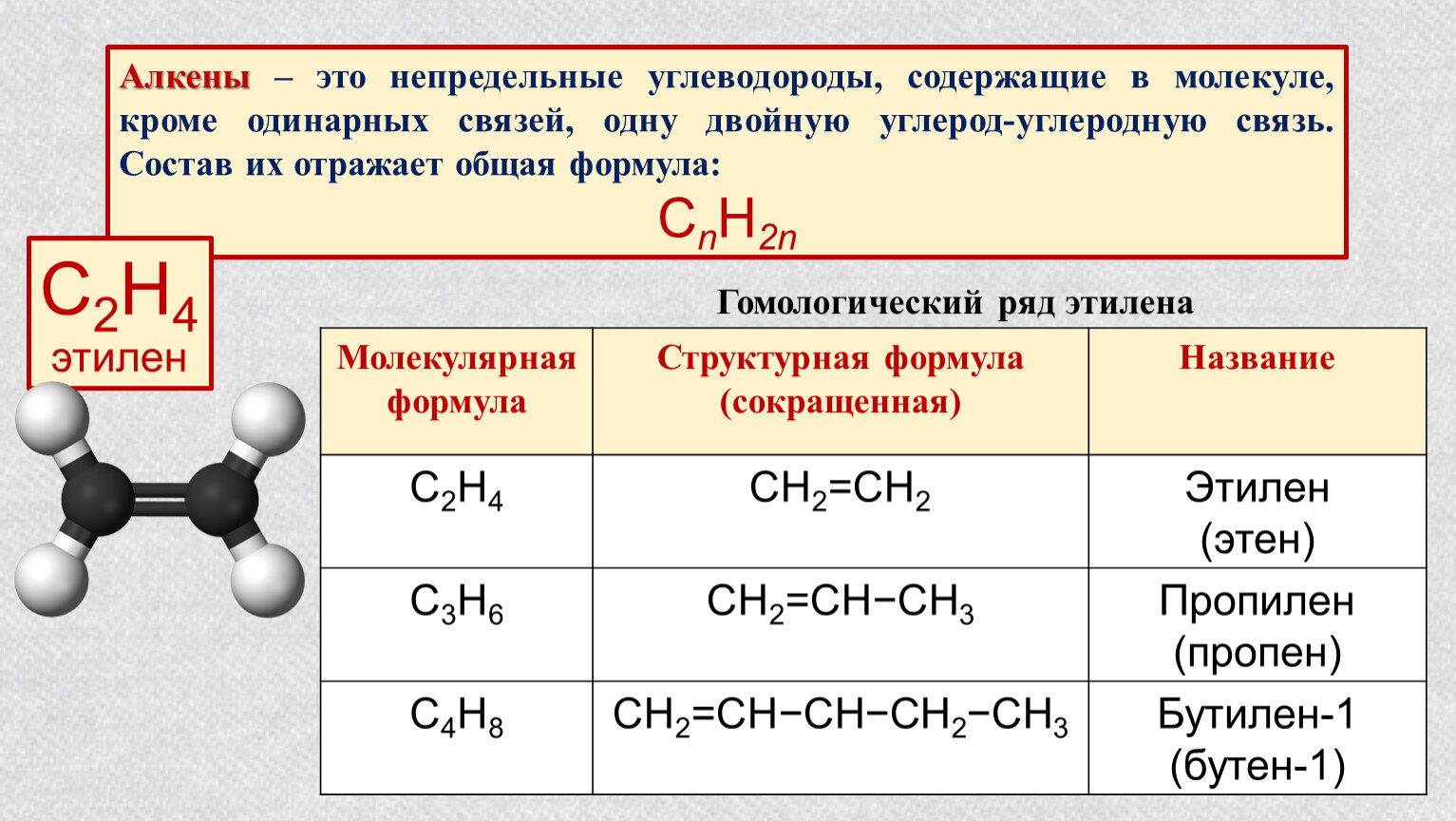
Алкены (олефины, этиленовые углеводороды)– углеводороды, которые содержат в молекуле одну двойную связь. Общая формула – CnH2n.
структурная формула этилена
При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен. Методы отбора проб». Отбор пробы этилена может производиться и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
1) Окисление. Это добавление кислорода, например, при окислении этилена до окиси этилена. Он используется в производстве этиленгликоля (1,2-этандиола), который применяется в качестве незамерзающей жидкости и в производстве полиэфиров путем конденсационной полимеризации.
З 1979 року правилами IUPAC назву «етилен» рекомендовано використовувати лише для двовалентного вуглеводневого замісника –СН2–СН2–, а ненасичений вуглеводень СН2=СН2 називати «етен».
Категории химических веществ
Тема: «Химические свойства водорода. Применение»Цель урока: изучить химические свойства водорода, научиться обнаруживать водород и рассмотреть области применения водорода.Задачи: Образ…
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.
как получить этилен реакция ацетилен этен 1 2 вещество этилен кислород водород связь является углекислый газ бромная вода уравнение реакции масса объем полное сгорание моль молекула смесь превращение горение получение этилена напишите уравнение реакций этилен
Производство окиси этилена в РоссииПра?
Этилен по токсикологической характеристике относится к веществам 4-го класса опасности (малоопасным веществам) по ГОСТ 12.1.007.
Пять σ-связей двух sp2-гибридизованных атомов углерода лежат в одной плоскости под углом 120o и составляют σ-скелет молекулы. Над и под этой плоскостью симметрично расположена электронная плотность π-связи, которую можно изобразить также в виде плоскости, перпендикулярной σ-скелету.
Цис- и трансизомеры, имея различное расположение атомов в пространстве, отличаются многими физическими и химическими свойствами.
Методы получения алкеновПра?
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
1)sp-гибридизация атомов углерода в молекуле2)реакция галогенирования3)реакция полимеризации4)наличие сигма и пи- связей в молекулах5)высокая растворимость в воде6)реакция горения2.
Для ароматических углеводородов характерны реакции1)замещения2)нейтрализации3)присоединения4)полимеризации5)горения6)этерификации3,Бензол взаимодействует с 1)бромной водой2)окислителями3)хлором на свету4)азотной кислотой5)толуолом6)с бромом в присутствии катализатора
• Они легко вступают в реакции присоединения, реагируя с водородом, галогенами, галогеноводородами и т.д.
Підручник з Хімії. 10 клас. Величко — Нова програма
С 1. Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме СН4→ С2Н2 → СН3СОН → С2Н5ОН → С2Н5Сl→ С4Н10 ↓ СН3СООС2Н5
В работе представлены: цель урока, планируемые результаты и программа наблюдений для учащихся, которая включает задания для самостоятельной работы….
-При изучении химии, вы познакомились со свойствами некоторых газов, узнали способы их получения, собирания и распознавания. На сегодняшнем уроке вам предстоит вспомнить, как в лабораторных условиях получают водород, кислород, углекислый газ, аммиак и этилен; как собирают и распознают эти газы. По ходу изучения материала вы должны заполнить таблицу.
Б 2. С аминоуксусной кислотой может реагировать 1) сульфат натрия 2) хлороводород 3) метан 4) этанол 5) анилин 6) гидроксид калия
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Презентация для школьников на тему «Получение и применение этилена» по химии. pptCloud.ru — удобный каталог с возможностью скачать powerpoint презентацию бесплатно.
Б 3. И для этилена, и для ацетилена характерны 1) взаимодействие с оксидом меди (ΙΙ) 2) наличие σ- и π-связей в молекулах 3) sp2-гибридизация атомов углерода в молекулах 4) реакция гидрирования 5) горение на воздухе 6) реакции замещения
ПОМОГИТЕ ПОЖАЛУЙСТА!!!!!!Напишите уравнения реакций гидрирования, бромирования(монобромирования), гидробромирования, гидратации: пропена и бутена-1. Назовите продукты реакций
Во французском языке термин «маслородный» звучит, как oléfiant. А после того, как были обнаружены и другие углеводороды подобного типа, то Антуан Фуркруа,французский химик и ученый, ввел новый термин, который стал общим для всего класса олефинов или алкенов.
Изучение свойств этилена, его производных и гомологов началось с середины ХIХ века. Начало практическому использованию этих соединений положили классические исследования А.М.
Бутлерова и его учеников в области непредельных соединений и особенно созданная Бутлеровым теория химического строения.
В 1860 году он получил этилен действием меди на йодистый метилен, установив структурную формулу этилена.
12) Одним из самых распространенных продуктов, изготовленных непосредственно из этилена, является пластмасса.
Исчерпывающее метилирование по Гофману — разложение четвертичных аммониевых оснований на алкен, третичный амин и воду[23]:
Краткий план урока по химии по теме «Химические свойства предельных одноатомных спиртов, получение и применение. Простые эфиры» для 10 класса, обучающегося по УМК Кузнецовой в объеме 3 часа …
-Еще аммиак можно распознать по изменению окраски влажной лакмусовой бумажки и по появлению белого дыма при поднесении стеклянной палочки, смоченной в соляной кислоте.
Он включает в себя: – экономику Второй индустриализации России, – теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России, – организационный механизм осуществления Второй индустриализации России, – справочник прорывных технологий.
1. При пропускании углекислого газа через раствор гидроксида кальция протекае Гость
Читать ответ
При поранении растений происходят синтез и выделение этилена. Есть данные о том, что при объедании листьев древесных растений животными объеденное растение выделяет этилен и под его воздействием в листьях соседних растений могут синтезироваться вещества, делающие листья невкусными для животных (Bleecker,1996) .
Этен, пропен и бутен – газы. Алкены, содержащие от 5 до 18 атомов С в молекуле, – жидкости. Если атомов в молекуле алкена больше 19 – это твердые вещества.
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 1980-х годов в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений[4], среди прочего[5] отвечает за опадание иголок у хвойных.
Реакции взаимодействия этилена с бромом и перманганатом калия служат для открытия ненасыщенных углеводородов. Метан и другие насыщенные углеводороды, как уже отмечалось, с перманганатом калия не взаимодействуют.
Хлоргидриновый процесс был первым промышленным методом производства окиси этилена, и хотя на начало XXI века он полностью вытеснен методом прямого окисления этилена, знакомство с ним представляет не только исторический интерес, но и практический: метод до сих пор используется в производстве окиси пропилена[65].
Б 1. Установите соответствие между молекулярной формулой органического вещества и классом, к которому оно относится А) С 12Н22О11 1) альдегиды Б) С3Н8О3 2) карбоновые кислоты В) С4Н8О 3) многоатомные спирты Г) С18Н36О2 4) углеводы 5) одноатомные спирты
А 6. Изомерами являются: 1) пентан и пентадиен 3) этан и ацетилен 2) уксусная кислота и метилформиат 4) этанол и этаналь
Ацетилен застосовують в органічному синтезу, він є однією із вихідних речовин для виробництва полівінілхлорида та інших полімерів. З ацетилену виробляють розчинники (1,1,2,2-тетрахлоретан та 1,2,2-трихлоретан). При згоранні ацетилену в кисні температура полум'я досягає 3150°С, тому його застосовують для зварювання та різки металів.
– как сырье в химической промышленности для органического синтеза различных органических соединений: галогенпроизводных, спиртов (этанола, этиленгликоля), винилацетата, дихлорэтан, винилхлорида, окиси этилена, полиэтилена, стирола, уксусной кислоты, этилбензола, этиленгликоля и пр.,
Для бутена-1 геометрическая изомерия невозможна (у одного из атомов С при двойной связи оба заместителя одинаковы: 2 атома водорода).
Щоб з’ясувати природу подвійного зв’язку, звернемося до електронної будови атома Карбону. Відомо, що у збудженому стані в його зовнішньому електронному шарі містяться чотири неспарені електрони — один s- і три p-електрони.
Згідно з гіпотезою гібридизації в момент утворення молекули етену s-електронна орбіталь атома Карбону гібридизується з двома p-електронними орбіталями, унаслідок чого утворюються три нові sp2-гібридні електронні орбіталі (мал.
29).
Тэги: #структурн #нахожден #почем #с2н4 #заполн #этин #картинк #кратк #плюс #перечисл #реферат #этэн #википеди #нужен #охарактеризуйт
Нашли неточность или устаревшие данные? Отредактируйте статью!
Источник: https://skibiit.ru/10852/
Урок по химии на тему: "Этилен, свойства, применение, получение"
- Қ
 азақстан Республикасының білім және ғылым Министрлігі
азақстан Республикасының білім және ғылым Министрлігі - Ақмола облысының білім беру басқармасының қарамағындағы
- МКҚК Щучинск қаласы, «Экология және орман шаруашылығы колледжі»
- Министерство образования и науки Республики Казахстан
- ГККП «Колледж экологии и лесного хозяйства г. Щучинск»
- при управлении образования Акмолинской области
- УРОК ХИМИИ на тему:
- «ЭТИЛЕН, СВОЙСТВА,
- ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ»
Құрастырған оқытушы: Оспанова А.К.
Составила преподаватель: Оспанова А.К.
- Щучье қаласы – 2014
- г. Щучинск — 2014
- Тема урока: Этилен, свойства, применение и получение.
- Цель урока:
-
Расширить знания учащихся об углеводородах – дать понятие о непредельных углеводородах, их классификации. Знать общую формулу алкенов, физические и химические свойства, способы получения и области применения углеводородов ряда этилена.
-
Развивать навыки: а) записывать молекулярные, структурные и электронные формулы этиленовых; б) обозначать распределение электронной плотности в молекуле; в) уметь называть вещества ряда этилена по систематической номенклатуре и по названию записывать формулы.
-
Воспитывать аккуратность при работе с хим.реактивами.
- Вид урока: комбинированный.
- Оборудование: модель молекулы этилена, растворы С2Н5ОН, Вr2 , KMnO4 , HCl, пробирки, спиртовка, газоотводная трубка.
- Ход урока:
- IОрганизационный момент
-
взаимное приветствие;
-
проверка готовности к уроку.
- IIПроверка знаний уч-ся по теме: «Метан, свойства, получение и применение».
- Методы опроса: фронтальный, индивидуальный с применением карточек.
- Опрос у доски.
-
физические и химические свойства метана;
-
получение и применение метана;
-
гомологический ряд предельных углеводородов.
- Проверка домашних заданий:
- Шестеро уч-ся решают задачи самостоятельно (по карточкам).
- а) Синтез метана из неорганических веществ впервые осуществил Бертло по схеме:
- CS2 + 2H2S + 4Cu → CH4 + 2Cu2S.
- Сколько литров СН4 получится, если в реакцию вступил 1 моль атомов меди?
- б) Сколько литров воздуха потребуется для полного сжигания смеси 30л метана?
- в) Напишите структурные формулы следующих углеводородов:
- 2,3,3 триметилбутан
- 2 метил 3 этилбутан
- 3,3,4,4 тетраметилпентан
- 3,3 диэтилпентан
- 2,2,3 триэтилпентан
г) Сколько литров кислорода требуется для сгорания 900 л метана?
д) Допишите и назовите следующие углеводороды.
Подведение итогов опроса. Выставление оценок и их комментарий.
- IIIИзучение нового материала.
- «Этилен, свойства, получение и применение».
- «Гомологический ряд этилена».
- Методы и способы его изложения: беседа, рассказ с элементами проблемного обучения.
- а) Физические свойства и молекулярная формула этилена.
Этилен – бесцветный газ, почти без запаха, плохо растворяется в воде, горит коптящим пламенем. Для установления молекулярной формулы определим молекулярную массу газа.
Плотность этилена при нормальных условиях – 1,25 г/л. Молярная масса этилена 1,25 г/л∙ 22,4л/моль = 28 г/моль, молекулярная масса его, следовательно, 28.
исходя из значения молекулярной массы, делаем вывод, что молекула этилена должна иметь два атома углерода.
И действительно, если молекула углеводорода имеет один атом углерода, то это уже известный нам газ метан. При наличии в молекуле этилена двух атомов углерода на вес атомов водорода (в углеродных единицах) приходится четыре углеродных единицы: 28-24=4.
- Понятно, что в молекуле этилена не может быть трех атомов углерода, так как это привело бы к более высокой молекулярной массе, поэтому формула этилена С2Н4.
- Структурная формула → СН2 = СН2.
- Таким образом, двойная связь в молекуле этилена – это не сумма связей, она состоит из σ-связи и π-связи.
- π -связь sp2 – гибридизация; строение молекулы плоское, угол = 120°, длина связи = 0,134 нм.
Свободное вращение атомов в молекуле этилена невозможно, т.к. есть π-связь.
- б) Химические свойства.
- Этилен горит на воздухе светящимся пламенем, образуя при этом оксид углерода (IV) и воду:
- С2Н4 = 3О2 → 2СО2 + 2Н2О
- Реакция присоединения хлора с образованием дихлорэтана:
- СН2 = СН2 + Cl2 → СН2Cl- СН2Cl
- Присоединение водорода в присутствии катализатора (никель) с образованием этана:
- СН2= СН2 + Н2 → СН3-СН3
- Реакции, в которых происходит присоединение водорода к веществу, называются реакциями гидрирования или гидрогенизации.
- Присоединение галогеноводородов с образованием бромэтана.
- СН2= СН2 + НВr → CH3 — СН2Br
- Реакция полимеризации.
- Процесс соединения одинаковых молекул в более крупные молекулы называется реакцией полимеризации:
- СН2= СН2 + СН2= СН2 → -СН2 — СН2- + -СН2 — СН2- → -СН2 — СН2-СН2 — СН2-
- nСН2= СН2 → (-СН2 — СН2-)n
- Реакция окисления.
- При окислении этилена раствором перманганата калия образуется двухатомный спирт этиленгликоль.
- СН2= СН2 + О + Н2О → СН2 — СН2
- ׀ ׀
- ОН ОН
- При реакции этилена с бромом образуется дибромэтан С2Н4Вr2
- CH2 = CH2 + Br2 → СН2 — СН2
- ׀ ׀
- Br Br
- в) Получение этилена:
- В лаборатории этилен получают дегидратацией этилового спирта (отщеплением воды).
- С2Н5ОН → СН2 = СН2 + Н2О
В промышленности этилен получают при термическом разложении этана путем его дегидрирования при высокой температуре, т.е. отщепления водорода
С2Н6 → СН2 = СН2 + Н2
г) Применение этилена
Дихлорэтан (С2Н5Сl2) – летучая, трудновоспламеняющаяся жидкость. Будучи хорошим растворителем многих органических веществ, он используется для растворения смол, очистки текстильных материалов.
Как вещество, действующее на организмы, дихлорэтан применяется в сельском хозяйстве для обеззараживания зернохранилищ и в борьбе с филлоксерой винограда. Хлорэтан используют в медицине для замораживания – местной анестезии – при легких операциях. Для получения этилового спирта и полиэтилена.
Этилен используют для ускорения созревания плодов (помидоров, груш и т.д.), а также применяют для получения взрывчатых веществ.
- д) Гомологический ряд этилена.
- Гомологи этилена имеют строение молекул, сходное с этиленом.
- Гомологический ряд этиленовых:
- Этилен С2Н4 (этен)
- Пропилен С3Н6 (пропен)
- Бутилен С4Н8 (бутен)
- Амилен С5Н10 (пентен)
- Гексилен С6Н12 (гексен)
Названия углеводородов ряда этилена образуются путем изменения суффикса —ан соответствующего предельного углеводорода на –илен. Однако наряду с такой номенклатурой в настоящее время все чаще употребляется систематическая (международная) номенклатура, согласно которой названия этих углеводородов принимают суффикс –ен (этен, пропен и т.д.)
Общая формула СnH2n
е) Пространственная изомерия.
На примере этилена мы видим, что атомы, соединенные двойной связью, утрачивают возможность вращения. Это приводит к новому виду изомерии, который не наблюдался нами у предельных углеводородов.
Как мы знаем, можно по-разному изготовить модель молекулы бутана – в виде прямого зигзага и изогнутого. Однако эти модели будут изображать не разные вещества, а одно вещество, так как атомы углеводорода в предельных углеводородах обладают свободным вращением и при этом одна форма легко превращается в другую.
Обратимся теперь к строению непредельного углеводорода с тем же числом атомов углеводорода.
Модель молекулы бутена-2 мы также можем представить в двух видах. Но здесь атомы углерода, соединенные двойной связью, лишены свободного вращения (вспомните почему).
Поэтому молекула одной конфигурации не может превратиться в молекулу другой конфигурации (без дополнительной затраты энергии), и если получены были молекулы того и другого строения, то это будут уже два разных вещества, изомерных друг другу.
В отличие от известных нам случаев изомерии, данный вид ее обусловлен не разной последовательностью соединения атомов в молекуле (здесь она одна и та же), а различной их конфигурацией в пространстве. Это – пространственная изомерия, или стереоизомерия.
- Если замещающие группы в изомере (в данном случае группы СН3 замещающие в этилене атомы водорода) находятся по одну сторону плоскости двойной связи, это будет цис-изомер, если они находятся по разные плоскости двойной связи – транс-изомер.
- Данный вид изомерии называется цис-транс-изомерией.
- ж) Понятие о высокомолекулярных соединениях.
Изучая непредельные углеводороды, мы узнали об их свойстве полимеризоваться и давать при этом высокомолекулярные соединения.
Высокомолекулярные полимерные вещества состоят из больших и гибких молекул цепного строения. Широко известные в виде разнообразных пластмасс, волокон, каучука и т.д.
, они с каждым годом приобретают все большое значение. Нам предстоит сейчас более подробно ознакомиться с особенностями этих соединений.
Строение полимеров. В процессе реакции полимеризации, как мы видели на примере этилена и пропилена, происходит последовательное присоединение молекул низкомолекулярного вещества к растущей углеводородной цепи.
- Сложный процесс последовательного присоединения молекул мы кратко выражаем следующими уравнениями:
- n СН2= СН2 → (-СН2 — СН2-)n
- полиэтилен
длина линейной молекулы в тысячи раз превышает ее поперечник. В увеличенном виде такую молекулу можно представить как нить диаметром в 1 мм и длиной в несколько метров.
Надо иметь только в виду, что молекулы линейной структуры не являются прямыми: мы уже знаем, что углеродный скелет молекулы имеет зигзагообразное строение.
Кроме того, молекулы обычно сильно изогнуты в различных направлениях, иногда даже свернуты в клубки.
Понятие молекулярная масса для полимеров имеет некоторые особенности.
В процессе полимеризации и макромолекулы соединяется не строго постоянное число молекул мономера: в одни цепи соединяется таких молекул больше, и другие – меньше, в зависимости от того, когда произойдет обрыв растущей полимерной цепи.
Вследствие этого образуются макромолекулы разной длины и, следовательно, разной массы. Поэтому обычно указываемая для такого вещества молекулярная масса – это лишь средняя величина, от которой масса отдельных молекул существенно отклоняется в ту или иную сторону.
Например, если молекулярная масса полимера 28000, то в нем могут быть молекулы с относительной массой 26000, 28000, 30000 и т.д. Зная особенности молекулярной массы полимеров, вы сами можете ответить, является ли степень полимеризации величиной постоянной для всех молекул данного образца полимера.
Свойства полимеров.
Низко молекулярные вещества обычно характеризуются определенными температурами плавления, кипения и другими константами.
Будем нагревать какой-нибудь из известных нам полимеров линейной структуры.
Мы заметим, что сначала будет размягчаться и лишь затем, по мере дальнейшего повышения температуры, начнет постепенно плавиться, образуя вязко-текучую жидкость.
При дальнейшем нагревании полимер разлагается, перегонку его осуществить не удается. Многие полимеры характеризуются плохой растворимостью, растворы их обладают большой вязкостью.
Важным свойством полимеров является их высокая механическая прочность, что в сочетании с другими свойствами (легкость, химическая стойкость и др.) и обуславливает их широкое применение.
Чтобы вещество расплавилось, испарилось или перешло в раствор, надо путем нагревания или действием растворителя преодолеть силы взаимного притяжения между его молекулами.
У высокомолекулярных веществ взаимодействие между молекулами значительно сильнее, чем у низкомолекулярных, так как они притягиваются друг к другу огромным количество звеньев.
Когда мы нагреваем полимер и он начинает размягчаться, это значит, что силы взаимодействия между некоторыми макромолекулами уже ослаблены настолько, что вследствие теплового движения они могут перемещаться относительно друг друга.
Более крупные макромолекулы взаимодействуют между собой сильнее, и. чтобы приобрести такую подвижность, они требуют дальнейшего нагревания. В этом причина того, что высокомолекулярные соединения не имеют определенной точки плавления.
Чтобы осуществить перегонку, надо нагреть вещество до еще более высокой температуры. Большие молекулы полимеров могли бы стать летучими, очевидно, лишь при сильном нагревании. Но они не выдерживают такого нагревания, химические связи между атомами начинают рваться, и наступает разложение вещества прежде, чем осуществится его перегонка.
Трудно разъединить макромолекулы и при помощи небольших молекул растворителей. Этим объясняется плохая растворимость многих полимеров.
Наконец, наличием тех же больших межмолекулярных сил объясняется и механическая прочность высокомолекулярных соединений.
ПОЛИЭТИЛЕН. Полиэтилен – твердый, белого цвета, несколько жирный на ощупь материал, напоминающий парафин.
Если образец полиэтилена поместить в сосуд с водой, он будет плавать на ее поверхности: плотность его примерно 0,92 г/см3.
Попробуйте сломать предмет из полиэтилена или разорвать полиэтиленовую пленку – вы убедитесь в большой прочности материала. Легко также убедиться, что полиэтилен не проводит электрического тока.
При нагревании полиэтилен размягчается, в этом состоянии можно легко изменить его форму. При охлаждении он снова затвердевает и сохраняет приданную ему форму. При следующем нагревании полиэтилен снова будет размягчаться и т.д.
Свойство тел изменять форму в нагретом состоянии по действием внешней силы и затем сохранять эту форму при охлаждении называется термопластичностью. Это свойство присуще многим полимерам и имеет большое значение для их переработки.
Если поджечь полиэтилен, он горит голубоватым, слабо светящимся пламенем. Какие вещества образуются при этой реакции?
Если мы поместим полиэтилен в серную кислоту, раствор щелочи, бромную оду или раствор перманганата калия, то при обычных условиях ни в одном из случаев не обнаружим химических изменений, что характерно и для предельных соединений. Кислоты разрушают полиэтилен лишь при нагревании.
Вначале полиэтилен получали в промышленности под давлением около 1500 ат(150МПа) и температуре 200оС (в присутствии небольшого количества кислорода, необходимого для появления свободных радикалов, инициирующих рост полимерной цепи).
В настоящее время полиэтилен получают и другим способом – при низком давлении в присутствии специальных катализаторов. Полиэтилен «низкого давления» имеет большую молекулярную массу и меньшее число ответвлений в макромолекулах.
Межмолекулярное взаимодействие в таком полимере сильнее, в следствии этого он по ряду свойств превосходит полиэтилен «высокого давления»: плавится при более высокой температуре, обладает большей механической прочностью.
ПОЛИПРОПИЛЕН. Полипропилен – твердое, жирное на ощупь молочно-белого цвета вещество. Подобно полиэтилену он термопластичен. Он устойчив к действию агрессивных веществ – кислот, щелочей, окислителей.
От полиэтилена он отличается более высокой температурой плавления (160-170оС) и повышенной прочностью. Причина этого в пространственной структуре полимера. Представим себе молекулу полипропилена в виде вытянутой цепи.
Все атомы углерода, образующие зигзагообразный скелет молекулы, будут лежать в одной плоскости, углеводородные же радикалы СН3 – могут занимать по отношению к этой плоскости различные положения в пространстве. Если они расположены в беспорядке по одну и другую сторону плоскости молекулы – это будет полипропилен нерегулярного строения.
Если же пространственное расположение радикалов упорядочено, например, все они расположены по одну сторону плоскости молекулы или строго очередно по одну и другую сторону молекулы, образуется полимер стереорегулярного строения.
IVСамостоятельная работа уч-ся:
Составьте структурные формулы изомерных алкенов:
-
2,2,5 триметилоктен-4
-
2 метилбутен-1
-
2,3 диметилпентен-3
-
2 метил 3 этилбутен-1
-
3,3 диэтилбутен-1
- VДомашнее задание:
- § 8-10
- Решите следующую задачу:
В 1860г. А.М.Бутлеров получил этилен при взаимодействии иодистого метилена с медью по схеме:
- СН2I2 + Cu → CuI + СН2 = СН2
- Расставьте коэффициенты в схеме реакции, вычислите массу меди, которая расходуется на получение 1 л этилена.
- VIСписок литературы:
Л.А.Цветков «Органическая химия»
А.И.Астахов и Д.Л.Шамнин «Химия»
Л.Г.Гуськов «Задачи и упражнения по химии»

Источник: https://infourok.ru/urok-po-himii-na-temu-etilen-svoystva-primenenie-poluchenie-1870015.html
Алкены
Углеводороды ряда этилена по международной номенклатуре называют алкенами.
Химическая формула и строение молекулы этилена
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду равна 14.
- Простейшая формула этилена CH2. Молярная масса, соответствующая этой формуле, следующая:
- M = 12 + 2 = 14; M = 14 г/моль
- На основе закона Авогадро находим истинную молярную массу этилена:
- M = 2D (H2) = 2 * 14 = 28; M = 28 г/моль
Отсюда следует, что простейшую формулу нужно удваивать. Поэтому молекулярная формула этилена C2H4.
В отличии от предельных углеводородов, в молекулах которых между атомами углерода имеется одинарная связь, в молекулах углеводорода ряда этилена между атомами углерода имеется одна двойная связь. Поэтому углеводородам ряда этилена можно дать следующее определение:
Углеводороды с общей формулой CnH2n, в молекулах которых между атомами углерода имеется одна двойная связь, называют углеводородами ряда этилена, или алкенами.
Так как в гибридизации участвуют s — электрон и два p — электрона, то такой ее вид называется sp2 — гибридизацией. Валентный угол: 120 градусов.
Изомерия и номенклатура
Формулы углеводородов ряда этилена можно вывести из соответствующих формул предельных углеводородов.
Названия углеводородов ряда этилена образуют путем изменения суффикса -ан соответствующего предельного углеводорода на -ен или -илен.
Гомологический ряд этилена
- C2H4 — Этилен (Этен)
- C3H6 — Пропилен (Пропен)
- C4H8 — Бутен
- C5H10 — Пентен
- C6H12 — Гексен
- C7H14 — Гептен
- C8H16 — Октен
- C9H18 — Нонен
- C10H20 — Децен
Получение
- Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
- Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
- На производстве этилен получают из природного газа и при процессах пиролиза нефти.
- Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
- При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Физические свойства
Этилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде. Пропилен и бутены (бутелены) при нормальных условиях также газообразны, от пентена C5H10 до октадецена C18H36 включительно углеводороды находятся в жидком состоянии, а начиная с нонадецена C19H38 — в твердом.
Химические свойства
Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Для них характерны реакции присоединения, окисления и полимеризации.
- Реакции присоединения.
- Этилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду:H2C = CH2 + Br2 -> Ch2Br — CH2Br
- Аналогично происходит присоединение водорода (гидрирование этилена и его гомологов)
- В присутствии серной или ортофосфорной кислоты и других катализаторов этилен присоединяет воду (реакция гидратации). Этой реакцией пользуются для получения этилового спирта в промышленности.
- Этилен и его гомологи присоединяют также галогеноводороды. Пропилен и последующие углеводороды ряда этилена реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена — к наименее гидрированному атому углерода:
(пропилен) CH2 = CH — CH3 + HBr → CH3 — CHBr — CH3 (2 — бромпропан) - Реакции окисления.
- Этилен и его гомологи способны гореть на воздухе. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси.
- Этилен и его гомологи легко окисляются, например кислородом перманганата калия; при этом раствор последнего обесцвечивается.
- Большое промышленное значение имеет частичное окисление этилена кислородом воздуха.
- Реакции полимеризации. При повышенной температуре, давлении и в присутствии катализаторов молекулы этилена соединяются друг с другом вследствие развала двойной связи.
Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Получение
Этилен и его соединения используются для получения горючего с высоким октановым числом, пластмасс, взрывчатых веществ, антифризов, растворителей, для ускорения созревания фруктов, для получения ацетальдегида, синтетического каучука.
Другие заметки по химии
Источник: http://edu.glavsprav.ru/info/alkeny




