Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления (–2).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
H2O — оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
 |
 |
 |
CO2 — оксид углерода((IV)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза. Оксид углерода((IV)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.

 CO — оксид углерода((II)), угарный газ.
CO — оксид углерода((II)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
 |
 |
Fe2O3 — оксид железа((III)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
 |
 |
SiO2 — оксид кремния.
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
 |
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основной оксид, является невысокой: (+1) или (+2).
Примеры основных оксидов:
оксид натрия Na2O, оксид меди((II)) CuO.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы((VI)) SO3, оксид азота((IV)) NO2.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от (+5) до (+8). Например, оксид хрома((VI)) CrO3 и оксид марганца((VII)) Mn2O7.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
- Амфотерные свойства проявляет оксид цинка ZnO, оксид алюминия Al2O3, оксид бериллия BeO.
- Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
- Например, хром может быть двухвалентен, трёхвалентен и шестивалентен.
- Амфотерными свойствами обладает именно оксид хрома ((III)) Cr2O3.
Несолеобразующими называют оксиды, которые при обычных условиях не взаимодействуют ни с кислотами, ни с основаниями.
Примеры несолеобразующих оксидов: оксид углерода((II)), или угарный газ CO, оксид азота((I)), или веселящий газ N2O, и оксид азота((II)) NO.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например: Na2O — оксид натрия, Al2O3 — оксид алюминия.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu2O — оксид меди((I)), CuO — оксид меди((II)), FeO — оксид железа((II)), Fe2O3 — оксид железа((III)), Cl2O7 — оксид хлора((VII)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода CO, диоксид углерода CO2, триоксид серы SO3.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO, серный ангидрид SO3 и т. д.
Источник: https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/oksidy-13609/re-29d095fc-d20b-44e5-a3c1-28ca9c299050
Урок 8: Оксиды, кислоты, основания
- План урока:
- Оксиды
- Кислоты
- Основания
- Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.

Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.

Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
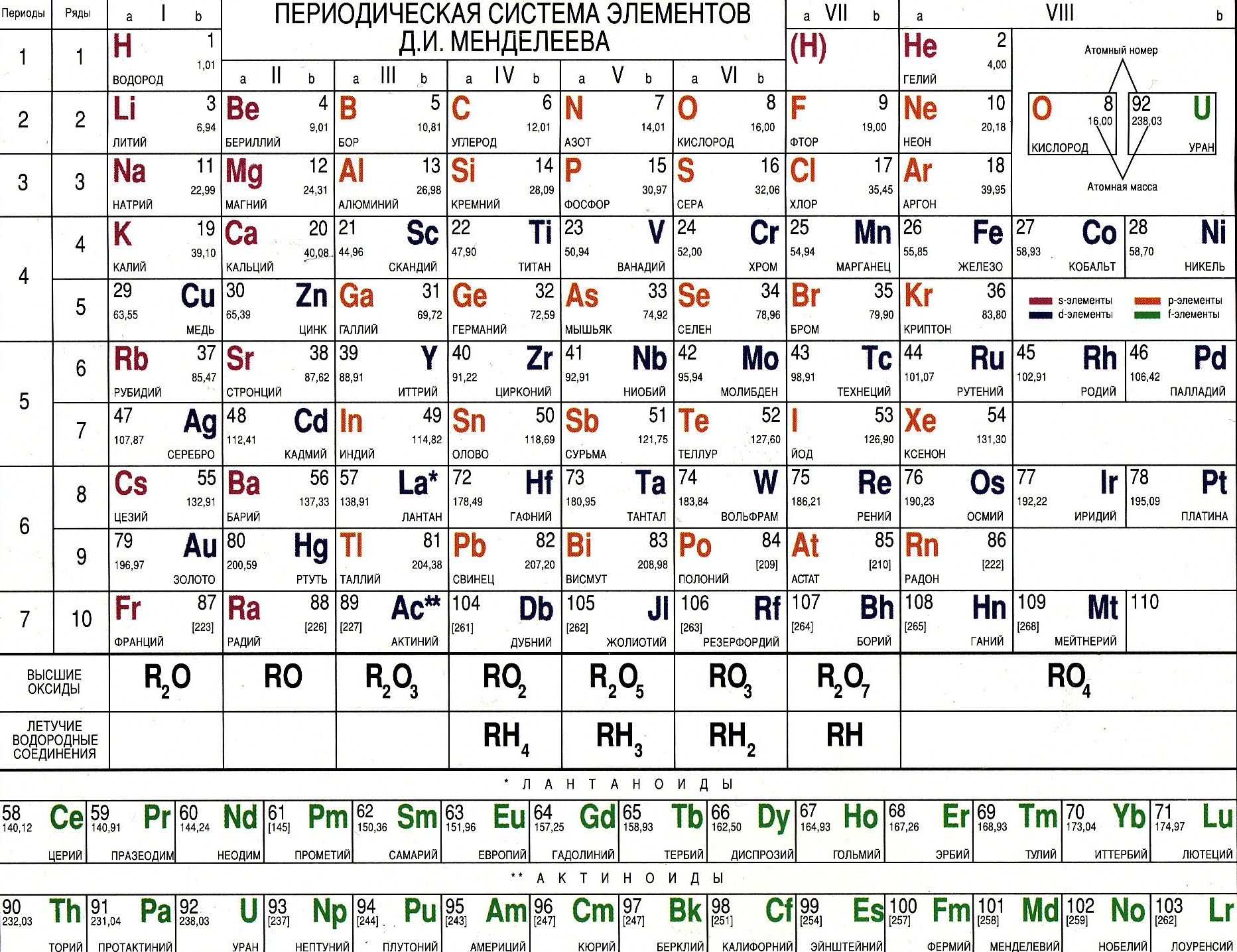
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.

Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.

Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.

Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.

Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы.
Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.

Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции — соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.

Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
 Источник
Источник
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
- Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы — ОН.
- Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
- Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого.
Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки.
Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры.
Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
- Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
- Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
- Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
- Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты.
Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли.
Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
- Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
- Источник
- Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
- Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
- Источник
Источник: https://100urokov.ru/predmety/urok-8-oksidy-kisloty-osnovaniya
Урок 31. Оксиды – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.

Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Содержание
- Состав оксидов
- Классификация оксидов
- Оксиды в природе
Состав оксидов
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов.
Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.

Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
![]()
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
![]()
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.

Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.

Краткие выводы урока:
- Оксиды делятся на кислотные и основные. Кислотным оксидам соответствуют кислоты, а основным — основания.
- Оксиды широко распространены в природе.
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-31-oksidy.html
Оксиды. Химические свойства и способы получения
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2.
По способности образовывать соли оксиды делят на солеобразующие и несолеобразующие (СО,SiO,NO,N2О).
Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты.
К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li2О, Na2О, К2О, Cs2О, Rb2О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu2O, CuO, Ag2O, СrO, FeO, MnO, СоO, NiO).
 Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
Кислотные оксиды образуют как элементы-неметаллы (СО2, SO2, NO2,Р2O5, Cl2O7), так и элементы-металлы, степень окисления атома металла должна быть +5 и выше(V2O5, СrO3, Mn2O7, MnO3). Амфотерные оксиды образуют только элементы металлы (ZnO, AI2O3, Fe2O3, BeO, Cr2O3, PbO, SnO, MnO2).
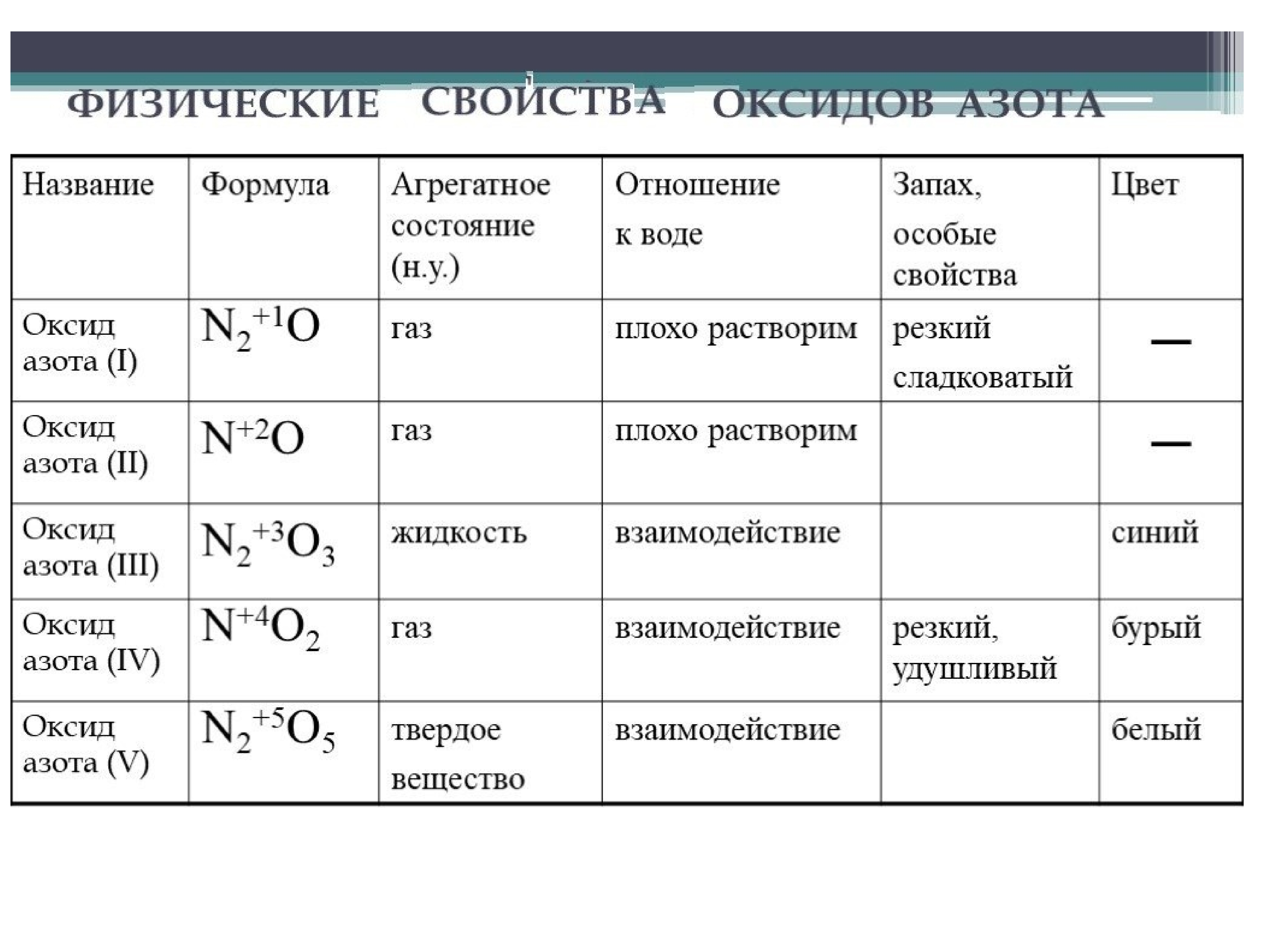
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO3,Сl2O7,Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2).
Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют.
Одни оксиды окрашены: бурый газ NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Аl2O3 и ZnO, другие — бесцветные (H2O, CO2, SO2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества молекулярного строения (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).

Химические свойства оксидов

- Al2O3+6KOH+3H2O=2K3[Al(OH)6] — гексагидроксоалюминат калия;
ZnO+2NaOH+H2O=Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
Источник: http://himege.ru/oksidy-svojstva/
Составление формул оксидов
Запомни при составлении
формул первым ставят
элемент степень окисления. которого со знаком +, а
вторым элемент с отрицательной степенью окисления. Для оксидов это
всегда кислород. Далее
необходимо: 1. расставить степени
окисления
(с.о.) для каждого атома. Кислород в оксидах всегда имеет с.о. -2
(минус два). 2. Для того чтобы
правильно
определить степень окисления. второго элемента необходимо познакомится
с таблицей возможных степеней окисления некоторых элементов:
Таблица.1 Степени окисления некоторых элементов
| Элемент | Возможные степени окисления |
| N (азот) | -3, 0, +1, +2, +3, +4,+5. |
| P (фосфор) | -3, 0, +3, +5. |
| S (сера) | -2, 0, +4, +6. |
| C (углерод) | -4, 0, +2, +4. |
Степень окисления «0» —
ноль имеют:
1. Простые вещества: Н2,
Са, О2 …
2. Сложные в-ва (в сумме): Са+2О-2 (+2 – 2 =0)
Степень окисления со знаком +
характерна для элементов которые отдают свои электроны в соединениях
другим атомам или от которых оттянуты общие электронные пары, т.е.атомы
менее электроотрицательных элементов.
например металлы
всегда имеют положительную степени окисления. Подсказка: Узнать степени окисления для металлов
можно в таблице «растворимости…».
В ней представлены заряды ионов металлов они обычно совпадают со
степенью окисления.
С неметаллами кислород образует оксид, если только этот неметалл менее
электроотрицательный, чем сам кислород см. таблицу
электроотрицательности.

рис.2
Запомни если степени
окисления.
элементов в бинарных соединениях равны по модулю, то индексы в формуле
не ставятся: Сa+2О-2.
Составим формулу
оксида натрия:
По
таблице растворимости заряд иона натрия +,
соответственно степень окисления натрия имеет значение +1 (Na+1),
с.о. кислорода в оксидах всегда -2.
Натрий
имеет положительный заряд, значит, его ставим первым, а вторым
ставим кислород и по правилу креста получим: Na2+1O-2
или Na2O.
Правило
наименьшего общего кратного
это способ наиболее универсальный для составления формул. Как им
пользоваться рассмотрим на примере.
Составить формулу
оксида серы (VI).
1.
У кислорода с.о. -2 следовательно в формуле он ставиться вторым, а
первым элементом будет сера ее с.о. указана в названии оксида VI, т. е
+6. S+6O-2.
2.
Найдем наименьшее общее кратное. Для чисел 2 и 6 это будет 6. 3.
Находим индексы и расставляем для каждого элемента. См. рисунки ниже. 6 : 6 = 1 это индекс для серы.
Индексы со значением 1 в формулах не ставятся.
- Рис.3
- 6 : 2 = 3
это индекс для кислорода - Рис.4
- В результате получим
формулу оксида серы (VI): 
- * * *
Источник: http://osievskaja.narod.ru/klass/oksid/oksid_formula.html
Оксиды их классификация, способы получения и химические свойства (таблица, схема)
- Оксиды — это бинарные соединения кислорода, то есть сложные вещества, состоящие из двух элементов, один из которых является кислород.
- Э2+nOn-2 — общая формула оксидов, где
- n — степень окисления элемента
- -2 — степень окисления кислорода
- Названия оксидов составляется из слова «оксид» и названия элемента образующего оксид в родительном падеже (CaO — оксид кальция).
Схема классификация оксидов

Таблица классификация оксидов с примерами
| Классификация оксидов | Определение | Примеры реакций | Типичные взаимодействия |
| Нормальные | Оксиды, в которых есть только связи между кислородом и каким-нибудь элементом | MgO, SO3, SiO2 | Смотрите свойства кислотных и основных оксидов |
| Пероксиды | Те, в которых есть связи между двумя атомами кислорода | Na2O2, H2O2 | Смотрите таблицу свойства пероксида водорода |
| Смешанные оксиды | Те, которые представляют собой смесь двух оксидов одного элемента в разных степенях окисления | Pb3O4 = 2РbО · PbO2 Fe3O4 = FeO · Fe2O3 | Обладают теми же свойствами, что и входящие в их составы оксиды |
| Кислотные или ангидриды | Оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами — образуют соли | SO3, SO2, Mn2O7 |
|
| Основные оксиды | Те, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют соли | CaO, Na2O |
|
| Амфотерные оксиды | Те, которые в зависимости от условий проявляют свойства и кислотных, и основных оксидов | ZnO, Al2O3 |
|
| Безразличные (несолеобразующие) | Оксиды, которые не реагируют ни с кислотами, ни с основаниями. Солей не образуют | NO, N2O | NO + Н2O -/-> N2O + NaOH |
Способы получения оксидов таблица
Почти все хим. элементы образуют оксиды. На данный момент не получены оксиды гелия, неона и аргона.
| Способы получения оксидов | Примеры | Примечание |
| Взаимодействие простых веществ с кислородом | S + O2 → SO2 4Аl + 3O2 → 2Аl203 |
Так получают преимущественно оксиды неметаллов |
| Термическое разложение оснований, солей, кислот |
|
Так получают преимущественно оксиды металлов |
| Взаимодействие простых веществ и солей с кислотами-окислителями |
|
Способ получения преимущественно оксидов неметаллов |
Химические свойства оксидов таблица
| Классификация оксидов | Химические свойства оксидов | Примеры реакции |
| Основные оксиды | 1. Основной оксид* + вода —> щелочь | К2О + Н2О → 2КОН, ВаО + Н2O → Ва(ОН)2 |
| 2. Основной оксид + кислота —> соль + вода | CuO + H2SO4 → CuSO4 + Н2О | |
| 3. Основной оксид + кислотный оксид —> соль | MgO + СО2 → MgCO3, ЗСаО + P2O5 → Ca3(PO4)2 |
|
| Кислотные оксиды | 1. Кислотный оксид + вода —> кислота |
|
| 2. Кислотный оксид + щелочь —> соль + вода | SO3 + 2NaOH → Na2SO4+ Н2O | |
| 3. Кислотный оксид + основной оксид —> соль | SiO2 + CaO t→ CaSiO3, Р2O4 + ЗК2O → 2К3РО4 |
|
| Амфотерные оксиды | 1. С кислотами реагируют как основные оксиды | ZnO + H2SO4 → ZnSO4 + Н2O |
| 2. С основаниями (щелочами) реагируют как кислотные оксиды | ZnO + 2NaOH → Na2ZnO2 + Н2O |

_______________
Источник информации: Насонова А.Е. Химия, школьная программа в таблицах и формулах, 1998
Источник: https://infotables.ru/khimiya/895-klassifikatsiya-oksidov
Основные оксиды
Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является кислород. Оксиды могут быть солеобразующими и несолеобразующими: одним из видов солеобразующих оксидов являются основные оксиды.
Чем они отличаются от других видов, и каковы их химические свойства?

Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные оксиды. Если основным оксидам соответствуют основания, то кислотным – кислоты, а амфотерным оксидам соответствуют амфотерные образования. Амфотерными оксидами называют такие соединения, которые в зависимости от условий могут проявлять либо основные, либо кислотные свойства.
Рис. 1. Классификация оксидов.
Физические свойства оксидов очень разнообразны. Они могут быть как газами (CO2), так и твердыми (Fe2O3) или жидкими веществами (H2O). При этом большинство основных оксидов является твердыми веществами различных цветов.
оксиды, в которых элементы проявляют свою высшую активность называются высшими оксидами. Порядок возрастания кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
Основными оксидами называются оксиды, которым соответствуют основания. Например, основным оксидам K2O, СaO соответствуют основания KOH, Ca(OH)2 .
Рис. 2. Основные оксиды и соответствующие им основания.
Основные оксиды образуются типичными металлами, а также металлами переменной валентности в низшей степени окисления (например, CaO, FeO), реагируют с кислотами и кислотными оксидами, образуя при этом соли:
CaO (основной оксид)+CO2 (кислотный оксид)=СaCO3 (соль)
FeO (основной оксид)+H2 SO4 (кислота)=FeSO4 (соль)+2H2O (вода)
Основные оксиды также взаимодействуют с амфотерными оксидами, в результате чего происходит образование соли, например:
С водой реагируют только оксиды щелочных и щелочно-земельных металлов:
BaO (основной оксид)+H2O (вода)=Ba(OH)2 (основание щелочнозем. металла)
Многие основные оксиды имеют характер восстанавливаться до веществ, состоящих из атомов одного химического элемента:
При нагревании разлагаются только оксиды ртути и благородных металлов:
Рис. 3. Оксид ртути.
| Название оксида | Химическая формула | Свойства |
| Оксид кальция | CaO | негашенная известь, белое кристаллическое вещество |
| Оксид магния | MgO | белое вещество, малорастворимое в воде |
| Оксид бария | BaO | бесцветные кристаллы с кубической решеткой |
| Оксид меди II | CuO | вещество черного цвета практически нерастворимое в воде |
| Оксид ртути II | HgO | твердое вещество красного или желто-оранжевого цвета |
| Оксид калия | K2O | бесцветное или бледно-желтое вещество |
| Оксид натрия | Na2O | вещество, состоящее из бесцветных кристаллов |
| Оксид лития | Li2 O | вещество, состоящее из бесцветных кристаллов, которые имеют строение кубической решетки |
В главных подгруппах периодической системы при переходе от одного элемента к другому сверху вниз наблюдается усиление основных свойств оксидов
При образовании основных оксидов одним из обязательных элементов является кислород.Основные оксиды обладают рядом физических и химических свойств, таких как взаимодействие с водой, кислотами и другими оксидами.
Средняя оценка: 4.6. Всего получено оценок: 745.
Источник: https://obrazovaka.ru/himiya/osnovnye-oksidy-spisok.html
Оксиды – Химия 8 класс — Основы химии на Ида Тен
- Химические формулы оксидов и их названия Вам уже известно, что оксиды – это бинарные соединения, в состав которых обязательно входит химический элемент кислород.
- На сегодняшний день получены оксиды всех существующих в природе химических элементов кроме трех: гелия, неона и аргона.
- Рассмотрим химические формулы оксидов, с которыми мы уже встречались:
CO2, SO2, Fe3O4 и т.д.
Как видно, в формулах оксидов на первом месте принято записывать химический символ элемента, который образует оксид, а на втором – химический символ кислорода.
Попробуем вывести общую формулу для оксидов, то есть формулу, при помощи которой можно составить формулу оксида любого элемента.
Элемент, образующих оксид, будем обозначать буквой R, а его валентность в оксиде, как х.
С учетом того, что валентность кислорода равна II, получим:
Итак, общая формула оксидов:
R2Ox.
Рассмотрим пример. Необходимо составить формулы оксидов серы, в которых сера проявляет валентность IV и VI. Получаем: В тех случаях, когда оксид образован химическим элементом с переменной валентностью, после названия оксида, в скобках, римской цифрой указывается валентность элемента в данном оксиде.
Например:
SO2 – оксид серы (IV), SO3 – оксид серы (VI). Если валентность химического элемента постоянна, естественно, он может образовать с кислородом только один оксид. В таких случаях валентность в скобках после названия не указывается. Например: ZnO – оксид цинка
Классификация оксидов
Оксиды – весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд природных пигментов.
Оксидами также является класс минералов, представляющих собой соединения металлов с кислородом. Самым распространенным оксидом в земной коре является минерал кварц, его систематическое название – оксид кремния (IV) – SiO2.
Этот оксид образует множество различных минералов, которые геологи объединяют в минералы группы кварца.
По своему агрегатному состоянию оксиды могут быть газообразными: углекислый газ CO2, сернистый газ SO2 – эти газы бесцветны. А оксид азота (IV) NO2 – газ коричневого цвета.
Оксидов – жидкостей в обычных условиях сравнительно немного. Примеры таких оксидов: вода – оксид водорода, оксид марганца (VII) Mn2O7, оксид хлора (VII) Cl2O7, оксид хлора (VI) ClO3.
Большинство оксидов – твердые вещества, имеющие молекулярное или ионное строение.
Оксиды металлов имеют ионное строение. В кристаллических решетках оксидов металлов находятся ионы кислорода O2− и ионы соответствующего металла. Оксиды неметаллов, как правило, имеют молекулярное строение. На рисунке 139 приведена модель молекулы оксида фосфора (V).
Химическая формула оксида фосфора (V), которую мы уже записывали не раз – P2O5.
На самом деле это эмпирическая, простейшая формула. Истинная химическая формула, которая реально отвечает строению оксида фосфора (V) – P4O10 Существуют оксиды и атомного строения. К таким оксидам относятся оксид бора B2O3, оксид кремния (IV) SiO2. Кристаллические решетки этих оксидов состоят из атомов.
Применение оксидов
Многие оксиды нашли разнообразное применение в различных сферах деятельности человека. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила).
Поскольку ZnO практически нерастворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил.
TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
TiO2 добавляют в качестве наполнителя в мыло, лекарственные препараты, которые выпускаются в виде таблеток.
Оксид хрома (III) – Cr2O3 – кристаллы темно-зеленого цвета (см. рисунок 138, а), нерастворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это далеко не единственное их применение Оксиды неметаллов так же имеют широкое применение.
Углекислый газ, или оксид углерода (IV) – CO2 применяется как наполнитель углекислотных огнетушителей, так как данный оксид негорюч. Сернистый газ, или оксид серы (IV) – SO2 применяется в качестве дезинфицирующего вещества для зернохранилищ. Как вы уже заметили, множество химических веществ имеют тривиальные названия.
Ниже приведены тривиальные названия некоторых оксидов:
| Химическая формула | Химическое название | Тривиальное название |
| СО | Оксид углерода (II) | Угарный газ |
| СО2 | Оксид углерода (IV) | Углекислый газ |
| SO2 | Оксид серы (IV) | Сернистый газ |
| Al2O3 | Оксид алюминия | Глинозём |
| СаО | Оксид кальция | Негашеная известь |
- Оксиды – бинарные соединения, в состав которых входит химический элемент кислород
- Оксиды известны для всех химических элементов, встречающихся в природе, кроме гелия, неона, аргона
- Общая формула оксидов R2Ox
- В названии оксида нужно указывать валентность образующего оксид химического элемента, если она переменная
- Оксиды существуют во всех трех агрегатных состояниях, имеют разнообразную окраску и отличаются по строению
Источник: https://idaten.ru/chemistry/oksidi-himiya-8-klass
Как определить тип оксида?
- В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
- 1) несолеобразующие
- 2) основные
- 3) кислотные
- 4) амфотерные
- Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
- Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
- Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить.
Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
| Оксид неметалла | Оксид металла |
|
1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
|
|
| 3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Источник: https://scienceforyou.ru/poleznye-spravochnye-materialy-k-egje/kak-opredelit-tip-oksida




