


Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой H3PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:

| Наименование | Количество атомов | Массовая доля, % |
| Водород (H) | 3 | 3,10 |
| Фосфор (P) | 1 | 65,30 |
| Кислород (O) | 4 | 31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
| Концентрация, % | Температура плавления, °C | Плотность, грамм/мл |
| 75 | -20 | 1,579 |
| 80 | 0 | 1,633 |
| 85 | +20 | 1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации H3PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO43- и молекулами воды H2O.
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- H3PO4 = H+ + H2PO4-.
- H2PO4- = H+ + HPO42-.
- HPO42- = H+ + PO43-.
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.

При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный.
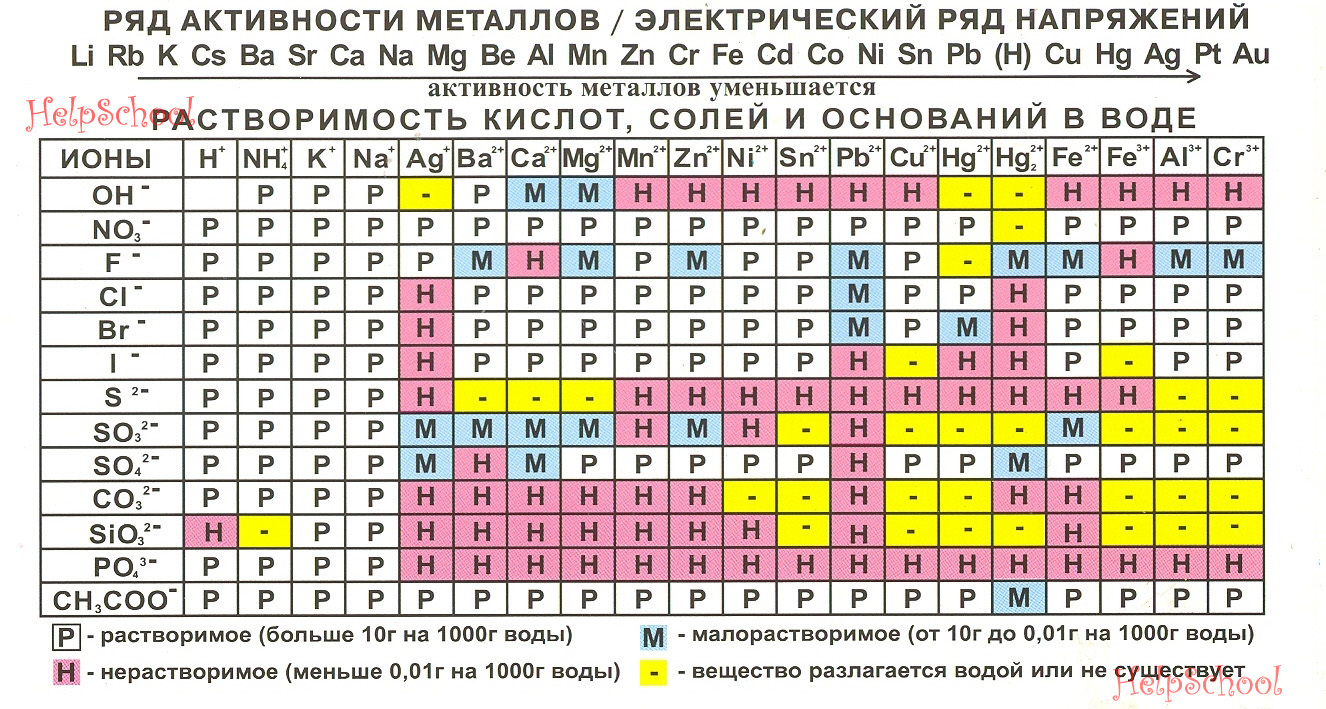
Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2.
Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Основные способы получения

Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:

- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот.
Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях.
Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах.
Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6.
Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.

Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338.
Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке.
Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.

Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует H3PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей.
В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Источник: https://nauka.club/khimiya/fosfornaya-kislota.html
Оксид фосфора (V), свойства, получение, химические реакции
![]()
![]()
![]()
![]()
- Оксид фосфора (V) – неорганическое вещество, имеет химическую формулу P4O10 и P2O5.
- Краткая характеристика оксида фосфора (V)
- Модификации оксида фосфора (V)
- Физические свойства оксида фосфора (V)
- Получение оксида фосфора (V)
- Химические свойства оксида фосфора (V)
- Химические реакции оксида фосфора (V)
- Применение и использование оксида фосфора (V)
Краткая характеристика оксида фосфора (V). Формула оксида фосфора (V):
Оксид фосфора (V) – неорганическое вещество белого цвета.
Оксид фосфора (V) содержит четыре атома фосфора и десять атомов кислорода.
Химическая формула оксида фосфора (V) P4O10 и P2O5. Для простоты записи используют последнюю формулу.
В воде не растворяется, а взаимодействует с ней, образуя кислоты.
Кислотный оксид.
Модификации оксида фосфора (V):
Твердый оксид фосфора (V) склонен к полиморфизму. Существуют три формы-модификации оксида фосфора (V): H, O`, O и G формы-модификации.
| гексагональная H-форма | орторомбическая O`-форма | орторомбическая O-форма | G-форма | |
| Состояние вещества | Кристаллический вид | Кристаллический | Кристаллический вид | Стекловидный вид |
| Характер стабильности формы | Метастабильная форма | Стабильная форма | Метастабильная форма | |
| Другие характеристики | a=0,744 нм, угол = 87°, пространственная группа R3C | a=1,63 нм, b=0,814 нм, c=0,526 нм, пространственная группа Fdd2 | a=0,923 нм, b = 0,718 нм, c = 0,494 нм, пространственная группа Pnam |
H-форма переходит в O-форму при 300-360 °C (процесс заканчивается при 378 °C).
Физические свойства оксида фосфора (V). Масса, цвет, плотность, температура и пр.:
| Наименование параметра: | Значение: |
| Химическая формула оксида фосфора (V) | P4O10 и P2O5 |
| Синонимы и названия иностранном языке | phosphorus (V) oxide (англ.)
|
| Тип вещества | неорганическое |
| Внешний вид | белые тригональные кристаллы |
| Цвет оксида фосфора (V) | белый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность H-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2300 |
| Плотность H-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,3 |
| Плотность O`-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 3000 |
| Плотность O`-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 3,0 |
| Плотность O-формы (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2720 |
| Плотность O-формы (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,72 |
| Температура сублимации H-формы, °C | 340,5 |
| Температура кипения O`-формы, °C | 605,5 |
| Температура кипения O-формы, °C | 605,5 |
| Температура плавления H-формы, °C | 420,5 (0,48 МПа) |
| Температура плавления O`-формы, °C | 580,5 (74 кПа) |
| Температура плавления O-формы, °C | 562 (58 кПа) |
| Молярная масса оксида фосфора (V), P2O5, г/моль | 141,94 |
| Молярная масса оксида фосфора (V), P4O10, г/моль | 283,88 |
Примечание:
* — нет данных.
Получение оксида фосфора (V):
- Оксид фосфора (V) получают путем сжигания фосфора в избытке кислорода или воздуха.
- P4 + 5O2 → P4O10 (t = 34-60 °C).
- Готовый продукт состоит из смеси разных форм P4O10.
Химические свойства оксида фосфора (V). Химические реакции оксида фосфора (V):
- Оксид фосфора (V) относится к кислотным оксидам.
- Химические свойства оксида фосфора (V) аналогичны свойствам кислотным оксидов других неметаллов. Поэтому для него характерны следующие химические реакции:
- 1. реакция оксида фосфора (V) и белого фосфора:
- 3P4O10 + 2P4 → 5P4O6 (t = 50 °C).
- В результате реакции образуются оксид фосфора (III).
- 2. реакция оксида фосфора (V) и натрия:
- 3P4O10 + 16Na → 10NaPO3 + 2Na3P (t = 300-400 °C).
- В результате реакции образуются соли – метафосфат натрия и фосфид натрия.
- 3.
реакция оксида фосфора (V) и лития:
- 3P4O10 + 16Li → 10LiPO3 + 2Li3P (t = 300-400 °C).
- В результате реакции образуются соли – метафосфат лития и фосфид лития.
- 4. реакция оксида фосфора (V) и фтора:
- P4O10 + 6F2 → 4POF3 + 3O2 (t = 100 °C).
- В результате реакции образуются оксид-трифторид фосфора(V) и кислород.
- 5. реакция оксида фосфора (V) с водой:
- P4O10 + 6H2O → 4H3PO4 или P2O5 + 3H2O → 2H3PO4,
- P4O10 + 2H2O → 4HPO3 или P2O5 + H2O → 2HPO3.
- В результате реакции образуются кислоты: в первом случае – ортофосфорная кислота, во втором – метафосфорная кислота.
- 6. реакция оксида фосфора (V) с оксидом кальция:
- CaO + P2O5 → Ca(PO3)2,
- 2CaO + P2O5 → Ca2P2O7,
- 3CaO + P2O5 → Ca3(PO4)2 (t°).
- В результате реакции образуется соль, в первом случае – метафосфат кальция, во втором – дифосфат кальция, в третьем – фосфат кальция.
- 7.
реакция оксида фосфора (V) с оксидом натрия:
- 3Na2O + P2O5 → 2Na3PO4.
- В результате реакции образуется соль – ортофосфат натрия.
- 8. реакция оксида фосфора (V) с оксидом бора:
- 2B2O3 + P4O10 → 4BPO4 (t°).
- В результате реакции образуется соль – фосфат бора.
- 9.
реакция оксида фосфора (V) с гидроксидом натрия:
- P4O10 + 12NaOH → 4Na3PO4 + 6H2O или P2O5 + 6NaOH → 2Na3PO4 + 3H2O.
В результате реакции образуется соль – ортофосфат натрия и вода. Гидроксид натрия – разбавленный раствор.
- 10. реакция оксида фосфора (V) с плавиковой кислотой:
- P4O10 + 3HF → POF3 + 3HPO3 (t = 120-170 oC).
- В результате химической реакции получается оксид-трифторид фосфора и метафосфорная кислота.
- 11. реакция оксида фосфора (V) с бромистым водородом (бромоводородом):
- P4O10 + 3HBr → POBr3 + 3HPO3 (t = 200 oC).
- В результате химической реакции получается оксид-трибромид фосфора и метафосфорная кислота.
- 12. реакция оксида фосфора (V) с азотной кислотой:
- 4HNO3 + P4O10 → 2N2O5 + 4HPO3 или 2HNO3 + P2O5 → N2O5 + 2HPO3 (t = -10 oC).
- В результате химической реакции получается оксид азота и метафосфорная кислота.
- 13. реакция оксида фосфора (V) с ортофосфорной кислотой:
- P4O10 + 8H3PO4 → 6H4P2O7 (t = 80-100 oC).
В результате химической реакции получается дифосфорная кислота. Ортофосфорная кислота – концентрированный раствор.
14. реакция оксида фосфора (V) с пероксидом водорода:
P4O10 + 8H2O2 → 4H3PO2(O2)2 + 2H2O (t = -20 oC).
В результате химической реакции получается дипероксодиоксофосфата водорода и вода. Пероксид водорода – безводный.
15. реакции оксида фосфора (V) с органическими веществами:
Оксид фосфора (V) реагирует с амидами, превращая их в нитрилы, а также со спиртами, эфирами, фенолами и другими органическими соединениями, при этом образуются фосфорорганические соединения.
Применение и использование оксида фосфора (V):
Оксид фосфора (V) используется как осушитель газов и жидкостей в органическом синтезе.
Примечание: © Фото //www.pexels.com, //pixabay.com
-



- карта сайта
- оксид фосфора (V) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида фосфора (V)
реакции с оксидом фосфора (V)
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/oksid-fosfora-v-svoystva-poluchenie-himicheskie-reaktsii/
Определение молярных масс фосфора при разных температурах
Задача 913. При 800°С плотность паров фосфора по отношению к воздуху составляет 4,27, а при 1500°С она уменьшается в два раза. Из скольких атомов состоит молекула фосфора при указанных температурах?Решение:Молярная масса воздуха равна 29 г/моль. По формуле:
![]()
Рассчитаем молярные массы фосфора при разных температурах, получим:
а) находим молярную массу фосфора при 800 0С:
М(Р') = D(возд.) . М(возд.) = 4,27 . 29 = 123,83 г/моль;
б) находим молярную массу фосфора при 1500 0С:
М(P») = D(возд.) . М(возд.) = (4,27/2) . 29 = 61,915 г/моль.
Рассчитаем, из скольких атомов состоит молекула фосфора при разных температурах:

Здесь D(возд.) — плотность вещества по воздуху; М(В) – молярная масса вещества; n – число атомов в молекуле вещества (В).
Таким образом, при температуре 800 0С молекула газообразного фосфора состоит из 4 атомов (Р4), а при 1500 0С – из 2 (Р2).
Ответ: а) из 4-х атомов; б) из из 2-х атомов.
Задача 914. Какое количество теплоты выделяется при превращении 1 т белого фосфора в красный, если теплота перехода составляет 16,73 кДж на 1 моль атомов?Решение:Уравнение реакции имеет вид:
Р(белый) ⇒ Р(красный) ; ΔН = -16,73 кДж.
Находим количество фосфора:
![]()
Рассчитаем количество теплоты, которое выделилось при переходе 1 т. белого фосфора в красный, получим:
ΔН0х.р = [(1000000/31)] . 16,73 = 540147,87 = 5,4 . 105 кДж.
Ответ: ΔН0х.р = 5,4 . 105 кДж.
Задача 915. Указать названия и формулы аммонийных солей ортофосфорной кислоты. Почему аммиак может быть получен из них непосредственным нагреванием, тогда как для получения аммиака из хлорида аммония последний необходимо предварительно смешать с гашеной известью или щелочью?
- Решение:
- (NH4)H2PO4 — дигидроортофосфат аммония (аммония дигидроортофосфат);
- (NH4)2HPO4 — гидроортофосфат аммония (диаммония гидроортофосфат);
- (NH4)3PO4 — ортофосфат аммония (триаммония ортофосфат).
- Аммонийные соли нелетучей ортофосфорной кислоты разлагаются до конца с образованием аммиака и кислоты:
- (NH4)H2PO4 NH3↑ + H3PO4;
- (NH4)2HPO4 2NH3↑ + H3PO4;
- (NH4)3PO4 3NH3↑ + H3PO4.
- Так, при нагревании хлорида аммония происходит его термическая
- диссоциация:
- NH4Cl NH3↑ + HCl↑,
- а образующиеся продукты, покинув зону высокой температуры, вновь
Формулы аммонийных солей ортофосфорной кислоты:
реагируют друг с другом. Таким образом, хлорид аммония (или нашатырь), — возгоняется (испаряется при нагревании), поэтому для в лаборатории аммиак обычно получают, нагревая хлорид аммония с гашеной известью. Реакция выражается уравнением:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + H2O↑
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).
Источник: http://buzani.ru/zadachi/khimiya-glinka/1297-molyarnye-massy-fosfora-zadachi-913-915
Фосфор
Один из наиболее распространённых простых веществ в земной коре – фосфор. В чистом виде не встречается, т.к. имеет высокую активность и быстро вступает в реакции. Входит в состав живых организмов.

Фосфор находится в V группе, в третьем периоде таблицы Менделеева. Располагается под 15 номером. Известно шесть изотопов фосфора, полученных искусственным путём.
Фосфор – элемент р-семейства. Атом фосфора состоит из положительно заряженного ядра +15 и 15 отрицательно заряженных электронов, располагающихся на трёх электронных оболочках.
Пять валентных электронов располагаются на внешнем энергетическом уровне: 2 – на s-орбитали, 3 – на p-орбитали. В обычном состоянии p-орбиталь остаётся незавершённой, и фосфор проявляет III валентность.
В возбуждённом состоянии электроны с s-орбитали переходят на p-орбиталь, и фосфор приобретает высшую валентность – V.
Рис. 1. Строение атома фосфора.
Электронная формула фосфора – 1s22s22p63s23p3.
Фосфор при нормальных условиях постоянно находится в одном агрегатном состоянии. Это твёрдое кристаллическое вещество, нерастворимое в воде. Относительная атомная масса – 31 а.е.м., молярная масса – 30,9738 г/моль.
Фосфору свойственна аллотропия – способность модифицироваться. Модификации отличаются физическими свойствами фосфора. Особенности видов описаны в таблице.
| Тип | tпл., °С | tкип., °С | ρ, г/см3 | Характеристика |
| Белый | 44 | 280 | 1,823 | Из-за примесей может иметь жёлтый цвет. Наиболее мягкая модификация, режущаяся ножом, со специфическим запахом. Молекула состоит из четырёх атомов (Р4), расположенных в виде тетраэдра. Окисляется на воздухе со свечением, воспламеняется при 40°С. Токсичен, имеет небольшие смертельные дозы (0,05-0,15 г) |
| Красный | 593 под давлением 4,36 МПа | – | 2,4 | Получается при нагревании белого фосфора в отсутствии воздуха и под ионизирующим излучением. Представляет собой полимер (Pn), состоящий из нескольких молекул Р4. Не ядовитый, не светится. Воспламеняется при 210°С. Не плавится в обычных условиях, а сразу улетучивается. Из паров образуется белый фосфор |
| Чёрный | 1000 под давлением 18·105 Па | – | 2,69 | Получается при длительном нагревании белого фосфора при 230°С под высоким давлением. Имеет металлический блеск. Похож на графит, жирный на ощупь. Не растворяется даже в органических растворителях. Имеет свойства полупроводника. Можно поджечь при предварительном прокаливании до 500°С |
Рис. 2. Модификации фосфора.
При обычных условиях фосфор имеет только три модификации. Однако под высоким давлением из чёрного фосфора можно получить металлический фосфор. Это самая плотная модификация (3,83 г/см3), проводящая электрический ток.
Активность снижается при переходе от одной модификации к другой. Поэтому активным является белый фосфор, инертным – металлический.
Фосфор вступает в реакции со многими простыми и сложными веществами. Особенности химических свойств описаны в таблице.
| Реакция | Особенности | Уравнение |
| С кислородом | В избытке кислорода образуется оксид фосфора (V). При медленном окислении получается оксид фосфора (III) | – 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
| С галогенами и неметаллами | Восстанавливает | – 2P + 3Cl2 → 2PCl3; – B + P → BP |
| С металлами | Окисляет. Образует фосфиды | 3Mg + 2P → Mg3P2 |
| С водой | Реагирует с водяным паром, образуя фосфин и фосфорную кислоту. Красный фосфор реагирует при нагревании и катализаторе, образуя фосфорную кислоту | – 8Р + 12Н2О → 5РН3 + 3Н3РО2; – 2Р + 8Н2О → 2Н3РО2 + 5Н2 |
| С кислотой | Связывается с водородом, замещая неметаллы | 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
| Со щелочами | Образует фосфин | 4Р + 3KOH + 3Н2О → РН3 + 3KH2PO2 |
Фосфор не взаимодействует со свободным водородом.
В природе фосфор встречается в виде солей и минералов. В частности входит в состав апатита.
В организме животных и человека фосфор выполняет структурную функцию. Его содержат:
- белки;
- ДНК;
- АТФ;
- фосфолипиды;
- костная, нервная, мышечная ткани.
Фосфор участвует в постройке клеточной мембраны, в метаболизме, в механизме сокращения мышц. Вместе с кальцием в виде фосфата кальция Са3(PO4)2 придаёт прочность скелету.
Фосфор участвует в круговороте веществ. Основной источник фосфора – растения, получающие его из почвы. В грунт фосфор попадает в результате гниения. Специальные бактерии перерабатывают органические вещества, содержащие фосфор, в фосфаты – неорганические соединения, усвояемые растениями.
Рис. 3. Круговорот фосфора.
Фосфор – один из важнейших элементов неорганической химии, входящий в состав живых организмов. Электронная конфигурация – 1s22s22p63s23p3. Имеет переменную валентность – III и V.
Это твёрдый неметалл, образующий три аллотропические формы – белый, красный и чёрный фосфор. Формы отличаются физическими и химическими свойствами. Самый активный – белый фосфор, окисляющийся на воздухе.
Элемент реагирует с кислородом, металлами, неметаллами, галогенами, кислотами, водой и щелочами. Фосфор не реагирует с водородом.
Средняя оценка: 4.6. Всего получено оценок: 116.
Источник: https://obrazovaka.ru/himiya/fosfor-formula-svoystva-9-klass.html
§ 10. Относительные атомная и молекулярная массы
1. Что такое относительная атомная масса? Почему эта величина не имеет размерности?
Относительной атомной массой называется величина, показывающая, во сколько раз масса атома данного элемента, больше массы атома водорода, принятой за единицу.
Эта величина не имеет размерности потому, что относительная. По сути она показывает количество масс атома водорода.
2. Что такое относительная молекулярная масса? Как она рассчитывается?
- Относительной молекулярной массой называется величина, показывающая, во сколько раз масса молекулы, больше массы атома водорода, принятой за единицу.
- Или
- Относительная молекулярная масса — это сумма относительных атомных масс всех элементов, входящих в состав молекулы.
- Второе определение является ответом на вопрос про расчет относительной молекулярной массы:
- Mr = ∑Ar
- где Mr — относительная молекулярная масса;
- ∑ — знак суммирования;
- Ar — относительная атомная масса.
3. В состав молекулы фосфорной кислоты входят три атома водорода, один атом фосфора и четыре атома кислорода. Найдите относительную молекулярную массу этого вещества.
- 1. Запишем формулу вещества по количеству атомов, указанных в условиях задачи: три атома водорода, один атом фосфора и четыре атома кислорода — H3PO4
- 2. Рассчитаем относительную молекулярную массу фосфорной кислоты, согласно формуле Mr = ∑Ar
- Mr(H3PO4) = 3Ar(H) + 1Ar(P) + 4Ar(O) = 3*1 + 30 + 4*16 = 97
4. Рассчитайте относительные молекулярные массы веществ по их формулам: Br2, H2O, CO2, H2SO4, KOH, BaCl2. Значения относительных атомных масс найдите по таблице Д. И. Менделеева, округлите их до целых чисел (за исключением хлора,Ar(Cl) = 35,5).
Делаем так же, как в предыдущем задании. В итоге должно получиться:
Mr(Br2) = 80*2 = 160
Mr(H2O) = 2*1 + 16 = 18
Mr(CO2) = 12 + 16*2 = 44
Mr(H2SO4) = 1*2 + 32 + 16*4 = 98
Mr(KOH) = 39 + 16 + 1 = 56
Mr(BaCl2) = 137 + 35,5*2 = 208
4. Атом серы образует с атомами кислорода два сложных вещества (их называют оксидами) разного состава. Относительная молекулярная масса первого оксида равна 64, а второго – 80. Выведите формулы этих оксидов.
Итак, у нас есть формула Mr = ∑Ar
Так же мы знаем, что в состав оксидов входит только 1 атом серы. А еще мы знаем относительную атомную массу кислорода. Это позволяет нам вычислить количество атомов кислорода в оксидах по общей формуле:
N (O) = (Mr — Ar (S)) / Ar (O)
где N (O) — количество атомов кислорода;
Mr — относительная молекулярная масса оксида;
Ar (S) — относительная атомная масса серы;
Ar (O) — относительная атомная масса кислорода.
То есть, что мы делаем? Из относительной молекулярной массы оксида сразу вычитаем относительную атомную массу серы. В итоге получаем сумму атомных масс кислорода. Деля полученную величину на относительную атомную массу кислорода мы получим количество атомов кислорода в молекуле.
(64 — 32) / 16 = 2
(80 -32) / 16 = 3
Таким образом, в состав оксида с относительной молекулярной массой 64 входит 2 атома кислорода (SO2), а в оксиде с относительной молекулярной массой 80 уже три атома кислорода (SO3).
5. Не производя расчетов, а только на основании значений относительных атомных масс (найдите их по таблице Д. И. Менделеева) определите, у какого из веществ, формулы которых приведены ниже, наибольшая и наименьшая относительные молекулярные массы:
а) селеноводород H2Se; б) вода Н2О;в) теллуроводород H2Te; г) сероводород H2S.
Все указанные вещества имеют одинаковую общую формулу H2X, где X — элемент. Поэтому разница в относительных молекулярных массах веществ будет равна разнице относительных атомных масс элемента X.
По таблице Менделеева не сложно определить, что самым тяжелым элементом, из входящих в состав задачи, является теллур, с относительной атомной массой 127,6. А самым легким — кислород, с относительной атомной массой 16. Таким образом, наибольшая относительная молекулярная масса будет у теллуроводорода, а наименьшая у воды.
Источник: https://himgdz.ru/gdz-gabrielyan-7-10/
Фосфор пятихлористый — Phosphorus pentachloride
Пентахлорид фосфора является химическим соединением с формулой PCl 5 . Это одна из наиболее важных хлориды фосфора, другие являются PCl 3 и POCl 3 . PCl 5 , может быть использована в качестве хлорирующего реагента. Это бесцветная, чувствительные к влаге и влага твердого вещества , хотя коммерческие образцы могут быть желтоватыми и загрязнены хлористым водородом .
Состав
Структуры хлоридов фосфора неизменно соответствуют VSEPR теории. Структура PCl 5 зависит от его окружающей среды. Газообразный и расплавленный PCl 5 является нейтральной молекулой с тригональной бипирамидальной геометрией и ( D 3h ) симметрией .
Гипервалентная природа этого вида (а также для PCl — 6 , см ниже) можно объяснить с включением не-связывающими молекулярных орбиталей ( теории молекулярных орбиталей ) или резонансом ( валентность теории связей ). Это тригональной бипирамидальная структура сохраняется в неполярных растворителях, таких как CS 2 и CCl 4 .
В твердом состоянии PCl 5 представляет собой ионное соединение , сформулированный PCl + 4 PCl — 6 .
Структура твердого пентахлорида фосфора, иллюстрирующий его автоионизацию при более высоких концентрациях.
В растворах полярных растворителях, PCl 5 подвергается само- ионизации . Разбавленные растворы диссоциируют в соответствии со следующим равновесием:
PCl 5 ⇌ PCl + 4 + Cl —
При более высоких концентрациях, второе равновесие становится все более распространенным:
2 PCl 5 ⇌ PCl + 4 + PCl — 6
Катион PCl + — и анион PCl — 6 является тетраэдрическими и октаэдрическим , соответственно. В свое время, PCl 5 в растворе считалось , чтобы сформировать димерный структуру, P 2 Cl 10 , но это предположение не подтверждается спектроскопических комбинационных измерений.
AsCl 5 и SbCl 5 также принимают тригональные бипирамидальные структуры. Соответствующие длины связей являются 211 м (В-Cl экв ), 221 м (Ас-Cl ах ), 227 ч (Sb-Cl экв ), и 233,3 мкм (Sb-Cl ах ). При низких температурах, SbCl 5 обращенных к димеру, диоктаэдрического Sb 2 Cl 10 , структурно связан с пентахлоридом ниоби .
подготовка
PCl 5 получают путем хлорирования из PCl 3 . Эта реакция используется для производства около 10000 тонн PCl 5 в год (по состоянию на 2000 г.).
PCl 3 + Cl- 2 ⇌ PCl 5 (Δ Н = -124 кДж / моль)
PCl 5 существует в равновесии с PCl 3 и хлора , а также при 180 ° C степень диссоциации составляет около 40%. Из — за это равновесие, образцы PCl — часто содержат хлор, который придает зеленоватый цвет.
Реакции
Гидролиз
В своей наиболее характерной реакции, PCl 5 реагирует при контакте с водой , чтобы выпустить хлористый водород и оксиды фосфора дают. Первым продуктом гидролиза является оксихлорид фосфора :
PCl 5 + Н 2 O → POCl 3 + 2 HCl ,
В горячей воде, гидролиз полностью переходит к ортофосфорной кислоте :
PCl 5 + 4 Н 2 O → H 3 PO 4 + 5 HCl ,
Хлорирование органических соединений
В синтетической химии, два класс хлорирования, как правило , представляет интерес: окислительные chlorinations и замещающих chlorinations. Окислительное chlorinations влечет за собой передачу Cl 2 от реагента к субстрату. Субститутивный chlorinations влечет за собой замену О или ОН — группах с хлоридом. PCl 5 может использоваться для обоих процессов.
После обработки с PCl 5 , карбоновые кислоты преобразовать в соответствующий хлорангидрид . Был предложен следующий механизм:
Он также преобразует спирты в алкилхлориды . Тионилхлорид чаще используется в лаборатории , поскольку полученный в результате диоксид серы более легко отделяются от органических продуктов , чем POCl 3 .
PCl 5 реагирует с третичной амидой, такие как диметилформамид (ДМФА), с получением хлорида dimethylchloromethyleneammonium, которая называется реагент Вильсмайера , [(CH 3 ) 2 N = CClH] Cl.
Более типично, соль , связанные генерируется из реакции ДМФ и POCl 3 .
Такие реагенты могут быть использованы при получении производных бензальдегида формилированием и для превращения С-ОН — групп в С-Cl групп.
Он особенно известен для конверсии C = O групп к CCl 2 групп. Так , например, бензофенон и пентахлорид фосфора реагируют с получением дифенилдихлорметана :
(С 6 Н 5 ) 2 СО + PCl 5 → (С 6 Н 5 ) 2 CCl 2 + POCl 3
Электрофильный характер PCl 5 подсвечивается его реакции с стирола с получением, после гидролиза , фосфоновой кислоты производных.
Оба PCl 3 и PCl 5 конвертировать R — COH группы в хлорангидриде R 3 CCl. Пентахлорид однако источник хлора во многих реакциях. Это chlorinates аллильные и бензильные CH связей.
PCl 5 имеет большее сходство с SO 2 Cl 2 , также является источником Cl 2 .
Для окислительных chlorinations на лабораторном масштабе, сульфурилхлорид часто предпочтительнее , чем PCl 5 , так как газообразный SO 2 побочный продукт легко отделяется.
Хлорирование неорганических соединений
Что касается реакции с органическими соединениями, использование PCl 5 было заменено SO 2 Cl 2 . Реакция пятиокиси фосфора и PCl 5 производит POCl 3 :
6 PCl 5 + Р 4 O 10 → 10 POCl 3
PCl 5 chlorinates диоксида азота с образованием нестабильного хлорида нитрил :
PCl 5 + 2 NO 2 → PCl 3 + 2 NO 2 Cl
2 NO 2 Cl 2 → NO 2 + Cl 2
PCl 5 является предшественником гексафторфосфата лития , LiPF 6 , электролита в литий — ионных батарей . LiPF6 получают путем реакцииPCl5 сфторида лития, схлоридом литиякачестве побочного продукта:
PCl 5 + 6 LiF → LiPF 6 + 5 LiCl
безопасности
PCl 5 является опасным веществом , как он бурно реагирует с водой.
история
Фосфор пятихлористый был первым подготовлен в 1808 году английским химиком Хэмфри Дэви . Анализ Дэви пентахлорида фосфора неточно; первый точный анализ был представлен в 1816 году французский химик Пьер Луи Дюлонга .
Смотрите также
Рекомендации
внешняя ссылка
Источник: https://ru.qwe.wiki/wiki/Phosphorus_pentachloride
Оксид фосфора (V) | справочник Пестициды.ru
Оксид фосфора (V) [P2O5] – соединение фосфора с кислородом, существует в виде димера P4O10 (декаоксид тетрафосфора). Наиболее употребима формула состава P2O5 (пентаоксид фосфора).
Устаревшее название – фосфорный ангидрид. Является действующим веществом всех фосфорсодержащих удобрений
Оксид фосфора – бесцветное аморфное или стекловидное вещество, существующеев трех кристаллических, двух аморфных и двух жидких формах.[1]
Токсичное вещество. Вызывает ожоги кожи и раздражение слизистой оболочки.
Пентаоксид фосфора очень гигроскопичен. Реагирует со спиртами эфирами, фенолами, кислотами и прочими веществами.
В процессе реакции с органическими веществами происходит разрыв связей фосфора с кислородом, и образуются фосфорорганические соединения.
Вступает в химические реакции с аммиаком (NH3) и галогеноводородами с образованием фосфатов аммония и оксигалогенидов фосфора. С основными оксидами образует фосфаты.[3]
Фактически в почве имеются только соли ортофосфорной кислоты H3PO4, но в сложных удобрениях могут быть и соли мета-, пиро- и полифосфорных кислот.[4]
Основой для образования ортофосфорной кислоты является пентаоксида фосфора. Именно поэтому, а так же в связи с тем, что растения не поглощают элементарный фосфор, условлено обозначать концентрацию фосфора через содержание пентаоксида фосфора.[2]
P2O5 + 3H2O → 2H3PO4
Все встречающиеся в почве соли ортофосфорной кислоты и одновалентных катионов (NH4+, Na+, K+) и однозамещенные соли двухвалентных катионов (Ca(H2PO4)2 и Mg(H2PO4)2) растворимы в воде.
Двузамещенные соли двухвалентных катионов в воде не растворимы, но легко растворяются в слабокислых кислотах корневых выделений и органических кислотах жизнедеятельности микроорганизмов. В этой связи они так же являются хорошим источником P2O5 для растений.[4]
Как указывалось выше, в природе основной источник фосфора – это соли ортофосфорнонй кислоты H3PO4. Однако после гидролиза пиро-, поли- и метафосфаты так же используются практически всеми культурами.
- Гидролиз пирофосфата натрия:
- Na4P2O7 + H2O + 2H+ → 2NaH2PO4 +2Na+
- Гидролиз триполифосфата натрия:
- Na5P3O10 + 2H2O + 2H+ → 3NaH2PO4 +2Na+
- Гидролиз метафосфат иона (в кислой среде):
- (PO3)66- + 3H2O → H2P3O103- + H2P2O72- + H2PO4-
Ортофосфорная кислота, будучи трехосновной отдиссоциирует три аниона H2PO—4, HPO42-, PO4 3- .
В условиях слабокислой реакции среды, именно в них возделываются растения, наиболее распространен и доступен первый ион, в меньшей степени второй и практически недоступен третий.
Однако люпин, гречиха, горчица, горох, донник, конопля и другие растения способны усваивать фосфор из трехзамещенных фосфатов.[4]
Некоторые растения приспособились усваивать фосфат-ион из фосфорорганических соединений (фитин, глицефосфаты и прочее).
Корни данных растений выделяют особый фермент (фотофтазу), который и отщипляет анион фосфорной кислоты от органических соединений, а затем растения поглощают этот анион.
К подобного рода растениям относятся горох, бобы, кукуруза. Причем фосфатазная активность возрастает в условиях фосфорного голода.
Многие растения могут питаться фосфором из очень разбавленных растворов, вплоть до 0,01 мг /л P2O5 . Естественно, что удовлетворить потребность в фосфоре растения могут только при условии постоянного возобновления в нем концентрации хотя бы такого же низкого уровня.
Опытным путем установлено, что поглощаемый корнями фосфор прежде всего идет на синтез нуклеотидов, а для дальнейшего продвижения в наземную часть фосфаты вновь поступают в проводящие сосуды корня в виде минеральных соединений.[4]
- В некоторых случаях требуется рассчитать процентное содержание фосфора в удобрении, если дано содержание по P2O5. Расчет производится по формуле:
- y = x,% × 30,974 (молярная масса P) × 2 / 30,974 (молярная масса P) × 2 + 15,999 (молярная масса O) × 5
- где:
- х – содержание P2O5 в удобрении, %;
- y – содержание P в удобрении, %
- Или:
- y = x, % × 0,43643
- Например:
- в удобрении содержится 40% оксида фосфора
- для пересчета процентного содержания элемента фосфор в удобрении нужно умножить массовую долю оксида в удобрении на массовую долю элемента в оксиде (для P2O5 – 0,43643): 40 * 0,43643 = 17,4572 %
Составители: Григоровская П.И., Товпеко А.
Последнее обновление: 21.09.13 04:49
Литературные источники:
1.
Ван Везер «Фосфор и его соединения». Монография. т. 1.: Изд-во иностранной литературы, М., 1962.
2.
Калинский А.А., Вильдфлуш И.Р., Ионас В.А. и др. – Агрохимия в вопросах и ответах – Мн.: Урожай,1991. – 240 с.: ил.
3.
Химическая энциклопедия: в пяти томах: т.1: А-Дарзана/Редкол.: Кнунянц И.Л. (гл. ред.) и др. – М.: Советская энциклопедия, 1988. – 623.: ил
4.
Ягодин Б.А., Жуков Ю.П., Кобзаренко В.И. Агрохимия / Под редакцией Б.А. Ягодина.– М.: Колос, 2002.– 584 с.: ил (Учебники и учебные пособия для студентов высших учебных заведений).
Свернуть Список всех источников
Источник: http://www.pesticidy.ru/dictionary/phosphorus_oxide




