Соляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода (HCl) в воде, сильная одноосновная кислота.
Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω = 0,5 % присутствует в желудке человека, что соответствует pH = pω − lg ( ρH2O / μHCl ) ≅ 0,86.
Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³. Соли соляной кислоты называются хлоридами.
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес),кг HCl/кг | Конц. (г/л),кг HCl/м³ | Плотность,кг/л | МолярностьM | Водородный показатель (pH) | Вязкость,мПа·с | Удельная теплоемкость,кДж/(кг·К) | Давление пара,Па | Температура кипения,°C | Температура плавления,°C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
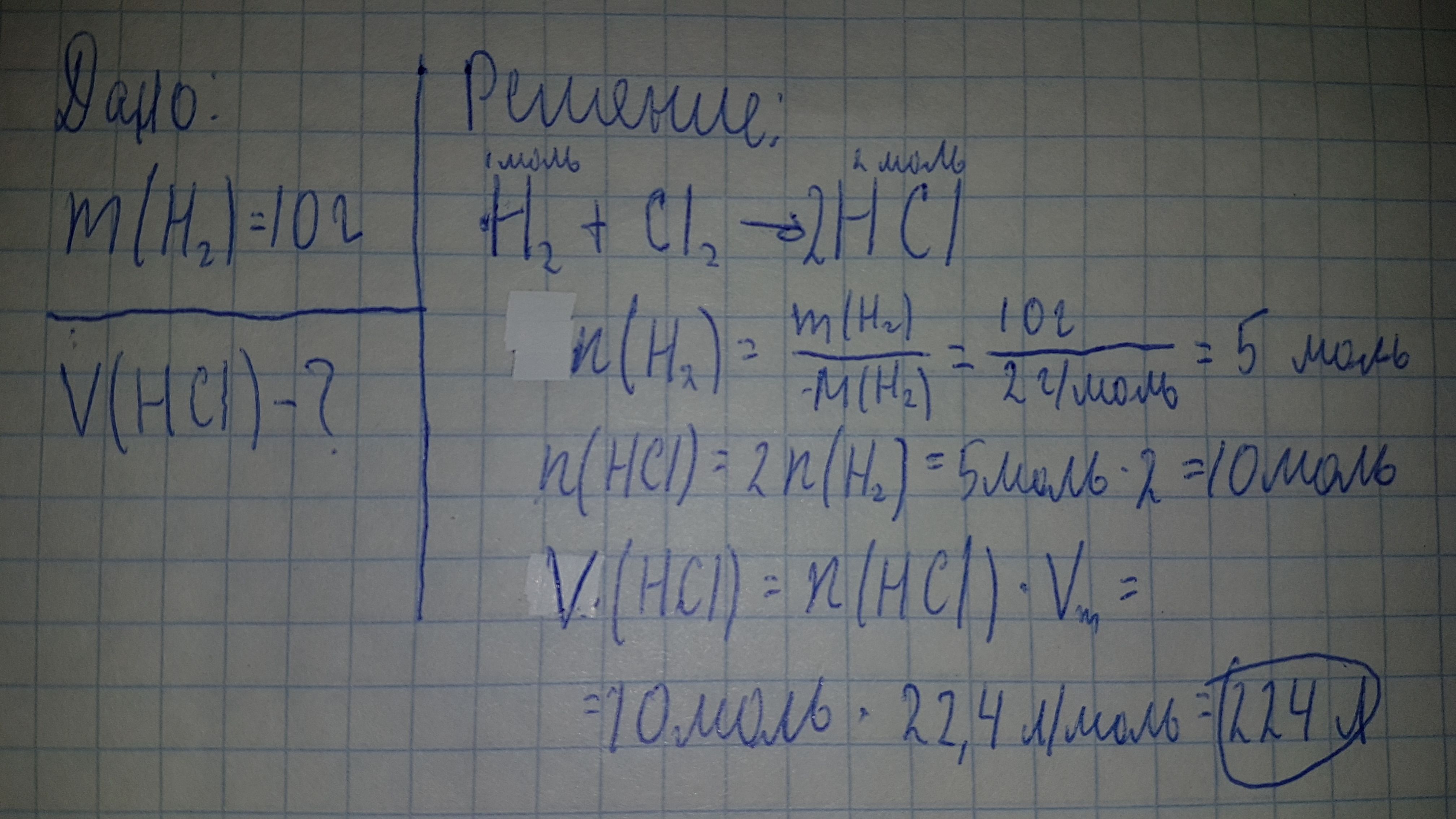
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2Na + 2HCl ⟶ 2NaCl + H2 ↑Mg + 2HCl ⟶ MgCl2 + H2 ↑2Al + 6HCl ⟶ 2AlCl3 + 3H2 ↑
- Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
Na2O + 2HCl ⟶ 2NaCl + H2O MgO + 2HCl ⟶ MgCl2 + H2OAl2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
NaOH + HCl ⟶ NaCl + H2O Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2OAl(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2 ↑
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
2KMnO4 + 16HCl ⟶ 5Cl2 ↑ + 2MnCl2 + 2KCl + 8H2O
- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
NH3 + HCl ⟶ NH4Cl
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
HCl + AgNO3 → AgCl ↓ + HNO3

Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
NaCl + H2SO4 →150oC NaHSO4 + HCl
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
2NaCl + H2SO4 →550oC Na2SO4 + 2HCl
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
MgCl2 ⋅ 6H2O →t,oC MgO + 2HCl + 5H2OAlCl3 ⋅ 6H2O →t,oC Al(OH)3 + 3HCl + 3H2O
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
MgCl2 + H2O → Mg2OCl2 + HCl
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
 Перевозка соляной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Перевозка соляной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
Основная статья: Кислотность желудочного сока
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.

Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
- При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
- Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
- В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.

Источник: https://chem.ru/soljanaja-kislota.html
Молекулярная масса соляной кислоты равна |
 ( ) ( ) |
| Общие |
| Хлороводородная кислота |
| H2O:HCl |
| HCl |
| бесцветная жидкость |
| 36.46 г/моль |
| 1.19 г/см³ |
| Температура |
| -30 °C |
| 48 °C |
| Энтальпия |
| -605.22 кДж/моль |
| -10 |
| Растворимость |
| смешивается |
| 7647-01-0 |
| 933-977-5 |
| E507 |
| MW4025000 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
| Медиафайлы на Викискладе |
Соля́ная кислота́ (также хлороводоро́дная, хлористоводоро́дная кислота) — раствор хлороводорода ( HCl >> ) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
Содержание
История [ править | править код ]
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis ). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты.
В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав.
Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород.
В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия [1] .
Физические свойства [ править | править код ]
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л),кг HCl/м³ | Плотность,кг/л | Молярность,M | Водородный показатель (pH) | Вязкость,мПа·с | Удельнаятеплоемкость,кДж/(кг·К) | Давлениепара,Па | Т. кип.,°C | Т. пл.,°C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)
При низкой температуре хлороводород с водой даёт кристаллогидраты составов HCl ⋅ H 2 O >> (т. пл. −15,4 °С), HCl ⋅ 2 H 2 O >> (т. пл. −18 °С), HCl ⋅ 3 H 2 O >> (т. пл. –25 °С), HCl ⋅ 6 H 2 O >> (т. пл. −70 °С). При атмосферном давлении (101,3 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием HCl >> 20,4 мас. % [2] .
Химические свойства [ править | править код ]
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
2NaCl + H2 ^>>>»> 2 Na + 2 HCl ⟶ 2 NaCl + H 2 ↑ >2NaCl + H2 ^>>>»/> , MgCl2 + H2 ^>>>»> Mg + 2 HCl ⟶ MgCl 2 + H 2 ↑ >MgCl2 + H2 ^>>>»/> , 2AlCl3 + 3H2 ^>>>»> 2 Al + 6 HCl ⟶ 2 AlCl 3 + 3 H 2 ↑ >2AlCl3 + 3H2 ^>>>»/> .
- Взаимодействие с оксидамиметаллов с образованием растворимой соли и воды:
2NaCl + H2O>>>»> Na 2 O + 2 HCl ⟶ 2 NaCl + H 2 O >2NaCl + H2O>>>»/> , MgCl2 + H2O>>>»> MgO + 2 HCl ⟶ MgCl 2 + H 2 O >MgCl2 + H2O>>>»/> , 2AlCl3 + 3H_2O>>>»> Al 2 O 3 + 6 HCl ⟶ 2 AlCl 3 + 3 H 2 O >2AlCl3 + 3H_2O>>>»/> .
- Взаимодействие с гидроксидамиметаллов с образованием растворимой соли и воды(реакция нейтрализации):
NaCl + H2O>>>»> NaOH + HCl ⟶ NaCl + H 2 O >NaCl + H2O>>>»/> , BaCl2 + 2H_2O>>>»> Ba ( OH ) 2 + 2 HCl ⟶ BaCl 2 + 2 H 2 O >BaCl2 + 2H_2O>>>»/> , AlCl3 + 3H_2O>>>»> Al ( OH ) 3 + 3 HCl ⟶ AlCl 3 + 3 H 2 O >AlCl3 + 3H_2O>>>»/> .
- Взаимодействие с солямиметаллов, образованных более слабыми кислотами, например угольной:
2NaCl + H2O + CO2 ^>>>»> Na 2 CO 3 + 2 HCl ⟶ 2 NaCl + H 2 O + CO 2 ↑ >2NaCl + H2O + CO2 ^>>>»/> .
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
5Cl_2 ^ + 2MnCl2 + 2KCl + 8H2O>>>»> 2 KMnO 4 + 16 HCl ⟶ 5 Cl 2 ↑ + 2 MnCl 2 + 2 KCl + 8 H 2 O >5Cl_2 ^ + 2MnCl2 + 2KCl + 8H2O>>>»/> .
NH4Cl>>>»/> .
- Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[4] :
AgCl v + HNO3>>>»> HCl + AgNO 3 ⟶ AgCl ↓ + HNO 3 >AgCl v + HNO3>>>»/> .
Получение [ править | править код ]
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов.
Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре.
Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
- В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
- ^< ext>]NaHSO4 +HCl>>> [150
- При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
- ^< ext>]Na2SO4 +2HCl>>> [550
- Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
- ^< ext>]MgO +2HCl +5H2O>>>»> MgCl 2 ⋅ 6 H 2 O → t , ∘ C MgO + 2 HCl + 5 H 2 O >> [t,
- ^< ext>]Al(OH)3 +3HCl +3H2O>>>»> AlCl 3 ⋅ 6 H 2 O → t , ∘ C Al ( OH ) 3 + 3 HCl + 3 H 2 O >> [t,
- Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
- Mg2OCl2 + 2HCl>>>»> 2 MgCl 2 + H 2 O ⟶ Mg 2 OCl 2 + 2 HCl > Mg2OCl2 + 2HCl>>>»/> [5]
- Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl , что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение [ править | править код ]
Промышленность [ править | править код ]
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина [ править | править код ]
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения [ править | править код ]
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен [6] .
Молярная масса соляной кислоты
Во втором случае оно представляет собой бесцветный газ, хорошо растворимый в воде, а в первом – раствор сильной кислоты (35-36%). Строение молекулы соляной кислоты, а также её структурная формула приведены на рис. 1. Плотность – 1,6391 г/л (н.у.). Температура плавления равна – (-114,0 o С), кипения – (-85,05 o С).
Рис. 1. Структурная формула и пространственное строение молекулы соляной кислоты.
Брутто-формула соляной кислоты – HCl. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
- Mr(HCl) = Ar(H) + Ar(Cl);
- Mr(HCl) = 1 + 35,5 = 36,5.
- Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
- Это означает, что молярная масса соляной кислоты равна 36,5 г/моль.
Молярную массу вещества в газообразном состоянии можно определить, используя понятие о его молярном объеме. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества, а затем вычисляют массу 22,4 л этого вещества при тех же условиях.
Для достижения данной цели (вычисление молярной массы) возможно использование уравнения состояния идеального газа (уравнение Менделеева-Клапейрона):
где p – давление газа (Па), V – объем газа (м 3 ), m – масса вещества (г), M – молярная масса вещества (г/моль), Т – абсолютная температура (К), R – универсальная газовая постоянная равная 8,314 Дж/(моль×К).
Примеры решения задач
Задание Составьте формулу оксида азота, если массовая доля азота в нём – 30%, а кислорода – 70%. Решение Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (азот) и «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева округлим до целых чисел):
Значит формула соединения азота с кислородом будет иметь вид NO2. Это оксид азота (IV).
Ответ
NO2Задание Определите формулу гидроксида железа, если массовые доли составляющих его элементов равны 62,2% (Fe), 35,6% (О) и 2,2% (Н). Решение Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (железо), «у» (водород), «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
- x:y:z = ω(Fe)/Ar(Fe) : ω(H)/Ar(H) : ω(O)/Ar(O);
- x:y:z= 62,2/56 : 2,2/1: 35,6/16;
- x:y:z= 1,1 : 2,2: 2,225 = 1 : 2 : 2.
- Значит формула гидроксида железа будет иметь вид Fe(OH)2.
- В нашей проектной организации Вы можете заказать расчет массы соляной кислоты на основании технологического задания и/или технологической схемы производственного процесса.
- ‘);> //—> Справочные данные:
- Плотность соляной кислоты = 1190 кг/м3 (при нормальных условиях).
- Молярная масса соляной кислоты = 36.46 г/моль
Плотность соляной кислоты может изменяться в зависимости от условий окружающей среды (температура и давление). Точное значение плотности соляной кислоты в зависимости от условий окружающей среды смотрите в справочной литературе.
Определить массу соляной кислоты не сложно. На этой странице представлен самый простой онлайн калькулятор расчета массы соляной кислоты. С помощью этого калькулятора в один клик вы можете вычислить массу соляной кислоты, если известны его плотность и объем.
Монитор пишет неоптимальный режим что делать
Источник: http://es-provodnik-app.ru/molekuljarnaja-massa-soljanoj-kisloty-ravna/
Соляная Кислота
Хлороводородная кислота
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Формула Соляной Кислоты в химии: HCl. В молекуле атомы водорода соединяются с атомами галогена – Cl. Если рассмотреть электронную конфигурацию этих молекул, то можно отметить, что в образовании молекулярных орбиталей соединения принимают участие 1s-орбитали водорода и обе 3s и 3p-орбитали атома Cl.
В химической формуле Соляной Кислоты 1s-, 3s- и 3р-атомные орбитали перекрываются и образуют 1 , 2 , 3 -орбитали. При этом 3s-орбиталь не носит связывающий характер.
Наблюдается смещение электронной плотности к атому Cl и снижается полярность молекулы, но увеличивается энергия связи молекулярных орбиталей (если рассматривать ее в ряду с другими галогеноводородами).
Физические свойства хлористого водорода. Это прозрачная бесцветная жидкость, обладающая способностью дымиться при соприкосновении с воздухом. Молярная масса химического соединения = 36,6 грамма на моль.
При стандартных условиях, при температуре воздуха 20 градусов Цельсия, максимальная концентрация вещества составляет 38% по массе. Плотность концентрированной хлороводородной к-ты в такого рода растворе составляет 1,19 г/см³.
В целом же, физические свойства и такие характеристики, как плотность, молярность, вязкость, теплоемкость, температура кипения и pН , сильно зависят от концентрации раствора. Эти величины подробнее рассматриваются в таблице плотностей.
Например, плотность Соляной Кислоты 10% = 1,048 кг на литр. При затвердевании вещество образует кристаллогидраты разных составов.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H.
С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует хлорид натрия и воду.
Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. Карбонат кальция и карбонат натрия будут образовывать после реакции с HCl хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца, перманганатом калия: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
Вещество реагирует с аммиаком, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония.
Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца: MnO2+4HCl=Cl2+MnO2+2H2O (реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра выпадает белый осадок хлорида серебра и образуется азотная к-та. Уравнение реакции взаимодействия метиламина с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl.
Вещество реагирует со слабым основанием анилином. После растворения анилина в воде к смеси прибавляют Соляную Кислоту.
В результате основание растворяется и образует солянокислый анилин (хлорид фениламмония): (С6Н5NH3)Cl. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3.
Уравнение реакции карбоната калия с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде.
Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота).
При производстве данного химического соединения применяют ГОСТ 3118 77 – на реактивы и ГОСТ 857 95 – для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия или магния.
Во время реакции могут образоваться оксихлориды переменного состава.
Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
- его используют в гидрометаллургии, при декапировании и травлении;
- при очистке металлов при лужении и пайке;
- в качестве реактива для получения хлорида марганца, цинка, железа и других металлов;
- при изготовлении смесей с ПАВ-ами для очистки металлических и керамических изделий от инфекции и грязи (применяется Кислота Соляная ингибированная);
- в качестве регулятора кислотности E507 в пищевой промышленности, в составе содовой воды;
- в медицине при недостаточной кислотности желудочного сока.
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду.
Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия и прочими окислителями, то образуется токсичный газ — хлор.
На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Фармакологическое действие
Повышает кислотность желудочного сока.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl.
Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока.
Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые витамины и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН.
Активирует пепсиноген, переводит его в активный фермент пепсин. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник.
Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, изжога и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Показания к применению
Вещество входит в состав синтетических моющих средств, концентрата для полоскания ротовой полости ухода за контактными линзами. Разбавленная Соляная Кислота назначается при заболеваниях желудка, сопровождающихся пониженной кислотностью, при гипохромной анемии в сочетании с препаратами железа.
Противопоказания
Лекарство нельзя применять при аллергии на синтетическое вещество, при болезнях пищеварительного тракта, ассоциированных с повышенной кислотностью, при остром гастрите.
Побочные действия
Концентрированная Соляная Кислота при попадании на кожу, в глаза и дыхательные пути может вызывать сильные ожоги. В составе различных лек. препаратов используют разбавленное вещество, при длительном применении больших дозировок может возникнуть ацидоз, ухудшение состояния эмали зубов.
Инструкция по применению (Способ и дозировка)
Хлороводородную кислоту применяют в соответствии с инструкцией.
Внутрь лекарство назначают, предварительно растворив в воде. Обычно используют 10-15 капель препарата на пол стакана жидкости. Лекарство принимают во время еды, 2-4 раза в день. Максимальная разовая дозировка составляет 2 мл (около 40 капель). Суточная доза – 6 мл (120 капель).
Передозировка
Случаи передозировки не описаны. При бесконтрольном приеме вещества внутрь в больших количествах возникают язвы и эрозии в пищеварительном тракте. Следует обратиться за помощью к врачу.
Взаимодействие
Вещество часто используют в комбинации с пепсином и прочими лек. препаратами. Химическое соединение в пищеварительном тракте вступает во взаимодействие с основаниями и некоторыми веществами (см. химические свойства).
Особые указания
При лечении препаратами Соляной Кислоты необходимо четко придерживаться рекомендаций в инструкции.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Для промышленных целей используют Кислоту Соляную ингибированную (22-25%). В медицинских целях применяют раствор: Хлористоводородная кислота разведенная. Также вещество содержится в концентрате для полоскания ротовой полости Паронтал, в растворе для ухода за мягкими контактными линзами Биотру.
Отзывы
В Интернете часто можно встретить вопросы, как сделать Соляную Кислоту в домашних условиях и где взять Соляную Кислоту? Вещество часто приобретают для хим. лабораторий и промышленных целей. Отзывов о применении средства внутрь мало.
- “… С возрастом стала беспокоить проблема с желудком и проблемы с пищеварением. Поставили диагноз – гастрит и атрофия слизистой желудка. Врачи назначили пить ферментные лекарства с Соляной Кислотой. Сейчас я прохожу курс лечения, есть первые улучшения в состоянии”;
- “… Мне назначали это лекарство при пониженной кислотности. Но я решила, что буду лечиться более щадящими методами. Пью настой из перечной мяты, мед, растворенный в воде”.
Цена Соляной кислоты, где купить
Где купить Соляную Кислоту ингибированную? Где можно купить Соляную Кислоту в Москве? Купить в розницу данное вещество для технических целей может быть достаточно сложно. На рынке предлагают приобрести средство по приблизительной цене за литр – 20 рублей, но в больших объемах. Указать стоимость препарата для приема внутрь на данный момент невозможно.
Источник: https://medside.ru/solyanaya-kislota
Формула соляной кислоты
- Определение и формула соляной кислоты
- ОПРЕДЕЛЕНИЕ
- Соляная кислота (хлороводородная кислота, хлористоводородная кислота, хлористый водород) – раствор хлороводорода ( mathrm{HCl} ) в воде.
- Формула соляной кислоты
- Формула – ( mathrm{HCl} )
- Молярная масса равна 36,46 г/моль.
- Физические свойства – бесцветная едкая жидкость, на воздухе «дымит».
- Техническая соляная кислота имеет желтый цвет из-за наличия примесей железа, хлора и других веществ
Максимальная концентрация в растворе при ( 20^{circ} mathrm{C} ) равна 38%, плотность этого раствора 1,19 г/см3. Молярная масса 36,46 г/моль.
- Соляная кислота – сильная одноосновная кислота, константа диссоциации.
- Образует соли – хлориды.
- Химические свойства соляной кислоты
- Взаимодействует с металлами, находящимися в электрохимическом ряду напряжений до водорода с образованием соответствующих хлоридов и выделением водорода:
- ( Z n+2 H C l=Z n C l_{2}+H_{2} uparrow )
- Взаимодействует с оксидами металлов с образованием растворимых солей и воды:
- ( M g O+2 H C l=M g C l_{2}+H_{2} O )
- Взаимодействует с гидроксидами металлов с образованием растворимых хлоридов и воды:
- ( A l(O H)_{3}+3 H C l=A l C l_{3}+3 H_{2} O )
- Взаимодействует с солями металлов, образованных более слабыми кислотами:
- ( mathrm{Na}_{2} mathrm{CO}_{3}+2 mathrm{HCl}=2 mathrm{NaCl}+mathrm{H}_{2} mathrm{O}+mathrm{CO}_{2} uparrow )
- Реагирует с сильными окислителями (перманганатом калия, диоксидом марганца) с выделением хлора:
- ( 2 K M n O_{4}+16 H C l=5 C l_{2} uparrow+2 M n C l_{2}+2 K C l+8 H_{2} O )
- Реагирует с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
- ( N H_{3}+H C l=N H_{4} C l )
- Качественной реакцией на соляную кислоту и её соли является реакция с нитратом серебра, в результате которой образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
- ( H C l+A g N O_{3}=A g C l downarrow+H N O_{3} )
- Получают соляную кислоту растворением газообразного хлороводорода в воде.
- Применение
Соляная кислота применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов металлов (цинка, марганца, железа и др.). Смеси соляной кислоты с ПАВ используются для очистки керамических и металлических изделий от загрязнений и дезинфекции.
В пищевой промышленности соляная кислота используется в качестве регулятора кислотности ( mathrm{pH} ) , пищевой добавки E507 . Является естественной составной частью желудочного сока человека.
Концентрированная соляная кислота – едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание кислоты в глаза. Для нейтрализации ожогов применяют раствор слабой щёлочи (питьевой соды).
- Примеры решения задач
- ПРИМЕР 1
- Задание
- Вычислить нормальность раствора соляной кислоты, если на титрование 20 мл его израсходовано 19,2 мл 0,1 н раствора едкого натра.
- Решение
- Запишем уравнение реакции титрования:
- ( H C l+N a O H=N a C l+H_{2} O )
- Запишем закон эквивалентов для данного процесса титрования:
- ( V_{N a O H} cdot N_{N a O H}=V_{H C l} cdot N_{H C l} )
- Выразим нормальную концентрацию раствора соляной кислоты:
- ( N_{H C l}=frac{V_{N a O H} cdot N_{N a O H}}{V_{H C l}}=frac{19,2 cdot 0,1}{20}=0,096 )
- Ответ
- Нормальность раствора соляной кислоты равна 0,096 н.
- ПРИМЕР 2
- Задание
Раствор соляной кислоты ( mathrm{HCl} ) объемом 1,8 мл (плотность 1,18 г/мл) с массовой долей вещества 36%, разбавили водой до 1 литра. Найти ( _{1} mathrm{pH} ) полученного раствора.
- Решение
- Запишем уравнение диссоциации соляной кислоты:
- ( H C l=H^{+}+C l^{-} )
- Найдем массу исходного раствора соляной кислоты по формуле:
- ( m=
ho cdot V ) - где (
ho ) – плотность раствора, ( mathrm{V} ) – объем раствора. - ( m_{p-p a}=1,18 cdot 1,8=2,124 г. )
- Найдем массу соляной кислоты в растворе. Выражение для массовой доли вещества в растворе:
- ( omega=frac{m_{b-b a}}{m_{p-p a}} )
- Если раствор соляной кислоты 36%, то массовая доля соляной кислоты в нем будет равна 0,36.
- Выразим массу соляной кислоты:
- ( m_{H C l}=omega cdot m_{p-p a}=0,36 cdot 2,124=0,765 )
- Учитывая, что молярная масса соляной кислоты равна 36,5 г/моль, рассчитаем количество вещества ( mathrm{HCl} ) в растворе
- ( n_{H C l}=frac{m_{H C l}}{M_{H C l}}=frac{0,765}{36,5}=0,021 ) моль
- Поскольку исходный объем раствора разбавили водой до 1 л, найдем молярную концентрацию полученного раствора соляной кислоты по формуле:
- ( C_{M}(H C l)=frac{n_{H C l}}{V}=frac{0,021}{1}=0,021 ) моль/л
- Соляная кислота является сильной кислотой, диссоциирует в водном растворе полностью, поэтому концентрация ионов водорода будет равна концентрации кислоты:
- ( left[H^{+}
ight]=M(H C l)=0,021 ) моль/л - рН раствора рассчитывается по формуле:
- ( p H=-l gleft[H^{+}
ight]=-lg (0,021)=1,678=1,678 ) - Ответ
- рН полученного раствора равен 1,678
Нужны оригинальность, уникальность и персональный подход? Закажи свою оригинальную работу УЗНАТЬ СТОИМОСТЬ
Источник: https://sciterm.ru/spravochnik/formula-solyanoj-kisloti/
Соляная кислота — это… Что такое Соляная кислота?
- СОЛЯНАЯ КИСЛОТА — (НСl), водный раствор хлороводорода, бесцветного газа с резким запахом. Получают действием серной кислоты на поваренную соль, как побочный продукт хлорирования углеводородов, или реакцией водорода и хлора. Соляная кислота используется, для… … Научно-технический энциклопедический словарь
- Соляная кислота — – HCl (СК) (хлористоводородная кислота, хлороводородная кислота, хлористый водород) – это раствор хлороводорода (НСl) в воде, противоморозная добавка. Представляет собой бесцветную жидкость с резким запахом, без взвешенных частиц.… … Энциклопедия терминов, определений и пояснений строительных материалов
- СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) раствор хлористого водорода в воде; сильная кислота. Бесцветная, дымящая на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20 .С) 38% по массе,… … Большой Энциклопедический словарь
- СОЛЯНАЯ КИСЛОТА — (Acidum muriaticum, Acid, hydrochloricum), раствор хлористого водорода (НС1) в воде. В природе встречается в воде нек рых источников вулканического происхождения, а также находится в желудочном соке (до 0,5%). Хлористый водород может быть получен … Большая медицинская энциклопедия
- СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
- СОЛЯНАЯ КИСЛОТА — (хлористоводородная кислота) НСl водный раствор хлористого водорода, сильная одноосновная кислота, летучая, с резким запахом; примеси железа, хлора окрашивают её в желтоватый цвет. Поступающая в продажи концентрированная С. к. содержит 37 %… … Большая политехническая энциклопедия
- соляная кислота — сущ., кол во синонимов: 1 • кислота (171) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
- СОЛЯНАЯ КИСЛОТА — СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Современная энциклопедия
- Соляная кислота — СОЛЯНАЯ КИСЛОТА, водный раствор хлористого водорода HCl; дымящая на воздухе жидкость с резким запахом. Применяют соляную кислоту для получения различных хлоридов, травления металлов, обработки руд, в производстве хлора, соды, каучуков и др.… … Иллюстрированный энциклопедический словарь
- соляная кислота — (хлороводородная кислота), раствор хлороводорода в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость (техническая соляная кислота желтоватая из за примесей Fe, Cl2 и др.). Максимальная концентрация (при 20°C) 38% по массе,… … Энциклопедический словарь
Источник: https://dic.academic.ru/dic.nsf/ruwiki/201





