


Уникальное в своем роде вещество считается одним из самых распространенных во всей Вселенной, уступая пальму первенства в своем объеме только водороду, ведь его доля составляет около 23 процентов от общей массы этого безграничного пространства. Близкие к рекордным показатели демонстрируют и другие физические свойства гелия, которые стоит рассмотреть более подробно.
Физические особенности
Химический элемент относят к практически полностью инертным газам, он не является токсичным и не имеет вкуса и запаха.
Одиночное строение атома гелия остается таковым при любых условиях, чего не скажешь о других его характеристиках, зависящих от атмосферного давления, температурного режима и многих других параметров.
Самый легкий идеальный газ после водорода, гелий обладает следующими физическими свойствами:
- Молярная масса атома газа составляет 4,002601 грамма на моль. Что касается молярного объема, то этот показатель равен 31,81 сантиметра кубических на моль, тогда как молярная теплоемкость составляет 20,79 Дж/Кмоль.
- Плотность вещества напрямую зависит от температурного режима, соответствуя 0,147 грамма на сантиметр кубический при падении столбика термометра ниже отметки в минус 270 градусов Цельсия и 0,000117846 градуса при нагревании до плюс 20 градусов и выше.
- Температура кипения у гелия является наиболее низкой, если сравнивать его с любым другим химическим элементом. Так, вещество имеет свойство закипать при температуре, равной 4,2152 Кельвина, что эквивалентно минус 268,94 градуса Цельсия.
- Температурный режим плавления соответствует 0,95 Кельвина или минус 272,2 градуса Цельсия при давлении, равном 2,5 МПа. При этом удельная теплота плавления составляет 0,0138 килоДжоуля на моль при удельной теплоте испарения 0, 0829 кДж/моль.
- Получение вещества в твердом виде становится возможным только при атмосферном давлении выше 25 атмосфер, тогда как при любых других показателях (даже нулевых) он не переходит в эту фазу.
- Гелий, найденный в природных условиях, всегда состоит из двух изотопов стабильного типа, один из которых имеет высокий процент распространения, близком к сотне, тогда как другой встречается гораздо реже, причем в совершенно разных естественных источниках (до 0,00014%). Помимо прочего, науке известны еще как минимум 6 радиоактивных гелиевых изотопов искусственного происхождения.

Стоит отметить, что для качественного определения вещества сегодня используется анализ эмиссионного спектра излучения, тогда как для количества применимым остается хроматографическое и масс-спектрометрическое тестирование. Кроме того, актуальными являются простейшие методы идентификации, подразумевающие измерение таких основных параметров, как плотность, молярная масса и теплопроводность.
Гелий в своем газообразном состоянии очень тяжело растворяется в воде (гораздо сложнее, чем любой другой газ).
Так, в литре воды, температура которой составляет 20 градусов Цельсия, объем растворимого газа составляет не более 8,8 миллилитра из 100.
Еще худшую растворимость можно наблюдать в этиловом спирте, так как ее показатель не превышает 2,8 мл/л при 15-градусной температуре и 3,2 мл при нагревании этанола до 25 градусов Цельсия.
А вот скорость диффузии гелия превышает актуальный для воздуха показатель в три раза, опережая даже водород, у которого коэффициент проникаемости ниже на 65%. Абсолютным рекордсменом гелий является и по коэффициенту преломления, максимально приближаясь к единице. Эффект Джоуля — Томсона у гелия имеет отрицательное значение в нормальной среде из-за его слишком быстрого охлаждения.
Что касается остывания в процессе дросселирования, то оно становится возможным только при 40 К и нормальном атмосферном давлении.
Если же температура продолжит опускаться, то становится возможным переход гелия из газообразного в жидкое состояние, но только при условии применения охлаждения расширительного типа, обеспечить которое реально только с помощью специального преобразователя относительной потенциальной энергии в механическую.
Химические свойства
Гелий является наименее активным элементом из всех известных, относясь к 18-й группе периодической таблицы и имея общепринятое обозначение He.
Такой же является и химическая формула гелия (электронная состоит из двух протонов и такого же количества нейтронов, дающих массовое число 4), который имеет в своей основе кристаллическую решетку гексагонального типа с параметрами 3,570 для показателя a и 5,84 для c, дающих соотношение 1,633. Что касается других химических характеристик вещества, то среди них стоит выделить:
- Величина ковалентного радиуса равна 28 пм при радиусе иона, соответствующем 93 пм.
- Уровень электроотрицательности по шкале Полинга соответствует 4,5 баллам.
- Электродный потенциал, как степени окисления, а следовательно, и валентность элемента имеют нулевые значения.
- Энергия ионизации первого электрона равна 2361,3 кДж/моль.
- Показатель теплопроводности элемента соответствует 300 К.
- Молекулярная ионная энергия равна 58 ккал/моль.
- Равновесное расстояние между ядрами химически связанных элементов соответствует 1,09 А.
Что касается соединений вещества, то сегодня известной является его связь LiHe. Сам элемент имеет свойство образовывать двухатомные молекулы фторида и хлорида, обозначение первого из которых HeF, а второго HeCl, притом что их получение становится возможным только при воздействии электрического разряда или УФ-излучения на смесь описываемого элемента с фтором или хлором, соответственно.
Совершенно другими свойствами обладает гелий в газообразном состоянии. Не последнюю роль в этом вопросе играет воздействие на газ различного рода физических и химических процессов.
К примеру, если пропустить ток через трубочку с гелием, то можно наблюдать его радужное свечение, сила которого будет зависеть от создаваемого давления в закрытом пространстве.
Если же не прибегать к подобным приемам, то останется один только желтый спектр, считающийся привычным для гелия в его нормальном состоянии.
Ввиду содержания в веществе нескольких линий спектра по мере уменьшения атмосферного давления происходит изменение его цветового излучения, которое начинает меняться от желтого к оранжевому, розовому и зеленому.
Всего же учеными принято выделять два основных спектра — единичный и триплетный, первый из которых свойственен атомам в их нормальном состоянии.
Что касается перехода в триплетное состояние, то он становится возможным только при использовании разряда в 19,77 эВ.

Вывести атом из его привычного состояния можно и другими методами воздействия, один из которых заключается в искусственно созданном столкновении с другими атомами вещества с последовательной передачей энергии между ними.
А вот обратный переход из триплетного состояния в синглетное естественным путем практически невозможен.
Такое состояние называется метастабильным и для того, чтобы перевести газ в стандартное положение вновь, приходится прибегать к различным методам внешнего воздействия.
Интересные факты о гелии
Название элемента происходит от греческого «Гелиос», что означает «Солнце» и латинского «гелиум», притом что второе наименование было выбрано отнюдь не случайно.
Так, не секрет, что окончание «ум» применяется по отношению к металлам, к которым и относился гелий на момент своего открытия.
И хотя на самом деле вещество является неметаллом, иногда его так и называют по-латыни, что не является ошибкой.
Немного истории
Сегодня уже мало кто вспомнит, что открытие элемента произошло еще 18 августа 1868 года, когда известный французский ученый решил исследовать солнечную хромосферу в момент полного затмения звезды в одном из индийских городов. Примечательно, что всего лишь через 3 месяца такое же открытие было сделано в Англии, правда, тогда о его неактуальности еще никто не знал, ввиду более сложной корреспонденции научных данных.
В 1881 году итальянский вулканолог Луиджи Пальмери, исследовавший Везувий, также идентифицировал это вещество, поспешив сообщить о своей находке общественности.
Но самое важное событие в области открытия гелия произошло 27 годами позже, когда он был впервые выявлен в недрах планеты.
Тогда газ удалось добыть из такого распространенного минерала, как клевеит, и со временем именно он использовался учеными для того, чтобы установить величину его удельного веса и других физических параметров.

Со временем исследователи научились получать гелий в жидком виде, для чего впервые довелось применить процедуру дросселирования.
В отличие от этого попытки добывать твердый гелий долгое время не увенчивались успехом.
Ситуация изменилась только в 1926 году, когда вдобавок к охлаждению было применено и критическое понижение атмосферного давления до 35 атм, в результате чего удалось выделить кристаллическую решетку вещества.
Получение и применение
Удивительно, но, несмотря на свое внушительное распространение во всей Вселенной, гелий довольно редко встречается на Земле.
Разной является и природа образования этого элемента на Земле и в космосе, так как в первом случае его выделение происходит за счет распада альфа-частиц тяжелых элементов.
В итоге часть вещества проходит через земные породы, сливаясь с природным газом и демонстрируя концентрацию от 7 процентов от общего объема и выше.
В настоящее время месторождения, в которых наблюдаются большие залежи гелия, имеются на территории таких стран, как Индия, Бразилия, Россия и Танзания.
Естественно, речь идет о гелийсодержащих газах, которые используются в промышленности для выведения чистого элемента или его производных.
Для этого применяется процедура охлаждения посредством дросселирования, и в этом случае сложность разжижения элемента в значительной мере облегчает процесс.
На выходе удается получить смесь, состоящую не только из гелия, но и из водорода и неона, после чего производится очистка. В итоге доля сырого гелия будет составлять около 70−90 процентов от общего объема.
После финишной фильтрации продукт, который, как известно, не может гореть, а следовательно, и не представляет никакой угрозы, транспортируясь в металлических баллонах, изготовленных в соответствии с ГОСТ 949–73 .
Если же стоит вопрос о перевозке сжиженного газа, то в ход идут специальные сосуды марки СТГ-10 и СТГ-25.

Что касается применения, то гелий используется в следующих сферах:
- Металлургия.
- Пищевая промышленность.
- Для изготовления хладагентов для различных агрегатов и рабочих установок.
- Для наполнения различных судов воздухоплавания и шариков.
- В дайвинге для приготовления дыхательных смесей, необходимых для погружения.
- В ракетных установках в качестве одной из составляющих теплоносителя.
- Для наполнения трубок газорезного типа.
- В сфере газовой хроматографии.
- Для поиска утечек в трубопроводах и всевозможных инфраструктурных установках.
Естественно, на этом применение элемента не заканчивается, ввиду чего производство гелия является очень развитым и востребованным в настоящее время.

Среди прочих преимуществ газа — его высокие перспективы в сфере термоядерной энергетики, благо, мировые запасы гелийсодержащих веществ не позволяют отнести его в разряд дефицитного.
Так, современные эксперты называют цифру в 45,6 миллиарда метров кубических, притом что объемы производства перевалили за 110 миллионов еще в 2003 году.
Источник: https://nauka.club/khimiya/geliy.html
Гелий, свойства атома, химические и физические свойства
![]()
![]()
![]()
![]()
He 2 Гелий
4,002602(2) 1s2
Гелий — второй элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 2. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), первом периоде периодической системы.
Атом и молекула гелия. Формула гелия. Строение атома гелия
- Изотопы и модификации гелия. Гелий-I и гелий-II
- Свойства гелия (таблица): температура, плотность, давление и пр.
- Физические свойства гелия
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием
Получение гелия
Применение гелия
Таблица химических элементов Д.И. Менделеева
Атом и молекула гелия. Формула гелия. Строение атома гелия:
Гелий (He, лат. helium) – химический элемент VIII группы короткой формы (18-й группы длинной формы) периодической системы химических элементов первого периода системы химических элементов Д. И. Менделеева, с атомным номером 2.
Гелий возглавляет группу инертных газов в периодической таблицы химических элементов Д. И. Менделеева.
- Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
- Молекула гелия одноатомна.
- Химическая формула гелия He.
Электронная конфигурация атома гелия 1s2. Потенциал ионизации (первый электрон) атома гелия равен 24,47 эВ (2361,3 кДж/моль).
Строение атома гелия. Атом гелия состоит из положительно заряженного ядра (+2), вокруг которого по атомной оболочке (s-орбитали) движутся два электрона. Поскольку гелий расположен в первом периоде, оболочка всего одна. В свою очередь ядро атома гелия состоит из двух протонов и двух нейтронов.
Радиус атома гелия составляет 31 пм.
Атомная масса атома гелия 4,002602(2) а. е. м. (г/моль).
Гелий – практически инертный химический элемент.
Изотопы и модификации гелия. Гелий-I и гелий-II:
Изотопы гелия – разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре.
Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Остальные представляют собой шесть искусственных радиоактивных изотопа.
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость – 99,99986 %) и гораздо более редкого 3He (0,00014 %, содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах).
Гелий в атмосфере, почти весь состоящий из тяжёлого нуклида 4He, является продуктом α-распада тяжёлых радиоактивных элементов (урана, тория, актиния), лишь незначительная его часть является реликтовой (то есть захваченной миллиарды лет назад уплотнявшейся космической пылью, из которой образовалась Земля). Ежегодно накапливается в доступных для изучения толщах Земли и вод (25-28)⋅106 м³ гелия.
Содержание 3He в выделенном из атмосферы гелии ничтожно мало, отношение 3He/4He для воздуха равно 1,1⋅10−6, а для гелия из природных газов 1,4⋅10−7. Установлено, что 3He получается в результате β-распада тяжёлого нуклида водорода – трития, который образуется в ряде ядерных реакций в земной коре и верхних слоях атмосферы.
- Звёздный гелий (гелий Вселенной) – продукт термоядерной реакции синтеза ядер водорода, протекающей на Солнце и звездах по протон-протонному и углеродно-азотному циклам.
- Искусственно получены также другие – тяжёлые радиоактивные изотопы гелия с массовыми числами 5-10:
- – 5He, состоящий из двух протонов и трех нейтронов,
- – 6He, состоящий из двух протонов и четырех нейтронов,
- – 7He, состоящий из двух протонов и пяти нейтронов,
- – 8He, состоящий из двух протонов и шести нейтронов.
- – 9He, состоящий из двух протонов и семи нейтронов.
- – 10He, состоящий из двух протонов и восьми нейтронов.
Свойства гелия (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Гелий/ Helium |
| Символ | Нe |
| Номер в таблице | 2 |
| Тип | Неметалл |
| Открыт | Норман Локьер, Англия, 1868 г., Жюль Жансен, Франция, 1868 г. |
| Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| Содержание в земной коре | 5,5×10-10 % |
| Содержание в океане | 7,2×10-10 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 4,002602(2) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 |
| Радиус атома | 31 пм |
| Химические свойства | |
| Степени окисления | |
| Валентность | |
| Ковалентный радиус | 28 пм |
| Радиус иона | 93 пм |
| Электроотрицательность | 4,5 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 2361,3 кДж/моль (24,47 эВ) |
| Электродный потенциал | |
| Физические свойства | |
| Плотность (при +20 °C и нормальных условиях, состояние вещества газ) | 1,7846×10-4 г/см3 |
| Плотность (при –269 °C и нормальных условиях, состояние вещества жидкость) | 0,13 г/см3 |
| Температура плавления (при 2,5 МПа) | -272,2 °C (0,95 K) |
| Температура кипения | -268,928 °C (4,222 K) |
| Уд. теплота плавления (энтальпия плавления ΔHпл) | 0,0138 кДж/моль |
| Уд. теплота испарения (энтальпия кипения ΔHкип) | 0,0829 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 31,8 см³/моль |
| Теплопроводность (при 300 K) | 0,152 Вт/(м·К) |
| Критическая температура | -267,95 °C |
| Критическое давление | 0,229 МПа |
| Критическая плотность | 0,0693 г/см3 |
| Давление паров | 1 мм.рт.ст. (при -271,9°C), 10 мм.рт.ст. (при -271,4°C), 100 мм.рт.ст. (при -270,5°C) |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 126,04 Дж/(моль·K) |
| Стандартная мольная теплоемкость Cp (при 298 К, для состояния вещества – газ) | 20,79 Дж/(моль·K) |
| Диэлектрическая проницаемость | 1,000068 (при 0°C), 1,0555 (при -271,095°C) |
| Электропроводность в твердой фазе | |
| Сверхпроводимость при температуре | |
| Твёрдость | |
| Структура решётки | гексагональная |
| Параметры решётки | a = 3,570 Å, c = 5,84 Å |
| Отношение c/a | 1,633 |
| Температура Дебая |
Физические свойства гелия:
При стандартных температуре и давлении гелий – бесцветный, не имеющий запаха и вкуса, нетоксичный, инертный одноатомный газ с химической формулой He.
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом.
Гелий – лёгкий газ. Гелий легче воздуха в 7,26 раза, но тяжелее водорода. Так, один кубический метр воздуха, который состоит из смеси разных газов, весит 1,293 кг, а один кубический метр гелия 0,178 кг. Поэтому, например, мыльные пузыри, наполненные гелием, на воздухе стремятся вверх. Один кубический метр гелия может поднять предмет массой 1,115 кг.
Плотность гелия (Нe) составляет 0,00017846 г/см3 при 20 °C и нормальных условиях, а при –269 °C плотность жидкого гелия составляет 0,13 г/см3.
Теплопроводность гелия при 300 K составляет 0,152 Вт/(м·К). Гелий обладает большей теплопроводностью, чем у всех других газов, за исключением водорода. Теплопроводность гелия примерно в 6,255 раз выше теплопроводности воздуха – 0,0243 Вт/(м·К).
Гелий (Нe) почти не растворяется в воде и органических растворителях. Так, растворимость гелия в воде составляет 0,000179 г/100 г (при температуре 30 °C).
- Гелий не растворяется в металлах, как, например, водород.
- Скорость диффузии гелия сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
- При обычных условиях и выше −250 °С при расширении гелий разогревается, а не охлаждается как большинство газов (“нормально” он начинает себя вести ниже −250 оС).
- Температура кипения гелия (Нe) составляет −268,928 °C.
Точка кипения гелия (T = 4,222 K для 4He) наименьшая среди всех веществ. При атмосферном давлении гелий не переходит в твёрдую фазу даже при абсолютном нуле.
При 2,17 К и обычном давлении гелий претерпевает фазовый переход второго рода (от гелия I к гелию II), сопровождающийся резким изменением ряда свойств: теплоемкости, вязкости, плотности. Для гелия II (ниже 2,17 K) характерна сверхтекучесть – способность протекать без трения через узкие щели (размером менее 100 нм).
У гелия-II отсутствует вязкость. Гелий II также обладает огромной теплопроводностью. Поэтому в отличие от бурно кипящего гелия I, выглядит как спокойная жидкость с ясно видимым мениском.
Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
Наглядно сверхтекучесть жидкого гелия проявляется, например, в ходе следующего опыта. Если сверхтекучий жидкий гелий налить в сосуд, он начнет вытекать наружу через его края в направлении более высокой температуры, даже если уровень жидкости сильно ниже краев этого сосуда.
Жидкий гелий практически не растворяет другие вещества.
Гелий – единственное вещество не затвердевающее при обычном давлении даже вблизи 0 K, он кристаллизуется только под давлением выше 2,5 МПа. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Температура плавления гелия (Нe) при давлении 2,5 МПа составляет −272,2 °C.
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску.
По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра.
Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия.
Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Критические параметры гелия (Нe) очень низкие: критическая температура гелия − 267,95 °C и критическое давление гелия 0,229 МПа. Этим объясняются трудности при сжижении гелия.
Скорость звука в гелии (Нe) составляет: 1056 м/с (при 30 °C, состояние вещества – газ), 965 м/с (при 0 °C, состояние вещества – газ), 237,66 м/с (при -272,165 °C, состояние вещества – жидкость), 231,4 м/с (при -271,39 °C, состояние вещества – жидкость), 221,7 м/с (при -270,97 °C, состояние вещества – жидкость), 223,3 м/с (при -270,65 °C, состояние вещества – жидкость), 179,8 м/с (при -268,93 °C, состояние вещества – жидкость).
Динамическая вязкость гелия (Нe) составляет: 0,0188 мПа·с (при 0°C, состояние вещества – газ), 0,0229 мПа·с (при 100°C, состояние вещества – газ), 0,0269 мПа·с (при 200°C, состояние вещества – газ), 0,0342 мПа·с (при 400°C, состояние вещества – газ),
0,0407 мПа·с (при 600°C, состояние вещества – газ).
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием:
- При нормальных условиях гелий химически инертен.
- Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние.
- Например, гелий образует двухатомные молекулы He+2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Получение гелия:
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя его свойство сжижаться труднее всех остальных газов.
Жидкий гелий впервые получен в 1908 г., твердый – в 1926 г.
Применение гелия:
- Гелий используется во многих областях промышленности и быту:
- – в металлургии в качестве защитного инертного газа для выплавки чистых металлов;
- – в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
- – в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
- – для наполнения воздухоплавающих судов (дирижаблей и аэростатов). В отличие от водорода гелий в силу негорючести абсолютно безопасен;
- – в дыхательных смесях для глубоководного погружения;
- – для наполнения воздушных шариков и оболочек метеорологических зондов;
- – для заполнения газоразрядных трубок;
- – как компонент рабочего тела в гелий-неоновых лазерах;
- – в качестве носителя в газовой хроматографии;
- – и пр.
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-




- карта сайта
- гелий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле гелия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/geliy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Молекула литий-гелия: не кантовать
Молекула литий-гелия LiHe — одна из самых хрупких известных молекул. Её размер более, чем в десять раз, превосходит размер молекул воды.
 Условное строение атомов гелия (слева) и лития (справа).© The University of Birmingham
Условное строение атомов гелия (слева) и лития (справа).© The University of Birmingham
Как известно, нейтральные атомы и молекулы могут образовывать друг с другом более менее устойчивые связи тремя способами. Во-первых, при помощи ковалентных связей, когда два атома разделяют одну или несколько общих электронных пар. Ковалентные связи — самые сильные из трёх. Характерная энергия их разрыва равна обычно нескольким электрон-вольтам.
Заметно слабее ковалентных водородные связи.
Это притяжение, возникающее между связанным атомом водородом и электроотрицательным атомом другой молекулы (обычно таким атомом является кислород или азот, реже фтор).
Несмотря на то, что энергия водородных связей в сотни раз меньше, чем ковалентных, именно они во многом определяют физические свойства воды, а также играют важнейшую роль в органическом мире.
И наконец, самым слабым является так называемое ван-дер-ваальсовое взаимодействие. Иногда его также называют дисперсным. Оно возникает в результате диполь-дипольного взаимодействия двух атомов или молекул. При этом диполи могут как быть изначально свойственны молекулам (например, дипольный момент есть у воды), так и индуцироваться в результате взаимодействия.
 Условная схема, поясняющая, как возникают дисперсионные силы.© The University of Akron
Условная схема, поясняющая, как возникают дисперсионные силы.© The University of Akron
Характерная энергия ван-дер-ваальсовой связи — единицы кельвин (электрон-вольт, упоминавшийся выше, соответствует приблизительно 10 000 кельвин). Самой слабой из ван-дер-ваальсовых является связь между двумя индуцированными диполями.
Если имеется два неполярных атома, то в результате теплового движения у каждого из них имеется некий осциллирующий случайным образом дипольный момент (электронная оболочка как бы немного дрожит относительно ядра).
Эти моменты, взаимодействуя друг с другом, в результате преимущественно имеют такие ориентации, чтобы два атома начали притягиваться.
Наиболее инертным из всех атомов является гелий. Он не вступает в ковалентные связи ни с одним другим атомом. При этом и величина его поляризуемости очень мала, то есть и дисперсные связи ему образовывать сложно. Имеется, однако, одно важное обстоятельство.
Электроны в атоме гелия настолько сильно связаны ядром, что его можно, не опасаясь возникновения отталкивающих сил, подносить очень близко к другим атомам — вплоть до расстояния порядка радиуса этого атома.
Дисперсные же силы растут с уменьшением дистанции между атомами очень быстро — обратно пропорционально шестой степени расстояния!
Отсюда родилась идея: если сблизить два атома гелия друг с другом, то между ними всё-таки возникнет хрупкая ван-дер-ваальсова связь. Это, действительно удалось реализовать в середине 1990-х, хотя и потребовало значительных усилий. Энергия такой связи составляет всего 1 мК, и молекула He₂ была зарегистрирована в незначительных количествах в сверхохлаждённых струях гелия.
При этом свойства молекулы He₂ во многом уникальны и необычны. Так, например, её размер составляет… около 5 нм! Для сравнения, размер молекулы воды — около 0,1 нм.
При этом минимум потенциальной энергии молекулы гелия приходится на значительно меньшее расстояние — около 0,2 нм — однако, большую часть времени — около 80% — атомы гелия в молекуле проводят в режиме туннелирования, то есть в области, где в рамках классической механики они находиться не могли бы.
 Приблизительно так выглядит молекула гелия.Среднее расстояние между атомами намного превосходит их размеры.
Приблизительно так выглядит молекула гелия.Среднее расстояние между атомами намного превосходит их размеры.
© Institut für Kernphysik, J. W. Goethe Universität
Следующий по размерам после гелия атом — это литий, поэтому после получения молекулы гелия, естественным стало изучение возможности зафиксировать связь между гелием и литием. В 2013 году, наконец, учёным удалось сделать и это.
У молекулы литий-гелия LiHe энергия связи повыше, чем у гелий-гелия — 34±36 мК, а расстояние между атомами наоборот поменьше — около 2,9 нм. Однако и в этой молекуле атомы большую часть времени находятся в классически запрещённых состояниях под энергетическим барьером.
Интересно, что потенциальная яма для молекулы LiHe настолько мала, что она может существовать только в одном колебательном энергетическом состоянии, являющемся правда расщеплённым из-за спина атома ⁷Li дублетом.
Её константа вращения же настолько велика (около 40 мК), что возбуждение вращательного спектра приводит к разрушению молекулы.
 Потенциалы обсуждаемых молекул (сплошные кривые) и квадрат модуля волновых функций атомов в них (штриховые кривые). Отмечены также точки PM — минимум потенциала, OTP — внешняя точка разворота для низшего энергетического уровня, MIS — средневзвешенное расстояние между атомами.© Brett Esry/Kansas State University
Потенциалы обсуждаемых молекул (сплошные кривые) и квадрат модуля волновых функций атомов в них (штриховые кривые). Отмечены также точки PM — минимум потенциала, OTP — внешняя точка разворота для низшего энергетического уровня, MIS — средневзвешенное расстояние между атомами.© Brett Esry/Kansas State University
Пока что полученные результаты интересны исключительно с фундаментальной точки зрения. Однако уже вызывают интерес для смежных областей науки. Так, гелиевые кластеры из многих частиц могут стать инструментом изучения эффектов запаздывания в вакууме Казимира.
Изучение гелий-гелиевого взаимодействия важно и для квантовой химии, которая могла бы на этой системе тестировать свои модели.
И, конечно, не вызывает сомнений, что учёные придумают и другие интересные и важные приложения для таких экстравагантных объектов как молекулы He₂ и LiHe.
Источник: https://zen.yandex.ru/media/id/592ec39be3cda8c8f17c6169/59441eda1410c3b791c1f58f
Молекула He2 • Задачи
Размер молекулы димера гелия был впервые определен в 1995 году. Эксперименты были выполнены по первой методике, причем в них использовался целый набор наноситечек с отверстиями от 98 до 410 нм.
Измерения показали, что среднее расстояние между атомами гелия в димере составляет 62 ± 10 ангстрема.
Это совершенно гигантская величина для атомной физики; напомним, что диаметр одного атома гелия — меньше 1 ангстрема!
Вторая методика была экспериментально реализована в 2000 году и дала чуть меньшее и более точное значение 52 ± 4 ангстрема. Отметим, что этот способ является в каком-то смысле неразрушающим: даже столь хрупкие молекулы отклоняются от первоначального направления движения, не разваливаясь, за счет своих волновых свойств.
Здесь полезно еще раз взглянуть на рис. 2. Тот факт, что среднее расстояние между атомами гелия в димере составляет примерно 52 ангстрема, вовсе не означает, что атомы крутятся друг относительно друга именно на таком расстоянии. На самом деле, два атома размазаны в очень широком диапазоне расстояний: от нескольких до нескольких сотен (!) ангстрем. На рис.
5 показана теоретически рассчитанная волновая функция димера в зависимости от межатомного расстояния. Интересно отметить, что такое аномально широкое и несимметричное распределение приводит к тому, что среднее (то есть средне-взвешенное) межатомное расстояние совсем не совпадает с наиболее вероятным расстоянием (при котором волновая функция имеет максимум).

Настолько размазанная молекула — явление совершенно необычное для атомной физики, и потому экспериментаторы долго искали способ не только измерить среднее межатомное расстояние, но и прощупать сам профиль волновой функции. Это удалось сделать совсем недавно, в прошлом году, с помощью так называемого кулоновского взрыва молекулы.
Когда молекула поглощает фотон, из нее быстро вылетает один или несколько электронов. В данном случае удавалось с помощью одного фотона выбить по одному электрону из каждого атома гелия. В результате от химической связи не оставалось и следа: два иона гелия начинали сильно отталкиваться друг от друга и разлетались в разные стороны.
По углам и скоростям вылета электронов и ядер можно восстановить то, в каком состоянии находились ядра в момент ионизации.
Последняя любопытная вещь, которую тут стоит упомянуть, относится к изотопам гелия. Все описанные эксперименты проводились с гелием-4. Более легкий изотоп гелия, гелий-3, вообще не образует димеров. Химическая связь He–He в нём такая же, но квантовое дрожание атомов гелия-3 сильнее, и поэтому они не способны удержаться вместе.
Для того чтобы удержать атомы гелия-3 в компактном кластере, требуется не два, не три, не четыре, а примерно 30 атомов. Только тогда их взаимное притяжение оказывается достаточно сильным, чтобы удерживать атомы вместе. Выражаясь поэтично, можно сказать, что гелий-3 — это вещество, которое начинается не с молекул, а с капелек.
Источник: https://elementy.ru/problems/156/Molekula_He_2
Строение атома
Слово атом на греческом языке означает “неделимый”. Учение о том, что в природе все вещества состоят из мельчайших частиц — атомов, возникло благодаря усилиям древнегреческих философов в V-IV в.в. до н.э., а в XVII-XVIII в.в.
химики экспериментально доказали справедливость этой теории, показав, что есть предел по расщеплению отдельных веществ на составляющие части.
Однако в конце XIX века физики обнаружили, что атом не является неделимым, а состоит из некоторых элементарных частиц: каким сегодня представляют строение атома физики?

В 1897 г. английский физик Джозеф Джон Томсон в результате экспериментов по изучению электрического разряда в газах, фотоэффекта и термоэлектронной эмиссии обнаружил, что при соударениях атомов в плазме электрического разряда, при нагревании вещества или освещении его ультрафиолетовым (коротковолновым) светом из атомов любого химического элемента вылетают одинаковые отрицательно заряженные частицы. Эти частицы назвали электронами. Электрический заряд e отдельного электрона впервые измерил американский физик Роберт Милликен в 1909 г. Он оказался действительно одинаковым у всех электронов и равным 1,6*10-19 К.
Обнаружение электронов в составе атомов любого химического элемента было первым доказательством сложной структуры атомов. На основе полученных результатов Томсон первым, в 1897 г., предложил схему строения атома.
Рис. 1. Модель атома Томсона – пудинг.
Модель атома, предложенную Томсоном, иногда, для наглядности, называют “пудингом” — английским мучным десертом, в массе которого равномерно распределены изюм или другие ягоды.
Томсон полагал, что атом имеет форму шара, состоящего из равномерно распределенного положительного заряда. Внутри этого положительно заряженного объема находятся вкрапления (“изюминки”) электронов. В целом получается, что атом электрически нейтрален.
Томсон также предположил, что когда электроны колеблются относительно центра шара, то атом излучает свет.
Однако эта модель не смогла дать объяснения последовавшим далее экспериментам и открытиям.
В 1896 г. французский ученый Анри Беккерель исследовал соли урана. Он обнаружил, что атомы урана испускают не видимые глазом излучения, проникающие через бумагу, и вызывающие почернение фотографической пластинки.
Явление испускания атомами невидимых проникающих излучений назвали радиоактивностью.
Рис. 2. Радиоактивный распад. Открытие Беккереля.
Дальнейшие исследования этого явления показали, что радиоактивные атомы испускают не один тип излучения, а три вида излучений различной физической природы. Эти излучения назвали альфа-, бета- и гамма-лучами.
Альфа-лучи α оказались потоком положительно заряженных ионов гелия 4He2, бета-лучи β — потоком электронов, гамма-лучи γ — потоком квантов электромагнитного излучения с очень малой длиной волны, порядка 10-11 – 10-13 м.
Англичане Эрнест Резерфорд и Фредерик Содди доказали, что в результате радиоактивного распада происходит превращение атомов одного химического элемента в атомы другого химического элемента. Например атом урана 235U92 в результате распада превращается в два атома — атом тория 232Th90 и атом гелия 4He2.
Открытие радиоактивного распада окончательно опровергло представление о неизменности, неделимости атомов, что долгое время считалось общей характеристикой для всех атомов.
В 1932 г. английский физик Джеймс Чедвик экспериментально доказал, ядро атома состоит не только из протонов, но и из нейтронов — частиц, не имеющих электрического заряда. Протон и нейтрон притягиваются друг к другу с помощью сильного ядерного взаимодействия. Число нейтронов в ядре равно числу протонов.
Эрнест Резерфорд поставил серию экспериментов, которые позволили ему сделать выдающееся открытие — понять как устроена структура атома. В этих опытах он изучал рассеяние заряженных α – частиц при прохождении через тонкие слои золотой фольги (толщиной порядка 0,1 мкм).
За фольгой на экране располагался экран, покрытый слоем сульфида цинка (сульфида цинка ZnS), способного светиться от ударов быстрых заряженных частиц. Было обнаружено, что большинство α – частиц отклоняется от прямолинейного пути на углы не более 1-20.
Но небольшая доля частиц отклонялась на значительно большие углы.
Рис. 3. Опыт Резерфорда. Планетарная модель атома.
Получив основные сведения из поставленных экспериментов, Резерфорд пришел к следующим выводам:
- Рассеяние α – частиц на большие углы вызвано тем, что положительный заряд в атоме распределен неравномерно, как полагал Томсон, а сосредоточен в центре атома. В этой центральной положительно заряженной части атома — атомном ядре — сосредоточена почти вся масса атома. Резерфорд рассчитал радиус атомного ядра, который оказался равен примерно 10-15 м;
- Атом устроен подобно космической системе планет. Электроны вращаются вокруг атомного ядра как планеты нашей солнечной системы вращаются вокруг Солнца;
- Радиус круговой орбиты самого далекого от ядра электрона равен радиусу атома;
- При столкновении с электронами, масса которых мала, α–частицы отклоняются на небольшие углы;
- Однако в тех случаях, когда быстрая заряженная частица пролетает вблизи от атомного ядра, то под действием сильного электрического поля ядра (положительно заряженного) может произойти отклонение (рассеяние) α–частицы на большие углы, вплоть до 1800.
Эта модель, названная планетарной, позволила объяснить основные закономерности рассеяния заряженных частиц.
Планетарная модель дала объяснение далеко не всем физическим явлением. Дальнейшее развитие модели Резерфорда было сделано датским физиком Нильсом Бором, что привело к созданию нового раздела физики — квантовой механики.
Итак, мы узнали как возникли и развивались представления об атомах. Модель Томсона не смогла объяснить многие экспериментальные данные.
Но открытие им электронов, а также опыты Беккереля с радиоактивными веществами, окончательно развеяли представления о неделимости атомов.
Планетарная модель атома Резерфорда, построенная им на сновании экспериментов, позволила понять огромное количество явлений в физике, химии и биологии.
Средняя оценка: 4.2. Всего получено оценок: 155.
Источник: https://obrazovaka.ru/fizika/stroenie-atoma-shema-s-obyasneniyem.html
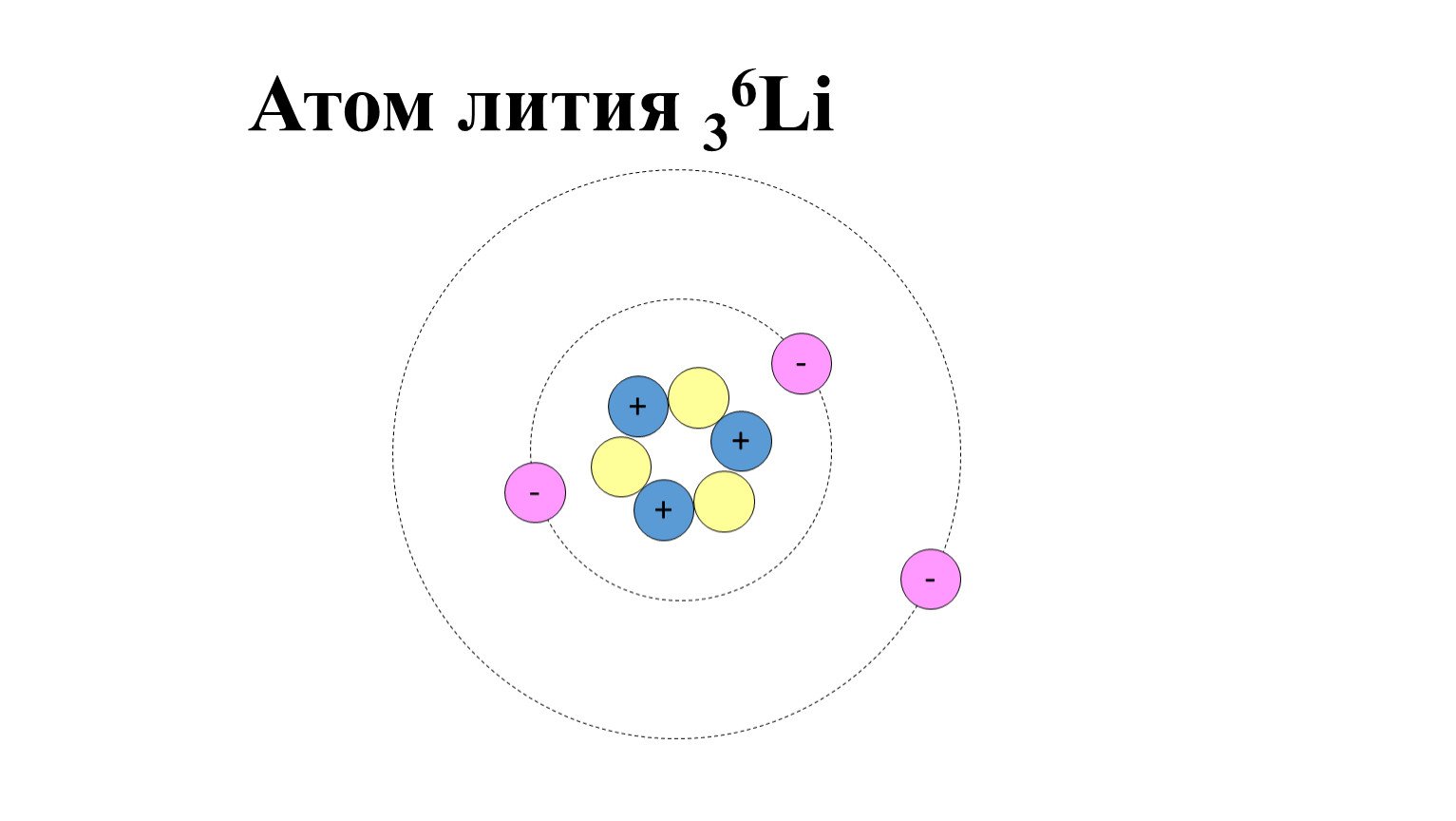
Строение атома Гелия
10-11 класс
В него входят два протона и два нейтрона и два электрона.
Атом гелия или элемент гелий Не имеет порядковое число 2 и массовое число 4.
Оболочка атома образована ЭЛЕКТРОНАМИ. Они вращаются с большой скоростью в шарообразной области вокруг атомного ядра. Эту область называют электронной оболочкой атома
Электроны имеют отрицательный электрический заряд и обладают очень малой массой. Отрицательный заряд соответствует по величине положительному заряду протонов в ядре атома. В атоме число электронов и протонов одинаково, атом по отношению к внешней среде является электрически нейтральным. С помощью противоположных по знаку зарядов электроны удерживаются на своих орбитах
Электроны группируются в электронные оболочки, которых вокруг ядра может быть до семи. Они находятся от ядра на различных расстояниях. В каждой электронной оболочке может быть определенное максимальное число электронов. Во внутренней оболочке может быть 2 электрона
Ответить
SpartachokarmiАрмида / 23 апр. 2014 г., 12:59:54
Помогите пожалуйста задачу по физике очень надо
1 Автомобиль массой 10 т движется со скоростью 28,8 км/ч и останавливается при торможении. Сколько теплоты выделилось во время торможения, если вся кинетическая энергия его обратилась во внутреннюю?
Dobkinadarya / 17 сент. 2014 г., 12:16:09
1.Расчитайте энергию связи ядра атома гелия. Масса протона 1,0073 а.e.м. масса нейтрона 1,0087 а.е.м., маса изотопа гелия 4,00260 а.е.м. 2. Сколько
нуклонов в ядре атома олова 3.Сколько нейтронов и протонов содержит ядро атома алюминия 4.
Для нейтрального атома цинка, определите: а) зарядовое число, б) число протонов, в) заряд ядра, г) число электронов, е) масовое число ядра, ж) число нуклонов, з) число нейтронов, д) массу ядра в а.е.м.
5) В ядро какого элемента превратилось ядро стронция, испытав В-распад ( запишите реакцию) 6) Ядро изотопа нептуния испытало два А и три В распада, определите массовое число нового элемента и зарядовое число
Вы находитесь на странице вопроса «Строение атома Гелия«, категории «физика«. Данный вопрос относится к разделу «10-11» классов.
Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории «физика«.
Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Источник: https://fizika.neznaka.ru/answer/3050917_stroenie-atoma-gelia/




