


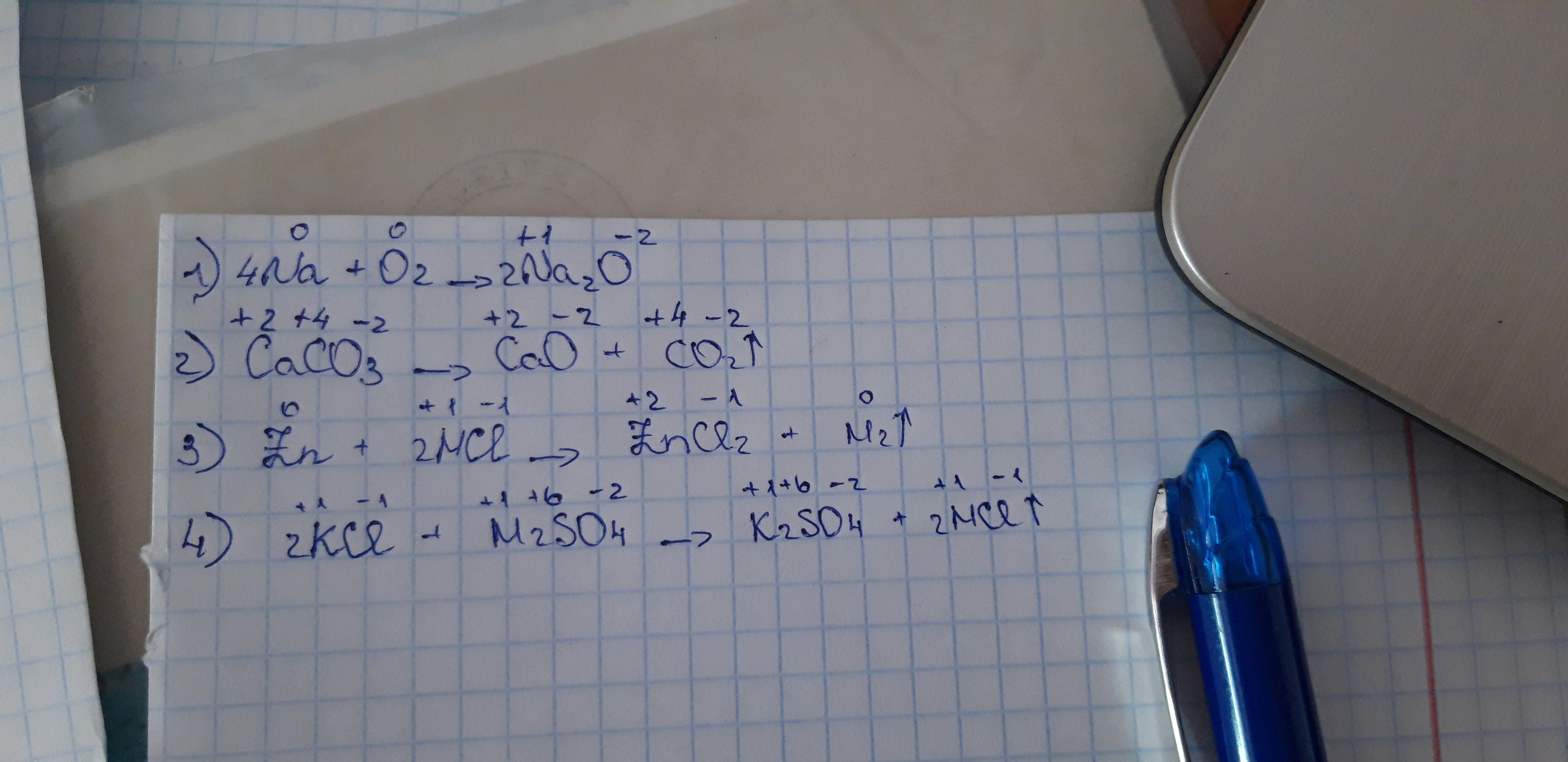




Классификация солеобразующих оксидов Солеобразующие оксиды Основные: К 2 О, Са. О, Cu. O, Mn. O. Амфотерные: Be. O, Zn. O, Pb. O, Sn. O, Al 2 O 3, Cr 2 O 3, Pb. O 2, Sn. O 2 Гидратная форма – основание. Гидратная форма К 2 О — КОН, амфотерный Са. О — Са(ОН)2, гидроксид Cu. O -Cu(OH)2, Mn. O — Mn(OH)2 Кислотные: СО 2, SO 3, Cr. O 3, Mn 2 O 7 Гидратная форма -кислота. СО 2 — H 2 CO 3, SO 3 -H 2 SO 4, Cr. O 3 — HCr. O 4, Mn 2 O 7 -HMn. O 4
Химические свойства оксидов Основные оксиды. • Оксид + вода=основание (щелочь). Растворимы в воде только оксиды щелочных и щелочноземельных металлов. • K 2 O+H 2 O= 2 KOH • Ba. O+H 2 O= Ba(OH)2
2. Основной оксид+ кислотный оксид= соль • Mg. O+CO 2 =Mg. CO 3 • Li 2 O+N 2 O 5=2 Li. NO 3
3. Основной оксид + кислота= соль+вода • Cu. O+H 2 SO 4= Cu. SO 4+H 2 O • Fe. O+2 HCl=Fe. Cl 2+ H 2 O
Кислотные оксиды. Это оксиды неметаллов и металлов в высшей степени окисления.
1. Кислотный оксид+вода = кислота. • В воде растворяются все кислотные оксиды кроме Si. O 2. • SO 3+H 2 O=H 2 SO 4, • N 2 O 5 +H 2 O=2 HNO 3 • Cr. O 3 +H 2 O= H 2 Cr. O 4, • Mn 2 O 7 +H 2 O=2 HMn. O 4
2. Кислотный оксид+основной=соль • Приведите примеры.
3. Кислотный оксид+основание=соль+вода • Si. O 2+2 KOH=K 2 Si. O 3+H 2 O • N 2 O 5+Ca(OH)2= Ca(NO 3)2+H 2 O
Амфотерные оксиды. Оксиды металлов, которые в зависимости от условий могут проявлять свойства либо кислотных, либо основных оксидов. Ве. О, Zn. O, Pb. O, Sn. O, Al 2 O 3, Cr 2 O 3, Pb. O 2, Sn. O 2
Свойства • В воде нерастворимы. • могут растворяться как в кислотах (проявляют основные свойства), так и в щелочах (проявляют кислотные свойства).
В качестве гидратной формы им могут соответствовать как кислота, так и основание • Zn(OH)2 Zn. O Al(OH)3 Al 2 O 3 H 2 Zn. O 2 H 3 Al. O 3
Свойства амфотерных оксидов. Амфотерный оксид + Основной оксид = соль • Be. O+K 2 O=K 2 Be. O 2 сплавление
2. Амфотерный оксид+щелочь= соль + вода • Al 2 O 3+Na. OH(тв. )=Na. Al. O 2+H 2 O сплавление • Cr 2 O 3+6 Na. OH(р-р)+3 H 2 O = 2 Na 3[Cr(OH)6] Na. Al. O 2 — метаалюминат натрия Na 3[Al(OH)6]-гексагидроксоалюминат натрия
3. Амфотерный оксид+кислотный оксид=соль • Zn. O+SO 3=Zn. SO 4 4. Амфотерный оксид+кислота=соль+вода • Al 2 O 3+6 HCl=2 Al. Cl 3+3 H 2 O
Получение оксидов Взаимодействие простых веществ с кислородом. • S+O 2=SO 2 , • Mg+O 2=2 Mg. O ( нагревание)
2. Горение сложных веществ в кислороде. • CH 4+O 2=CO 2+2 H 2 O • 4 NH 3+O 2=4 NO+6 H 2 O • 2 H 2 S+3 O 2=2 SO 2+2 H 2 O
3. Разложение сложных веществ. • Са. СО 3=Са. О+СО 2; • Cu(OH)2= Cu. O+H 2 O – нагревание • (NH 4)2 Cr 2 O 7=Cr 2 O 3+N 20+4 H 2 O (тепловой импульс)
4. Взаимодействие оксида металла с другим металлом. • Al + Cr 2 O 3=Cr +Al 2 O 3 (нагревание)
Основания – сложные вещества, в состав которых входят атомы металла и гидроксогруппы OHИсключением является основание NH 4 OH (гидроксид аммония), которое не содержит атомов металла)
Общая формула • Me+n(OH)n-1 • Me – металл • n – степень окисления металла
Номенклатура оснований Название оснований составляют из слова «гидроксид» и названия металла в родительном падеже: KOH – гидроксид калия; Mg(OH)2 — гидроксид магния; Ca(OH)2 — гидроксид кальция; Al(OH)3 — гидроксид алюминия.
Пример Если металл образует несколько оснований, то после названия металла в скобках римской цифрой указывается степень его окисления: Fe(OH)2 – гидроксид железа (II); Fe(OH)3 – гидроксид железа (III); Cr(OH)2 – гидроксид хрома (II); Cr(OH)3 – гидроксид хрома (III).
Основания Растворимые Амфотерн. в воде гидроксиды щёлочи Li. OH, KOH, Na. OH, Rb. OH, Cs. OH, Ca(OH)2. Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3. Нерастворимые в воде – нерастворимые основания Cu(OH)2 – гидроксид меди (II), Fe(OH)2 – гидроксид железа (II),
Химические свойства оснований Амфотерные гидроксиды • Амфотерные гидроксид + кислота → соль + вода Zn(OH)2 + 2 HCl → Zn. Cl 2 +2 H 2 O
Амфотерные гидроксид + щелочь → соль + вода • (при сплавлении) Zn(OH)2 + 2 Na. OH(тв. ) → Na 2 Zn. O 2 +2 H 2 O • в растворе: Zn(OH)2 + 2 Na. OH(р-р) → Na 2[Zn(OH)4]
Щелочи 1. Действие на индикаторы: фенолфталеин – малиновый, метилоранж – желтый, лакмус – синий Нерастворимые основания _ 2. Основание + кислота =соль 1.
Основание + кислота = + вода соль + вода 2 Fe(OH)3+3 H 2 SO 4= Fe 2(SO 4)3 2 KOH +2 HCl =2 KCl + H 2 O + 6 H 2 O 3. Основание + кислотный 2. Основание-t= оксид + вода оксид = соль + вода 2 Fe(OH)3 t= Fe 2 O 3 + 3 H 2 O Ba(OH)2 +CO 2 = Ba.
CO 3 + H 2 O Cu(OH)2 t=Сu. O + H 2 O 4. Щелочь + соль 1 = соль 2 + основание 2 KOH+Cu. SO 4=…. K 2 SO 4+Cu(OH)2 =
Получение оснований • Активный металл+вода → щелочь+водород • только щелочные( Li, Na, K, Rb, Cs), 2 Na+2 H 2 O → 2 Na. OH+H 2 щелочноземельные (Ca, Sr, Ba) Ba +2 H 2 O → Ba(OH)2+H 2
2. Основной оксид+вода → щелочь • только оксиды щелочных и щелочноземельных металлов K 2 O+H 2 O → 2 KOH; Sr. O+H 2 O → Sr(OH)2
3. Соль 1(р-р)+основание 1(р-р) → соль2(р-р)+нерастворимое основание 2 • Fe. Cl 3(р)+ 3 KOH(р) → 3 KCl(р)+Fe(OH)3↓ цвет ржавчины • Zn. SO 4(р)+NH 4 OH(р) → (NH 4)2 SO 4(р)+Zn (OH)2 ↓ белый
Кислоты. Определение Кислоты — это сложные вещества, в состав которых входят ионы водорода Н+, способные замещаться на металл, и кислотный остаток
Общая формула кислот • Нn+ Х-n — Х — кислотный остаток • n – заряд кислотного остатка
Классификация кислот. По наличию атомов кислорода в составе молекулы : • Бескислородные • Кислородосодержащие (оксокислоты) – гидраты кислотных оксидов (ангидридов)
По числу атомов водорода в кислоте , способных замещаться на металл различают кислоты • одноосновные • многоосновные.
Кислородосодержащие • одноосновные – HNO 3, HNO 2, HMn. O 4 • двухосновные – H 2 SO 4, H 2 Si. O 3 • трехосновные – H 3 PO 4, H 3 As. O 4
Бескиcлородные • одноосновные HF, HCl, HBr, HI • двухосновные H 2 S, H 2 Se, H 2 Te,
Номенклатура Бескиcлородные кислоты – название неметалла + «О» +слово водородная. Примеры: HCl -хлороводородная; HF — фтороводородная; H 2 Se –селеноводородная. Запишите формулы кислот: сероводородной , иодоводородной, бромоводородной
Кислородосодержащие По степени окисления кислотообразующего элемента • • • H 2+S+6 O 4 -2 – cерная кислота H+N+5 O 3 -2 — азотная кислота H 2+S+4 O 3 -2 – сернистая кислота H+N+3 O 2 -2 – азотистая кислота H 2+Cr+6 O 4 -2 – хромовая кислота H+Cr+3 O 2 -2 – хромистая кислота
По количеству молекул воды, присоединенных одной молекулой ангидрида • P 2 O 5 + 3 H 2 O →H 3 PO 4 — ортофосфорная кислота • P 2 O 5 + 2 H 2 O → H 4 P 2 O 7 – пирофосфорная кислота • P 2 O 5 + H 2 O → 2 HPO 3 – метафосфорная кислота
• H 3 Al. O 3 – ортоалюминиевая кислота (более богатая водой) • HAl. O 2 – метаалюминиевая кислота (H 3 Al. O 3 – Н 2 О → HAl. O 2)
Свойства кислот Кислоты окрашивают индикаторы лакмус красный метилрот розовый метилоранж красный
Физические свойства Твердые: HPO 3, H 3 PO 4, H 3 BO 3, H 2 Si. O 3 Жидкие: H 2 SO 4, HNO 3, HCl и т. д.
Кислоты Летучие: H 2 СO 3, H 2 SO 3, HNO 2 и бескислородные кислоты Нелетучие: H 2 SO 4, H 3 PO 4, и т. д Сильные: H 2 SO 4, HNO 3, HCl, HBr, HI и содержащие металл в высшей степени окисления (H 2 Cr.
O 4, HMn. O 4) Слабые: H 2 СO 3, H 2 SO 3, H 3 BO 3, H 2 Si. O 3, СН 3 СООН, H 2 S и т. д.
Химические свойства кислот 1. Кислота+ основной оксид → соль + вода • 2 HNO 3+Na 2 O → 2 Na. NO 3+H 2 O
2. Кислота+ основной оксид → соль + вода • 2 HNO 3+Са. O → Са(NO 3)2+H 2 O
3. Кислота+ основание → соль + вода • Реакция нейтрализации • H 2 SO 4 +2 Na. OH → Na 2 SO 4+2 H 2 O • 2 HCl+Cu(OH)2↓ → Cu. Cl 2+2 H 2 O
4. Кислота 1+соль1 → кислота 2+соль2 • H 2 SO 4(конц. )+2 Na. Cl(тв) (t) → 2 HCl ↑ +Na 2 SO 4 • 2 HCl+ Na 2 СO 3 → CO 2 ↑ +H 2 O +2 Na. Сl • K 2 Si. O 3+2 HNO 3 → H 2 Si. O 3↓ +2 KCl
Кислота + металл Обычные – выделяется водород + соль Кислоты окислители – водород не образуется
Кислоты окислители • H 2 SO 4 концентрированная, • HNO 3 любой концентрации • при нагревании реагируют со всеми металлами кроме благородных (Au, Pt) и неметаллами. • Холодные концентрированные кислоты пассивируют Fe, Cr, Al.
Водород из этих кислот не выделяется ! Продукты восстановления кислотообразующего элемента зависят от концентрации кислоты и активности металла
Схемы реакций соль+SО 2+Н 2 О Н 2 SO 4 + Ме Ме неакт. соль+ S (Н 2 S )+Н 2 О Ме акт.
Ме+HNO 3(конц. ) Соль+NO 2+Н 2 О Все металлы, кроме благородных. На холоду пассивируются железо, хром, алюминий.
Ме+HNO 3(разб. ) Соль+NO 2+Н 2 О – неакт Ме Соль+N 2 O(N 2)+Н 2 О — акт. Ме
б) обычные кислоты • все кроме HNO 3, H 2 SO 4 концентрированной • (H 2 SO 4 разбавленная, H 3 РO 4, HСl…). Реагируют со всеми металлами (кроме свинца), стоящимими в ряду напряжений до водорода. • Образуются соль и ВОДОРОД! • Fe+H 2 SO 4= Fe. SO 4+H 2
К слайду 70 Взаимодействие металлов с концентрированной серной кислотой • неактивный металл – (SO 4)2 — S+4 О 2 Cu+2 H 2 SO 4(к) Cu. SO 4+SO 2 +2 H 2 O • активный металл — (SO 4)2 — S 0 или до H 2 S-2 • Zn+2 H 2 SO 4 (к) Zn. SO 4+S +2 H 2 O • 4 Mg +5 H 2 SO 4 (к) 4 Mg. SO 4+H 2 S +4 H 2 O
Взаимодействие азотной кислоты с металлами Концентрированная азотная кислота. Продукт восстановления N+5 не зависит от активности металла. Неактивный металл Cu+4 HNO 3(к) Cu(NO 3)2+NO 2 +2 H 2 O Активный металл Mg+4 HNO 3 (к) Mg(NO 3)2+NO 2 +2 H 2 O
Разбавленная азотная кислота. Неактивный металл восстанавливает N+5 до NO 3 Cu+8 HNO 3(р) 3 Cu(NO 3)2+2 NO +4 H 2 O Неактивный металл восстанавливает N+5 до N 2 O или N 2 4 Zn+10 HNO 3 (р) 4 Zn(NO 3)2+N 2 O +5 H 2 O 5 Mg+12 HNO 3 (р) 5 Mg(NO 3)2+N 2 0 +6 H 2 O Очень разбавленная азотная кислота. Активный металл восстанавливает N+5 до N-3 4 Ca+10 HNO 3(оч. р) 4 Ca(NO 3)2+NH 4 NO 3+3 H 2 O
Получение кислот 1. Кислотный оксид + вода кислота. SO 3+H 2 O H 2 SO 4 – серная кислота P 2 O 5 + 3 H 2 O 2 H 3 PO 4 – ортофосфорная кислота Mn 2 O 7 + H 2 O 2 HMn. O 4 – марганцовая кислота В воде растворимы все кислотные оксиды кроме оксида кремния (IV).
2. Соль1+кислота 1 соль2+кислота 2 Кислородосодержащие: Ca. Cl 2+3 H 2 SO 4 Ca. SO 4 +2 HCl Na 2 Si. O 3+2 HCl 2 Na. Cl+ H 2 Si. O 3 Бескислородные 2 Na. Cl(тв. )+H 2 SO 4(конц. ) 2 Na 2 SO 4+2 HCl↑ Fe. S(тв. )+2 HCl (конц. ) Fe. Cl 2+H 2 S ↑
3. Синтез из простых веществ Водород+неметалл газ Газ пропускают в воду раствор бескислородной кислоты H 2+Cl 2 2 HCl (газ хлороводород); H 2+S H 2 S (газ сероводород);
4. Неметалл+HNO 3(конц. ) или H 2 SO 4(конц. ) кислота+оксиды+вода 2 P+5 H 2 SO 4(конц. ) 2 H 3 PO 4+5 SO 2 +2 H 2 O S+6 HNO 3 (конц. ) H 2 SO 4+6 NO 2 +2 H 2 O
Кислоты, особенно концентрированные, разрушают кожу и ткани! Кислоты требуют осторожного обращения! При попадании на кожу или одежду нейтрализовать раствором соды, а затем обильно смыть водой.
Источник: https://present5.com/klassy-neorganicheskix-soedinenij-stepen-okisleniya-elementa/
Оксиды: классификация, получение и свойства | CHEMEGE.RU
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Тренировочные тесты по теме Классификация оксидов.
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом:
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
- Например, алюминий взаимодействует с кислородом с образованием оксида:
- 4Al + 3O2 → 2Al2O3
- Не взаимодействуют с кислородом золото, платина, палладий.
- Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
- 2Na + O2 → 2Na2O2
- Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
- K + O2 → KO2
- Примечания: металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
- 4Fe + 3O2 → 2Fe2O3
- 4Cr + 3O2 → 2Cr2O3
- Железо также горит с образованием железной окалины — оксида железа (II, III):
- 3Fe + 2O2 → Fe3O4
1.2. Окисление простых веществ-неметаллов.
- Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
- Например, фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
- 4P + 5O2(изб.) → 2P2O5
- 4P + 3O2(нед.) → 2P2O3
- Но есть некоторые исключения.
- Например, сера сгорает только до оксида серы (IV):
- S + O2 → SO2
- Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
- 2SO2 + O2 = 2SO3
- Азот окисляется кислородом только при очень высокой температуре (около 2000оС), либо под действием электрического разряда, и только до оксида азота (II):
- N2 + O2 = 2NO
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
- При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
- Например, при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
- Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
- 2H2S + 3O2(изб.) → 2H2O + 2SO2
- 2H2S + O2(нед.) → 2H2O + 2S
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
- 4NH3 + 3O2 →2N2 + 6H2O
- А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
- 4NH3 + 5O2 → 4NO + 6H2O
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
- гидроксид → оксид + вода
- Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
- H2CO3 → H2O + CO2
- H2SO3 → H2O + SO2
- NH4OH → NH3 + H2O
- 2AgOH → Ag2O + H2O
- 2CuOH → Cu2O + H2O
- При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
- H2SiO3 → H2O + SiO2
- 2Fe(OH)3 → Fe2O3 + 3H2O
4. Еще один способ получения оксидов — разложение сложных соединений — солей.
- Например, нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
- Li2CO3 → H2O + Li2O
- CaCO3 → CaO + CO2
- Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
- 2Zn(NO3)2 → 2ZnO + 4NO2 + O2
- Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
- Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
- Химические свойства основных оксидов.
- Химические свойства кислотных оксидов.
- Химические свойства амфотерных оксидов.
Источник: https://chemege.ru/oxides/
ПОИСК
На основе электронного строения атомов указать, могут ли быть окислителями атомы натрия, катионы натрия, кистород в степени окисленности —2, иод в степени окисленности О, фторид-ионы, катионы водорода, нитрит-ионы, гидрид-ионы.. [c.
166]
В главной подгруппе первой группы периодической системы находятся литий, натрий, калий, рубидий, цезий и франций В соответствии с номером группы в своих соединениях (в большинстве случаев ионных) они проявляют всегда степень окисления -Ы. Чисто ковалентное а—ст-связывание имеет место в газообразных молекулах Кза, Ка и т. д. Эти элементы — самые неблагородные .
Их стандартные потенциалы порядка от —2,7 до —3,0 В (ср. табл. В.14). Ионные радиусы сопоставлены в табл. А.16. Обраш,ает на себя внимание тот факт, что при переходе от натрия к калию изменение радиусов оказывается, большим, чем в следующем за ними ряду элементов К—НЬ—Сз почему ). Это обстоятельство является главной причиной отличия свойств натрия от его более тяжелых аналогов.
С учетом этого становится понятной аналогия в свойствах соответствующих соединений калия, рубидия и цезия. Особо следует под [c.597]
Написать уравнение реакции получения тиосульфата натрия. Какова степень окисленности серы [c.226]
- Написать графическую формулу тиосульфата натрия, указать степень окисления серы в этом соединении и объяснить его неустойчивость в кислой среде, [c.139]
- В щелочной среде, взаимодействуя с бромом, хромит натрия окисляется и переходит в хромат натрия — соль хромовой кислоты, в которой хром проявляет высшую степень окисления [c.177]
- Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы степень окисленности хлора изменяется от О до —1 [c.266]
Написать уравнение реакции разложения сульфита натрия, учитывая, что вторым продуктом прокаливания является сульфат натрня. Как изменялась степень окислення серы в данной реакции Для каких степеней окисления серы возможны реакции диспропорционирования [c.99]
Запись данных-опыта. Написать уравнения реакций а) взаимодействия нитрата свинца с избытком едкого натра, б) окисления полученного На4[РЬ(ОН)б1 пероксидом водорода. Можно ли РЬ» окислить дихроматом калия (см. Приложение, табл. 11). Какая степень окисления более характерна для свинца +П или +1У [c.178]
Взаимодействие с сульфитом натрия е образованием тиосульфата натрия. Тиосульфат содержит серу в степенях окисления +6 и -2. [c.297]
Влияние продолжительности акустического воздействия на степень окисления этилмеркаптида натрия [c.55]
Запись данных опыта. Написать уравнение реакции. Как изменилась степень окисления висмута в результате реакции Написать графическую формулу висмутата натрия. Можно ли применять его в качестве восстановителя В качестве окислителя Ответ мотивировать. [c.161]
Изучение свойств тиосульфата натрия приводит к выводу, что атомы серы, входящие в его состав, имеют различную окисленность у одного из них степень окисленности — -4, у другого 0. [c.394]
Кроме окисления меркаптидов натрия, степень конверсии которых достигает 96…99%, также происходит заметное снижение концентрации сульфида натрия. Например, в пробе 5, при температурном режиме 65 С, снижение концентрации сульфида натрия произошло более чем на 60%. [c.63]
В большинстве соединений бор проявляет степень окисления +3 (борный ангидрид В2О3, тетраборат натрия, бура N826467, борная кислота НзВОз, нитрид бора BN). [c.326]
Ш,елочная абсорбция оксидов азота. Целесообразна при санитарной очиси е газов от оксидов азота при степени окисления бJH lзкoй к 50%- В качестве абсорбентов можно иримепять рас-твор1,1 соды, известкового молока, едкого натра. [c.67]
Здесь наблюдается постепенный переход ог типично основных оксидов натрия и магния к амфотерным, или промежуточным (алюминия), и к кислотным оксидам фосфора, серы и хлора. Этот пе-ре.
ход сопровождается понышепием окислительного числа эле.мен-тов, образующих оксиды. То же наблюдается у оксидов одного и того же элемента в разных степенях окисления. Так, например, в ряду [c.
126]
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы степень окисления натрия изменяется от О до -fl [c.262]
Металлы, как правило, не бывают окислителями. Но примеры того, что они все же могут присоединять электроны, имеются. Натрий хорошо растворяется в жидком аммиаке. Эти растворы содержат как атомы, так и ионы натрия На , На, На» «.
В комплексных соединениях — карбонилах На2 [Сг(С0)5] Наг [Ме(СО)4], где Ме = Ре, Со, НЬ, КЬ, — -элементы имеют отрицательные степени окисления -2.
Известны комплексные соединения, где отрицательные степени окисления проявляют другие -элементы Т1, V, Мп, Н1, а также щелочные элементы. [c.319]
При осторожном окислении аммиака гипохлоритом натрия степень окисления азота изменяется от —3 до —2, и основным продуктом реакции является гидразин N2H4 [c.171]
Была изучена также стойкость порошка rjSg против окисления в токе кислорода в интервале температур 500—1100° С [292, с. 844]. Навеску сульфида в лодочке помещали в трубку, находящуюся в печи при заданной температуре, и пропускали непрерывный ток кислорода.
Выделяющийся сернистый газ поглощали 3%-ным раствором Н Оз, образовавшуюся HjSO оттитровывали раствором едкого натра. Степень окисления оценивали по количеству выделившегося SOj.
При 500—600° С СГаЗз окисляется лишь незначительно, интенсивное окисление начинается при 700° С, при более высоких температурах (900—1000° С) происходит полное окисление до окиси хрома rjOg. [c.146]
Мазпаиня солей составляют из названия аниона кислоты в именительном падеже и названия катиона в родительном падеже (.хлорид натрия, сульфат меди п т. п.), При этом название аниона производят от корня латинского наименования кислотообразующего элемента. Степень окисленности металла, образующего катнон, указывают, если это необходимо, римскими цифрами в скобках. [c.35]
Названия комплексных соединений образуются аналогично названиям обычных солей (Na l — хлорид натрия, K2SO4 — сульфат калия и т. п.) с той лишь разницей, что указываются лиганды и степень окисления центрального иона. Молекулы Н2О и NH3 обозначаются соответственно аква и аммин . Вот несколько примеров, иллюстрирующих номенклатуру комплексов [c.118]
Запись данных опыта. Написать уравнения протекающих реакций, учитывая, что бром окисляет тиосульфат до сульфата, при этом в реакции участвует вода.
(Выделяющаяся сера является продуктом побочной реакции.) Иод окисляет тиосульфат до тетра-тионата Na2S40e.
В какую степень окисления переходит при этом бром и иод Может ли хлорная вода окислить тиосульфат натрия Ответ мотивировать. [c.144]
Диспропорционирование — это особый случай окислительно-восстановительной реакции, в ходе которой происходит переход одного и того же вещества средней степени окисления на более низкую и более высокую степень окисления. Вещество как бы само себя окисляет и восстанавливает.
Это явление называют также редокс-амфотерностью. Реакции такого типа часто встречаются в химии галогенов. Например, при растворенг1И иода в растворе едкого натра молекулы иода сначала диспро-порционируют на гипоиодид- и иодид-ионы.
Нестабильный ги-поиодид быстро диспропорционирует с образованием иодида и иодата [c.418]
Тиосульфат натрия Na2S20.з содержит один атом серы формально в степени окисления +6, а другой — в степени — 2 [c.115]
Исследование влияния температурного режима на процесс акустической регенерации, проводились на модельной смеси водно-щелочного раствора, с начальными концентрациями 0,0387 моль/л — меркаптида натрия и 593 мг/л-сульфида натрия. Продолжительность акустической обработки (180с.) при которой достигается максимальная степень окисления. [c.70]
В кислой среде в ионное уравнение реакции могут быть включены молекулы воды и ионы водорода, в щелочной — молекулы воды и гидроксильные ионы.
В нейтральной среде в левую часть уравнения кроме окислителя и восстановителя могут входить только молекулы воды, а в результате реакции могут получаться как ионы Н+, так и ионы 0Н . Разберем электронно-ионную схему на примере окисления сульфита натрия перманганатом калия в различных средах.
Сульфит натрия окисляется до сульфата Ыа2804, а КМПО4 восстанавливается до различных степеней окисления в зависимости от pH. [c.130]
При взаимодействии ванадатов с натрием в расплаве образуются также ионы ванадия (Н1).
Восстановление водородом в момент образования (при действии цинка на раствор ванадата, слабоподкисленный серной кислотой) заканчивается образованием фиолетового иона ванадия(II) [У(Н20ер+, чувствительного к действию кислорода воздуха.
Переходы между отдельными степенями окисления легко различимы по изменению окраски раствора. Соли ва-надия(П) — сильные восстановители [c.613]
Для окончательного суждения о проявлении восстановительных или окислительных свойств серы в различных степенях окислени-я провести следуюш,ий опыт. Поместить в пробирку микрошпатель кристаллов сульфита натрия, прибавить 5—6 капель 2 н.
раствора серной кислоты и после полного растворения кристаллов пропустить через прозрачный раствор струю сероводорода до выпадения серы (опыт проводить в вытяжном шкафу).
Написать уравнение взаимодействия сернистого газа, образовавшегося при растворении сульфита натрия в серной кислоте, с сероводородом. [c.98]
Запись данных опыта. Описать наблюдаемые явления. Написать уравнения реакций получения полисульфида натрия NaJSa и его разрушения в кислой среде (реакцию диспропорционирования), учитывая, что сера в степени окисления I переходит в 8 и 5 «-ион. [c.141]
Выполнение работы. В пробирку внохти I микрошпатель порошка PbgOi, добавить 5—6 капель 2 н. раствора азотной кислоты и нагреть маленьким пламенем горелки. Отметить изменение цвета осадка. Какое это вещество Написать его формулу.
Какая степень окисления свинца в этом соединении Дать раствору отстояться, после чего несколько капель раствора перенести пипеткой в чистую пробирку и подействовать на него раствором сульфата натрия.
На присутствие какого нона указывает образование белого осадка Какое это вещество - [c.179]
РЬд04 С азотной кислотой и полученного в растворе соединения свинца с сульфатом натрия. Выразить формулу РЬз04 в виде двух оксидов свинца, соответствующих степеней окисления. [c.180]
Названия оснований строятся из слова гидроксид и названия металла. Если металл не имеет постоянной валентности, то в скобках указывают значение степени окисления (валентности), проявляемое в этом соединении.
Например гидроксид цинка Zn(OH)j (читается цинк о аш дважды ), гидроксид натрия NaOH (читается натрии о аш ), гидроксид алюминия А1(0Н) (читается алюминий о аш 1 рижды ), гидроксид железа (II) Fe(OH)j (читается фер-рум о аш дважды ) и гидроксид железа (III) Ре(ОН)з (читается фер-рум (I аш 1рижды ). [c.12]
Металлы проявляют в своих соединениях обычно положительную степегп окисления, и низшая их степень окисления равна нулю. Иначе говоря, низшей степенью окисления они обладают только в свободном состоянии . Действительно, все свободные металлы способны, хотя и в различной степени, проявлять восстановительные свойства.
На практике в качестве восстановителей применяют алюминий, магний, натрий, ка.дий, цинк и некоторые другие металлы. Если металлу присущи несколько степеней окисления, то те его соединения, в которых он проявляет низшую из них, также обычно являются восстановителями, например, соединения железа (И), олова(П), хрома (II), меди(1).
[c.266]
Источник: https://www.chem21.info/info/861437/




