Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки.
Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг.
Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.

А вотраспространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.
Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na+, K+, Mg2+, Ca2+ в организме человека приходится 99% всех ионов металлов.

К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.

В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
| Название | Химический состав |
| Красный железняк (гематит) | Fe2O3 |
| Магнитный железняк (магнетит) | Fe3O4 |
| Бурый железняк | 2Fe2O3 · 3H2O |
| Железный колчедан (пирит) | FeS2 |
| Сильвин | KCl |
| Криолит | Na3AlF6 |
| Кальцит | CaCO3 |
| Корунд | Al2O3 |
| Малахит | (CuOH)2CO3 |
| Медный колчедан (халькопирит) | CuFeS2 |
| Киноварь | HgS |
| Гипс | CaSO4 · 2H2 |
| Свинцовый блеск (галенит) | PbS |
| Цинковая обманка | ZnS |
К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.
А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки, густо усеивающие дно.
Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой».
В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.
Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
- Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.
- Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.
- Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.
- Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд.
Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства.
Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.
Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.
Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл.
Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму.
В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
- 2Fe2O3 + 3C = 4Fe + 3CO2
- В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
- Fe2O3 + 3CO = 2Fe + 3CO2
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м3. Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом.
По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух.
В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.
- C + O2 = CO2
- доменная печь
- Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
- с образованием оксида углерода (II).
- CO2 + C = 2CO
- В результате реакций СО с оксидом железа (III) образуется железо.
- В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
- Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
- Конвертер
- Для получения некоторых металлов в качестве восстановителя используют водород.
- WO3 + 3H2 = W + 3H2O
В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:
- Fe2O3 + 2Al = 2Fe + Al2O3
- Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.
- Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.
Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока.
Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г.
Дэви впервые получил калий, натрий, барий и кальций.
Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд.
А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды.
Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.
При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна.
Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди».
Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов.
Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд.
В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Источник: https://videouroki.net/video/9-poluchieniie-mietallov-nakhozhdieniie-ikh-v-prirodie.html
Основные способы получения металлов

Основные способы получения металлов
Урок в 11 классе

- Способы получения металлов
- обычно разделяют на три типа:
- пирометаллургические — восстановление при высоких температурах;
- гидрометаллургические — восстановление из солей в растворах;
- электрометаллургические — электролиз раствора или расплава.

- Пирометал-лургически
- получают : чугун, сталь, медь, свинец, никель, хром и другие металлы.
- Доменный процесс –
- получение стали и чугуна

Гидрометаллургически получают : золото, цинк, никель и некоторые другие металлы.
Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др.
Электрометал-лургически получают : щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы.
- Общие способы получения металлов
- 1. Восстановление металлов из оксидов углем или угарным газом
- Например,
- Mе x O y + C = CO 2 + Me,
- 1. ZnO y + C t = CO + Zn
- Mе x O y + C = CO + Me,
- 2. Fe 3 O 4 + 4CO t = 4CO 2 + 3Fe
- 3. MgO + C t = Mg + CO
- Mе x O y + CO = CO 2 + Me
- Не подходит для металлов, образующих карбиды с углём.
- получают : Fe, Cu, Pb, Sn, Cd, Zn

- Общие способы получения металлов
- 2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
- Например,
- 1 стадия –
- Mе x S y +O 2 = Mе x O y +SO 2
- 1. 2ZnS + 3O 2 t = 2ZnO + 2SO 2 ↑
- 2 стадия –
- Mе x O y + C = CO 2 + Me или
- 2. MgCO 3 t = MgO + CO 2 ↑
- Mе x O y + CO = CO 2 + Me

- Общие способы получения металлов
- 3 Алюмотермия ( в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида )
- Например,
- 1. 4SrO + 2Al t = Sr(AlO 2 ) 2 + 3Sr
- Mе x O y + Al = Al 2 O 3 + Me
- получают: Mn, Cr, Ti, Mo, W, V и др
- 2. 3MnO 2 + 4Al t = 3Mn + 2Al 2 O 3
- 3. 2Al + 3BaO t = 3Ba + Al 2 O 3 (получают барий высокой чистоты)

- Общие способы получения металлов
- 4. Водородотермия — для получения металлов особой чистоты
- Например,
- 1. WO 3 + 3H 2 t = W + 3H 2 O↑
- Mе x O y + H 2 = H 2 O + Me
- 2. MoO 3 + 3H 2 t = Mo + 3H 2 O↑
- Получают металлы большей чистоты : Cu, Ni, W, Fe, Mo, Cd, Pb

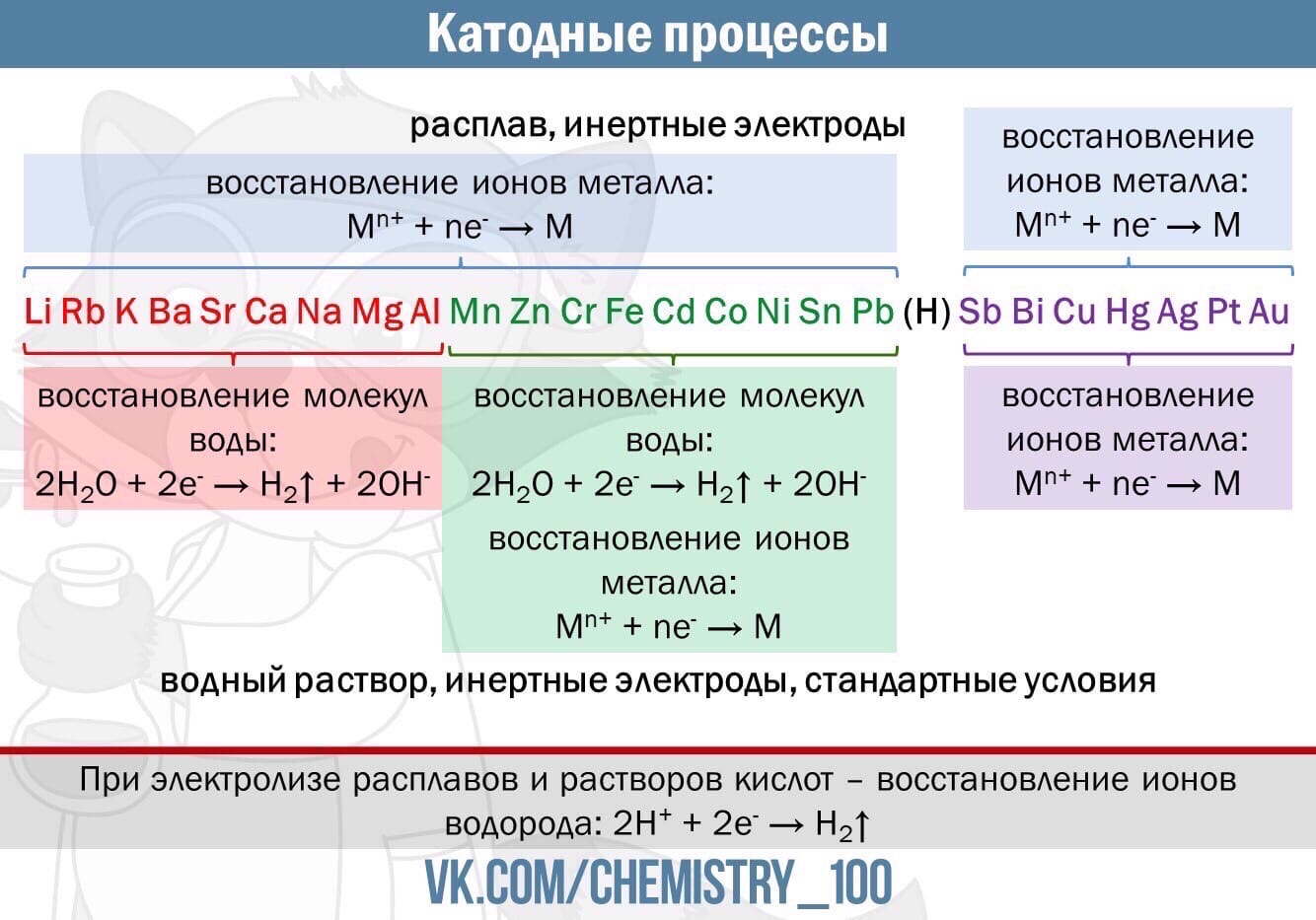
Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей ( хлоридов ):
2NaCl расплав, электр. ток. 2 Na + Cl 2 ↑
CaCl 2 расплав, электр. ток. Ca + Cl 2 ↑
расплавов гидроксидов :
4NaOH расплав, электр. ток. 4Na + O 2 ↑ + 2H 2 O
(!!! используют изредка для Na)
Восстановление металлов электрическим током (электролиз)
Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
2Al 2 O 3 расплав в криолите, электр. ток. 4Al + 3 O 2 ↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO 4 +2H 2 O раствор, электр. ток. 2Cu + O 2 + 2H 2 SO 4
- Металл, который получают
- Способ получения
- Щелочные металлы, Ca, Sr
- 5А
- Ba
- 3
- Al
- 5Б
- Fe в виде сплавов
- 1
- Для получения металлов средней активности и неактивных:
- 5В
- Примеры заданий по теме : «Общие способы получение металлов»
- Задания с выбором ответа ( А10, А24, А29).
- А1. Реакция возможна между
- 1) Ag и K 2 SO 4 (р-р)
- 2) Zn и KCl (р-р)
- 3) Mg и SnCl 2 (р-р)
- 4) Ag и CuSO 4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg
A3. Какой из металлов вытесняет медь из сульфата меди (II)?
- 1) Zn 2) Ag 3) Hg 4) Au
- A4. Формула вещества, восстанавливающего оксид меди (II) — это
- 1) CO 2 2) H 2 3) HNO 3 4) Cl 2
- A5. Формула вещества, не восстанавливающего оксид железа (III) —
- 1) HCl 2) Al 3) H 2 4) C
- А6. Для осуществления превращений в соответствии со схемой:
- Al(OH) 3 → AlCl 3 → Al необходимо последовательно использовать
- 1) хлор и водород
- 2) хлорид натрия и водород
- 3) хлороводород и цинк
- 4) соляную кислоту и калий
- А7. Пирометаллургический метод получения металлов отражает реакция:
- 1) HgS + O 2 → Hg + SO 2
- 2) CuSO 4 + Fe → FeSO 4 + Cu
- 3) 2NaCl (ток)→ 2Na + Cl 2
- 4) CuSO 4 + Zn → ZnSO 4 + Cu
- А8. Гидрометаллургический метод получения металлов отражает реакция:
- 1) HgS + O 2 → Hg + SO 2
- 2) CuSO 4 + Fe → FeSO 4 + Cu
- 3) 2NaCl (ток)→ 2Na + Cl 2
- 4) AlCl 3 + 3K → Al + 3KCl
- А9. В качестве восстановителя при выплавке железа в промышленности
- наиболее часто используют
- 1) водород
- 2) алюминий
- 3) натрий
- 4) кокс
- А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с
- 1) N 2 2) H 2 S 3) Fe 4) Fe 2 O 3
- Задания с кратким ответом (В3)
- В1. При электролизе раствора AgNO 3 на катоде выделяется
- 1) серебро
- 2) водород
- 3) серебро и водород
- 4) кислород и водород
- В2. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
- ВОДНОГО РАСТВОРА
- А) AgF 1) Ag, F 2
- Б) NaNO 3 2) Ag, O 2 , HF
- B) Pb(NO 3 ) 2 3) H 2 , O 2
- Г) NaF 4) Pb, O 2 , HNO 3
- 5) H 2 , NO 2 , O 2
- 6) NaOH, H 2 , F 2
- В3. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРА
- А) HgCl 2 1) металл, хлор
- Б) AlCl 3 2) водород, хлор, гидроксид
- В) Hg(ClO 4 ) 2 металла
- Г) Na 2 SO 3 3) водород, кислород
- 4) металл, кислород, кислота
- 5) металл, сернистый газ
- 6) водород, сернистый газ
- В4. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
- ВОДНОГО РАСТВОРА
- А) нитрат цинка 1) цинк, кислород, азотная кислота
- Б) бромид цинка 2) водород, кислород
- В) бромид калия 3) водород, оксид азота (IV)
- Г) нитрат калия 4) цинк, бром
- 5) водород, бром, гидроксид калия
- 6) калий, бром
- 7) калий, оксид азота (IV)
- В5. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, образующимся на като-де
- ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
- ВОДНОГО РАСТВОРА
- А) Li 2 SO 4 1) H 2
- Б) Ba(OH) 2 2) O 2
- В) MgCl 2 3) Cl 2
- Г) SnCl 2 4) Li
- 5) Ba
- 6) Mg
- 7) Sn
В6. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
- 1) верно только А
- 2) верно только Б
- 3) верны оба суждения
- 4) оба суждения неверны
- В7. Установите соответствие между металлом и способом его
- электролитического получения.
- МЕТАЛЛ ЭЛЕКТРОЛИЗ
- А) натрий 1) водного раствора солей
- Б) алюминий 2) водного раствора гидроксида
- В) серебро 3) расплава поваренной соли
- Г) медь 4) расплавленного оксида
- 5) раствора оксида в расплав-
- ленном криолите
- 6) расплавленного нитрата
В8. Установите соответствие между металлом и способом его электролитического получения.
- МЕТАЛЛ ЭЛЕКТРОЛИЗ
- А) калий 1) расплавленного нитрата
- Б) магний 2) водного раствора гидроксида
- В) медь 3) расплава хлорида
- Г) свинец 4) расплавленного оксида
- 5) раствора оксида в расплавленном криолите
- 6) водного раствора солей
В9. Установите соответствие между металлом и способом его электролитического получения.
- МЕТАЛЛ ЭЛЕКТРОЛИЗ
- А) хром 1) водного раствора солей
- Б) алюминий 2) водного раствора гидроксида
- В) литий 3) расплава соли
- Г) барий 4) расплавленного оксида
- 5) раствора оксида в расплав-
- ленном криолите
- 6) расплавленного нитрата
- Задания с развёрнутым ответом (С2)
- С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
- Cu → Cu(NO 3 ) 2 → Cu(OH) 2 → Х → Сu → CuSO 4
- Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота.
Напишите уравнения четырёх возможных реакции между этими веществами.
Источник: https://multiurok.ru/files/osnovnyie-sposoby-poluchieniia-mietallov.html
Общие способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
- Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
- Получение металлов из руд — задача металлургии.
- Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
- Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
- М n+ + ne−→M
- Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.

- В соответствии с этим существуют следующие способы получения металлов:
- • пирометаллургический;
- • гидрометаллургический;
- • электрометаллургический.
Пирометаллургия
- Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
- Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
- прокаливанием с углем (коксом):
- SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
- Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
- 2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
- FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк) - Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
- В качестве восстановителя можно применять водород или активные металлы:
- 1) МоO3 + ЗН2 = Мо + ЗН2O (водородотермия)
- К достоинствам этого метода относится получение очень чистого металла.
- 2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
- ЗМnO2 + 4Аl = ЗМn + 2Аl2O3 (алюминотермия)
- Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
- Q= Σ Q1 — Σ Q 2 ,
- где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
- Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe2Fe32)O4+ CO2
(Fe2Fe32)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);

Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
- Гидрометаллургия — это восстановление металлов из их солей в растворе.
- Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
- СuО + Н2SО4 = СuSO4 + Н2
- Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
- СuSO4. + Fе = Сu + FеSO4
- Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
- Примеры:
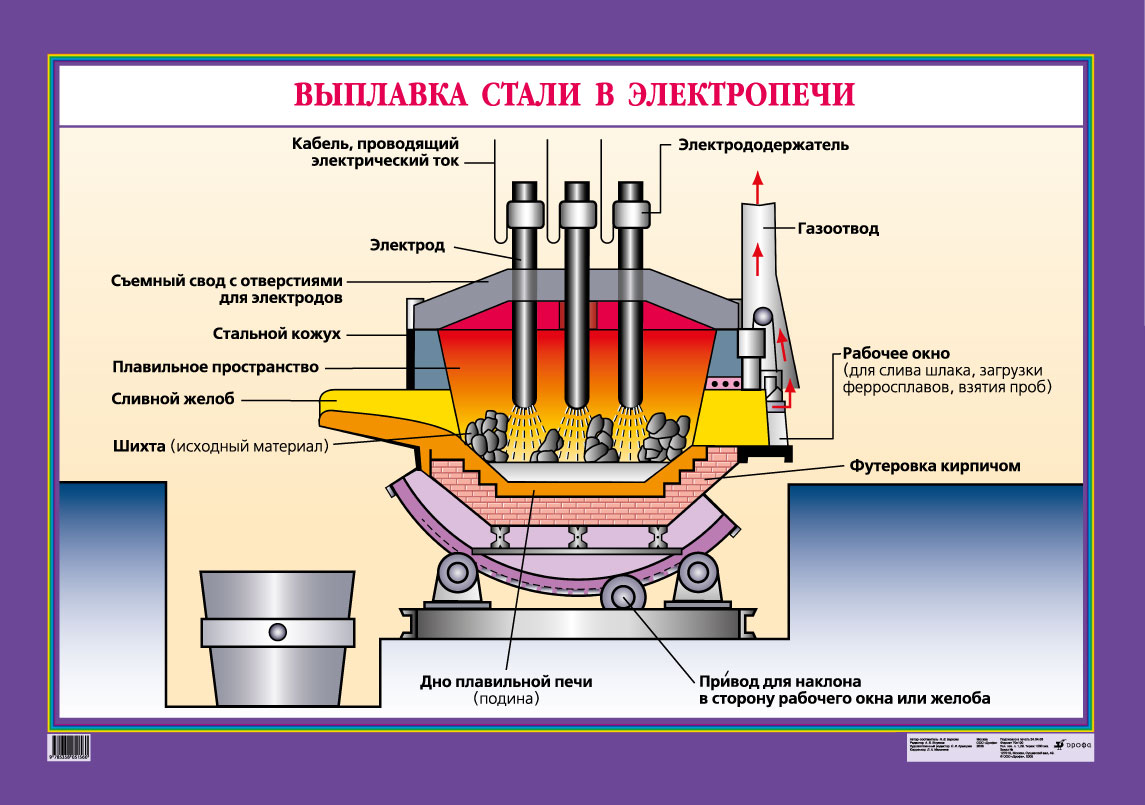 а) NaCl (электролиз расплава) → 2Na + Cl2
а) NaCl (электролиз расплава) → 2Na + Cl2 - б) CaCl2 (электролиз расплава) → Ca + Cl↑
в) 2Al2O3(электролиз расплава) → 2Al + 3O2↑
г) 2Cr2(SO4) + 6H2O(электролиз) → 4Cr↓ + 3O2↑ +6H2SO4
д) 2MnSO4 + 2H2O (электролиз) → 2Mn↓ + O2↑+2H2SO4
е) FeCl2(электролиз раствора) → Fe↓ + Cl2↑ 
Источник: http://himege.ru/obshhie-sposoby-polucheniya-metallov/
Общие способы получения металлов
Природные соединения металлов:
| хлориды | сильвинит КСl ∙ NaCl, каменная соль NaCl; |
| сульфиды | серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; |
| карбонаты | мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 ∙ MgCO3; |
| сульфаты | глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О; |
| оксиды | магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О. |
| нитраты | чилийская селитра NaNO3; |
- Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
- Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
- Способы получения металлов из руд.
1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
- При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
- NaCl (расплав) D Na+ + Cl-
- катод Na+ + e à Na0 ¦ 2
- анод 2Cl — — 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
- Al2O3 (расплав) D Al3+ + AlO33–
- катод Al3+ +3e à Al 0 ¦ 4
- анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
2. Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических: кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
| Алюмотермия: Fe+32O3 +2Al = 2Fe0 + Al2O3 | Получают железо, хром. |
| Восстановление оксидов металлов водородом (водородотермия): Cu +2O + H2 –(t)à Cu0 + H2O | Получают малоактивные металлы – медь, вольфрам. |
| Получение чугуна: В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды: |
|
| Восстановление углём (коксом): ZnO + C –(t)à Zn + CO | Получают цинк, никель. |
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
- CuSO4 + Fe = FeSO4 + Cu.
- Таким способом получают серебро, цинк, молибден, золото, ванадий.
- Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
- а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
- б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
- Чугун и сталь.

- Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
- 1) Сульфидные и другие руды вначале подвергают окислительному обжигу: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
- 2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
- 3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.

Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
Источник: https://kardaeva.ru/91-dlya-uchenika/11-klass/172-obshchie-sposoby-polucheniya-metallov
Металлы
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?

Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие.
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.
Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,5 г/см3). Металлы с плотностью больше 5 г/см3 относят к тяжелым, меньше 5 г/см3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают
Рис. 3. Металлы главных подгрупп.
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Средняя оценка: 4. Всего получено оценок: 442.
Источник: https://obrazovaka.ru/himiya/metally-formula-9-klass.html
4.2.1. Понятие о металлургии: общие способы получения металлов
- Металлургия — это комплексная отрасль промышленности, которая занимается производством металлов.
- Поскольку большинство металлов в природе существует в виде различных соединений, то химическая суть металлургических процессов заключается в восстановлении металлов:
- Me+n + nē → Me0
- В зависимости от того, какой используется восстановитель и каковы условия, при которых проводят процессы восстановления различают пиро-, гидро-, электро- и биометаллургию.
Пирометаллургия (от греч. огонь и металлургия) представляет собой все химические способы восстановления металлов из руд, осуществляемые с применением высоких температур.
В качестве восстановителей в пирометаллургии используют уголь (кокс), оксид углерода (II), водород, активные металлы, кремний.
Оксидные руды чаще всего восстанавливают коксом или оксидом углерода (II) — этот процесс носит название карботермия:
Для извлечения металлов пирометаллургическим способом из сульфидных руд их сначала подвергают предварительному отжигу:
А затем, полученный оксид восстанавливают коксом:
Тугоплавкие металлы, например, молибден и вольфрам, восстанавливают водородом:
Если восстановителями химически активные металлы, то этот пирометаллургический способ называют металлотермия. В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием. Способ металлотермии позволяет восстанавливать металлы не только из оксидов, но и с галогенидов:
Известен способ восстановления металлов кремнием, называемый силикотермией:
Гидрометаллургия представляет собой метод получения металлов, заклющийся в преобразовании природных соединений металлов в растворимую форму с последующим восстановлением металла из раствора.
О возможности применения гидрометаллургических процессов для извлечения металлов еще в 1763 г.. Говорил М. В. Ломоносов.
Гидрометаллургического способами добывают благородные (золото, серебро, платину), цветные (медь, никель, цинк, кобальт), редкие (цирконий, гафний, тантал) и другие металлы:
NiSO4 + Zn = Ni + ZnSO4
К преимуществам данного способа относится возможность его использования для получения металлов при их малом содержании в руде, которую невозможно перерабатывать обычными способами; снижение во многих случаях загрязнения окружающей среды, например, при обжиге сульфидных руд.
Электрометаллургия — это способ получения металлов с применением электрического тока — электролиза. Электролизом расплавов получают самые активные металлы (от лития до марганца в ряду активности), электролизом водных растворов — менее активные (Zn, Cu, Ni, Cr и т.д.).
Биометалургия основана на биохимических процессах, протекающих при использовании микроорганизмов. Известно, что микроорганизмы типа литотрофы (с лат.
– «поедающие камни») могут преобразовывать нерастворимые сульфиды металлов в растворимые сульфаты.
Сейчас с применением микроорганизмов добывают медь (в США данный метод достигает 10% от общего ее производства), уран, рений, серебро, никель, свинец, а также некоторые редкие металлы.
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/metallurgija










