- В зависимости от взаимного расположения обеих функциональных групп различают α-, β – и γ-аминокислоты:
- CH3-CH(NH2)-COOH (α-аминопропионованя кислота);
- CH2(NH2)-CH2-COOH (β – аминопропионованя кислота).
Аминокислоты представляют собой твердые кристаллические вещества, хорошо растворимые в воде. Они плавятся при высоких температурах с разложением.
Электронное строение аминокислот
В зависимости от строения радикала все аминокислоты можно разделить на алифатические, ароматические (содержат бензольное кольцо) и гетероциклические:

Аланин (2-аминопропановая кислота).
Аспаргиновая кислота (аминобутандиовая кислота).

Цистеин (2-амино-3-меркаптопропановая кислота).

Фенилаланин.

- Триптофан.
- Существует также классификации аминокислот в зависимости от их кислотно-основных свойств:
- — нейтральные (равное число амино- и карбоксильных групп);
- — кислые (дополнительная карбоксильная группа, как, например в аспаргиновой или глутаминовой кислотах);
- — основные (с дополнительной амино-группой, как, наприер в лизине).
В молекулах всех аминокислот, кроме глицина, атом углерода в α-положении содержит четыре различных заместителя, т.е. является асимметрическим. Благодаря центру хиральностиэти аминокислоты могут существовать в виде двух оптически активных энантиомеров.
Отнесение аминокислот к D- или L-стереохимическим рядам проводят по стереохимическому стандарту – глицериновому альдегиду (рис. 1): к D-ряду принадлежат соединения, у которых аминогруппа расположена в формуле Фишера справа, и к L-ряду – у которых она слева.
Рис. 1. Проекционные формулы Фишера D- и L-аминокислот.
Типы изомерии аминокислот
Для аминокислот характерно несколько типов изомерии, среди которых:
— изомерия углеродного скелета;

— изомерия положения функциональных групп;

— оптическая изомерия.

Одной из особенностей аминокислот является возможность взаимодействия их друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например,

Полученное соединение называют дипептидом. Вещества, построенные из многих остатков аминокислот, называются полипептидами.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/11-klass/stroenie-atoma/aminokisloty/
Строение аминокислот: структурные формулы и классификации
Строение основных аминокислот: 20 «магических», входящих в состав белка. Структура. Классификации. Таблицы с формулами. Название и международные сокращения протеиногенных аминокислот. С вами я, Галина Баева, 20 «магических» аминокислот и красивые таблицы со структурными формулами природных аминокислот.
Природные аминокислоты — это структурные единицы (мономеры) белков. В состав белков входят всего 20 т.н. «магических» аминокислот, которые также называются протеиногенными. Все они имеют сходное строение.
Кроме протеиногенных аминокислот в организме присутствуют и непротеиногенные, которые выполняют различную работу, в основном это промежуточные соединения в биохимическом конвейере, как например, орнитин, сигнальные молекулы, как β-аланин или нейромедиаторы, как ГАМК.
Особенности строения природных аминокислот
Строение аминокислот тесно связано с их функциями. Сходные по химической структуре вещества делают сходную работу. Попробуем разобраться, чтобы потом не путаться в аннотациях к препаратам.
- Все аминокислоты слеплены по одному лекалу.
- Голова – аминный остаток, содержащий азот N.
- Углеродный скелет, состоящий из цепочки атомов углерода (в простейшем случае – один углерод, к которому «спереди» прицеплен аминный остаток, а сзади – карбоновый хвост)
- Хвост – остаток карбоновой кислоты – СООН

Сбоку к углеродному скелету может быть присоединена еще какая-нибудь химическая группировка, которая придает данному веществу особые свойства.
Углеродная цепочка вместе с кислотным хвостом, присоединенная к аминной голове, называется мудреным словом «алифатический радикал».
Номенклатура аминокислот
Углеродная цепочка (скелет) может состоять как из 1 атома углерода, так и из нескольких. В последнем случае имеет значение, к какому атому углерода, начиная счет от карбоксильной группы, присоединится аминная голова.
Это может быть как 1-ый атом углерода, так и 2-ой, 3-ий и далее.
Химики договорились обозначать атомы углерода не цифрами, а буквами греческого алфавита: α — 1-ый атом углерода, начиная с карбоксильного хвоста, β— 2-ой, γ — 3-й, и т.д.

Если аминогруппа присоединяется к углероду в α-положении, такую аминокислоту называют α-аминокислотой, соответственно, если аминогруппа присоединена в β-положении — то это β-аминокислота, если в γ — то γ -аминокислота.
Все 20 природных протеиногенных аминокислот относятся к группе α -аминокислот.
Из β — аминокислот наиболее известен β-аланин, а из γ-аминокислот наиболее известна γ-аминомасляная кислота (ГАМК). Их структурные формулы приведены ниже.

Таблица 1 Строение протеиногенных аминокислот

Таблица 2 Структурные формулы аминокислот

Таблица 3 Модели структурных формул аминокислот
Классификация аминокислот
Существует несколько классификаций аминокислот:
- В зависимости от строения алифатического радикала, аминокислоты подразделяются на следующие группы:
- Просто аминокислоты с алифатическим радикалом, т.е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин
- Аминокислоты с разветвленной боковой цепью, у которых углеродный скелет образует боковые вилки: валин, лейцин, изолейцин. Изолейцин по химическому составу не отличим от лейцина, но его углеродный скелет по-другому загнут, т.е. он является стереоизомером. Иногда его выделяют в отдельную аминокислоту, а иногда – нет. Аминокислоты с разветвленной боковой цепью тоже относятся к группе МоноАминоМоноКарбоновых аминокислот.
- Аминокислоты, у которых в алифатическом радикале имеются разные группировки:
Спиртовая – ОН. Их называют ОксиМоноАминоМоноКарбоновые: серин и треонин
Карбоксильная, т.е. второй кислотный хвост. Это МоноАминоДиКарбоновые аминокислоты: аспарагиновая кислота (аспартат) и глутаминовая кислота (глутамат). Их называют еще Кислые аминокислоты, этакое «масло масляное».
Амидная. Карбоксильный хвост отрастил себе вторую аминную голову: аспарагин и глутамин. Кажется, понятным, что это производные соответственно аспартата и глутамата. Их называют Амиды МоноАминоДиКарбоновых аминокислот
- Аминная. Вторая аминная голова присоединилась к углеродному скелету: лизин
- Гуанидиновая: дополнительные аминные вставки — аргинин
- Лизин и Аргинин относят также к группе ДиАминоМоноКарбоновых аминокислот, ибо у них есть по второй аминной группе. Поскольку эти аминокислоты в нейтральной среде (вода, рН=7), проявляют щелочные (основные) свойства, повышая водородный показатель (рН становится › 7), то их относят к группе Основных аминокислот
- Серосодержащие аминокислоты. Имеют в радикале атом серы S: цистеин, метионин
- Аминокислоты, содержащие ароматический радикал– углеродное колечко или Ароматические аминокислоты фенилаланин, тирозин, триптофан
- Аминокислоты с гетероциклическим радикалом – колечко с атомом азота вместо углерода, поэтому он «гетеро» — «разнообразный»: триптофан и гистидин.
- Нетрудно заметить, что триптофан входит в группу как ароматических аминокислот, так и в группу аминокислот с гетероциклическим радикалом, а все потому, что у него есть как гетороциклический радикал, так и ароматический.
- Иминокислоты – углеродный скелет не вытянут в цепочку, а замкнут в колечко, из которого торчат аминная голова и рядом кислотный хвост: пролин и оксипролин
2. Классификация, в основу которой положена полярность алифатического радикала.
- Неполярные (гидрофобные) аминокислоты. Они имеют неполярные связи между атомами C-C, C-H. Это глицин, аланин, валин, лейцин, изолейцин, пролин, триптофан — 8 аминокислот
- Полярные незаряженные (гидрофильные) аминокислоты. Они имеют полярные связи между атомами С-О, C-N, O-H, S-H. Это серин, аспарагин, глутамин, треонин, метионин — 5 аминокислот
- Полярные отрицательно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН = 7) заряжены отрицательно, т.е. они выступают как отрицательно-заряженный ион (анион). Это аспарагиновая и глутаминовая кислоты, тирозин, цистеин — 4 аминокислоты
- Полярные положительно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН=7) заряжены положительно, т.е. они выступают как положительно-заряженный ион (катион). Это лизин, аргинин, гистидин — 3 аминокислоты.
Чем больше в белке аминокислот, обладающих полярностью, тем выше способность белка к химическим реакциям, т.е. его реактогенность. С реактогенностью белка непосредственно связаны его функции.
Белки соединительной ткани, например кератин, входящий в состав волос и ногтей, имеет мало полярных аминокислот.
Напротив, ферменты — белки-катализаторы биохимических реакций, обладают аминокислотным составом с множеством полярных групп.
3. Классификация по отношению к водородному показателю (рН)
- Аминокислоты, обладающие нейтральными свойствами с рН 5,97 – 6,02. Это глицин, аланин, серин, валин, лейцин, изолейцин,треонин, цистин, метионин — 9 аминокислот. Они имеют одну аминную голову и один карбоксильный хвост
- Аминокислоты, обладающие слабокислыми свойствами рН 3,0 – 5,7. Это аспарагиновая и глутаминовая кислоты. Они имеют одну аминную голову, но два карбоксильных хвоста, поэтому их называют «кислотами».
- Аминокислоты, обладающие щелочными свойствами с рН 9,7 – 10,7. У них две аминные головы и один карбоксильный хвост. Это лизин, аргинин, гистидин.
4. Классификация по способности к синтезу в организме человека и животных.
- Заменимые аминокислоты: глицин, серин, аланин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин
- Условно-заменимые аминокислоты: аргинин, гистидин, тирозин, цистеин
- Незаменимые аминокислоты: валин, лейцин, изолейцин, треонин, лизин, триптофан, фенилаланин, метионин
Подробнее о них рассказывается здесь: Аминокислоты заменимые и незаменимые: где взять.
5. Классификация аминокислот по путям биосинтеза.
В живых организмах аминокислоты могут производится (синтезироваться) из других соединений. Путь биосинтеза — это последовательность химических реакций, которые обусловлены наследственной (генетической) матрицей. Он записан в генетическом коде и обусловлен наличием ферментов, запускающих данные реакции.
Биосинтез идет не хаотично, а количество исходных и промежуточных соединений ограничено. Так из всего многообразия природных аминокислот для синтеза белка используются только 20.
Соответственно, исходные и промежуточные соединения на путях биосинтеза отдельных аминокислот образуют кластеры или семейства, где соединения могут преобразовываться друг в друга.
- Семейство аспартата: аспарагиновая кислота (аспартат), аспарагин, изолейцин, лизин, треонин, метионин
- Семейство глутамата: глутаминовая кислота (глутамат), глутамин, пролин, аргинин
- Семейство пирувата: аланин, валин, лейцин
- Семейство серина: серин, глицин, цистеин
- Семейство пентоз: гистидин, триптофан, фенилаланин, тирозин
- Семейство шикимата: триптофан, фенилаланин, тирозин
Надо сказать, что данные пути метаболизма реализуются в биологических системах, но не все они имеются в организме человека. Так высшие животные и человек не способны синтезировать ароматическое кольцо, поэтому путь шикимата — это не для нас. Аналогично с другими путями синтеза незаменимых аминокислот. Для наглядности незаменимые аминокислоты выделены жирным шрифтом.
6. Классификация аминокислот по путям катаболизма
Катаболизм — процесс распада, противоположен анаболизму или процессу синтеза. В организме катаболизм также обусловлен генетической программой и набором ферментов.
Конечным итогом деградации аминокислот является аммиак, вода и углекислый газ, а также выделяется энергия в виде тепла или связанная в молекулах АТФ.
В зависимости от промежуточных соединений, дающих энергию, аминокислоты подразделяются на следующие группы:
- Глюкогенные: дающие метаболиты (промежуточные соединения), из которых может быть синтезирована глюкоза: глицин, аланин, серин, треонин, валин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, аргинин, гистидин, цистин, метионин
- Кетогенные: распадающиеся до ацетоацетилКоА и ацетилКоА, из которых могут быть синтезированы кетонные тела: лизин, лейцин
- Промежуточные: при распаде этих аминокислот образуются метаболиты обоих типов: изолейцин, триптофан, фенилаланин, тирозин
Подробнее о глюкогенных и кетогенных аминокислотах можно прочитать здесь: Гликогенные аминокислоты
Правые и левые аминокислоты
В зависимости от прикрепления аминогруппы по отношению к карбоксильному хвосту в углеродной цепочке, аминокислоты могут быть «правыми» или «левыми», иначе говоря, их относят к D- или L- изомерам. Такие формы называют оптически активными, они не отличаются по химическому составу, но в пространстве относятся друг другу, как левая и правая рука.
В белковые молекулах присутствуют только L (левые) -изомеры аминокислот, правые (D) -изомеры могут обладать особыми свойствами и выступать как медиаторы, т.е. сигнальные молекулы, но чаще они образуют балласт. В обычных продуктах питания D-аминокислот практически нет.
Они образуются при химическом синтезе и могут встречаться в искусственных протеинах, используемых в спортивном питании или в качестве биологически-активных добавок к пище. D-аминокислоты с трудом расщепляются ферментами, ибо они не физиологичны.
В печени и почках содержится особый фермент — оксидаза D-аминокислот, предполагают, что она превращает нефизиологичные правые аминокислоты в физиологичные левые. Количество ее невелико, т.к. обычно в пище содержится очень мало D-аминокислот.
При химическом синтезе образуется равное количество D- и L- изомеров, но в синтезе белка участвуют аминокислоты только L – ряда. Это следует учитывать лицам, принимающим препараты аминокислот: L-аминокислоты будут существенно дороже из-за необходимости их выделения из смеси, но эффект от их применения будет существенно выше
Читайте далее о том, что делает в организме каждая аминокислота. Поверьте, им есть, чем заняться. С вами была Галина Батуро. Делитесь информацией в соц.сетях, оставляйте комментарии.
Источник: https://zaryad-zhizni.ru/stroenie-osnovnyih-aminokislot/
Что такое аминокислоты, таблица, формулы, свойства, применение
В составе живых организмов присутствуют такие сложные органические образования как белки. В состав тела человека входит 30% органических веществ, среди которых основное количество приходится на эти сложные соединения.
В свое время Фридрих Энгельс сказал «Жизнь есть способ существования белковых тел». Таблица аминокислот в количестве 20 молекул с разными формулами – это тот основной арсенал, из которого построены белковые макромолекулы.
Что такое аминокислоты
Разгадка их строения находится в названии. Слово «амино» говорит о наличии аминогруппы – NH2, а «кислоты» — о присутствии в составе кислотной карбоксильной группы – СООН. По-другому, данная группа соединений состоит из карбоновой кислоты, один из атомов водорода которой замещен на аминогруппу.
Формула не так проста: между аминогруппой и карбоксильной группой находится углеродный скелет аминокислоты, который отличается функциональными группами. Поэтому строение аминокислот различно, как и их формулы. Наличие кислотных и основных свойств делает их амфотерными (нейтральными) соединениями. Кислые аминокислоты – не совсем верное выражение, да и вкус у них сладковатый.
Это кристаллические вещества, которые плавятся при высоких температурах (+250°С) и хорошо растворяются в воде, но сохраняют состав в большинстве органических растворителей. Большинство веществ этой группы обладают сладким вкусом.
Они способны образовывать соли, эфиры, но основное химическое свойство аминокислот – это возможность создавать белковые макромолекулы. Соединяясь между собой аминокислоты обрадуют петпиды (кусочки белкового скелета). Две кислоты образуют дипептид:

Три собираются в трипептид, четыре формируют тетрапептид и так постепенно идет сборка белковой макромолекулы. Ответ, зачем нужны аминокислоты, кроется в создании огромного разнообразия белков. Они являются мономерами, из которых строится крупная полимерная нить белка со своей формулой и свойствами.
Представим себе аминокислоту (АМК) в виде бусины. Разные бусины нанизываем на длинную нить. Это первичное строение белка. Затем эту нить сворачиваем в виде зигзага, чтобы некоторые бусинки соприкасались между собой. Так получается вторичная структура.
Затем эту нить еще несколько раз скручиваем, чтобы образовался клубок, и выходим на третичную структуру. Несколько бусин-клубков, соединенных вместе, образуют четвертичную структуру.
Каждый белок устроен непросто, но благодаря строению и свойствам аминокислот создаются особые конфигурации разных белковых макромолекул со своим строением и уникальной формулой.
Ученые насчитали 200 различных аминокислот, которые встречаются в клетках и тканях разных организмов. Они обнаружены в свободном и связанном виде. Некоторые из них единичны и уникальны: они найдены в отдельных организмах.
Незаменимые и заменимые аминокислоты
Из большого разнообразия только 20 аминокислот обладают свойством образовывать белки. АМК делятся на α-, β-, γ-, δ- и ω-аминокислоты, обладающие разными формулами и химическими свойствами. Наиболее важны альфа аминокислоты, из которых строится большинство белков.
Существует классификация аминокислот, которая делит эту группу на гидрофильные (обладающие свойством взаимодействия с водой) и гидрофобные аминокислоты (пытаются избежать контакта с водой). Но есть и классификация, которая строится на поступлении их в организм: виды аминокислот делятся на заменимые и незаменимые.
Незаменимые
К незаменимым АМК относятся соединения, которые организм не способен синтезировать в необходимом количестве. Это следующий комплекс аминокислот:
- лейцин;
- валин;
- лизин;
- метионин;
- треонин;
- триптофан;
- фенилаланин;
- гистидин.
Каждая из них имеет свою формулу, свойства и выполняет определенную роль в ходе обменных процессов. Есть группа и условно-незаменимых аминокислот, которые организм синтезирует в недостаточных для него количествах. Это тирозин и цистеин.
Заменимые
Эту группу АМК организм синтезирует самостоятельно. Лучшие аминокислоты вырабатываются внутри организма, их не нужно постоянно поставлять извне. К ним относятся:
- аргинин;
- аланин;
- аспаргин;
- глутамин;
- глицин;
- карнитин;
- орнитин;
- пролин;
- серин;
- таурин.
Каждый из них играет важную роль в организме. Обладает строением (формулой), которое определяет его свойства. А в целом они участвуют в белково-углеводном обмене, в синтезе нужных организму веществ. Из аминокислот стоятся гормоны, витамины, алкалоиды, пигменты и другие соединения.
Аминокислоты в продуктах питания
Чтобы избежать дефицита соединений с важными свойствами, их нужно получать извне с пищей. Источником аминокислот служит «продуктовая корзина» с белковым набором веществ.
«Незаменимые аминокислоты: список в продуктах питания»
| незаменимые | ||
| 1. | лейцин | молочные продукты, овес, зародыши пшеницы, мясо |
| 2. | валин | мясо, грибы, зерновые и молочные продукты, грецкие орехи |
| 3. | лизин | бобовые и молочные продукты, мясо птицы, рыба, арахис, зародыши пшеницы |
| 4. | метионин | бобовые продукты, мясо, овощи, творог, арахис |
| 5. | треонин | молочные продукты, мясо, яйца, горох |
| 6. | триптофан | мясо индейки, молочные продукты, яйца, орехи, семечки, рис, картофель |
| 7. | фенилаланин | мясные и молочные продукты, куриное мясо, овес, зародыши пшеницы |
| 8. | гистидин | мясо, молочные продукты, зародыши пшеницы |
| условно-незаменимые | ||
| 9. | тирозин | молочные и мясные продукты, рыба, миндаль, бананы |
| 10. | цистеин | рыба, мясо, соевые продукты, пшеница, овес, куриное филе, чеснок |
Аминокислоты в продуктах в обязательном порядке должны поступать в организм. Они постоянно востребованы в синтезе белка. Это свойство делает их в полном смысле незаменимыми и нужными.
Зная, в каких продуктах содержатся аминокислоты, легко составить меню, включив необходимый продуктовый набор. Оптимальное соотношение нужных компонентов возможно только при правильном питании. Например, молоко и молочные продукты содержат практически полный комплекс незаменимых АМК.
Аминокислоты в человеческом организме
Природные аминокислоты – это 200 нужных соединений и 200 уникальных формул. Они встречаются в свободном или связанном виде. Когда АМК синтезируются самостоятельно, проблем не возникает. Основное внимание следует обращать на незаменимые компоненты белковых молекул, которые нужно получать извне. У них свои формулы и нужные организму, основные свойства:
- улучшение работы мозга за счет способности передачи нервных импульсов (валин, лейцин, триптофан);
- накопление кальция (лизин),
- усиление липидного обмена (метионин);
- нормализация деятельности ЦНС (изолейцин, метионин, треонин);
- улучшение аппетита (фенилаланин);
- снижение болевого порога (фенилаланин).
Существует 8 незаменимых АМК, но важен контроль за тремя из них: валином, лейцином и изолейцином (ВССА). Их формула имеет разветвленные боковые цепи. Если не возникнет дефицита ВССА, то и потребность в других аминокислотах будет удовлетворена.
Признаки недостатка и переизбытка аминокислот
Нехватка или избыточное содержание АМК влияет на общее состояние организма. При их недостатке наблюдается:
- плохой аппетит;
- состояние сонливости и слабости;
- торможение роста и развития;
- выпадение волос;
- плохое состояние кожи;
- анемия;
- слабая иммунная защита.
Свойства АМК таковы, что их переизбыток тоже влияет на здоровье:
- При высоком содержании тирозина изменяется баланс в работе щитовидки, развивается гипертония.
- При избытке гистидина возможны болезни суставов, аневризма аорты. Возникает ранняя седина.
- При большой концентрации метионина велик риск развития инсульта или инфаркта.
Такие проблемы возможны при нехватке ряда витаминов (А, С, группы В) и селена. В их присутствии происходит нейтрализация избыточного содержания аминокислот.
Баланс АМК связан с правильным питанием и состоянием здоровья. При наличии хронических патологий печени, ЖКТ, недостатке некоторых ферментов содержание количества АМК становится неконтролируемым.
Суточная потребность в аминокислотах
Каждая аминокислота со своей индивидуальной формулой и свойствами нужна организму в определенных количествах. Подсчет суточной нормы нужного организму набора сложен, поскольку зависит от ее содержания в 1 г белка. Общая потребность в нужных аминокислотах составляет 0,5-2 г в день.
Если суточная норма белка примерно 120 г, то человек получает:
- 8,4 г лейцина;
- 4,8 г изолейцина;
- 6 г валина.
Это те самые ВССА, которые покрывают дефицит незаменимых аминокислот. Суточная норма нужного белка для мужчин – 65-120 г, для женщин – 60-90 г. Половина этой нормы приходится на белки животного происхождения. Аминокислоты входят в состав белков, поэтому возможно просчитать, в каком количестве они попадают в организм.
Активный метаболизм аминокислот происходит:
- во время роста организма;
- при активных занятиях спортом;
- при серьезных умственных и физических нагрузках;
- в период болезни и в процессе выздоровления.
Скорость усвоения нужных АМК зависит от отдельных продуктов или их сочетания. Организм быстро усваивает белок яиц, обезжиренный творог, нежирное мясо и рыбу. Хорошо идет усвоение при сочетании молока с гречневой кашей и белым хлебом, мучных изделий с мясом и творогом.
Если организм здоров и потребление белка соответствует суточной норме, то можно не задумываться над вопросом, как правильно принимать аминокислоты. Больше всего нужных компонентов белка содержится в мясе, молоке и яйцах. Их правильное распределение в течение дня позволит насытить организм необходимыми веществами с разными формулами и с важными для метаболизма свойствами.
Полезные свойства аминокислот, их влияние на организм
Основной наследственный материал клетки – это ДНК, одной из задач которого является синтез цепочек аминокислот. Пептидные нити создаются также в митохондриях (органеллы, которые называются «маленькими силовыми станциями»). Так, в митохондриях синтезируется серин и другие кислоты.
Из них строятся нужные организму белковые конгломераты. АМК строят наше тело, создавая мышечную массу. Они нужны для работы мозга, помогают женщине сохранить внешнюю красоту. Но это лишь верхушка айсберга: биологическая роль аминокислот огромна.
Аминокислоты для спортсменов
Чтобы добиться нужных результатов в спорте, необходимо строить и укреплять мышечную массу. Свойства АМК обеспечивают:
- доступ к мышцам строительного материала;
- построение мышечных белков;
- быстрые окислительно-восстановительные процессы в мышцах;
- выработку гормонов;
- ускорение анаболических процессов (обновление клеток и тканей);
- необходимые процессы для иммунитета, его роста;
- нормализацию белкового обмена;
- сжигание жировой ткани.
Для спортсменов кислоты предлагаются в виде жидких концентратов и желатиновых капсул. Обычно их принимают во время еды или между приемами пищи в чистом виде. Как принимать аминокислоты, сказано в аннотации к каждому конкретному препарату: имеет значение также время начало или окончания тренировки.
Аминокислоты для похудения
Процесс потери лишних килограммов возможен только в том случае, если параллельно тренировать тело. Даже при диетическом питании включение в рацион белков обязателен. В реакцию с аминокислотами вступает жир, в результате чего происходит высвобождение дополнительной энергии.
Благодаря свойствам кислот происходит:
- быстрый белково-жировой обмен;
- расход жировых отложений;
- приостановка отложений жиров в артериях и печени.
При усиленных тренировках жировые отложения постепенно превращаются в мышечную массу. Жир более легкий, а белковая ткань тяжелая, поэтому планка весов может сохраняться на прежнем уровне. Визуально же фигура выглядит стройнее.
Аминокислоты для волос
Каждый волос образован белком кератином. В слое дермы находятся волосяные фолликулы, обладающие свойством роста. Формулы аминокислот волоса имеет линейное строение и нужны для построения новых кератиновых конгломератов. Белки волос образованы пятью основными АМК: глицином, таурином, пролином, аргинином и лизином.
Нужное и полноценное белковое питание поддержит качество волос в хорошем состоянии. Но если пряди потускнели, стали ломкими и слабыми, то нужны маски для укрепления формулы кератина.
Источником глицина и аргинина служит пищевой желатин, таурин входит в состав яичного желтка, а лизином и пролином богаты молочные продукты. Нужным для волос является и цистеин. Это источник серы, который придает прядям силу и блеск. Им обогащен желатин.
Отсюда вывод: нужно использовать желатиновые, масляно-яичные и молочные маски.
Если у женщины волосы сильно испорчены многочисленным окрашиванием или химическими завивками, то нужна профессиональная помощь косметолога и посещение салонов красоты, где предложат комплексную программу оздоровления прядей.
Аминокислоты для мозга
В медицине давно известно действие аминокислот на мозг. Это нужные кирпичики для строительства белков, которые являются питательным материалом для клеток головного мозга. Свойства некоторых кислот значительно улучшают состояние ЦНС в целом и работу мозга в частности:
- Формула глицина нормализует психоэмоциональное состояние и улучшает работоспособность мозга. Частично снимает губительное действие этанола на нервные клетки. Среди его полезных свойств восстановление нарушенных биоритмов: контроль за режимом сна и бодрствования.
- Формула фенилаланина обладает способностью восстанавливать организм при синдроме хронической усталости. Это нужное соединение для усиления остроты и скорости мысли и запоминания. Снимает тревожность и действует против стресса. Он синтезирует формулу фенилэтиламина – вещества, влияющего на состояние влюбленности.
- Тирозин – самый нужный и мощный антидепрессант. Он входит в состав «гормонов радости» и «гормонов опасности». Оказывая влияние на основные обменные процессы, поддерживает тонус организма. Снимает болевой порог и стресс у женщин при различных гормональных перестройках.
- Триптофан снижает уровень агрессии, что позволяет лечить гиперактивность у детей. Он обладает свойством обнаруживать очаги патологической активности в мозге, предупреждая развитие головной боли и расстройства сна. Усиливает чувство голода, позволяя лечить булимию и анорексию. Уменьшает количество депрессивных эпизодов.

Аминокислоты в таблетках используются, если их недостаточно в питании или нужно подкорректировать определенную проблему, возникшую в организме.
Например, свойства глицина используют при неврозах, истощении и стрессах. Он выпускается в виде белых таблеток со сладковатым вкусом.
Синтетический вариант фенилаланина предназначен для использования при лечении неврозов, депрессий и биполярного расстройства.
Выпускается большое количество нужных для здоровья препаратов с аминокислотами в составе. Например, Энсил, Феличита, Амвикс, Канакор и другие, не менее нужные и востребованные препараты.
Формулы компонентов и свойства позволяют решить некоторые проблемы, связанные со здоровьем. Как пить аминокислоты, указано в инструкции к препаратам. Дозировку и продолжительность приема назначает врач, исходя из анамнеза больного.
Лучше всего использовать нужные свойства аминокислот, поглощая насыщенные ими продукты. Включенные в рацион мясо, яйца, молочные продукты, злаковые, бобовые позволят организму получать необходимый набор кислот и строить огромное разнообразие белковых молекул. Не нужно забывать, что «жизнь есть способ существования белковых тел».
Источник: https://vitaminic.ru/nutrienty/aminokisloty
Аминокислоты | CHEMEGE.RU
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицинNH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) | цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) |
|
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOHглутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOHлизин |
Номенклатура аминокислот
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| 2 – Аминобутановая кислота | 3-Аминобутановая кислота |
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
| α-Аминомасляная кислота | β-Аминомасляная кислота |
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
Получение аминокислот
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):
Химические свойства аминокислот
| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |
1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
| Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с основаниями
По аминогруппе аминокислоты реагируют с основаниями:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |
3. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
| Например, глицин реагирует с аланином с образованием дипептида (глицилаланин): |
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Источник: https://chemege.ru/aminokisloty/
Уроки биологии в классах естественно-научного профиля
|
7. Утверждение: «Дигидрофосфат-ионы способны понизить рН клетки, превращаясь в гидрофосфат-ионы»:
а) верно; б) неверно.
- Ответы
- Вариант 1: 1 – б; 2 – в, г; 3 – а, б, в, г, е, ж, з; 4 – б; 5 – б; 6 – б; 7 – б, в.
- Вариант 2: 1 – б; 2 – а, б, д, з; 3 – б; 4 – а, б, г, е; 5 – б; 6 – б, в; 7 – а.
II. Изучение нового материала
1. Белки, их содержание в живом веществе и молекулярная масса
Из органических веществ живого вещества на первом месте по количеству и значению стоят белки, или протеины (от греч. протос – основной, первичный). В составе ныне живущих на Земле организмов содержится около 1 трлн т белков. От массы, например животной, клетки белки составляют 10–18%, т.е. половину сухого веса клетки.
Белковых молекул в каждой клетке содержится, по меньшей мере, несколько тысяч.
Белки – это высокомолекулярные полимеры (макромолекулы) с молекулярной массой от 6 тыс. до 1 млн и выше. По сравнению с молекулами спирта или органических кислот белки выглядят просто великанами. Так, молекулярная масса инсулина – 5700, яичного альбумина – 36 000, миозина – 500 000.
В состав белков входят атомы С, Н, О, N, S, Р, иногда Fe, Сu, Zn. Для выяснения химического строения белков знаний их элементарного состава недостаточно. Например, эмпирическая формула гемоглобина – C3032Н4816О872S8Fe4 – ничего не говорит о характере расположения атомов в молекуле. Необходимо познакомиться с особенностями строения белковых молекул подробней.
2. Белки – непериодические полимеры. Строение и свойства аминокислот
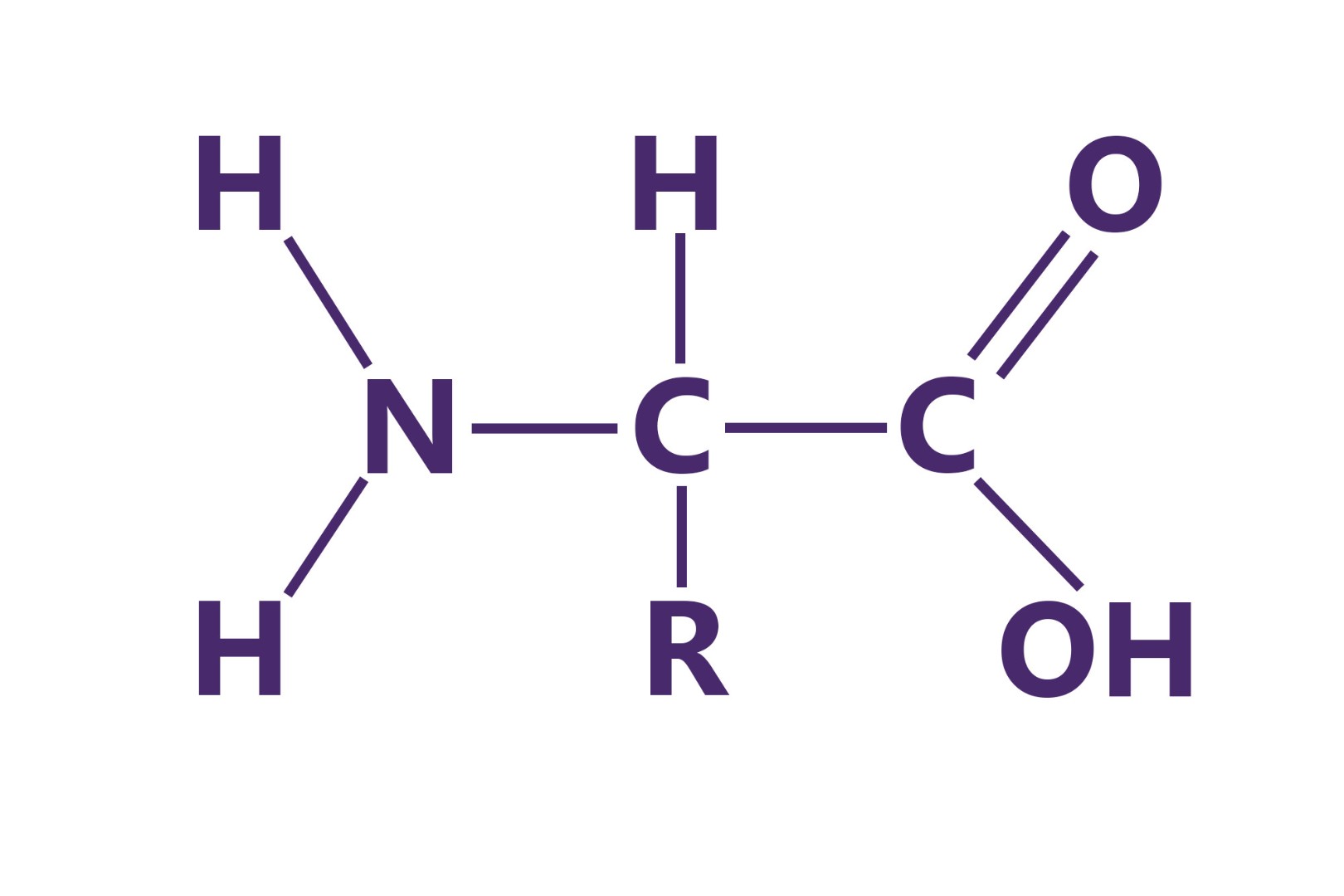
Схема строения аминокислоты |
По своей химической природе белки являются непериодическими полимерами. Мономерами белковых молекул являются аминокислоты. Вообще аминокислотой можно назвать любое соединение, содержащее одновременно аминогруппу (–NH2) и группировку органических кислот – карбоксильную группу (–СООН).
Число возможных аминокислот очень велико, но белки образуют только 20 так называемых золотых, или стандартных, аминокислот (8 из них являются незаменимыми, т.к. не синтезируются в организмах животных и человека). Именно сочетание этих 20 аминокислот и дает все многообразие белков.
После того как молекула белка собрана, некоторые аминокислотные остатки в ее составе могут подвергаться химическим изменениям, так что в «зрелых» белках можно обнаружить до 30 различных аминокислотных остатков (но строятся все белки исходно все равно только из 20!).
Аминокислоты, образующиеся в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь, называются нестандартными.
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков.
Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления пищеварительными ферментами белков пищи или распада собственных запасных белков.
В зависимости от аминокислотного состава белки бывают полноценными, содержащими весь набор аминокислот, и неполноценными, в составе которых отсутствуют какие-то аминокислоты.
Общая формула аминокислот изображена на рисунке. В левой части формулы расположена аминогруппа –NH2 а в верхней – карбоксильная группа –СООН. Группа –NH2 имеет основные свойства, группа –СООН – кислотные свойства. Таким образом, аминокислоты – амфотерные соединения, совмещающие свойства кислоты и основания.
Аминокислоты отличаются своими радикалами (R), в роли которых могут быть самые разные соединения (работа с рисунками учебника). Это обусловливает большое разнообразие аминокислот.
Амфотерными свойствами аминокислот обусловлена их способность взаимодействовать друг с другом. Две аминокислоты соединяются за счет реакции конденсации в одну молекулу путем установления связи между углеродом кислотной и азотом основной групп с выделением молекулы воды.
Образование пептидной связи
Связь, изображенная слева, называется пептидной (от греч. пепсис – пищеварение). Этот термин напоминает нам о том, что эта связь гидролизуется пищеварительным ферментом желудочного сока пепсином. По природе пептидная связь является ковалентной.
Соединение двух аминокислот называется дипептидом, трех – трипептидом и т.д. Примером трипептида может служить белок глютатион, состоящий из остатков глицина, цистеина и глютаминовой кислоты. Он содержится во всех живых клетках (особенно много его в зародыше пшеничного зерна и дрожжах) и активно участвует в обмене веществ.
Глютатион
В основном же белки, входящие в состав живых организмов, включают в себя сотни и тысячи аминокислот (чаще всего от 100 до 300), поэтому их называют полипептидами. Аминокислоты в составе белковой полипептидной цепи называют аминокислотными остатками.
Пептиды различаются числом (n), природой, порядком или последовательностью своих аминокислотных остатков. Их можно сравнить со словами разной длины, в написании которых использован алфавит, состоящий из 20 букв.
Из 20 аминокислот можно теоретически получить 1020 возможных вариантов цепей, длиной каждая не менее чем 10 аминокислотных остатков. Белки же, выделенные из живых организмов, образованы сотнями, а иногда и тысячами аминокислотных остатков.
В этом кроется источник бесконечного разнообразия белковых молекул, что является важной предпосылкой эволюционного процесса.
3. Первичная, вторичная, третичная и четвертичная структуры белка
Как показало изучение свойств белков в растворах, макромолекулы белков имеют форму компактных шаров (глобул) или вытянутых структур – фибрилл.
Исследования показали, что в укладке пептидной цепи нет ничего случайного или хаотичного. Она свертывается упорядоченно, для каждого белка определенным образом.
Полярные боковые группы аминокислот стремятся расположиться на поверхности глобулы, где могут взаимодействовать с водой, а неполярные группы располагаются внутри.
Образование глобулы
Для того, чтобы разобраться в замысловатой укладке (архитектонике) белковой макромолекулы, следует рассмотреть в ней несколько уровней организации.
Первичной структурой белка называется полная последовательность аминокислотных остатков в полипептидной цепи.
Она определяется генотипом, т.е. генами организма. В первичной структуре все связи между аминокислотными остатками являются ковалентными и, следовательно, прочными.
Разные белки отличаются друг от друга по первичной структуре: кератин имеет одну последовательность аминокислот, пепсин – другую, соматотропин (гормон роста) – третью и т.д.
В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером в 1944–1954 гг. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (из 21 и 30 аминокислотных остатков), удерживаемых друг около друга дисульфидными мостиками.
Однако молекула белка в виде цепи аминокислот, последовательно соединенных пептидными связями, еще не способна выполнять специфические функции. Для этого необходим более высокий уровень структурной организации, выражающийся в усложнении пространственного расположения мономеров.
Вторичная структура белка представлена спиралью, в которую закручивается полипептидная цепь. Группы N–H и С=О, входящие в пептидную связь, заметно поляризованы: азот обладает большей электроотрицательностью, чем водород, а кислород – большей, чем углерод.
Кислород группы С=О может образовывать водородные связи с водородом группы N–H (разумеется, расположенной в другой пептидной связи).
Одной из разновидностей вторичной структуры является —спираль, где каждый атом кислорода связан с атомом водорода четвертой по ходу спирали NH-группы.
-спираль
Любопытно, что эта сложная красивая структура сперва была предсказана известным биохимиком Л.Полингом теоретически и лишь потом обнаружена экспериментально.
Альтернативная вторичная структура -слой (или складчатый слой) имеет водородную связь между звеньями соседних полипептидных цепей.
-слой
- Третичная структура белка представляет собой сложную трехмерную пространственную упаковку -спиралей и -слоев.
Эта трехмерная структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи несколько типов:
- 1) ионные, возникающие за счет электростатического взаимодействия между отрицательно и положительно заряженными боковыми группами;
- 2) гидрофобные («не любящие воду»), устанавливающиеся за счет стремления неполярных радикалов объединяться друг с другом, а не смешиваться с окружающей их водной средой;
- 3) дисульфидные, которые образуются между атомами серы SH-групп двух остатков аминокислоты цистеина. Эти S–S связи по своей природе являются ковалентными;
- 4) водородные, которые также возникают за счет взаимодействия между атомами радикалов.
Третичная структура белка не является конечной. Для некоторых белков, чаще всего регуляторных, характерна четвертичная структура, необходимая им для эффективного выполнения функции.
Четвертичная структура представлена ассоциантом, состоящим из нескольких полипептидных цепей. Например, сложная молекула гемоглобина состоит из двух -субъединиц (141 аминокислотный остаток) и двух -субъединиц (146 аминокислотных остатков).
Каждая субъединица связана с молекулой железосодержащего гема. В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, то есть способен переносить кислород.
Четвертичная структура стабилизируется теми же связями, что и третичная.
Пространственная конфигурация белка т.е. третичная и четвертичная структуры называется конформацией.
Конформация белка определяется его первичной структурой: белковая цепочка с определенной последовательностью аминокислот самопроизвольно укладывается с образованием природной пространственной конфигурации. Это получило название «самосборка белковой молекулы».
Если полипептидную цепь взять за концы, растянуть ее и затем отпустить, то она всякий раз будет свертываться в одну и ту же структуру, характерную для этого вида полипептида.
В то же время из сказанного, очевидно, следует, что, изменив всего лишь одну аминокислоту в каком-либо полипептиде, мы получим молекулу с совершенно иной структурой, а значит и с иными свойствами.
Уровни организации белковых молекул
4. Классификация белков
Сложность строения белковых молекул и чрезвычайное разнообразие их функций крайне затрудняет создание единой четкой классификации белков на какой-либо одной основе. Поэтому рассмотрим несколько классификаций белков.
1. Классификация белков по составу.
Простые белки (протеины) – состоят только из аминокислот (альбумины, глобулины, гистоны, склеропротеины).
Сложные белки (протеиды) – состоят из глобулярных белков и небелкового материала. Небелковую часть называют простетической группой (фосфопротеиды, гликопротеиды, нуклеопротеиды, хромопротеиды, липопротеиды, металлопротеиды, флавопротеиды).
2. Классификация белков по их структуре.
Фибриллярные – образуют длинные волокна или слоистые структуры (коллаген, миозин, фиброин, кератин). Они нерастворимы в воде.
Глобулярные – их полипептидные цепи свернуты в компактные глобулы (ферменты, антитела, гормон инсулин).
Промежуточные – фибриллярной природы, но растворяются в воде (фибриноген).
3. Классификация белков по функциям.
- Структурные – входят в различные структуры клетки и организма.
- Ферменты – являются биологическими катализаторами.
- Гормоны – являются регуляторами биологических функций.
- Транспортные – переносят различные вещества.
- Защитные – обеспечивают иммунные реакции организма.
- Сократительные – участвуют в сокращении мышечных волокон.
- Запасные – служат резервными веществами клетки и организма.
- Токсины – являются ядами, используемыми живыми существами в целях защиты или нападения.
- Таким образом, подходы к классификации белков могут быть различными.
- Продолжение следует
Источник: https://bio.1sept.ru/article.php?ID=200501407





