Из (118) известных на данный момент химических элементов (96) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
| активныеметаллы | металлы среднейактивности | неактивныеметаллы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.
 |
 |
 |
| Сильвин — хлорид калияKCl с примесями |
|
|
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
 |
 |
 |
|
|
|
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
 |
 |
 |
| Самородное золото Au | Самородное серебро Ag | Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
 |
||
|
|
|
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Открыть таблицу в большом размере
Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от (1) до (3) электронов. Исключение составляют только металлы (IV)А, (V)А и (VI)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов (выделены красным цветом) уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
Источник: https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/metally-15154/re-687935b4-cd8a-4f4a-9816-f5b2d95c1b1d
Характеристика химических элементов на примере фосфора, калия и магния. Аллотропия
«Химия. 9 класс». О.С. Габриелян
Вопрос 1.а) Характеристика фосфора.1. Фосфор — (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, Z = 15, атомная масса 30,97376. Атом фосфора содержит в ядре 15 протонов, 16 нейтронов и 15 электронов.
Атомы фосфора проявляют как окислительные свойства (принимают недостающие для завершения внешнего уровня три электрона, проявляя при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами — металлами, водородом и тп.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.).Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).4. Неметаллические свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы (соседние элементы в периоде).5. Высший оксид фосфора имеет формулу Р2О5. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота Н3РО4.
Р2О5 + 3Н2О = 2Н3РО4.
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
Р2О5 + 3CaO = Ca3(PO4)2;
Р2О5 + 6NaOH = 2Na3PO4 + 3Н2О.6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:взаимодействие с основаниями и основными оксидами:
Н3РО4 + 3KOH = 2K3PO4 + 3Н2О.
2Н3РО4 + 3CaO = Ca3(PO4)2 + 3Н2О.7. Фосфор образует летучее соединение Н3Р — фосфин.б) Характеристика калия.1. Калий имеет порядковый номер 19, Z = 19 и Аr(К) = 39. Соответственно заряд ядра его атома +19 равен числу протонов. Следовательно, число нейтронов в ядре равно 20. Число электронов, содержащихся в атоме калия, равно 19.Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:Исходя из строения атома, можно предсказать степень окисления калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1. Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.2. Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.З. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.5. Оксид калия К2О является основным оксидом и проявляет все типичные свойства основных оксидов, взаимодействие с кислотами и кислотными оксидами.
K2O + 2HJ = 2KJ + Н2О;
K2O + CO2 = K2CO3.6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами. КОН + HJ = KJ + Н2О;
- 6КОН + P2O5 = 2K3PO4 + 3Н2О.
- Вопрос 2.

7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 3.Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.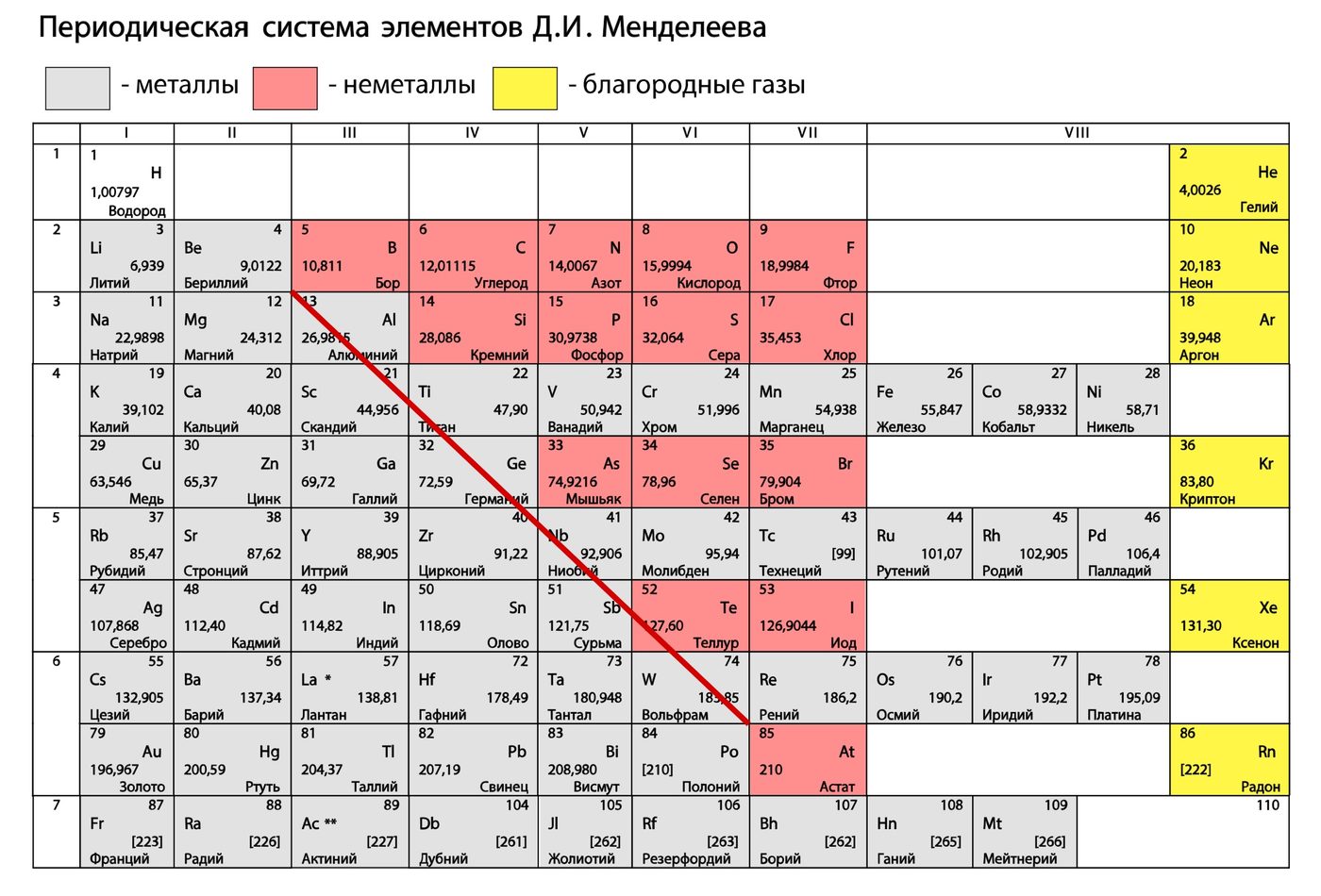
Вопрос 4.Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к.
происходит смещение электронной пары к более электроотрицательному атому — сере (S).Н → S ← Н
Физические свойства ромбической серы (S2):
Вещество лимонно-желтого цвета, устойчивое до t = 95,6°С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.Уравнения реакций:
Вопрос 5.Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, т.к. в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
- Вопрос 7.

- Вопрос 8.

Вопрос 9.Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4. Сернистой кислоте H2SO3 соответствует оксид SO2.Данные соответствия можно показать гидролизом оксидов:

Вопрос 10.
Источник: http://buzani.ru/khimiya/o-s-gabrielyan-9kl/21-vvedenie-obshchaya-kharakteristika-khimicheskikh-elementov-paragraf-1
Характерные химические свойства Be, Mg и щелочноземельных металлов
 К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», — пояснял Менделеев в «Основах химии».

- •Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
- • Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
- • Сильные восстановители
- •Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
- • К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
- • Бериллий по большинству свойств ближе к алюминию
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
- В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
- Mg + 2H2O –t°→ Mg(OH)2 + H2↑
- Ca + 2H2O → Ca(OH)2 + H2↑
2. Реакция с кислородом.
- Все металлы образуют оксиды RO, барий-пероксид – BaO2:
- 2Mg + O2 → 2MgO
- Ba + O2 → BaO2
- 3. С другими неметаллами образуют бинарные соединения:
- Be + Cl2 → BeCl2 (галогениды)
- Ba + S → BaS (сульфиды)
- 3Mg + N2 → Mg3N2 (нитриды)
- Ca + H2 → CaH2 (гидриды)
- Ca + 2C → CaC2 (карбиды)
- 3Ba + 2P → Ba3P2 (фосфиды)
- Бериллий и магний сравнительно медленно реагируют с неметаллами.
- 4. Все щелочноземельные металлы растворяются в кислотах:
- Ca + 2HCl → CaCl2 + H2
- Mg + H2SO4(разб.) → MgSO4 + H2
- 5. Бериллий растворяется в водных растворах щелочей:
- Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
- 6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
- соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.

 Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО2-2. Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО2-2. Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s22s22p63s2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е—.
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца.
Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку.
Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO4 и хлорид CaCL2. Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство.
Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Все соединения бария, кроме BaSO4, ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны.
Особую тревогу вызывает появление в организме радиоактивного изотопа стронция 90Sr.
Он исключительно медленно выводится из организма, а его большой период полураспада и, следовательно, длительность действия могут служить причиной лучевой болезни.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т1/2 = 1617 лет).
Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний.
Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция — наименее активного из всех щелочноземельных металлов — характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния («электрон»). Бериллий отличается от остальных металлов IIА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
- Be+H2O+2NaOH=Na2[Be(OH)4]+H2.
- Магний активно реагирует с азотом:
- 3 Mg + N2 = Mg3N2 .
- В таблице приведена растворимость гидроксидов элементов II группы.
| Растворимость, моль/л (200С) | Растворимость, г/л | |
Be(OH)2
|
8∙10-6
|
3,4∙10-4
|
Традиционная техническая проблема – жесткость воды, связанная с наличием в ней ионов Mg2+ и Ca2+ . Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Содержание S-элементов в организме человека
| Элемент | Содержание, % |
Li
|
10-4
|
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток. Изотонический раствор («физиологическая жидкость») содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п.
Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран («вытягивание» гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия.
В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов).
Кроме построения костей и зубов на основе гидроксилапатита Ca10(PO4)6(OH)2 , катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц. В сутки взрослому человеку нужно потреблять около 1 г кальция.
В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.

Источник: http://himege.ru/shhelochnozemelnye-metally/
Общая характеристика химических элементов и их соединений
Различают простые и сложные вещества. Простые вещества образованы атомами одного и того же элемента. Их условно разделяют на металлы и неметаллы. К неметаллам относят 22 элемента: благородные газы, галогены и H, B, C, N, O, Si, P, S. Остальные элементы относят к металлам.
Сложные вещества состоят из атомов различных элементов. В зависимости от состава и свойств сложные вещества подразделяют на классы: 1) оксиды; 2) гидроксиды; 3) соли.
Оксидами называют сложные вещества, состоящие из кислорода и какого-либо химического элемента ЭnOm.
Оксиды различают солеобразующие и несолеобразующие. К последним принадлежат СО, N2O, NO, SiO. Они не образуют солей, не реагируют с водой, другими оксидами. Солеобразующие оксиды подразделяют на основные – оксиды металлов с низкой степенью окисления +1, +2 (Na2O, CaO, CuO);
кислотные – оксиды металлов, имеющие степень окисления +5, +6, +7 и неметаллы (SO3, Cl2O5, CrO3, Mn2O7);
амфотерные – оксиды металлов, проявляющие основные и кислотные свойства, например: BeO, Al2O3, Cr2O3, PbO2, ZnO, SnO.
Гидратные формы оксидов называют гидроксидами. В зависимости от химических свойств их делят на основные (основания),кислотные(кислоты) и амфотерные. Все гидроксиды содержат в своем составе группы Э–О–Н. В основаниях связь Э–О слабее, чем О–Н: Э–О–Н = Э+ + (ОН)–. В кислотах связь Э–О прочнее, чем О–Н: Э–О–Н = (ЭО) – + Н+. В амфотерных гидроксидах связи по прочности почти равноценны:
- (ЭО) – + Н+ = Э–О–Н = Э+ + (ОН)–
- Например,
- Гидроксиды
| основные | кислотные | амфотерные |
| NaOH | H2SO4 | Be(OH)2 и H2BeO2 |
| Са(ОН)2 | HClO4 | Zn(OH)2 и H2ZnO2 |
| Cu(OH)2 | H2CrO4 | Al(OH)3 и H3AlO3 |
| Ni(OH)2 | HMnO4 | Cr(OH)3 и H3CrO3 |
Соли – химические соединения, представляющие собой продукт полного или частичного замещения атома водорода у кислот на катионы металла (или аммония). Соли делят на:
| средние | кислые | основные |
| Al2(SO4)3 | NaHCO3 | CuOHCl |
| Cu(NO3)2 | КНS | (FeOH)2SO4 |
| NiCl2 | Na2НРO4 | NiOHNO3 |
Химические свойства неорганических соединений
С водой реагируют: а) основные оксиды, образованные щелочными и щелочноземельными металлами, б) кислотные оксиды.
- Между собой реагируют соединения с противоположными свойствами. Например:
- 1) кислотные оксиды и кислоты реагируют:
- а) с основными оксидами и основаниями:
- SO3 + Na2O = Na2SO4; H2SO4 + CuO = CuSO4 + H2O;
- SO3 + NaOН = Na2SO4 + H2O; H2SO4 + Mg(OH)2 = MgSO4 + 2H2O.
- б) с амфотерными оксидами и гидроксидами:
- SO3 + ZnO = ZnSO4; H2SO4 + ZnO = ZnSO4 + H2O;
- SO3 + Zn(OH)2 = ZnSO4 + H2O; H2SO4 + Zn(OH)2 = ZnSO4 + 2H2O.
- 2) основные оксиды и основания взаимодейтсвуют:
- а) с кислотными оксидами и кислотами;
- б) оксиды щелочных металлов и щелочи взаимодействуют с амфотерными оксидами и гидроксидами:
- Na2O + ZnO = Na2ZnO2; 2 NaOН + ZnO = Na2ZnO2 + H2O;
- Na2O + Zn(OH)2 = Na2ZnO2 + H2O; 2NaOН + Zn(OH)2 = Na2ZnO2 + 2H2O
- 3) кислоты и щелочи реагируют с солями, если в результате образуются труднорастворимые, газообразные или слабодиссоциирующие соединения.
- НCl + AgNO3 = AgCl + НNO3;
- 2 NaOН + CuSO4 = Cu(OH)2 + Na2SO4;
- 2 NaOН + 2 CuSO4 = (CuOH)2SO4 + Na2SO4;
- 2 НNO3 + Na2CO3 = 2 NaNO3 + Н2CO3;
- НNO3 + Na2CO3 = NaNO3 + NaНCO3;
- КOН + NН4Cl = КCl + NН4OН.
- Способы получения кислых солей
- 1) взаимодействием кислоты или кислотного оксида с основанием или основным оксидом при недостатке последних:
- Н3РO4 + КOН = КН2РO4 + Н2O (дигидрофосфат калия);
- Н3РO4 + Na2O = Na2НРO4 + Н2O (гидрофосфат калия);
- CO2 + NaOН = NaНCO3 (гидрокарбонат натрия);
- 2) взаимодействием средней соли с кислотой:
- CaSO3 + H2SO3 = Ca(НSO3)2 (гидросульфит кальция).
- Кислые соли переводят в средние добавлением основания:
- Ca(НSO3)2 + Ca(OH)2 = 2 CaSO3 + 2 Н2O.
- Способы получения основных солей
- 1) взаимодействием основания с кислотным оксидом или кислотой при недостатке последних:
- Cu(OH)2 + НCl = CuOHCl + Н2O (гидроксохлорид меди);
- Fe(OH)3 + SO3 = FeOHSO4 + Н2O (гидроксосульфат железа III);
- 2) взаимодействием средней соли с недостатком щелочи:
- Mg(NO3)2 + NaOН = MgOНNO3 + NaNO3 (гидроксонитрат магния).
- Основные соли переводят в средние добавлением кислоты:
- FeOHCl2 + НCl = FeCl3 + Н2O.
- Задания к разделу общая характеристика химических элементов
- И их соединений
- Напишите уравнения возможных реакций взаимодействия КOН, H2SO4, Н2O, Be(OH)2 с соединениями, приведенными ниже:
- 81) К2O, NO, Na2СО3, Н2SiO3, Mg(OH)2, НCl;
- 82) HBr, Ca(OH)2, H2CO3, K2S, NO2, N2O3;
- 83) H2SO3, BaO, CO2, HNO3, Ni(OH)2, Ca(OH)2;
- 84) N2O5, HI, LiOH, SiO2, SrO, CaCO3;
- 85) HCl, P2O5, NH4OH, MgO, Ba(OH)2, Na2SO4;
- 86) NO, Cu(OH)2, SO3, HClO4, FeO, CuSO4;
- 87) N2O, CaO, HNO3, SO3, Co(OH)2, Al2(SO4)3;
- 88) NiSO4, KOH, HI, P2O3, SiO2, Co(OH)2;
- 89) HBr, K2O, NiCl2, Cr(OH)3, N2O5, Ca(OH)2;
- 90) H2S, Zn(OH)2, AlCl3, MgO, NaHCO3, NO2;
- 91) (CoOH)2SO4, HCl, BaCl2, CaO, SO2, Al(OH)3;
- 92) KHS, Mn(OH)2, BaCl2, BaO, CO2, HCl;
- 93) H3PO4, CdCl2, FeO, Sr(OH)2, KHCO3, N2O;
- 94) SO3, H2CO3, MgO, Cd(OH)2, NiOHCl, NH4Cl;
- 95) H2SO3, FeO, SnO, Fe2(SO4)3, KH2PO4, HCl;
- 96) CH3COOH, Mn2O7, MnO, BaCl2, Mg(OH)2, Al2O3;
- 97) K2HPO4, NH4Cl, SO2, NiSO4, Fe(OH)3, CdO;
- 98) NiOHNO3, SiO2, PbO, Cd(OH)2, KOH, ZnSO4;
- 99) HNO3, Mg(OH)2, KHCO3, CO, BaCl2, Cr(OH)3;
- 100) NO, AgNO3, SiO2, AlOHCl2, NiO, H2CO3.
Источник: https://infopedia.su/13x4f89.html
Общая характеристика металлов IА–IIIА групп
Кодификатор ЕГЭ. Раздел 1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность,г/см3 |
| Литий | 6,941 | +7 | 0,98 | 0,152 | 520,2 | 180,6 | 0,534 |
| Натрий | 22,99 | +11 | 0,99 | 0,186 | 495,8 | 97,8 | 0,968 |
| Калий | 39,098 | +19 | 0,82 | 0,227 | 418,8 | 63,07 | 0,856 |
| Рубидий | 85,469 | +37 | 0,82 | 0,248 | 403,0 | 39,5 | 1,532 |
| Цезий | 132,905 | +55 | 0,79 | 0,265 | 375,7 | 28,4 | 1,90 |
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами.
С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О.
Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Э2О + Н2О = 2ЭОН
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность,г/см3 |
| Бериллий | 9,012 | +8 | 1,57 | 0,169 | 898,8 | 1278 | 1,848 |
| Магний | 24,305 | +12 | 1,31 | 0,245 | 737,3 | 650 | 1,737 |
| Кальций | 40,078 | +20 | 1,00 | 0,279 | 589,4 | 839 | 1,55 |
| Стронций | 87,62 | +38 | 0,95 | 0,304 | 549,0 | 769 | 2,54 |
| Барий | 137,327 | +56 | 0,89 | 0,251 | 502,5 | 729 | 3,5 |
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
- Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
- Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
- … ns2nр1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Характеристики элементов IIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Радиус атома, нм | Энергия ионизации,Э → Э3+, эВ | Степень окисления в соединениях | Валентные электроны |
| Бор | 10,811 | +5 | 2,01 | 0,091 | 71,35 | +3, -3 | 2s22p1 |
| Алюминий | 26,982 | +13 | 1,47 | 0,143 | 53,20 | +3 | 3s23p1 |
| Галлий | 69,723 | +31 | 1,82 | 0,139 | 57,20 | +3 | 4s24p1 |
| Индий | 114,818 | +49 | 1,49 | 0,116 | 52,69 | +3 | 5s25p1 |
| Таллий | 204,383 | +81 | 1,44 | 0,171 | 56,31 | +1, +3 | 6s26p1 |
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы.
Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам.
Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
В общем металлы IА–IIIА подгрупп характеризуются:
- небольшим количеством электронов на внешнем энергетическом уровне:
- сравнительно сильными восстановительными свойствами;
- низкими значениями электроотрицательности;
- сравнительно большими атомными радиусами (относительно радиусов других атомов в периодах, в которых расположены соответствующие металлы);
- металлической кристаллической решеткой;
- высокой электро- и теплопроводностью;
- твердым фазовым состоянием при нормальных условиях.
Источник: https://chemege.ru/me-ia-iiia/
1.2.2. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
В IA группу (главная подгруппа первой группы) таблицы Менделеева входят металлы — литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr.
Традиционно, данные элементы называют щелочными металлами (ЩМ), так как их простые вещества образуют при взаимодействии с водой едкие щелочи.
Последний из известных представителей группы щелочных металлов (Fr) является радиоактивным элементом, в связи с чем его химические свойства изучены недостаточно: период полураспада его наиболее долгоживущего изотопа 223Fr составляет всего лишь около 22 мин.
Электронные формулы, а также некоторые свойства щелочных металлов представлены в таблице ниже:
| Свойство | Li | Na | К | Rb | Cs | Fr |
| Заряд ядра Z | 3 | 11 | 19 | 37 | 55 | 87 |
| Электронная конфигурация в основном состоянии | [He]2s1 | [Ne]3s1 | [Аr]4s1 | [Kr]5s1 | [Хе]6s1 | [Rn]7s1 |
| Металлический радиус rмет, нм | 0,152 | 0,186 | 0,227 | 0,248 | 0,265 | 0,270 |
| Ионный радиус rион*, нм | 0,074 | 0,102 | 0,138 | 0,149 | 0,170 | 0,180 |
| Радиус гидратированного иона,rион , нм | 0,340 | 0,276 | 0,232 | 0,228 | 0,228 | — |
| Энергия ионизации, кДж/моль: I1 I2 | 520,2 7298 | 495,8 4562 | 418,8 3052 | 403,0 2633 | 375,7 2234 | (380) (2100) |
| Электроотрицательность | 0,98 | 0,93 | 0,82 | 0,82 | 0,79 | 0,70 |
При движении вниз по IA группе возрастает радиус атомов металлов (rмет), что, собственно, характерно для любых элементов всех главных подгрупп. Относительно малое увеличение радиуса при переходе от K к Rb и далее к Cs обусловлено заполнением 3d- и 4d-подуровней соответственно.
Ионные радиусы ЩМ существенно меньше металлических, что связано с потерей единственного валентного электрона. Они также закономерно возрастают от Li+ к Cs+. Размеры же гидратированных катионов изменяются в противоположном направлении, что объясняется в рамках простейшей электростатической модели.
Наименьший по размеру ион Li+ лучше катионов остальных щелочных металлов притягивает к себе полярные молекулы воды, образуя наиболее толстую гидратную оболочку.
Исследования показали, что в водном растворе катион лития Li+ окружен 26 молекулами воды, из которых только 4 находятся в непосредственном контакте с ионом лития (первой координационной сфере).
По этой причине многие соли лития, например, хлорид, перхлорат и сульфат, а также гидроксид выделяются из водных растворов в виде кристаллогидратов. Хлорид LiCl·Н2O теряет воду при температуре 95 °С, LiOH·Н2O — при 110°С, а LiClO4·Н2O — только при температуре выше 150°С.
С увеличением ионного радиуса катиона щелочного металла сила его электростатического взаимодействия с молекулами воды ослабевает, что приводит к снижению толщины гидратной оболочки и, как следствие, радиуса гидратированного иона [М(Н2O)n] (где n = 17, 11, 10, 10 для М+ = Na+, К+, Rb+, Cs+ соответственно).
Внешний энергетический уровень атома ЩМ содержит один единственный электрон, который слабо связан с ядром, о чем говорят низкие значения энергии ионизации I1. Атомы щелочных металлов легко ионизируются с образованием катионов М+, входящих в состав практически всех химических соединений этих элементов.
Значения I2 для всех щелочных металлов настолько высоки, что в реально осуществимых условиях ион М2+ не образуется. Электроотрицательность щелочных элементов мала, их соединения с наиболее электроотрицательными элементами (хлор, кислород, азот)имеют ионное строение, как минимум в кристаллическом состоянии.
Маленький радиус иона Li+ и высокая плотность заряда, являются причиной того, что соединения лития оказываются схожими по свойствам аналогичным соединениям магния (диагональное сходство) и в то же время отличаются от соединений остальных ЩМ.
Элементы IIA группы
В IIA группу Периодической системы элементов входят бериллий Ве, магний Мg и четыре щелочноземельных металла (ЩЗМ): кальций Са, стронций Sr, барий Ва и радий Ra, оксиды которых, раньше называемые «землями», при взаимодействии с водой образуют щелочи. Радий — радиоактивный элемент (α-распад, период полураспада примерно 1600 лет).
Электронная конфигурация и некоторые свойства элементов второй группы приведены в таблице ниже.
По электронному строению атомов элементы второй группы близки щелочным металлам. Они имеют конфигурацию благородного газа, дополненную
| Свойство | Be | Mg | Ca | Sr | Ba | Ra |
| Заряд ядра Z | 4 | 12 | 20 | 38 | 56 | 88 |
| Электронная конфигурация в основном состоянии | [He]2s2 | [Ne]3s2 | [Ar]4s2 | [Kr]5s2 | [Xe]6s2 | [Rn]7s2 |
| Металлический радиус rмет, нм | 0,112 | 0,160 | 0,197 | 0,215 | 0,217 | 0,223 |
| Ионный радиус rион*, нм | 0,027 | 0,72 | 0,100 | 0,126 | 0,142 | 0,148 |
Энергия ионизации, кДж/моль:
|
899,5 1757 14850 | 737,7 1451 7733 | 589,8 1145 4912 | 549,5 1064 4138 | 502,8 965 3619 | 509,3 979 3300 |
| Электроотрицательность | 1,57 | 1,31 | 1,00 | 0,95 | 0,89 | 0,90 |
двумя s-электронами на внешнем уровне. В то же время от элементов первой группы они отличаются более высокими значениями энергии ионизации, убывающими в ряду Ве—Мg—Са—Sr— Ва. Эта тенденция нарушается при переходе от бария к радию: повышениe П и І, для Rа по сравнению с Ва объясняется эффектом инертной 6s2-пары.
Следует отметить, что в то время как для щелочных металлов характерна значительная разница между I1 и I2 для элементов второй группы подобный скачок наблюдается между I2 и I3.
Именно поэтому щелочные металлы в сложных веществах проявляют только степень окисления +1, а элементы второй группы +2.
Наличие единственной положительной степени окисления и невозможность восстановления ионов M2+ в водной среде придает большое сходство всем металлам s-блока.
Изменение свойств по группе следует общим закономерностям, рассмотренным на примере щелочных металлов. Элемент второго периода бериллий, подобно элементу первой группы литию, значительно отличается по своим свойствам от других элементов второй группы.
Так, ион Be2+ благодаря чрезвычайно малому ионному радиусу (0,027 нм), высокой плотности заряда, большим значениям энергий атомизации и ионизации оказывается устойчивым лишь в газовой фазе при высоких температурах.
Поэтому химическая связь в бинарных соединениях бериллия даже с наиболее электроотрицательными элементами (кислород, фтором) обладает высокой долей ковалентности.
Химия водных растворов бериллия также имеет свою специфику: в первой координационной сфере бериллия могут находиться лишь четыре лиганда ([Be(H2O)4]2+, (Bе(OH)4]—), что связано с малым ионным радиусом металла и отсутствием d-орбиталей.
Щелочноземельные металлы (Са, Sr, Ва, Ra) образуют единое семейство элементов, в пределах которого некоторые свойства (энергия гидратации, растворимость и термическая устойчивость солей) меняются монотонно с увеличением ионного радиуса, а многие их соединения являются изоморфными.
Элементы IIIA группы
Элементы IIIA группы: бор В, алюминий Al, галлий Ga, индий In и таллий Tl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация внешнего энергетического уровня в основном состоянии ns2nр1 характеризуется наличием одного неспаренного электрона.
В возбужденном состоянии элементы IIIA группы содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, принимают участие в образовании трех ковалентных связей. При этом у атомов остается одна незанятая орбиталь.
Поэтому многие ковалентные соединения элементов IIIA группы являются акцепторами электронной пары (кислоты Льюиса), т.е. могут образовывать четвертую ковалентную связь по донорно-акцепторному механизму, создавая которую, они изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации).
Бор сильно отличается по свойствам от других элементов IIIA группы. Он является единственным неметаллом, химически инертен и образует ковалентные связи со фтором, азотом, углеродом и т.д. Химия бора более близка химии кремния, в этом проявляется Диагональное сходство.
У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома. Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами.
Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-pяду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Для таллия, свинца, висмута и полония наиболее устойчивы соединения со степенью окисления +1, +2, +3, +4 соответственно.
| Свойство | B | Al | Ga | In | Tl |
| Заряд ядра Z | 5 | 13 | 31 | 49 | 81 |
| Электронная конфигурация в основном состоянии | [He]2s22p1 | [Ne]3s23p1 | [Ar]3d104s24p1 | [Kr]4d105s25p1 | [Xe]4f145d106s26p1 |
| Атомный радиус, нм | 0,083 | 0,143 | 0,122 | 0,163 | 0,170 |
| Энергия ионизации, кДж/моль: I1 I2 I3 | 801 2427 3660 | 577 1817 2745 | 579 1979 2963 | 558 1821 2704 | 589 1971 2878 |
| Электроотрицательность | 2,04 | 1,61 | 1,81 | 1,78 | 2,04 |
Для соединений элементов IIIA группы наиболее характерна степень окисления +3. В ряду бор-алюминий-галлий-индий-таллий устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается.
Энергия связи М—Hal в галогенидах последних при переходе от легких к более тяжелым элементам М уменьшаются, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности, склонность катионов к гидролизу (взаимодействию с водой) ослабевает.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga2O, Ga2S, InCl и др.) в водных растворах диспропорционируют. Для таллия состояние +1, напротив, является наиболее устойчивым из-за инертности электронной пары 6s2.
Источник: https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/harakteristika-metallov-ia-iiia-grupp




