ЦЕЛЬ УРОКА: Продолжить формирование понятий «химический элемент», «химическая реакция». Закрепить и углубить знания о периодической системе.
Подтвердить общие и особенные свойства меди и ее соединениях. Продолжить формирование логического мышления: умение сравнивать, делать выводы.
Показать причинно — следственную зависимость между составом, строением, свойствами и применением.
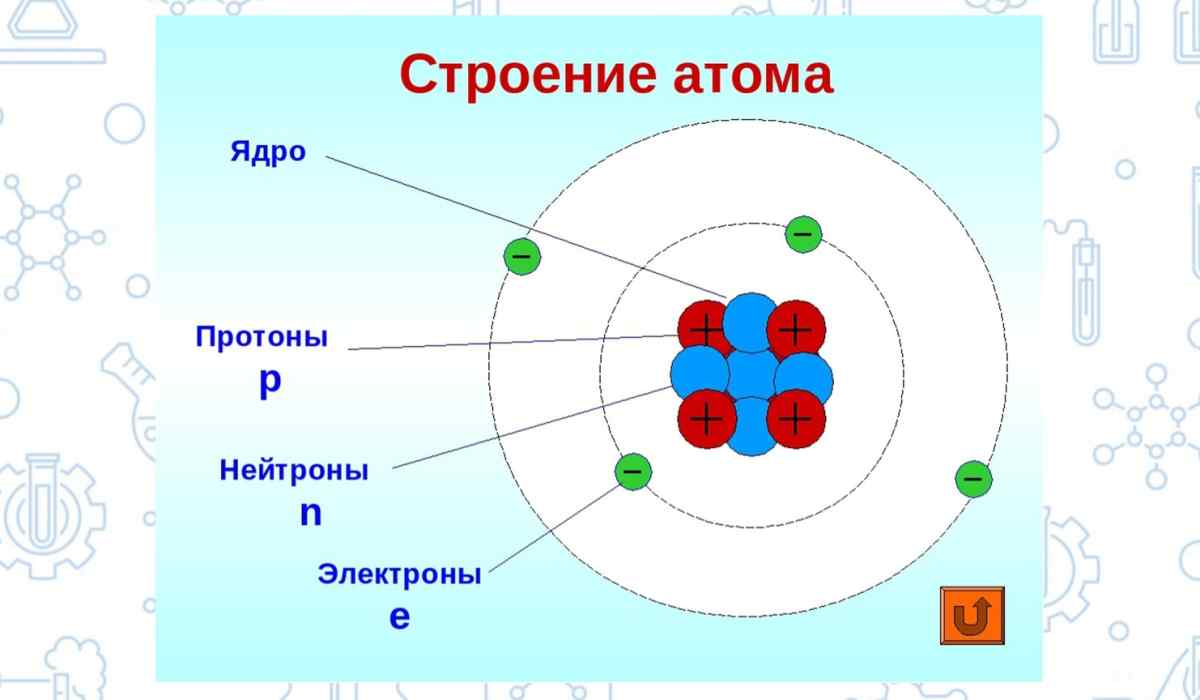
1.Строение атома
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Заряд ядра атома +29, относительная атомная масса равна 64. В ядре атома меди содержится 29 протонов, 29 электронов и 35 нейтронов. Обозначается символом Cu (лат. Cuprum).
29Сu +29 ) 2 ) 8 )18 )1
1s2 2s2 2p6 3s2 3p6 3d10 4s1
В атоме меди десятый d-электрон перешел на третий d-подуровень в результате «провала» с четвертого s-подуровня, поэтому этот электрон подвижный. Атомы меди в соединениях проявляют степени окисления +1(например, Cu2O) и +2 (например, CuO). Известно небольшое число нестойких соединений со степенью окисления +3 (например, Cu2O3).
2. Нахождение в природе
Медь встречается в природе как в соединениях, так и в самородном виде. Медные руды – природные минералы, содержащие медь в таких количествах, при которых извлечение металла экономически выгодно.
К важным минералам относятся:
Халькопирит CuFeS2 – (30 % меди)

Халькозин (медный блеск) Cu2S – (79,8% меди)

Ковеллин CuS – (64,4 % меди)

Малахит CuCO3 *Cu(OH)2 – (57,4 % меди)

Аузурит 2CuCO3 Cu(OH)2 – (55,5 % меди)

Природа сделала Казахстан кладовой руд цветных металлов, в том числе и меди. Большая часть запасов медных руд находится в Жезказганской области, имеются они и в Павлодарской, Жамбылской, Восточно-Казахстанской, Актюбинской областях, на Рудном Алтае.
- 3. Получение
- Для получения меди применяют пирометаллургический и гидрометаллургический процессы:
- а) пирометаллургический способ:
- 2Cu2S + 3O2 = 2Cu2 O + 2SO2
- 2Cu2O + Cu2S = 6Cu + SO2
- б) гидрометаллургический способ:
- CuO + H2SO4 = CuSO4 + H2O
- CuSO4 + Fe = Cu + FeSO4
Преимуществом гидрометаллургического метода является то, что получать металл можно, не извлекая руду на поверхность. В настоящее время этот метод является весьма перспективным.
Полученная медь обычно содержит много примесей. Очистку меди проводят при помощи электролитического рафинирования. Чистота получаемой электролитическим способом меди достигает 99,96%.
4. Физические свойства
Медь – блестящий, светло-розовый металл, тягучий, вязкий, легко прокатывается. Температура плавления 1083;плотность 8,9 г/см3.Отличный проводник электрического тока (уступает серебру).

5. Химические свойства
В сухом воздухе и при обычной температуре медь почти не изменяется, так как покрывается защитной пленкой соединений, состав которой зависит от примесей в воздухе. При повышенной температуре медь может вступать в реакции как с простыми, так и со сложными веществами.
- Взаимодействие с простыми веществами.
- 1. Взаимодействует с неметаллами
- Cu + Cl2 = CuCl2
- 2. При нагревании — с кислородом и серой
- 2Cu + O2 = 2CuО
- Cu + S = CuS
- С водородом и азотом медь не реагирует даже при нагревании.
- Взаимодействие со сложными веществами
- 1.Медь в ряду напряжений располагается после водорода, поэтому она реагирует с кислотами только в том случае, если они являются окислителями:
- Cu + 2H2SO4 (конц. ) = CuSO4 + SO2 + H2O
- Cu + 4HNO3 (конц. ) = Cu(NO3)2 + 2NO2 + 2H2O
- Сu + 4HNО3(разб.) = Cu(NО3 )2 + 2NO + 2Н2О
- 2. Ни с водой, ни с растворами обычных кислот медь не реагирует, но в присутствие кислорода может идти взаимодействие:
- 2Cu + 4HCI + O2 = 2CuCI2 + 2H2O
3. Она вытесняет из растворов солей менее активные металлы. Так, если погрузить медную пластинку в раствор нитрата серебра, то через некоторое время она покроется блестящим слоем серебра:
- Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
- 6. Соединения меди
- Наиболее распространены соединения, в которых медь имеет степень окисления +2, реже встречаются соединения со степенью окисления +1.
С кислородом медь образует два оксида. При нагревании на воздухе медь легко окисляется, превращаясь сначала в красный оксид Cu2O, а затем – в черный CuO.
- Водород восстанавливает медь из оксида меди:
- CuO + H2 = Cu + H2O [1].
- Cu(OH)2 – студенистый осадок голубого цвета. Его получают при действии щелочей на соли меди (II):
- CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
- Гидроксид меди (II) при нагревании разлагается:
- Cu(OH)2 = CuO + H2O
- чёрного цвета
- Легко растворяется в кислотах:
- CuO + H2SO4 = CuSO4 + H2O
- Cu(OH)2 + H2SO4 = CuSO4 + 2H2O [2].
CuSO4 – сульфат меди (II), белого цвета; с водой образует кристаллогидрат голубого цвета CuSO4 * 5H2O. Используется в сельском хозяйстве в качестве антисептика и для борьбы с вредителями.
Из других солей меди особой популярностью пользуется малахит Cu2(OH)2CO3, применяемый как ценный поделочный камень. Из солей меди вырабатывают большое количество минеральных красок: синих, коричневых, фиолетовых и черных.
- 7. Распознавание меди и ее соединений
- Медь и ее соединения окрашивают пламя горелки в сине-зеленый цвет. Соли меди (II) при добавлении щелочей образуют голубой осадок гидроксида меди (II):
- Cu2+ + 2OH- = Cu(OH)2
- 8. Биологическая роль меди
Не смотря на то, что ионы меди ядовиты, медь необходима нашему организму, она участвует в процессах кроветворения, входит в состав многих ферментов, ускоряющих процессы окисления, стимулирует углеводный обмен, синтез гемоглобина и жиров, образование витаминов. Cu в организме концентрируется в печени.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в ферменте супероксид дисмутазе и в переносящем кислород белке гемоцианине.
В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
9. Применение меди и ее сплавов
В электротехнике: медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже.
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость.
Теплообмен: Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Ювелирные сплавы: В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Другие сферы применения: Медь — самый широко употребляемый катализатор полимеризации ацетилена.
Бронза – сплав меди и олова, превосходит медь в твёрдости, устойчива к окислению. Бронзовый век — начало III тыс – I тыс до н. э.
Бронза широко использовалась для изготовления орудий труда, кухонная утварь: чаши, котлы. Изделия из бронзы отливались у египтян, индусов. Ассирийцев.
Широкое применение медь нашла в гальваностегии — получении металлических покрытий при помощи электролиза. Наиболее часто медь используется в коррозионно-стойком и декоративном никелировании и хромировании.



Источник: http://ebooks.semgu.kz/content.php?cont=r;1992
Соединения меди
- Медь относится к d-элементам.
- Как и все d-элементы, соединения меди ярко окрашены.
-

- Так же как у хрома, у меди наблюдается провал электронов — с s-орбитали на d-орбиталь
- Электронное строение атома:

- Соответственно, существуют 2 характерные степени окисления меди: +2 и +1.
- Простое вещество: металл золотисто-розового цвета.
- Оксиды меди: Сu2O оксид меди (I) оксид меди 1 — красно-оранжевого цвета
- СuO оксид меди (II) оксид меди 2 — черного цвета.
- Другие соединения меди Cu(I), кроме оксида, неустойчивы.
- Соединения меди Cu(II) — во-первых, стабильны, во-вторых, голубого или зеленоватого цвета.
Почему зеленеют медные монеты? Медь в присутствии воды взаимодействует с углекислым газом воздуха, образуется СuCO3 — вещество зеленого цвета.
Еще одно окрашенное соединение меди — сульфид меди (II) — осадок черного цвета.
Медь, в отличие от других элементов, стоит в ряду напряжений после водорода, поэтому не выделяет его из кислот:
- с горячей серной кислотой: Сu + 2H2SO4 = CuSO4 + SO2 + 2H2O
- с холодной серной кислотой: Сu + H2SO4 = CuO + SO2 + H2O
- с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 4NO2 + 4H2O - с разбавленной азотной кислотой:
3Cu + 8HNO3 = 3 Cu(NO3)2 + 2NO +4 H2O
Пример задачи ЕГЭ С2 вариант 1:
Нитрат меди прокалили, полученный твёрдый осадок растворили в серной кислоте. Через раствор пропустили сероводород, полученный чёрный осадок подвергли обжигу, а твёрдый остаток растворили при нагревании в азотной кислоте.
- 2Сu(NO3)2 → 2CuO↓ +4 NO2↑ + O2↑
- Твердый осадок — оксид меди (II).
- CuO + H2S → CuS↓ + H2O
- Сульфид меди (II) — осадок черного цвета.
«Подвергли обжигу» — значит, произошло взаимодействие с кислородом. Не путайте с «прокаливанием». Прокалить — нагреть, естественно, при высокой температуре.
- 2СuS + 3O2 = 2CuO + 2SO2
- Твердый остаток — это СuO — если сульфид меди прореагировал полностью, СuO + CuS — если частично.
- СuO + 2HNO3 = Cu(NO3)2 + H2O
- CuS + 2HNO3 = Cu(NO3)2 + H2S
- возможна так же другая реакция:
- СuS + 8HNO3 = Cu(NO3)2 + SO2 + 6NO2 + 4H2O
- Пример задачи ЕГЭ С2 вариант 2:
Медь растворили в концентрированной азотной кислоте, полученный газ смешали с кислородом и растворили в воде. В полученном растворе растворили оксид цинка, затем к раствору прибавили большой избыток раствора гидроксида натрия.
В результате реакции с азотной кислотой образуется Сu(NO3)2, NO2 и O2.
NO2 смешали с кислородом — значит, окислили: 2NO2 + 5O2 = 2N2O5. Cмешали с водой: N2O5 + H2O = 2HNO3.
ZnO + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
Обсуждение: «Соединения меди»
(Правила комментирования)
Источник: https://distant-lessons.ru/soedineniya-medi.html
Медь (Cu) и ее соединения, получение и применение меди
Медь купрум, свое название получила в честь острова Кипр, где было открытое крупное медное месторождение является одним из первых металлов, который освоил человек — Медный век эпоха, когда в обиходе человека преобладали медные орудия охватывает период IV—III тысячелетия до н. Сплав меди с оловом бронза был получен на Ближнем Востоке за лет до н.
Бронза была предпочтительней меди, поскольку была более прочна и лучше поддавалась ковке. Медь присутствует в природе, как в виде самородков, так и в соединений, наибольшее промышленное значение из которых имеют медный колчедан CuFeS2 , халькозин Cu2S и борнит Cu5FeS4. Разработка медных месторождений ведется открытым способом.
Медь в Периодической таблице химических элементов Д.

Строение атома меди
Химические связи образуются при взаимодействии электронных оболочек атомов. У всех атомов кроме водорода в образовании химических связей принимают участие не все электроны: Эти «активные»электроны называются валентными электронами. Валентные электроны — электроны, которые могут принимать участие в образовании атомом химических связей.
Иногда валентные электроны путают с внешними электронами, а это не одно и то же. Внешние электроны — электроны внешнего электронного слоя. Электронные облака внешних электронов имеют максимальный радиус и максимальное значение главного квантового числа.
Именно внешние электроны принимают участие в образовании связи в первую очередь, хотя бы потому, что при сближении атомов электронные облака, образованные этими электронами, приходят в соприкосновение прежде всего.
Но вместе с ними участие в образовании связи может принимать и часть электронов предвнешнего предпоследнего слоя, но только в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов.
И те и другие электроны атома являются валентными.
У лантаноидов и актиноидов валентными являются даже некоторые «предвнешние» электроны Энергия валентных электронов намного больше, чем энергия других электронов атома, а друг от друга валентные электроны по энергии отличаются существенно меньше. Внешние электроны — всегда валентные только в том случае, если атом вообще может образовывать химические связи.
Так, оба электрона атома гелия — внешние, но назвать их валентными нельзя, так как атом гелия вообще никаких химических связей не образует.
Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни. Валентные подуровни — электронные подуровни атома, на которых находятся, или могут находиться «свои «или «чужие «валентные электроны при образовании атомом химических связей.
Валентные орбитали — атомные орбитали, образующие валентные подуровни. В качестве примера рассмотрим атом железа, электронная конфигурация которого показана на рис. Следовательно, именно они и являются внешними электронами этого атома.
Внешние электроны — всегда валентные, следовательно, 4s-электроны атома железа — валентные электроны. А раз так, то и 3d-электроны, имеющие чуть большую энергию, также будут валентными.
На внешнем уровне атома железа кроме заполненной 4s-АО есть еще свободные 4p-, 4d- и 4f-АО.
Все они внешние, но валентные среди них только 4р-АО, так как энергия остальных орбиталей значительно больше, и появление электронов на этих орбиталях для атома железа не выгодно.
Томсон даже сумел определить скорость движения электрона скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. Электрон в атоме не имеет траектории движения, т.
По форме различают 4 известных ныне типа орбиталей, которые обозначаются латинскими буквами s, p, d и f. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром.
Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, — 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру.
По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Число подуровней равно значению главного квантового числа: Подуровни в свою очередь образованы орбиталями.
Каждому значению n соответствует число орбиталей, равное n. Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: Протоны и нейтроны Атом любого химического элемента сравним с крохотной Солнечной системой.
Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной. Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами от лат. Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия: Электроны обозначают e—. Поскольку атом электронейтрален, то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе.
Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента Z , т. Химические элементы, встречающиеся в природе, являются смесью изотопов.
Так, углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе.
Химические свойства изотопов большинства химических элементов совершенно одинаковы.
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Элементы первого периода Схема электронного строения атома водорода: Схемы электронного строения атомов показывают распределение электронов по электронным слоям энергетическим уровням.
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем 2 электрона. Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь. В атоме неона второй электронный слой завершен — в нем 8 электронов.
Подпишитесь!
Строение ядра Электроны Понятие атом возникло еще в античном мире для обозначения частиц вещества.
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В г.
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд.
Это наименьший отрицательный заряд, который в химии принят за единицу Томсон даже сумел определить скорость движения электрона скорость электрона на орбите обратно пропорциональна номеру орбиты n.
Радиусы орбит растут пропорционально квадрату номера орбиты. Электрон в атоме не имеет траектории движения, т.
По форме различают 4 известных ныне типа орбиталей, которые обозначаются латинскими буквами s, p, d и f. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром.
Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, — 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру.
По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Число подуровней равно значению главного квантового числа: Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: Протоны и нейтроны Атом любого химического элемента сравним с крохотной Солнечной системой.
Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной. Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов. Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона. Протоны и нейтроны вместе называют нуклонами от лат.
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия: Электроны обозначают e—. Поскольку атом электронейтрален, то также очевидно, что число протонов и электронов в атоме одинаково.
Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента Z , т.
Химические элементы, встречающиеся в природе, являются смесью изотопов.
Так, углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе.
Химические свойства изотопов большинства химических элементов совершенно одинаковы.
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Элементы первого периода Схема электронного строения атома водорода: Схемы электронного строения атомов показывают распределение электронов по электронным слоям энергетическим уровням. Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен — в нем 2 электрона. Водород и гелий — s-элементы; у этих атомов заполняется электронами s-орбиталь. В атоме неона второй электронный слой завершен — в нем 8 электронов.
Элементы третьего периода У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg — s-элементы.
Все элементы от Al до Ar — р-элементы. Элементы четвертого — седьмого периодов У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т.
Это 3d-элементы. Обратите внимание на строение электронных оболочек атомов хрома и меди. Элементы от Ga до Кr — р-элементы.
У атома криптона внешний слой четвертый завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни. У элементов пятого периода идет заполнение по-дуровней в следующем порядке: В шестом и седьмом периодах появляются f-элементы, т.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: Основное и возбужденное состояния Швейцарский физик В. Паули в г. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек — записывают так называемые графические электронные формулы.
Для этой записи используют следующие обозначения: При записи графической электронной формулы следует помнить два правила: Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
Правило Хунда и принцип Паули Правило Хунда — правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: Сформулировано Фридрихом Хундом в году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются образуют двухэлектронное облако и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия. Мультиплетность максимальна При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода то есть от бора до неона в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина.
Правило Хунда и принцип Паули Правило Клечковского Правило Клечковского — по мере увеличения суммарного числа электронов в атомах при возрастании зарядов их ядер, или порядковых номеров химических элементов атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l.
Физически это означает, что в водородоподобном атоме в отсутствие межэлектронного отталкивания орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: Аналогичная ситуация характерна и дляорбиталей 7s, 6d и 5f.
Распределение элекронов в атоме хрома — согласно правилам сверху и реальное снизу , согласно исключениям из правила Клечковского: Распределение элекронов в атоме меди — согласно правилам сверху и реальное снизу , согласно исключениям из правила Клечковского:
Медь (cu) и ее соединения, получение и применение меди

Электронное строение атома меди в химии, Cu. Атом состоит из положительно заряженного ядра (+29), внутри которого Схематическое строение. атом меди. Рис. Строение атома меди. Электронная конфигурация атома меди — 1s22s22p63s23p63ds1 (см. Электронная структура атомов). Электронное строение атома меди 1s22s22p63s23p63ds1. Атом меди легко отдает внешний электрон, образуя соединения Cu(I).
Ролик: Строение атома меди (Cu), схема и примеры
Строение ядра Электроны Понятие атом возникло еще в античном мире для обозначения частиц вещества.
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В г.
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд.
Источник: http://word.isp.regruhosting.ru/stroenie-atoma-medi-shema/
Cu — Медь

МЕДЬ (лат. Cuprum), Cu (читается «купрум»), химический элемент I группы периодической системы Менделеева, атомный номер 29, атомная масса 63,546.
Природная медь состоит из двух стабильных нуклидов 63Cu (69,09% по массе) и 65Cu (30,91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s2p6d104s1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.
В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро (Ag) и золото (Au).
Радиус нейтрального атома меди 0,128 нм, радиус иона Cu+ от 0,060 нм (координационное число 2) до 0,091 нм (координационное число 6), иона Cu2+ — от 0,071 нм (координационное число 2) до 0,087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7,726; 20,291; 36,8; 58,9 и 82,7 эВ.
Сродство к электрону 1,8 эВ. Работа выхода электрона 4,36 эВ. По шкале Полинга электроотрицательность меди 1,9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0,339 В.
В ряду стандартных потенциалов медь расположена правее водорода (H) и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь — красивый розовато-красный пластичный металл.
Название: латинское название меди происходит от названия острова Кипра (Cuprus), где в древности добывали медную руду; однозначного объяснения происхождения этого слова в русском языке нет.
Физические и химические свойства: кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0,36150 нм.
Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C.
Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10–3 Ом·м).
В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3.
Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной.
Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
- Красновато-коричневый оксид меди (I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди (I) CuBr и иодид меди (I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
- Cu2O + H2SO4 = Cu + CuSO4 + H2O.
- При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода — восстанавливается до свободного металла.
- Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
- CuO + H2SO4 = CuSO4 + H2O
- При сплавлении со щелочами CuO образуются купраты, например:
- CuO + 2NaOH = Na2CuO2 + H2O
- Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
- Cu2O = CuO + Cu.
- Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
- CuO + СО = Cu + СО2.
- Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами, например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.
- При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2]–, [CuCl3]2– и [СuCl4]3–, например за счет процесса:
- CuCl + НCl = H[CuCl2]
- При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
- H2S + CuSO4 = CuS + H2SO4
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
- В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
- 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
- С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
- 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
- С концентрированной серной кислотой медь реагирует при сильном нагревании:
- Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O.
- Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
- 2FeCl3 + Cu = CuCl2 + 2FeCl2
- Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(NH3)]2+. При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
- Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
- Сu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O.
- Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
- Сu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
Нахождение в природе: в земной коре содержание меди составляет около 5·10–3% по массе. Очень редко медь встречается в самородном виде (самый крупный самородок в 420 тонн найден в Северной Америке).
Из руд наиболее широко распространены сульфидные руды: халькопирит, или медный колчедан, CuFeS2 (30% меди), ковеллин CuS (64,4% меди), халькозин, или медный блеск, Cu2S (79,8% меди), борнит Cu5FeS4 (52-65% меди).
Существует также много и оксидных руд меди, например: куприт Cu2O, (81,8% меди), малахит CuCO3·Cu(OH)2 (57,4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.
Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо (Fe), цинк (Zn), свинец (Pb), и другие металлы.
Как примеси медные руды обычно содержат рассеянные элементы (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1 % по массе, а то и менее. В морской воде содержится примерно 1·10–8 % меди.
промышленное получение меди — сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем.
В результате обжига образуется огарок — твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн, в котором содержание меди составляет до 40-50%.
Далее штейн подвергают конвертированию — через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2).
В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:
- 2FeS + 3O2 + 2SiO2 = 2FeSiO3 + 2SO2
- Одновременно сульфид меди (I) Cu2S окисляется:
- 2Cu2S + 3О2 = 2Cu2О + 2SO2
- Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
- 2Cu2О + Cu2S = 6Cu + SО2
В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98,5-99,3% по массе. Далее черновую медь подвергают рафинированию.
Рафинирование на первой стадии — огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки.
На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде.
При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама, а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99,9% и более.
Применение: медь, как полагают, — первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры.
Позднее широкое применение сплавов меди определило материальную культуру бронзового века (конец 4 — начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах.
Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы.
С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры.
Из-за высокой теплопроводности медь — незаменимый материал различных теплообменников и холодильной аппаратуры.
Широко применяется медь в гальванотехнике — для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы — латуни (основная добавка цинк (Zn)), бронзы (сплавы с разными элементами, главным образом металлами — оловом (Sn), алюминием (Al), берилием (Be), свинцом (Pb), кадмием (Cd) и другими, кроме цинка (Zn) и никеля (Ni)) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер.
В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием (Al) и медь с никелем (Ni)) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
Биологическая роль: медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы). В растениях и животных содержание меди варьируется от 10–15 до 10–3%. Мышечная ткань человека содержит 1·10–3% меди, костная ткань — (1-26)·10–4 %, в крови присутствует 1,01 мг/л меди.
Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления.
Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии.
Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления.
Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.
Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений.
Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека.
ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
Источник: http://WebElements.narod.ru/elements/Cu.htm
СТРОЕНИЕ. Медь-элемент побочной подгруппы Медь-элемент побочной подгруппы 1 группы. 1 группы. Строение атома
1
2 СТРОЕНИЕ. Медь-элемент побочной подгруппы Медь-элемент побочной подгруппы 1 группы. 1 группы. Строение атома: Строение атома: +12 Сu 1s 2 |2s 2 2p 6 |3s 2 3p 6 3d 10 |4s 1 | +12 Сu 1s 2 |2s 2 2p 6 |3s 2 3p 6 3d 10 |4s 1 |
3 Нахождение в природе. Медь встречается в природе в основном в связанном виде и входит в состав следующих минералов: Cu 2 S(медный блеск),CuFeS 2 (медный колчедан), (CuOH) 2 CO 3 (малахит). Содержание в земной коре 0,01 процент.
4 Физические свойства. Медь – металл светло-розового цвета, тягучий, вязкий, легко прокатывается. Температура плавления 1083 градуса по Цельсию. Отличный проводник электрического тока. Плотность 8,92. Медь – металл светло-розового цвета, тягучий, вязкий, легко прокатывается. Температура плавления 1083 градуса по Цельсию. Отличный проводник электрического тока. Плотность 8,92.
5 Химические свойства. В сухом воздухе и при обычной температуре медь почти не изменяется. А при повышенной температуре медь может вступать в реакции как с простыми так и с сложными веществами. В сухом воздухе и при обычной температуре медь почти не изменяется. А при повышенной температуре медь может вступать в реакции как с простыми так и с сложными веществами.
6 Взаимодействие с простыми веществами. С кислородом С кислородом 2Cu+O 2 2CuO оксид меди(2) С серой С серой Cu+S CuS сульфид меди (2) С галогенами С галогенами Cu+Cl 2 CuCl 2 хлорид железа (2)
7 Взаимодействие со сложными веществами. Находясь в ряду напряжений левее водорода медь не вытесняет водород из разбавленных растворов соляной и серной кислот. Находясь в ряду напряжений левее водорода медь не вытесняет водород из разбавленных растворов соляной и серной кислот. Взаимодействие с H 2 SO 4 (конц.) Взаимодействие с H 2 SO 4 (конц.) Cu+2H 2 SO 4 (конц.
) CuSO 4 +SO 2 +2H 2 O Cu+2H 2 SO 4 (конц.) CuSO 4 +SO 2 +2H 2 O Взаимодействие с HNO 3 (разб.) Взаимодействие с HNO 3 (разб.) 3Сu+8HNO 3 (разб.) 3Cu(NO 3 ) 2 +2NO 2 +4H 2 O 3Сu+8HNO 3 (разб.) 3Cu(NO 3 ) 2 +2NO 2 +4H 2 O Взаимодействие с HNO 3 (конц.) Взаимодействие с HNO 3 (конц.) Cu+4 HNO 3 (конц.) Cu(NO 3 ) 2 +2NO 2 +H 2 O Cu+4 HNO 3 (конц.
) Cu(NO 3 ) 2 +2NO 2 +H 2 O
8 Получение. Процесс получения меди весьма сложный. Упрощенно процесс ее производства из медного блеска отразить можно так: Процесс получения меди весьма сложный.
Упрощенно процесс ее производства из медного блеска отразить можно так: Cu 2 S+3O 2 2Cu 2 O+2SO 2 Cu 2 S+3O 2 2Cu 2 O+2SO 2 затем оксид меди вступает в реакцию оставшимся медным блеском – и получается медь.
затем оксид меди вступает в реакцию оставшимся медным блеском – и получается медь. 2Cu 2 O+Cu 2 S 6Cu+SO 2 2Cu 2 O+Cu 2 S 6Cu+SO 2
9 Применение. Чистая медь используется в электротехнической промышленности для изготовления электрических проводов, кабелей и в теплообменных аппаратах. Она входит в состав различных сплавов. Например, медный купорос необходим для борьбы с вредителями и болезнями растений.
А гидроксидом меди определяют альдегидную группу в органических соединениях. Чистая медь используется в электротехнической промышленности для изготовления электрических проводов, кабелей и в теплообменных аппаратах. Она входит в состав различных сплавов. Например, медный купорос необходим для борьбы с вредителями и болезнями растений.
А гидроксидом меди определяют альдегидную группу в органических соединениях.
10 Соединения меди. CuSO 4 –сульфат меди (белый порошок). CuSO 4 –сульфат меди (белый порошок). CuSO 4 *5H 2 O –медный купорос (голубой порошок). CuSO 4 *5H 2 O –медный купорос (голубой порошок).
CuCl 2 *2H 2 O –хлорид меди (темно- зеленый кристалл). CuCl 2 *2H 2 O –хлорид меди (темно- зеленый кристалл). Cu(NO 3 ) 2 *3H 2 O –нитрат меди (синие кристаллы). Cu(NO 3 ) 2 *3H 2 O –нитрат меди (синие кристаллы).
11 1. Оксид меди (2) получение: 2Cu+O 2 2CuO 2Cu+O 2 2CuO черный порошок, проявляет свойства основного оксида черный порошок, проявляет свойства основного оксида взаимодействует с кислотами: взаимодействует с кислотами: Cu+2HCl CuCl 2 +H 2 O Cu+2HCl CuCl 2 +H 2 O 2.
Гидроксид Cu(OH) 2 получение: CuCl 2 +2NaOH 2NaCl+Cu(OH) 2 CuCl 2 +2NaOH 2NaCl+Cu(OH) 2 проявляет свойства основания, взаимодействует с кислотами: проявляет свойства основания, взаимодействует с кислотами: Cu(OH) 2 +2HCl CuCl 2 +2H 2 O Cu(OH) 2 +2HCl CuCl 2 +2H 2 O
Источник: http://www.myshared.ru/slide/692153/




