1001student.ru > Химия > Сера — химические и физические свойства

- Сера – важнейший элемент в современной промышленности.
- Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Оглавление:
- Что такое сера и как она выглядит
- Характеристика серы
- Физические свойства
- Химические свойства
- Области применения
- Нахождение серы в природе
- Биологическая роль серы
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).
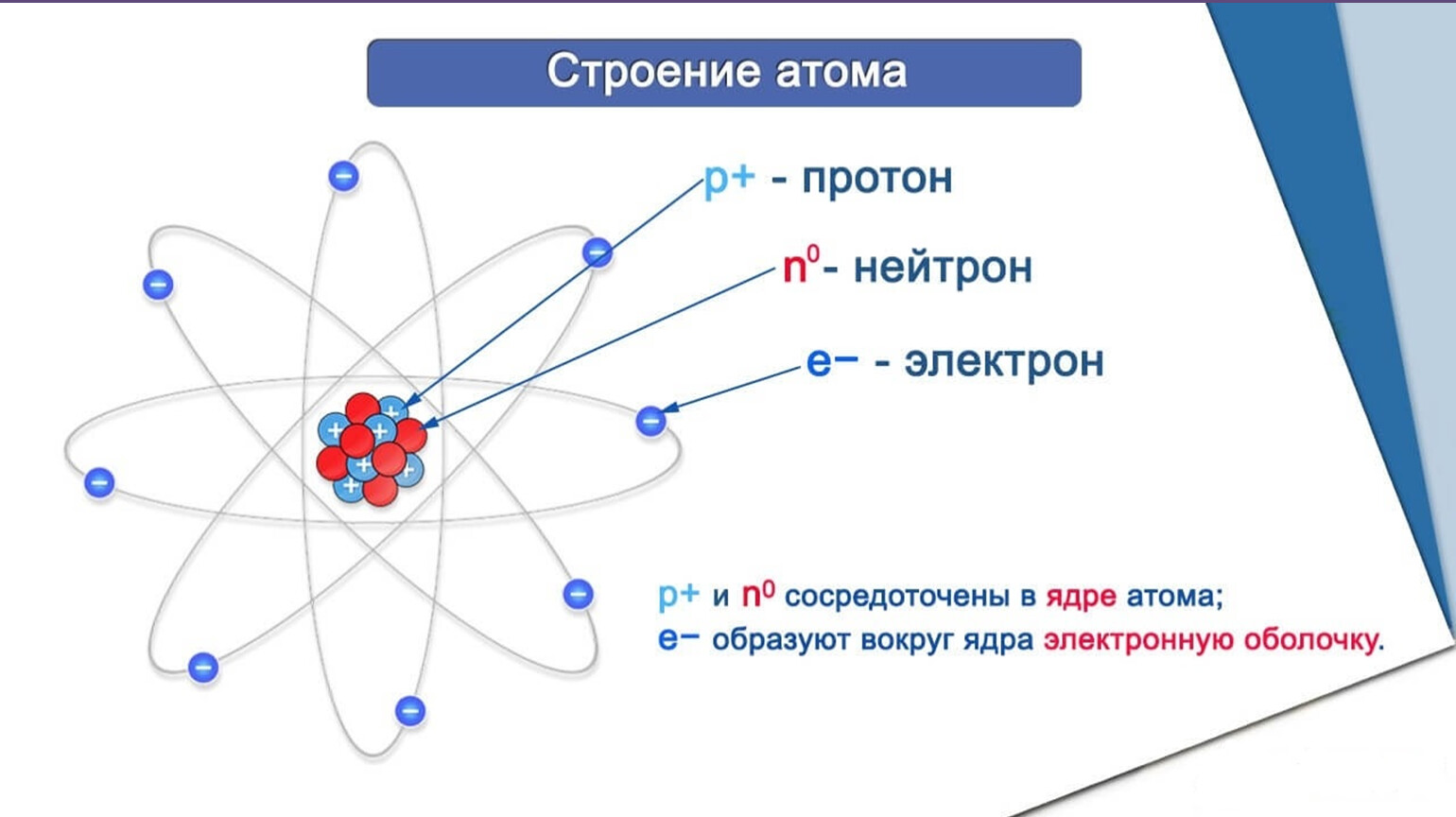
Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.

Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
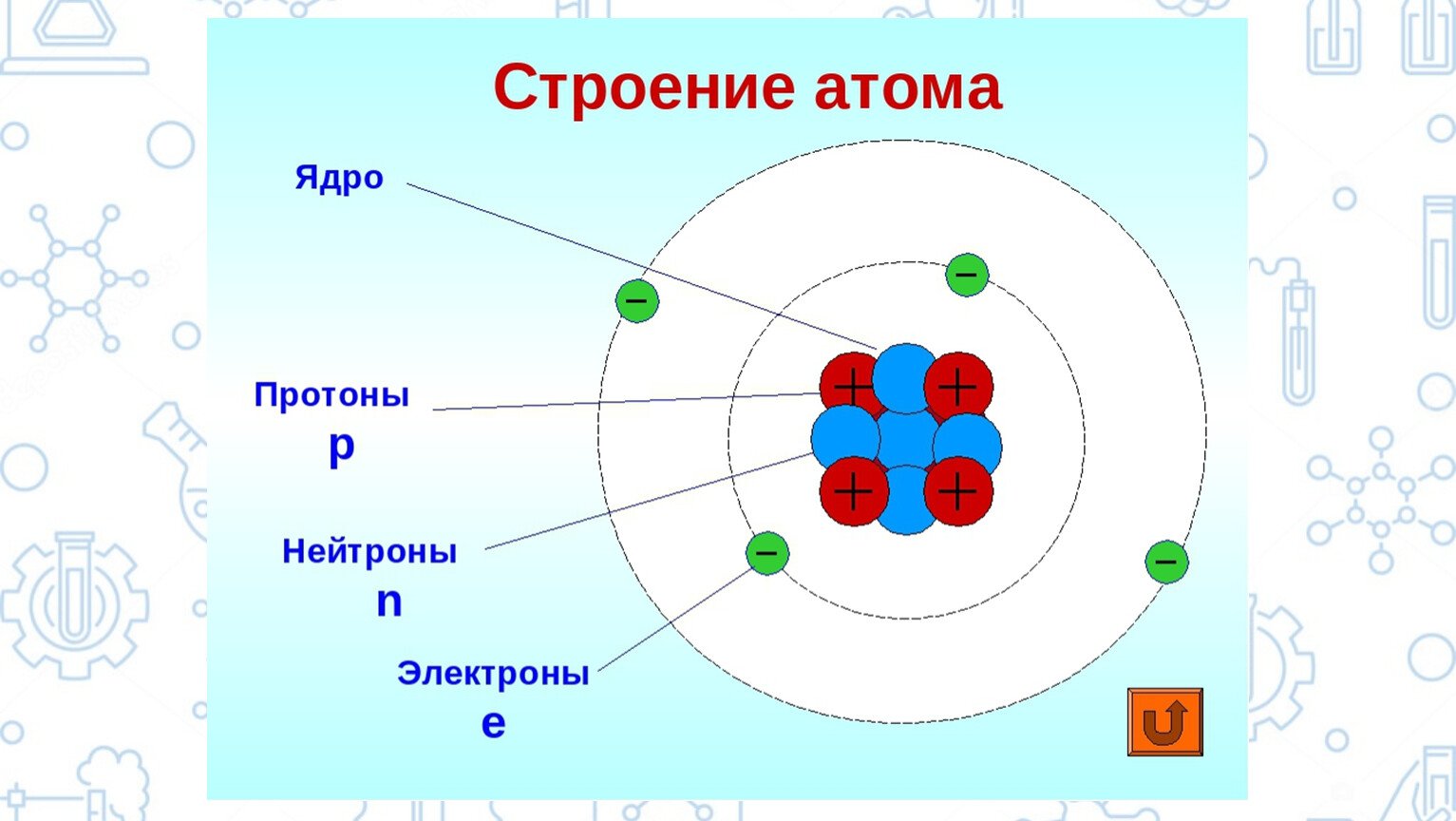
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.

Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула H2SO4) со степенью окисления серы +6 и сернистую (H2SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.

- В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
- Hg + S = HgS
- Na + S = Na2S
- Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
- Fe + S (t) = Fe2S3
- Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
- S + O2 = SO2
- В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
- H2 + S = H2S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.

В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.

При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (H2SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.

- Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
- Сероводород (H2S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
- Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе

Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2H2O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
Источник: https://1001student.ru/himiya/svojstva-sery.html
Урок 15. Сера – HIMI4KA
Самоучитель по химии › Неорганическая химия
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
![]()
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:

Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:

Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:

Иногда эти свойства проявляются в одной реакции:
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
![]()
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
![]()
Сероводород горит:
![]()
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Сернистый газ и сернистая кислота
SO2 — сернистый газ с резким удушливым запахом. Ядовит. Растворяется в воде, образуя сернистую кислоту:
- Эта кислота средней силы, но очень неустойчива, существует только в растворах. Поэтому при действии на её соли — сульфиты — другими кислотами можно получить сернистый газ:
- При кипячении полученного раствора эта кислота разлагается полностью.
Задание 15.5. Определите степень окисления серы в сернистом газе, сернистой кислоте, сульфите натрия.
- Поскольку степень окисления +4 для серы является промежуточной, все перечисленные соединения могут быть и окислителями и восстановителями:
- Например:
Задание 15.6. Расставьте коэффициенты в этих схемах методом электронного баланса. Укажите, какие свойства проявляет атом серы со степенью окисления +4 в каждой из реакций.
Восстановительные свойства сернистого газа применяются на практике. Так, при восстановлении теряют цвет некоторые органические соединения, поэтому оксид серы IV и сульфиты применяют при отбеливании. Сульфит натрия, растворённый в воде, замедляет коррозию труб, так как легко поглощает кислород из воды, а именно кислород является «виновником» коррозии:
- Окисляясь в присутствии катализатора, сернистый газ превращается в серный ангидрид SO3:
Серный ангидрид и серная кислота
- Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
- Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
- Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
- Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
- Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
- Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
- Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.
Выводы
Изложенное выше можно отразить в шутливом стишке: «Сера, сера, буква S, 32 атомный вес, сера в воздухе горит, образует ангидрид (какой кислоты?), ангидрид плюс вода — получилась кислота (какая?)».
Источник: https://himi4ka.ru/samouchitel-po-himii/urok-15-sera.html
Физические и химические свойства серы. Оксиды серы
Билет № 16
1. Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства
Положение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе.
Атомный номер серы 16, следовательно, заряд атома серы равен +16, число электронов 16. Три электронных уровня (равно периоду), на внешнем уровне 6 электронов (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
16S ) ) )
2 8 6
Ядро атома серы 32S содержит 16 протонов (равно заряду ядра) и 16 нейтронов (атомная масса минус число протонов: 32 − 16 = 16).
Сера как простое вещество образует аллотропные модификации: кристаллическая сера и пластическая.
Кристаллическая сера — твердое вещество желтого цвета, хрупкое, легкоплавкое (температура плавления 112° С), нерастворима в воде. Сера и многие руды, содержащие серу, не смачиваются водой. Поэтому порошок серы может плавать на поверхности, хотя сера тяжелее воды (плотность 2 г/см3).
На этом основан метод обогащения руд под названием флотация: измельченная руда погружается в емкость с водой, через которую продувается воздух. Частички полезной руды подхватываются пузырьками воздуха и выносятся наверх, а пустая порода (например, песок) оседает на дно.
Пластическая сера темного цвета и способна растягиваться, как резина.
Это отличие в свойствах связано со строением молекул: кристаллическая сера состоит из кольцевых молекул, содержащих 8 атомов серы, а в пластической сере атомы соединены в длинные цепи. Пластическую серу можно получить, если нагреть серу до кипения и вылить в холодную воду.
В уравнениях для простоты записывают серу без указания числа атомов в молекуле: S.
Химические свойства:
- В реакциях с восстановителями: металлами, водородом, — сера проявляет себя как окислитель (степень окисления −2,валентность II). При нагревании порошков серы и железа образуется сульфид железа:
Fe + S = FeSСо ртутью, натрием порошок серы реагирует при комнатной температуре:
Hg + S = HgS - При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S - В реакциях с сильными окислителями сера окисляется. Так, сера горит, образуется оксид серы (IV) — серни́стый газ:
S + O2 = SO2
Оксид серы (IV) — кислотный оксид. Реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Эта реакция происходит в атмосфере при сжигании каменного угля, который обычно содержит примеси серы. В результате выпадают кислотные дожди, поэтому очень важно подвергать очистке дымовые газы котельных.
- В присутствии катализаторов оксид серы (IV) окисляется до оксида серы (VI):
- 2SO2 + O2 2SO3 (реакция обратима)
- Оксид серы (VI) реагирует с водой с образованием серной кислоты:
- SO3 + H2O = H2SO4
SO3 — бесцветная жидкость, кристаллизуется при 17° С, переходит в газообразное состояние при 45° С
2. Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция
- Гидроксид кальция (гашеная известь) — малорастворимое вещество. Взбалтываем немного извести в 2 мл воды (около 2 см по высоте пробирки), даем постоять несколько минут. Большая часть извести не растворится, осядет на дно.
- Сливаем раствор, фильтруем (если нет фильтра, ждем пока отстоится).
Прозрачный раствор гидроксида кальция называется известковой водой. Делим на 2 пробирки.
В одну капаем индикатор фенолфталеин (ф-ф), он окрашивается в малиновый цвет, что доказывает осно́вные свойства извести:
Ca(OH)2 Ca2+ + 2OH− - Во вторую пробирку пропускаем углекислый газ, известковая вода мутнеет в результате образования нерастворимого карбоната кальция (это качественная реакция для обнаружения углекислого газа):
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Если придется делать эти реакции на практике, углекислый газ можно получить в пробирке с газоотводной трубкой, добавив соляную или
азотную кислоту в мел или соду.
автор: Владимир Соколов
Источник: https://staminaon.com/ru/chemistry/chemistry_9-16.htm
Строение атома серы и схема электронной оболочки — Помощник для школьников Спринт-Олимпиады
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Содержание
- Строение
- Физические свойства
- Химические свойства
- Что мы узнали?
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Рис. 1. Положение в периодической таблице.
Природная сера имеет несколько изотопов:
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Рис. 2. Строение атома.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Рис. 3. Сера.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
| Взаимодействие | Продукты реакции | Пример |
| С металлами | Сульфиды | Cu + S → CuS |
| С кислородом при 280°С | Оксид серы | – S + O2 → SO2; – 2S + 3O2 → 2SO3 |
| С водородом при нагревании | Сероводород | H2 + S → H2S |
| С фосфором при нагревании в отсутствии воздуха | Сульфид фосфора | 2P + 3S → P2S3 |
| С фтором | Фторид серы | S + 3F2 → SF6 |
| С углеродом | Сероуглерод | 2S + C → CS2 |
| С кислотами | Кислота | S + 2HNO3 → 2NO + H2SO4 |
| Со щёлочью | Сульфиды и сульфиты | 3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы.
Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов.
В природе находится в свободном и связанном виде.
ПредыдущаяСледующая
Источник: https://Sprint-Olympic.ru/uroki/himija/17105-stroenie-atoma-sery-i-shema-elektronnoi-obolochki.html
основные свойства серы и строение атомов подскажите кто знает пожалуйст!!! пасибо!
основные свойства серы и строение атомов подскажите кто знает пожалуйст!!! пасибо!
- ФИЗИЧЕСКИЕ СВОЙСТВА.
Природный сросток кристаллов самородной серы
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера хрупкое вещество желтого цвета.
Одно из особенных физических свойств серы — флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха.
Некоторые модификации серы растворяются в органических растворителях, например сероуглероде.
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
ХИМИЧЕСКИЕ СВОЙСТВА. При комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства: S + 3F2 = SF6 S + Cl2 = SCl2 С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь: S + 6HNO3(конц. ) = H2SO4 + 6NO2 #8593; + 2H2O
S + 2H2SO4(конц. ) = 3SO2 #8593; + 2H2O
- На воздухе сера горит, образуя сернистый ангидрид бесцветный газ с резким запахом: S + O2 = SO2
- С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
- При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом: C + 2S = CS2 (сероуглерод)
- Сера при нагревании растворяется в щлочах — реакция диспропорционирования: 3S + 6KOH = K2SO3 + 2K2S + 3H2O
- Сера участвует в реакции демеркуризации — при нейтрализации пролитой ртути.
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углем, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Обнаружение горения серы является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Горение происходит при низкой температуре.
Горение серы
СТРОЕНИЕ АТОМОВ СЕРЫ. В атоме серы на внешней орбите имеется шесть так называемых валентных электронов. Поэтому сера максимально может быть в соединениях шестивалентной.
СЕРА — хим. элемент VI гр. периодич. системы, атомный номер -16, атомная масса = 32,066; относится к халькогенам. Природная сера состоит из четырех изотопов: 32S (95,084%), 33S(0,74%), 34S(4,16%), 36S(0,016%).
Конфигурация внеш. электронной оболочки атома 3s2 3р4; наиб. характерные степени окисления — 2, +4, +6; энергии ионизации при последоват. переходе от S0 к S6+ равны соотв.
10,3601, 23,35, 34,8, 47,29, 72,5, 88,0 эВ;
атомный радиус 0,104 нм. ионные радиусы (в скобках даны координац. числа) , нм: S2- 0,170 (6), S4+ 0,051 (6), S6+ 0,026 (4).
http://www.xumuk.ru/encyklopedia/2/4017.html
Природный сросток кристаллов самородной серыСера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера хрупкое вещество желтого цвета.
Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. Формулу пластической серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
В воде сера нерастворима, некоторые е модификации растворяются в органических растворителях, например сероуглероде.
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
- править Химические свойства
- Горение серыПри комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства: S + 3F2 = SF6 S + Cl2 = SCl2
- С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь:
S + 6HNO3(конц. ) = H2SO4 + 6NO2 #8593; + 2H2O S + 2H2SO4(конц. ) = 3SO2 #8593; + 2H2O
- На воздухе сера горит, образуя сернистый ангидрид бесцветный газ с резким запахом: S + O2 = SO2
- С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.2
- При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом: C + 2S = CS2 (сероуглерод)
- Сера при нагревании растворяется в щлочах реакция диспропорционирования 3S + 6KOH = K2SO3 + 2K2S + 3H2O
править Пожароопасные свойства серы Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углем, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: Распыленная вода, воздушно-механическая пена 3.
Обнаружение горения серы является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Горение происходит при низкой температуре. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере.
Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаруженно распространными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы 4.
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет Вест Западной Капской провинции Южно-Африканской Республики произошел крупный пожар, погибли два человека. 56
Источник: https://info-4all.ru/obrazovanie/domashnie-zadaniya/osnovnie-svojstva-seri-i-stroenie-atomov-podskazhite-kto-znaet-pozhalujst-pasibo/




