Углерод является шестым элементом периодической системы Менделеева. Его атомный вес равен 12.
Углерод находится во втором периоде системы Менделеева и в четвёртой группе этой системы.
Номер периода сообщает нам, что шесть электронов углерода располагаются на двух энергетических уровнях.
А четвёртый номер группы говорит, что на внешнем энергетическом уровне у углерода находится четыре электрона. Два из них это спаренные s-электроны, а два другие – не спаренные р-электроны.
Структура внешнего электронного слоя атома углерода может быть выражена следующими схемами:

Каждая ячейка вэтих схемах означает отдельную электронную орбиталь, стрелка – элетрон, находящийся на орбитали. Две стрелки внутри одной ячейки – это два электрона, находящиеся на одной орбитали, но имеющие противоположно направленные спины.
При возбуждении атома (при сообщени ему энергии) один из спаренных S-электронов занимает р-орбиталь.
Возбуждённый атом углерода может учавствовать в образовании четырёх ковалентных связей. Поэтому в подавляющем большинстве своих соединений углерод проявляет валентность, равную четырем.
Так, простейшее органическое соединение углеводород метан имеет состав СН4. Строение его может быть выражено структурной или электронной формулами:

Электронная формула показывает, что атом углерода в молекуле метана имеет устойчивую восьмиэлектронную внешнюю оболочку, а атомы водорода – устойчивую двухэлектронную оболочку.
Все четыре ковалентных связи углерода в метане (и в других подобных соединениях) равноценны и симметрично направлены в пространстве. Атом углерода находится как бы в центре тетраэдра (правильной четырёхугольной пирамиды), а четыре соединённых с ним атома (в случае метана – четыре атома водорода) в вершинах тетраэдра.

Углы между направлениями любой пары связей одинаковы и составляют 109 градусов 28 минут.
Это объясняется тем, что в атоме углерода, когда он образует ковалентные связи с четырьмя другими атомами, из одной s— и трёх p-орбиталей в результате sp3-гибридизации образуются чтыре симметрично расположенные в пространстве гибридные sp3-орбитали, вытянутые в направлении к вершинам тетраэдра.

Количество электронов на внешнем энергетическом уровне является главным фактором, определяющим химические свойства элемента.
В левой части периодической системы расположены элементы с малозаполненным внешним электронным уровнем. У элементов первой группы на внешнем уровне один электрон, у элементов второй группы – два.
Элементы этих двух групп являются металлами. Они легко окисляются, т.е. теряют свои внешние электроны ипревращаются в положительные ионы.
В правой части периодической системы, наоборот, находятся неметаллы (окислители). В сравнении с металлами они обладают ядром с большим числом протонов. Такое массивное ядро обеспечивает гораздо более сильное притяжение своего электронного облака.
Такие элементы с большим трудом теряют свои электроны, зато непрочь присоединить к себе дополнительные электроны других атомов, т.е. окислить их, а самим, при этом, превратиться в отрицательный ион.
Металлические свойства элементов по мере возрастания номера группы в периодической системе ослабляются, а их способность окислять другие элементы увеличивается.
Углерод находится в четвёртой группе, т.е. как раз посередине между металлами, легко отдающими электроны, и неметаллами, легко эти электроны присоединяющими.
По этой причине углерод не обладает ярко выраженной склонности отдавать или присоединять электроны.
Углеродные цепи.
Исключительным свойством углерода, обуславливающим многообразие органических соединений, является способность его атомов соединяться прочными ковалентными связями друг с другом, образуя углеродные схемы практически неограниченной длины.
Кроме углерода, цепи из одинаковых атомов образует его аналог из IV группы – кремний. Однако такие цепи содержат не более шести атомов Si. Известны длинные цепи из атомов серы, но содержащие их соединения непрочны.
Валентности атомов углерода, не задействованные для взаимного соединения, используются на присоединение других атомов или групп (в углеводородах – для присоединения водорода).
Так углеводороды этан (С2Н6) и пропан (С3Н8) содержат цепи соответственно из двух и трёх атомов углерода. Строение их выражают следующие структурные и электронные формулы:
Известны соединения, содержащие в цепях сотни и более атомов углерода.
Вследствии тетраэдрической направленности связей углерода, его атомы, входящие в цепь, располагаются не на прямой, а зигзагообразно. Причём, благодаря возможности вращения атомов вокруг оси связи, цепь в пространстве может принимать различные формы (конформации):

Такая структура цепей даёт возможность сближаться концевым или другим не смежным атомам углерода. В результате возникновения связи между этими атомами углеродные цепи могут замыкаться в кольца (циклы), например:

Таким образом, многообразие органических соединений определяется и тем, что при одинаковом числе атомов углерода в молекуле возможны соединения с открытой незамкнутой цепью углеродных атомов, а также вещества, молекулы которых содержат циклы.
Простые и кратные связи.
Ковалентные связи между атомами углерода, образованные одной парой обобщённых электронов, называются простыми связями.

Связь между атомами углерода может осуществляться не одной, а двумя или тремя общими парами электронов. Тогда получаются цепи с кратными – двойными или тройными связями. Эти связи можно изобразить следующим образом:

Простейшие соединения, содержащие кратные связи – углеводороды этилен (с двойной связью) и ацетилен (с тройной связью):
Углеводороды с кратными связями называются непредельными или ненасыщенными. Этилен и ацетилен – первые представители двух гомологических рядов – этиленовых и ацетиленовых углеводородов.
Источник: http://xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai/views/alchemy/theory/chemistry/organic-chemistry/Carbon-structure_and_properties.php
Углерод. Химия. 9 класс. Конспект урока
Класс: 9.
Автор УМК: Габриелян О.С.
Тип урока: урок изучения нового материала.
Вид урока: смешанный
Цель урока. Обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания знаний состава, строения, свойств и применения углерода; закрепить знания обучающихся об аллотропии. Формирование базовых компетентностей современного человека: учебно-познавательной, информационной, коммуникативной, личностного совершенствования.
Задачи урока:
- Образовательные: повторить строение атома и аллотропию на примере углерода. Рассмотреть строение, сравнение свойств и применение алмаза и графита. Познакомить учащихся с явлением адсорбции и его практическом значении. Изучить химические свойства углерода. Рассмотреть круговорот углерода в природе.
- Развивающие: развивать у учащихся умения сравнивать и анализировать теоретические сведения, применять их на практике, делать выводы; развивать логическое мышление.
- Воспитательные: формировать естественно — научное мировоззрение; информационную культуру; чувство патриотизма на примере научной деятельности русских ученых – химиков (Ловиц Т.Е., Зелинского Н.Д.); бережного отношения к природным ресурсам.
Материально-техническое обеспечение урока: компьютеры; учебник-навигатор химия 9 класс издательства «Дрофа»; мультимедийный проектор и экран.
Оборудование и реактивы. Периодическая таблица химических элементов Д.И.Менделеева. Модели кристаллических решеток алмаза и графита, иллюстрации с картин В. Боровиковского и фотографии сокровищ Алмазного фонда, образцы изделий из графита (карандаши, электроды и др.
) и сажи (тушь, краски, резина и др.), древесный уголь, таблетки карболена, растворы чернил, вишневого компота, сока свеклы; одеколон.
Стеклянная трубка диаметром 1,5–2 см (или пробирка с дырявым дном), штатив, вата, речной песок, стакан, колба, прибор для восстановления меди из оксида меди, противогаз, кукурузные палочки, пипетка.
- Межпредметные и внутрипредметные связи.
- Межпредметная связь с предметами: искусство, география, физика, биология, экология, ОБЖ, геометрия.
- Внутрипредметные связь:
- химия 8 класс – строение атома, химические связи, способы очистки веществ, аллотропия, кристаллические решетки, окислительно-восстановительные свойства;
- химия 9 класс – получение и химическое свойства металлов, химические элементы в клетках живых организмов;
- химия 10 класс – строение атома углерода, получение метана, природные источники углеводородов;
- химия 11 класс – валентные возможности атомов химических элементов, неметаллы.
Ход урока
I. Организационный момент
Приветствие. Проверка готовности учащихся к учебным занятиям.
II. Актуализация знаний
Учитель выразительно читает стихотворение:
- Из меня состоит все живое, Я – графит, антрацит и алмаз, Я на улице, в школе и в поле,
- Я в деревьях и в каждом из вас.
- Учитель: о каком химическом элементе идет речь в этом стихотворении?
- Угадывая название элемента, учащиеся называют тему урока и вместе с учителем формулируют его цель.
- Цель урока:
- Изучить строение атома углерода, опираясь на положение в таблице Менделеева;
- Рассмотреть аллотропные модификации углерода;
- Изучить химические свойства углерода и познакомиться с его применением.
III. Изучение нового материала
1. Строение и свойства атомов
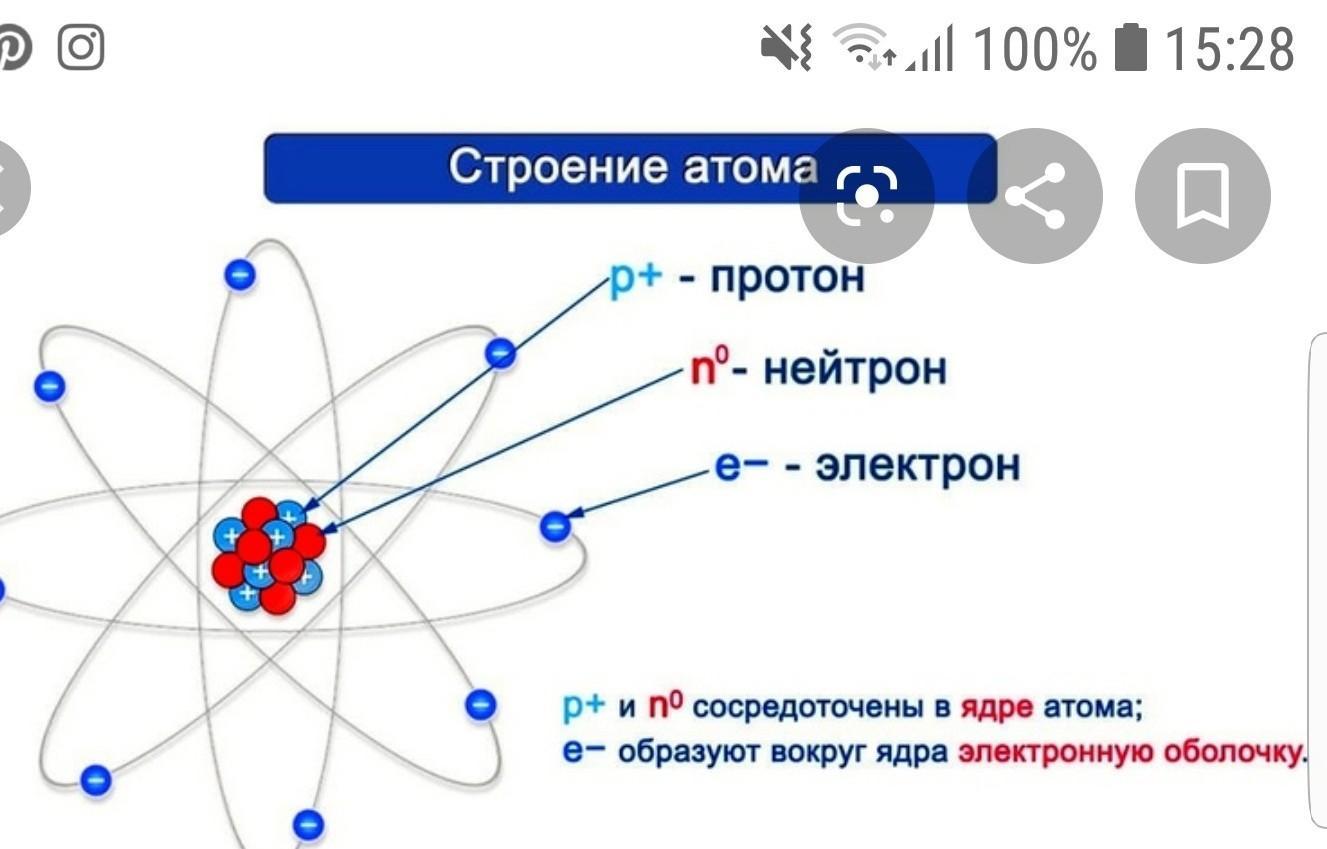
Учитель: охарактеризуйте строение атома углерода на основании его положения в Периодической системе химических элементов, ответив на вопросы и используя материал электронного учебника:
- Каков химический знак углерода?
- Положение в периодической системе Д.И.Менделеева (номер периода и его вид, номер группы и тип подгруппы, номер элемента).
- Каков заряд ядра?
- Какова атомная масса?
- Сколько протонов в ядре атома?
- Сколько нейтронов в ядре атома?
- Сколько электронов в атоме углерода?
- Электронная формула атома.
- Чему равна высшая степень окисления?
- Чему равна низшая степень окисления?
- Какие свойства будет проявлять углерод, вступая в химическое взаимодействие?

Учащиеся характеризуют положение углерода в ПСХЭ, определяют его порядковый номер и составляют электронную формулу атома, делают соответствующую запись в тетради:
- химический знак – С
- второй период малый, IV группа, главная подгруппа, номер элемента – 6
- заряд ядра +6
- Ar(C) = 12
- 6 протонов
- 6 нейтронов
- 6 электронов
- +6С 2 e 4 e
- высшая степень окисления +4
- низшая степень окисления –4
Исходя из строения атома, прогнозируют окислительно-восстановительные свойства углерода:

2. Аллотропия
- Учитель: Почему углерод – это графит, антрацит и алмаз?
- Учащиеся: Углерод образует несколько простых веществ.
- Учитель: Как называется такое явление?
Учащиеся: аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Эти простые вещества называются – аллотропными видоизменениями или модификациями.
- Учитель: каковы причины аллотропии углерода?
- Учащиеся: различное строение кристаллических решеток.
- Учитель демонстрирует модели решеток алмаза и графита и предлагает учащимся заполнить таблицу «Аллотропные модификации углерода», предварительно ознакомившись с материалом электронного учебника.



«Аллотропные модификации углерода»
| Признаки сравнения | Алмаз | Графит |
| Сходство | ||
| Качественный состав | ||
| Тип вещества | ||
| Физические свойства | ||
| Различия | ||
| Кристаллическая решетка | ||
| Физические свойства | ||
| Применение |
Заполнив таблицу, учащиеся слушают выступления одноклассников с дополнительной информацией об алмазах, демонстрацией иллюстрации с картин В. Боровиковского и фотографий сокровищ Алмазного фонда.
- Учитель: кроме алмаза и графита, углерод образует и другие аллотропные модификации – это карбин, фуллерен.
- Сообщения учащихся о карбине и фуллерене.
- Учащиеся под руководством учителя обобщают полученные знания.
- Углерод образует аллотропные модификации: алмаз, графит, карбин, фуллерен. Причина этого явления состоит в разном строении кристаллических решеток:
- 1) алмаз имеет объемную тетраэдрическую атомную решетку;
- 2) графит – плоскостную атомную кристаллическую решетку;
- 3) карбин – линейную;
- 4) фуллерен – сферическую.
- Учитель: сходное строение с графитом имеют сажа и древесный уголь.
- Учащиеся работают с дополнительным материалом электронного учебника.


3. Адсорбция
Учитель демонстрирует древесный уголь и таблетки карболена (активированный уголь). Что общего между ними?
Учащиеся отвечают, что и древесный уголь и активированный уголь обладают способностью поглощать газы и растворенные вещества – адсорбцией.
Учитель демонстрирует адсорбционные свойства угля (приложение 1).

Рассказывает, что открытое русским химиком Ловицем явление адсорбции широко используется для очистки сахара на рафинадных заводах от веществ, придающих ему желтый цвет; для очистки спирта.
На поглотительной способности активированного угля также основано и действие противогазов – устройства для защиты от вредных примесей, имеющихся в воздухе. Первый противогаз был изобретен Н.Д.Зелинским и спас жизнь тысячам солдат в период Первой мировой войны.

Учащиеся знакомятся с биографией ученого по дополнительному материалу из электронного учебника.

4. Химические свойства углерода
Учитель: Рассмотрим химические свойства углерода.
Итак, исходя из электронного строения атома углерода, мы выяснили, что углерод может проявлять восстановительные и окислительные свойства.
Причем при обычных условиях углерод химически малоактивен, однако при нагревании он реагирует со многими веществами. Таким образом, все реакции углерода протекают при высоких температурах (от 600-1700°С).
Самой активной формой является аморфный углерод, менее активен графит, самый инертный – алмаз.
Учащиеся записывают уравнения химических реакций и проводят виртуальный лабораторный опыт «Горение угля в кислороде».
| Углерод — восстановитель | Углерод — окислитель |
|
С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан: С + 2H2 CH4 |
|
|
| При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО + Н2 | |
|
Учитель проводит демонстрационный опыт «Восстановление меди из оксида меди (II) углем» (приложение 2).
5. Природные соединения углерода
Учитель: Итак, мы выяснили, что атомы углерода могут соединяться разнообразными способами между собой и с атомами многих других элементов, образуя огромное многообразие веществ. А в каком же виде углерод встречается в природе?
В природе углерод встречается как в свободном виде (алмаз, графит), так и в связанном. В связанном состоянии углерод входит в состав карбонатов (CaCO3 – мел, известняк, мрамор, MgCO3 – магнезит, CaCO3·MgCO3 – доломит), в каменных и бурых углях, торфе. Углерод входит в состав всех живых и растительных организмов, нефти, природного газа, углей.
- Учащиеся знакомятся с природными соединениями углерода по дополнительному материалу из электронного учебника.
6. Круговорот углерода в природе
Учитель: все перечисленные источники углерода участвуют в круговороте его в природе. Учащиеся работают по материалу «Круговорот углерода в природе» электронного учебника (просмотр анимации).
IV. Этап первичного закрепления в обобщающей беседе
- Учитель задает вопросы, учащиеся отвечают на них.
- – Почему алмаз, графит и уголь называют «родными братьями»?
- – От чего зависит твердость алмаза и мягкость графита?
- – Для каких целей применяют алмаз и графит?
- – О каком явлении рассказывается в сказке «Мороз Иванович»?
- “Между тем Рукодельница воротится, воду процедит, в кувшины нальёт, да ещё какая затейница: коли вода нечиста, так свернет лист бумаги, наложит в неё угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальёт в неё воды, а вода-то знай проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная”.
- – Где еще в настоящее время широко используется явление адсорбции?
- (Медицина, военное дело, химическая промышленность.)
- – Назовите природные соединения углерода.
- – Каковы химические свойства углерода?
- – В каких условиях протекает большинство реакций с участием углерода?
- – Чем объясняется не высокая химическая активность углерода?
- – Какая из модификаций углерода химически наиболее активна?
V. Рефлексивно-оценочный этап (первичный контроль) – тестирование
- Учитель предлагает проверить, как дети внимательно слушали друг друга и что запомнили.
- Учащиеся работают в интерактиве «Характеристика углерода» электронного учебника.
- После того, как они выполнили задания, на экран мультимедийного проектора отображаются критерии оценивания.
- Учащиеся оценивают свою работу.
- Рефлексия с помощью сигнальных карточек.
- Учащиеся работают с сигнальными карточками, которые показывают итог тестирования.
- Красные – рейтинг 5; синие – рейтинг 4; зеленые – рейтинг 3.
- По желанию учащихся, полученные оценки можно выставить в журнал.
VI. Домашнее задание
Предлагается учащимся в двух формах:
1) обычной — по учебнику О.С. Габриеляна «Химия 9 класс» (М.: Дрофа, 2009) § 29, упр. 6,8;
- 2) творческой (по желанию):
- • Выполнить творческое задание в программе «Power Point» по теме «Алмаз — уникальный камень» или написать сказку с участием углерода и прислать на электронный адрес учителя.
- • Проделать дома опыт, доказывающий адсорбционные свойства угля.
Налейте в емкость воду объемом 40-50 см3 и добавьте 1-3 капли чернил, чтобы получился слабо окрашенный раствор.
Затем добавьте 3-5 таблеток активированного угля и круговыми движениями колбы интенсивно перемешайте смесь. Дайте смеси отстоятся.
Если обесцвечивания не произошло, добавьте еще 2-3 таблетки угля и повторите перемешивание. Убедившись, что адсорбция произошла полностью, профильтруйте смесь.
• Составить кроссворд по теме «Углерод»
• Подготовить краткое сообщение «Живопись глазами химика» по теме «Углерод. Графит. Сажа»
VII. Подведение итогов. Рефлексия
– Прочитайте цель урока. Достигли ли вы цели? В какой степени? Оцените свою работу на уроке.
Учитель подводит итог урока, проводит рефлексию, где учащиеся показывают результаты усвоения новых знаний, оценивают и комментируют работу наиболее активных учащихся.
Уходя с урока, учащиеся дорисовывают волосы заранее нарисованным рожицам: грустной или веселой в зависимости от их настроения и эмоционального состояния. По их шевелюре можно понять понравился ли урок или нет.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений — М.: Дрофа, 2012.
- Габриелян О.С. Настольная книга учителя. Химия. 9 класс», М.: Дрофа, 2002.
- Габриелян О.С. Химия 9 класс: рабочая тетрадь к учебнику Габриеляна О.С. «Химия.9» — М.: Дрофа, 2013.
- Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений- М.: Дрофа, 2012.
- Книга для чтения по неорганической химии. Ч.2/ Сост. В.А.Крицман – М:Просвещение, 1992
- Учебник – навигатор по химии 9 класс — М.: Дрофа,2013
- Химический эксперимент в школе/Т.С. Назарова, А.А. Грабецкий В.Н. Лаврова.- М.:Просвещение, 1987.
- Химия: Большой справочник для школьников и поступающих в вузы/Е.А.Алферова, Н.С.Ахметов, Н.В.Богомолова и др. — М.: Дрофа, 1999.
Источник: https://rosuchebnik.ru/material/uglerod-himiya-9-klass-konspekt-uroka/
Гибридизация орбиталей атома углерода | Химия онлайн
Гибридизация – это смешение атомных орбиталей (электронных облаков) разной формы, обладающих различной энергией; в результате образуются гибридные орбитали (облака) одинаковые по форме и энергии. Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
- Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
- Объяснение этого факта впервые дал американский химик Лайнус Полинг.
- Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
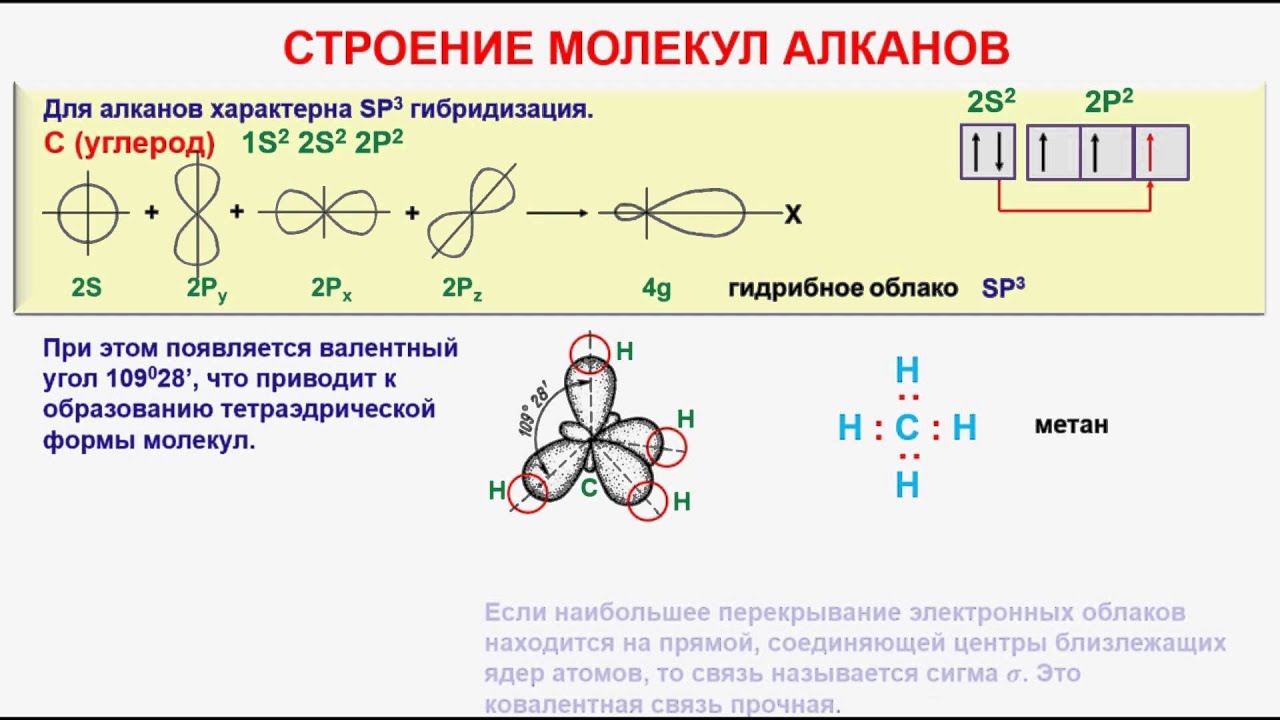
Атом С в органических соединениях может находиться в трех валентных состояниях. Этим валентным состояниям соответствуют различные типы гибридизации электронных орбиталей атома углерода.
- Модель атома углерода
- Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях.
- Электронная формула атома углерода в основном (стационарном) состоянии 1s22s22p2 указывает на то, что внешние электроны углерода неодинаковы: s-электрон имеет орбиталь в виде шара, р-электроны – в виде объемных восьмерок, расположенных под углом 900 друг к другу.

Если бы такое различие существовало, то у четырехвалентного углерода должна была бы наблюдаться неравноценностей связей. На самом же деле все четыре связи равноценны.
Да и сама четырехвалентность углерода не согласуется с приведенной выше электронной формулой: ведь валентность равна числу неспаренных внешних электронов, которых в приведенной формуле только два.

Объясняется это противоречие следующим образом. При образовании связей атом углерода переходит в возбужденное состояние, один из двух s-электронов перемещается на свободную 2р-орбиталь, приобретая электронную конфигурацию 1s22s12p3. Атом углерода в возбужденном состоянии обладает четырьмя неспаренными электронами: одним s-электроном и тремя p-электронами.
- Переход атома углерода из основного состояния в возбужденное.


- Электронная конфигурация атома углерода в основном и возбужденном состоянии

- Основное и возбужденное состояния атома углерода
- Образовавшиеся электронные облака четырех неспаренных электронов гибридизируются — смешиваются.
- В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp3, sp2, sp.
- sр3-гибридизация
- sр2-гибридизация
- sр-гибридизация
Источник: https://himija-online.ru/organicheskaya-ximiya/gibridizaciya/tipy-gibridizacii-atoma-ugleroda.html
Углерод. Аллотропия углерода — урок. Химия, 8–9 класс
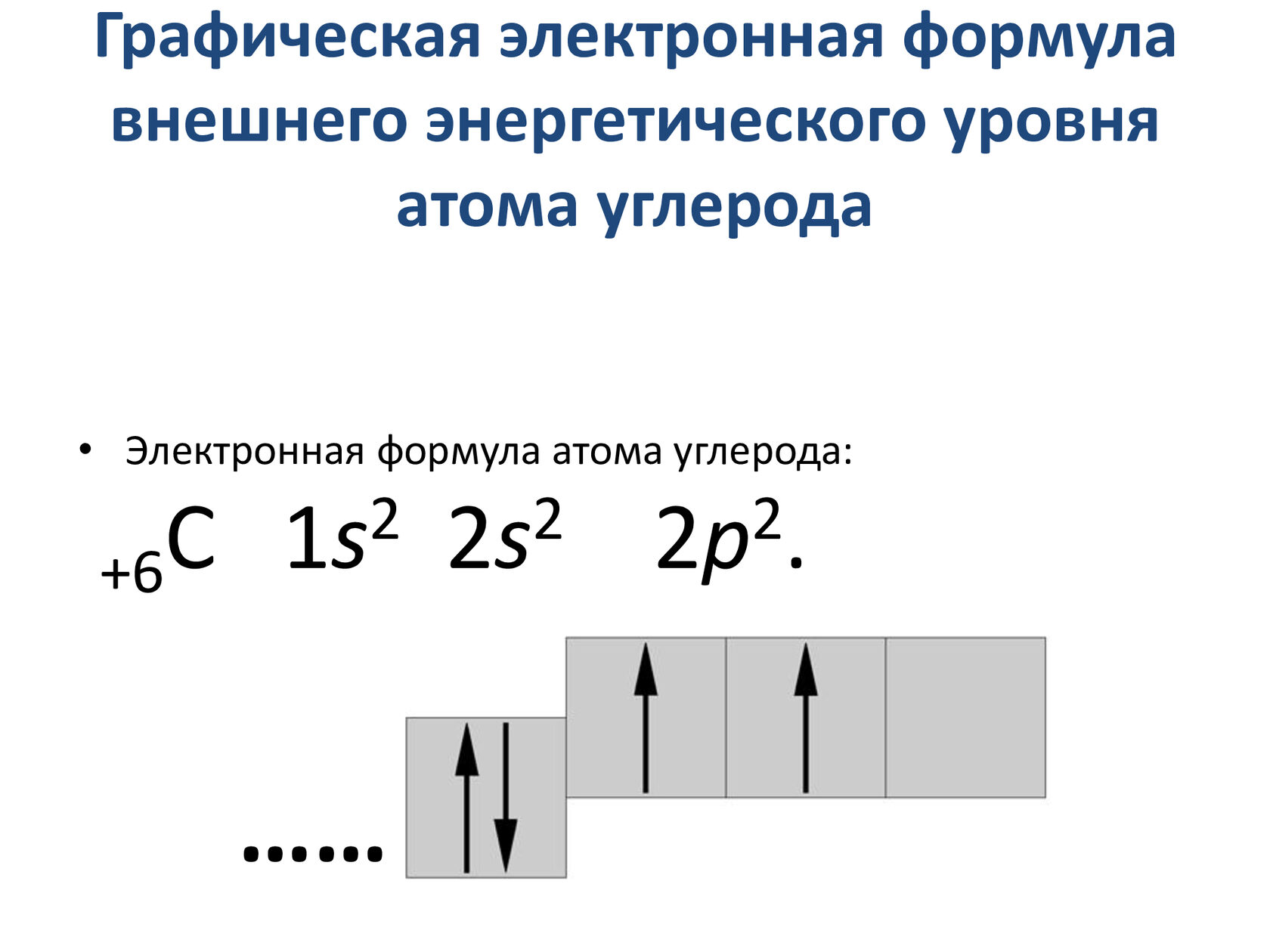
Углерод — химический элемент № (6). Он расположен в IVА группе Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления (–4), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: ( +2) или (+4).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ.
В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк).
Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.

Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.

Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления ((3700) °С).

Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.

Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
- Взаимодействие с металлами.
- Углерод реагирует с металлами при высокой температуре с образованием карбидов:
- 4Al0+3C0=tAl+34C−43.
- В этой реакции углерод выступает как окислитель.
- Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0+2H02=tC−4H+14.
- Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0+O02=tC+4O−22.
- Взаимодействие с оксидами металлов.
- Углерод способен восстанавливать металлы из их оксидов:
- 2Cu+2O+C0=t2Cu0+C+4O2.
- Применение простых веществ
- Алмаз применяется:
- для обработки твёрдых поверхностей;
- для резки стекла;
- для изготовления буров и свёрл;
- для изготовления ювелирных украшений.
Графит используется:
- при изготовлении карандашей;
- как твёрдая смазка в подшипниках;
- для изготовления электродов;
- в качестве замедлителя нейтронов в ядерных реакторах;
- для получения искусственных алмазов.
Сажа:
- входит в состав типографской краски, крема для обуви;
- используется как наполнитель для производства резины.
Уголь используется:
- в противогазах, промышленных и бытовых фильтрах;
- для очистки сахарного сиропа, спирта и т. д.;
- в медицине.
Кокс применяется в металлургической промышленности.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/uglerod-i-ego-soedineniia-163475/re-28df6da6-8e46-4344-9b2d-1694f2fff357
Углерод — характеристика элемента и химические свойства
Характеристика углерода. Свойства простых веществ и соединений
 Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
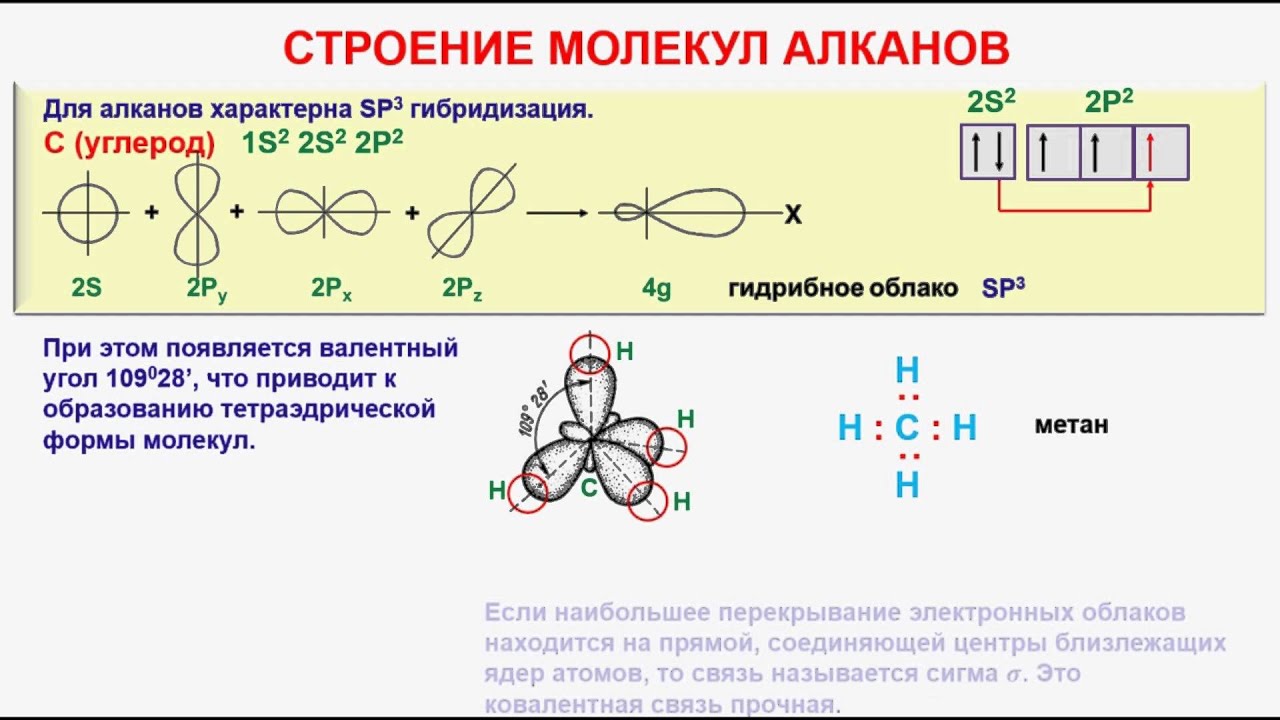
Атом углерода имеет 6 электронов: 1s22s22p2. Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх, а другой, либо 2ру, либо 2рz-орбитали.
 Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Это явление, как известно, называют sp3-гибридизацией, а возникающие функции – sp3-гибридными. Образование четырех sp3-cвязeй обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи.
Помимо sp3-гибридизации у атома углерода наблюдается также sp2— и sp-гибридизация. В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp2— гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp2.

При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.

Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp2-гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил.
Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода.
Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества.
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
- — с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание: - 2C0 + O2 –t°= 2C+2O угарный газ
- — со фтором
С + 2F2 = CF4 - — с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
- — с некоторыми металлами образует карбиды
- 4Al + 3C0 = Al4C3
- Ca + 2C0 = CaC2-4
- — с водородом — метан (а также огромное количество органических соединений)
- C0 + 2H2 = CH4
- — с кремнием, образует карборунд (при 2000 °C в электропечи):
- Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита.
В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3*CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.
Неорганические соединения углерода
Ни ионы С4+ , ни С4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
- Получение
1) В промышленности (в газогенераторах): - C + O2 = CO2
- CO2 + C = 2CO
- 2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO - H2C2O4 = CO + CO2 + H2O
- Химические свойства
- При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
- 1) с кислородом
- 2C+2O + O2 = 2C+4O2
- 2) с оксидами металлов
- C+2O + CuO = Сu + C+4O2
- 3) с хлором (на свету)
- CO + Cl2 –hn= COCl2(фосген)
- 4) реагирует с расплавами щелочей (под давлением)
- CO + NaOH = HCOONa (формиат натрия)
- 5) с переходными металлами образует карбонилы
- Ni + 4CO –t°= Ni(CO)4
- Fe + 5CO –t°= Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°= CaO + CO2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
- CaCO3 + 2HCl = CaCl2 + H2O + CO2
- NaHCO3 + HCl = NaCl + H2O + CO2
- Химические свойства СO2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты - Na2O + CO2 = Na2CO3
- 2NaOH + CO2 = Na2CO3 + H2O
- NaOH + CO2 = NaHCO3
- При повышенной температуре может проявлять окислительные свойства
- С+4O2 + 2Mg –t°= 2Mg+2O + C0
- Качественная реакция
- Помутнение известковой воды:
- Ca(OH)2 + CO2 = CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Угольная кислота и её соли
- H2CO3 — Кислота слабая, существует только в водном растворе:
- CO2 + H2O ↔ H2CO3
- Двухосновная:
H2CO3 ↔ H+ + HCO3— Кислые соли — бикарбонаты, гидрокарбонаты
HCO3— ↔ H+ + CO32- Cредние соли — карбонаты - Характерны все свойства кислот.
- Карбонаты и гидрокарбонаты могут превращаться друг в друга:
- 2NaHCO3 –t°= Na2CO3 + H2O + CO2
- Na2CO3 + H2O + CO2 = 2NaHCO3
- Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
- CuCO3 –t°= CuO + CO2
- Качественная реакция — «вскипание» при действии сильной кислоты:
- Na2CO3 + 2HCl = 2NaCl + H2O + CO2
- CO32- + 2H+ = H2O + CO2
Карбиды
- Карбид кальция:
- CaO + 3 C = CaC2 + CO
- CaC2 + 2 H2O = Ca(OH)2 + C2H2 .
- Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
- 2 LaC2 + 6 H2O = 2La(OH)3 + 2 C2H2 + H2.
- Be2C и Al4C3 разлагаются водой с образованием метана:
- Al4C3 + 12 H2O = 4 Al(OH)3 = 3 CH4.
- В технике применяют карбиды титана TiC, вольфрама W2C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na2CO3 + 2 NH3 + 3 CO = 2 NaCN + 2 H2O + H2 + 2 CO2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
- C=O: [:C=N:]–
- Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
- 2 Au + 4 KCN + H2O + 0,5 O2 = 2 K[Au(CN)2] + 2 KOH.
- При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды:
KCN + S = KSCN. - При нагревании цианидов малоактивных металлов получается дициан: Hg(CN)2 = Hg + (CN)2. Растворы цианидов окисляются до цианатов:
- 2 KCN + O2 = 2 KOCN.
- Циановая кислота существует в двух формах:
- H-N=C=O; H-O-C=N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH4OCN = CO(NH2)2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC)2) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO2 + 2 NH3 = CO(NH2)2 + H2O. При 1300С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H2CO3 – слабая кислота (К1 =1,3·10-4; К2 =5·10-11). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
- H2CO3 ↔ H+ + HCO3— .
- При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO2 + H2O ↔ H2CO3 . - При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
- H+ + CO32-↔ HCO3—
- CaCO3(тв.) ↔ Ca2+ + CO32-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na2CO3) используется в производстве стекла.
Источник: http://himege.ru/uglerod-xarakteristika-elementa-i-ximicheskie-svojstva/




