

Впервые золото нашли в виде самородков ещё в период неолита. Тогда горную породу использовали при изготовлении посуды и различных предметов быта. Металл был распространён в Древнем Египте, Риме, Китае и Индии. В те времена золото называли царём всех металлов. Древние люди верили, что материал жёлтого цвета обладает лечебными и магическими свойствами, он был символом солнца. Позже его стали использовать как платёжное средство. Золото подчёркивало высокий статус владельца, но и было опасно: люди были готовы на любые поступки, чтобы завладеть привлекательным и драгоценным материалом.

Первые цивилизации на территории Центральной Европы, Южной Америки и Северной Африки добывали золото ручным способом. Несколько самородков весом в 8−10 г можно было получить только за 2−3 дня. Поскольку минерал не могли очистить от примесей, в тот период он имел низкую пробу.
Во время поздней античности стала набирать популярность алхимия. Люди научились превращать недрагоценные вещества в благородные.
Хотя алхимия не достигла больших успехов, благодаря ей существуют современные технологии, которые позволяют добыть из руды золото и очистить его от примесей.
Некоторых людей интересует, почему при открытии металла учёные дали такое название химическому элементу. «Золото» родственно обозначениям солнца на разных языках. Наименование элемента Aurum с латыни переводится как «жёлтый». Слово родственно с «Авророй» (Aurora), богиней утренней зари. На славянском языке «жёлтый» звучало как «зёлто», что близко к золоту.
Открытие в природе
В природных условиях золото встречается часто. Оно составляет почти 5% всей литосферы планеты. Высокая цена металла обусловлена его трудоёмкой добычей даже со специальной техникой.
Существует много видов горных пород, в составе которых есть мелкие частицы золота, однако оно представлено рассеянной пылью.
Из истории известны интересные факты, что люди находили крупные залежи ископаемого просто под пластами земли.
Химический элемент формируется в земной коре под влиянием перепадов температуры. Материал добывают из железных и минеральных руд. В основном металл встречается в виде самородков, но в природе можно встретить его соединения с серебром, висмутом, медью, селеном или сурьмой. Известные природные твёрдые растворы называются:

- электрум (серебристое золото);
- аурокуприд (медистое золото);
- порпецит (палладистое золото).
Есть вторичные месторождения вещества, которые представляют собой результат разрушения первичных соединений. Причины происхождения таких ископаемых могут быть:
- физическими (ветер, вода, колебания температуры);
- химическими (химические реакции);
- биологическими (бактерии и другие микроорганизмы).
Довольно большой объём химического элемента встречается в морской воде, но добывать его оттуда нерентабельно. Россыпь материала похожа на песок, который разносится течением на далёкие расстояния от первичного месторождения. Небольшое количество чистого вещества можно обнаружить даже в обычной проточной воде.
Сегодня драгметалл добывают во многих странах мира:

- Россия;
- Китай;
- Австралия;
- Перу;
- Канада;
- США;
- ЮАР.
Золото обнаружено в Гане, Индонезии и Мексике. Эти страны поставляют золото на мировой рынок металлов. На физической карте он отмечается условным знаком в виде круга с затушёванной левой половиной.
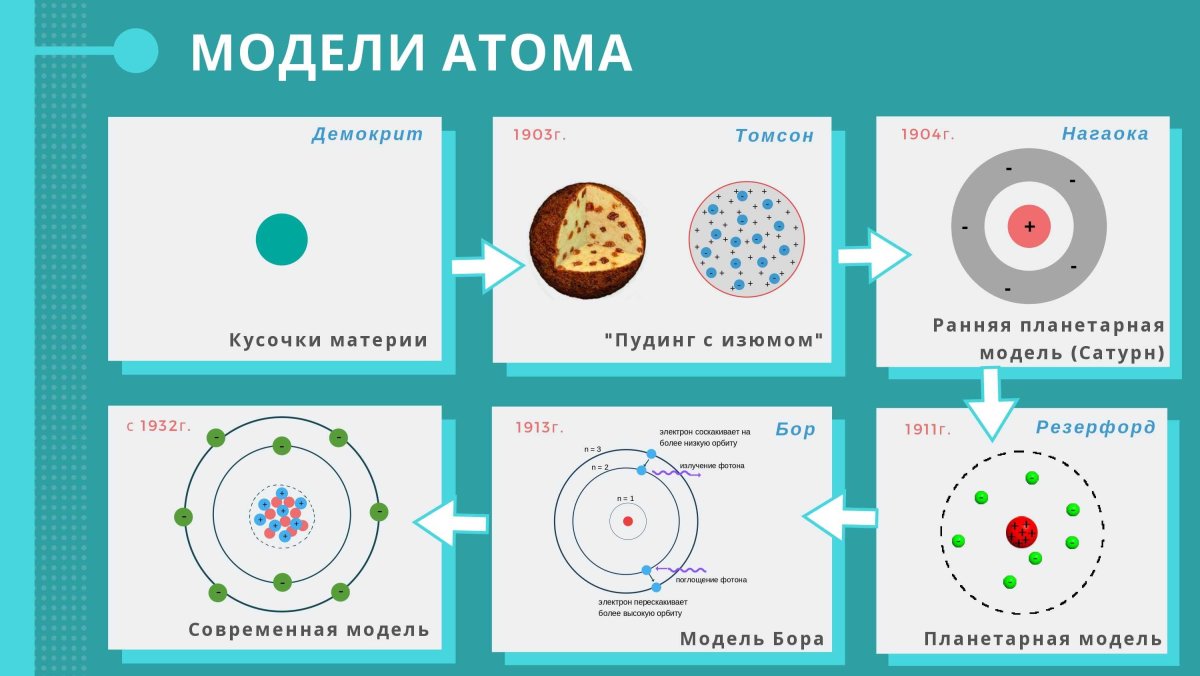
Строение атома и физические свойства
В таблице золото располагается в шестом периоде в подгруппе меди 11 группы. Его обозначение буквами — Au. Элемент имеет порядковый номер — 79. В ядре атома металла находится 79 протонов и 117 нейтронов.
На шести энергетических уровнях атома располагаются 79 электронов. Природный элемент существует в виде химически устойчивого изотопа 197Au. Остальные нестабильны и возможны только в условиях ядерного реактора.

Распределение электронов по орбиталям в электронной формуле золота — 1s22s22p63s23p63d104s24p64f145s25p65d106s1. В своих соединениях металл проявляет валентность I. Это обусловлено наличием одного неспаренного электрона. Но для элемента также характерна валентность II.
Золото относится к группе переходных металлов. Абсолютно чистое вещество характеризуется ярко-жёлтым цветом. Если в минерале есть примеси меди, тогда он может обладать красноватым оттенком. Химическому элементу характерна гранецентрированная кубическая кристаллическая решётка.
Основные физические характеристики золота:
- температура плавления — 1064,18 °C;
- температура кипения — 2856 °C;
- атомная масса — 196,96655;
- плотность — 19,3 г/см3;
- молярный объём — 10,2 см3/моль;
- твёрдость по шкале Мооса — 2,5.
Вещество характеризуется пластичностью и гибкостью. Золото — самый мягкий среди всех металлов, оно отлично поддаётся обработке.
Изделия из этого вещества высокой пробы возможно погнуть и повредить, поэтому их нужно беречь от любых механических повреждений.
При изготовлении столовых приборов производители добавляют в золото дополнительные сплавы, которые повышают прочность предметов. Жидкое вещество летучее и способно испаряться ещё до температуры плавления.
Минерал отличается высокой стойкостью к химическим реакциям и процессам. Это отличный проводник, который быстро транспортирует электрический ток и тепловую энергию. Металл легко полируется, после обработки приобретает мягкий блеск. Тонкая пластина, изготовленная из золота, способна пропускать свет. Поскольку температура вещества падает, его можно применять для тонировки окон.
Химические особенности
Золото имеет несколько степеней окисления: +1, +3, -1. Показатель +5 проявляется с фтором, соединение с которым выступает сильнейшим окислителем.
Поскольку элемент характеризуется относительной инертностью, он обычно не растворяется в кислотах. Поэтому его можно очищать от примесей этими соединениями. Однако есть несколько исключений: золото может растворяться в селеновой и синильной кислотах, цианидах, а также в царской водке.
В естественных условиях металл не окисляется под влиянием кислорода. Это одна из причин, почему он считается драгоценным. При высоких температурах вещество взаимодействует с галогенами (йодом, бромом и хлором).
Наиболее устойчивая — степень окисления +3. С однозарядными анионами золото образует плоско-квадратные комплексы. Степень окисления +1 считается относительно устойчивой. Показатель +2 обычно выражен формально, но при нём в веществах половина металла окислена до +1, а другая — до +3. В ауридах степень окисления Au равна -1.
Золото может реагировать с хлорной кислотой при комнатной температуре с образованием нестойких оксидов хлора, оно взаимодействует с кислородом и иными окислителями при комплексообразователях: растворяясь в цианидах, элемент образует цианоаураты.
Способы получения
Современные технологии позволяют получать благородный металл химическими способами. В 1947 году физики из США смогли преобразовать ртуть в золото. Однако такой путь требует крупных затрат, поэтому он не имеет экономического значения.
Популярные способы получения вещества:

- Промывка. Поскольку металл обладает высокой плотностью, его можно получить в потоке воды, которая смывает примеси с материала. Предварительно добытые ископаемые дробят, а затем промывают. В результате остаётся шлих, который представляет собой золотой песок тяжёлой фракции. Промывка применяется ещё с древних времён для обработки небольших россыпных месторождений. Сегодня при этом методе используются специальные промывочные установки и драги. Во время промывки специалисты следят не только за мелкими, но и за крупными обломками, которые могут оказаться самородками.
- Амальгамация. Этот метод был распространён в Испании в XVI веке. Тогда дроблёную породу сначала увлажняли, затем смешивали со ртутью и дополнительно измельчали на мельницах. После этого получался сплав амальгам, который подвергали промывке для получения золота. Позже дроблёный материал стали пропускать через специальные шлюзы с медными листами, покрытыми тонким слоем ртути. Этот способ применяется только на месторождениях с большим объёмом драгоценного металла. Сегодня он популярен в Африке и Южной Америке.
- Цианирование. При этом методе золото смешивают с цианидами в присутствии кислорода. Полученный измельчённый материал обрабатывают раствором цианида натрия, а затем осаждают нужное вещество цинковой пылью или ионообменными смолами. Сначала такой способ использовался на крупных заводах в специальных чанах для дробления добытых ископаемых. Но с развитием технологий было придумано кучное выщелачивание: на водонепроницаемую площадку насыпают руду и орошают её растворами цианидов. Растворившееся вещество попадает в специальные колонны, в которых осаждается.
Есть метод регенерации. Его осуществляют с помощью раствора щёлочи 10%, который воздействует на растворы солей золота и потом осаждает металл на алюминий из горячего раствора гидроксида. Чтобы извлечь элемент из сульфидных руд, используются многоэтапные технологии с высокой степенью очистки.
Сферы применения
Золото давно используется различными странами в виде монет. Однако в качестве монопольного денежного средства их утвердили только к XIX веку.
Сегодня драгметалл используется во многих сферах жизни общества:

- Ювелирная промышленность. Именно на эту область приходится большой объём добываемой горной породы. Украшения и аксессуары производят не из чистого вещества, а из его сплавов с другими металлами, которые повышают механическую прочность и стойкость изделий. Обычно золото соединяют с серебром и медью. Дополнительными компонентами служат цинк, кобальт, никель или палладий. Драгметалл определяет устойчивость сплава к коррозии, соотношение меди и серебра — оттенок и механические особенности. Важная характеристика таких изделий — проба. Она определяется содержанием золота в них.
- Промышленность. Вещество используется для электрических контактов. Микроэлектроника не обходится без золотых проводников и гальванических покрытий металлом. Обработка оконных стёкол этим материалом позволяет уменьшить потери тепла зимой и предохранить помещения от нагревания ультрафиолетовыми лучами летом. Золотыми припоями смачивают поверхности из разных металлов. Вещество применяется для защиты от коррозии и придания другим материалам дорогого вида.
- Стоматология. Золотые сплавы применяют для производства коронок и зубных протезов, которые не портятся.
- Фармакология. Вещество часто служит дополнительным компонентом в лекарствах от туберкулёза и ревматоидных артритов. Радиоактивный изотоп, который обозначается 198Au, применяется для лечения злокачественных опухолей. Перед использованием препаратов необходимо убедиться в том, что у пациента нет негативных реакций на золото.
- Пищевая промышленность. Элементом в качестве пищевой добавки E175 декорируют различные блюда.
Во все времена золото служило важным элементом финансовой системы. Этот металл не подвержен коррозии, поэтому ему стараются найти применение в различных областях. Периодически роль металла снижалась в качестве международной валюты, однако банки в любых странах хранят его как самый важный источник ликвидности.
Источник: https://nauka.club/khimiya/zoloto.html
Золото (химический элемент): формула, свойства и состав Aurum (Au), место в таблице Менделеева
Здравствуйте! Золото — химический элемент, унесший много жизней. При строительстве Исаакиевского собора в Петербурге купола золотились с помощью золотой амальгамы. Архитектор Огюст Монферран принял меры, чтобы защитить рабочих от паров ртути, но понимал, что они обречены. Зато купола не придется золотить больше никогда.
Так и случилось: все 60 человек погибли от отравления, а собор с тех пор ни разу не золотили.
Нахождение в природе
Золото везде. Кубический километр морской воды содержит 5 кг вожделенного элемента, а если уколоть палец и выдавить каплю крови, в ней будет 0,00025 мг золота.
10 мг содержится в человеческом скелете: если задаться целью выплавить кольцо из людей, понадобится всего 300 человек.
Но это золото находится в окружающей среде в настолько рассеянной форме, что извлекать его оттуда невыгодно, а часто и невозможно.
Месторождения, подходящие для добычи золота, подразделяются на коренные — первичные (постмагматические) и вторичные (россыпные).
Первичные месторождения
Химическим элементом Au богата магма — расплав внутри земного шара. Золото есть в верхних слоях мантии и частично в земной коре (впрочем, в ней содержится почти вся периодическая таблица).
Магма выходит на поверхность планеты, остывает и превращается в твердую породу.
Места, где она содержит столько драгоценного элемента, чтобы окупилась промышленная разработка, и есть коренные месторождения.

Природное золото находят в виде самородков — цельных зерен химически чистого вещества. Часто оно соединено с другими элементами (магма содержит почти все):
- серебром;
- медью;
- металлами платиновой группы;
- висмутом и другими.
Вторичные месторождения
Вторичные месторождения — итог разрушения первичных, так называемого выветривания, которое бывает:
- физическим (причина — ветер, вода, температурные колебания);
- химическим (химические реакции);
- биологическим (бактерии и другие организмы).
Россыпь чистого золота выглядит как песок и порой относится водами на много километров от коренного месторождения.
История открытия элемента
В чистом виде золото попало в руки человека в VI веке до нашей эры. Массовые разработки африканских месторождений начались раньше — около 2000 года до н. э., но методик избавления от примесей не было, и золотые изделия того времени имеют низкую пробу.
Во времена поздней античности (начало нашей эры) по миру начала распространяться алхимия с ее стремлением превращать недрагоценные химические элементы в благородные. Она не добилась успеха, но современная цивилизация благодаря ей владеет многими чудесами — например, техникой добычи химическичистого золота из руды.
Латинское название золота — Aurum (читается как аурум) — «желтый». Оно принято как интернациональное. Символ солнца у алхимиков выглядел как круг с точкой внутри, а в современной химии оно обозначается сокращением Au.
Как получают
Основные способы получения золота в промышленных масштабах дополняют друг друга — например, шлих можно очистить от плотных примесей путем амальгамации.
Промывка
Промывка (шлихование) — древний метод добычи золотого песка (шлиха) из вторичных месторождений. Песок отмывается благодаря плотности: менее плотные минералы вымываются водой, а шлих оседает.
Масштабная добыча золота автоматизирована: вместо людей работают промывочные устройства и экскаваторы. Однако принцип их действия за последние 2000 лет почти не изменился.
Шлих — не чистое золото. Существуют элементы плотнее — они оседают с песком на дне промывочной емкости. Для финальной очистки используются другие, в частности химические, способы.
Амальгамация
Этот метод тоже известен с древности, но описан в XVI веке. Он возможен благодаря свойству ртути образовывать сплавы (амальгамы) с другими металлами без дополнительного термического или химического воздействия. После избавления от фрагментов пустой породы химические элементы механически разделяются.
Амальгамация применяется не везде: в ряде стран (с 1988 года — в России) запрещено использовать ртуть из-за смертельной опасности этого элемента для человека.
Цианирование
Способ извлечения драгоценного элемента из руды цианированием основывается на способности золота растворяться в синильной кислоте (цианистом водороде, HCN) и ее солях. Руда обрабатывается слабым (0,03–0,3 %) раствором цианида. Благородный металл реагирует раньше других химических элементов, а после химической реакции осаждается из раствора.
Физические и химические свойства
Золото инертно: в чистом виде не образует оксидов, не подвержено коррозии. Еще у него:
- высокая плотность — 19,32 г/см³;
- среднеплавкость (температура плавления в диапазоне 600–1600 °С — 1064,43 °С);
- низкая твёрдость — 2,5 пунктов по шкале Мооса;
- высокая ковкость (благодаря ей создается позолота);
- высокая пластичность, тягучесть.
Место золота в периодической таблице Менделеева
Элемент располагается в XI группе (подгруппа меди), VI периоде периодической таблицы химических элементов.
Атомный номер (зарядовое число) золота — 79. Это количество протонов в ядре атома, равное количеству электронов, вращающихся вокруг ядра.
Атомная масса — суммарная масса протонов и нейтронов (ядра атома) — у золота равна 196,9665 а.е.м. (атомных единиц массы). Природное золото существует в виде химически устойчивого изотопа 197 Au.
Все остальные нестабильны и возможны только в условиях ядерного реактора.

Формула
Своей химической формулы золото не имеет, поскольку существует в виде одноатомных молекул. Электронная конфигурация атома Au записывается как [Xe] 4f14 5d10 6s1 и обозначает точное распределение электронов по орбиталям.

Взаимодействие с кислотами
В силу своей инертности (не абсолютной, но значительной) золото не растворяется в кислотах. Это позволяет использовать их для аффинажа (химической очистки элемента от примесей): сплав обрабатывается кислотой, например азотной, и так избавляется от лигатуры.
Но есть исключения. Чистое золото растворяют кислоты:
- селеновая;
- синильная и ее соли (цианиды);
- азотная в смеси с соляной (царская водка).
Степени окисления и связь с галогенами
В естественных условиях Au не окисляется под воздействием кислорода — это одно из свойств, делающих элемент драгоценным. При нагревании золото взаимодействует с галогенами (элементами XVII группы): йодом, фтором, бромом и хлором, образуя соответственно йодид, фторид, бромид и хлорид.
Стандартные степени окисления — 1 и 3. В лабораторных условиях выведен фторид со степенью окисления +5.
Меры чистоты золота
Государства контролируют оборот драгметалла. Век назад почти в каждой стране работала своя система пробирования, но сейчас большинство приведено к общему знаменателю.
Британская каратная система
В каратной системе (США, Канада, Швейцария) за 100 % принято число 24. Клеймо «18 K» говорит о том, что украшение состоит на 75 % из драгоценного металла, а на 25 % из чего-то ещё — например меди и палладия.

Метрическая система
В России, СНГ, Германии число на клейме — это количество промилле (тысячных долей) золота в сплаве. 500 ‰ — проба 500, 375 ‰ —375. Не существует только пробы 1000 — вместо нее 999,9. Она содержит микроскопическое количество примесей и условно считается чистой.
Золотниковая система
Золотниковая система проб действовала в Российской империи, РСФСР и СССР в 1798–1927 годах. Она основана на русском фунте, равном 96 золотникам, аналогична каратной математически, но делит целое не на 24, а на 96 долей.
Таблица соответствия проб
Посмотрим на три системы в сравнении. Существует также лотовая проба — она по сути повторяет каратную, но берет за сто процентов 16 единиц (лот). Лотовая проба использовалась для пробирования серебра в Европе до введения метрической системы и не имеет отношения к золоту.
| Метрическая система проб | 999 | 958 | 916 | 900 | 750 | 585 | 500 | 375 |
| Каратная система проб | 24 | 23 | 22 | 21,6 | 18 | 14 | 12 | 9 |
| Золотниковая система проб | 96 | 92 | 88 | 86,4 | 72 | 56 | 48 | 36 |
Сплавы с другими металлами
В промышленности применяются сплавы золота с медью, серебром, платиной, палладием, никелем и другими металлами. Лигатура меняет свойства сплава. Платина и палладий придают ему белый цвет, цинк и кадмий понижают температуру плавления (но цинк делает сплав хрупким, а кадмий — нет), медь окрашивает в красный и делает тверже.
Применение
Без золота нельзя представить себе:
- ювелирное дело;
- информационные технологии;
- нефтехимическое производство;
- производство измерительных приборов;
- элетронику и микроэлектронику;
- фармакологию;
- ядерные исследования.
До сих пор золото не утратило и первоначального предназначения — оно используется для сбережения и приумножения средств.
Как отличить подделку
Чтобы навариться, выдав изделия из неблагородных сплавов за ценные, мошенники прибегают к уловкам: обжигают серебро на огне, соединяют медь с цинком и оловом. Обращайте внимание на:
- Клеймо — оно должно соответствовать стандарту.
- Цену — если она неправдоподобно низка, это тревожный знак.
- Страну-производитель — проверьте украшение лишний раз, если это Турция, Китай или ОАЭ.
Встречаются советы попробовать вещь на зуб при продавце или испытать химически, капнув на нее йодом. Это действенные для определения подлинности высоких проб способы, но они не всегда приемлемы в обществе. Если продавец вызывает у вас сомнения настолько, что вы готовы кусать его товар, стоит отказаться от покупки.
Заключение
Не кладите золото в ртуть и не проливайте на него синильную кислоту — так оно прослужит дольше. А еще подписывайтесь на мои статьи и делитесь ими с друзьями!
Источник: https://zhazhdazolota.ru/interesnoe/himicheskij-element-aurum
Формула золота: химический элемент, характеристики, свойства
Золото известно человечеству с древнейших времен. Но в античности его ценили исключительно за внешний вид: сверкающие, словно солнце, украшения, были символом богатства. Только с развитием химии, люди поняли настоящую ценность этого мягкого металла, и на данный момент активно используют его в таких отраслях как:
- космическая промышленность;
- самолето- и судостроение;
- медицина;
- компьютерные технологии;
- и другие.
Эти отрасли обладают очень высокими требованиями к свойствам используемым в них материала. Важность и престижность этих сфер позволяет цене золота не только оставаться на прежнем уровне, но и медленно ползти вверх. Причиной этих свойств является электронная формула золота, которая, как и в случае с любыми другими элементами, определяет его параметры и возможности.
Место золота в периодической таблице Менделеева и его общие свойства
Какие можно выделить свойства золота? В детище русского гения драгоценный металл занимает 79 номер, и обозначается как Au. Au — сокращенно от его латинского названия Aurum, которое переводится как «сияющий». Оно находится в 6 периоде 11 группы, в 9 ряду.
 Электронная формула золота, которая является причиной ценных свойств золота — 4f14 5d10 6s1, все это говорит о том, что атомы золота имеют существенную молярную массу, большой вес и сами по себе инертны. Ко внешним электронам такой структуры относятся только 5d106s1 .
Электронная формула золота, которая является причиной ценных свойств золота — 4f14 5d10 6s1, все это говорит о том, что атомы золота имеют существенную молярную массу, большой вес и сами по себе инертны. Ко внешним электронам такой структуры относятся только 5d106s1 .
И именно инертность золота является его самым ценным свойством. Из-за нее золото очень хорошо сопротивляется воздействию кислот, почти никогда не окисляется, и окислителем выступает невероятно редко.
Следовательно, оно относится к т.н. «благородным» металлам. «Благородными» металлами и газами в химии называют элементы, которые почти ни с чем не реагируют в нормальных условиях.
Золото смело можно назвать самым благородным металлом, так как оно стоит правее всех своих собратьев в ряду напряжений.
Химические свойства золота и его взаимодействие с кислотами
Во-первых, соединения золота с чем-либо еще, кроме ртути, чаще всего распадаются. Ртуть, являющаяся в данном случае исключением, образует с золотом амальгаму, которая раньше использовалась для изготовления зеркал.
В остальных случаях связи недолговечны.
Инертность золота в Средние Века заставила думать алхимиков, что этот металл находится в неком «идеальном равновесии», они считали, что оно не взаимодействует абсолютно ни с чем.
В 17-м веке это представление было разрушено, так как обнаружили, что царская водка, смесь соляной и азотной кислот, способна разъедать золото. Список взаимодействующих с золотом кислот следующий:
- Царская водка (смесь 30-35% HCl и 65-70% HNO3), с образованием золотохлористоводородной кислоты Н[АuСl4].
- Селеновая кислота (H2SeO4) при 200 градусах.
- Хлорная кислота (HClO4) при комнатной температуре, с образованием нестойких оксидов хлора и перхлората золота III.
Кроме того, золото взаимодействует с галогенами. Проще всего удается проводить реакцию со фтором и хлором. Существует HAuCl4·3H2O — золотохлористоводородная кислота, которую получают при упаривании раствора золота в хлорной кислоте после пропускания через него паров хлора.
Кроме того, золото растворяется в хлорной и бромной воде, а также в спиртовом растворе йода. До сих пор неизвестно, окисляется ли золото под действием кислорода, потому что существование оксидов золота еще не доказано.
Степени окисления золота, его связь с галогенами и его участие в соединениях
Стандартными степенями окисления золота являются 1, 3, 5. Гораздо реже встречается -1, это ауриды — обычно соединения с активными металлами. Например, аурид натрия NaAu или цезия CsAu, который является полупроводником. Они очень многообразны по составу. Существуют аурид рубидия Rb3Au, тетраметиламмония (CH3)4NAu, и ауриды состава М3OAu, где М — металл.
Особенно легко их получать с помощью соединений, где золото выполняет роль аниона, и при нагревании с щелочными металлами. Наибольший потенциал электронных связей этого элемента раскрывается в реакциях с галогенами. Вообще, за исключением галогенов, золото как химический элемент, имеет исключительно разнообразные, но редкие связи.

Наиболее устойчивой степенью окисления является +3, при данной степени окисления золото образует наиболее прочную связь с анионом, кроме того, этой степени окисления очень просто добиться посредством использования однозарядных анионов, таких как:
Нужно понимать, что чем активнее анион в данном случае, тем легче он будет вступать в связь с золотом. Кроме того, существуют устойчивые плоско-квадратные комплексы [AuX4]−, которые являются окислителями. Линейные комплексы c содержанием золота Au Х2, которые в меньшей мере устойчивы, также являются окислителями, а золото в них имеет степень окисления +1.
Продолжительное время химики считали, что самая высокая степень окисления золота — +3, но при использовании дифторида криптона, относительно недавно в лабораторных условиях удалось получить фторид золота. Этот очень мощный окислитель содержит золото в степени окисления +5, а формула его молекулы выглядит как AuF6-.
При этом, было замечено, что соединения золота +5 стабильны только со фтором. Резюмируя вышенаписанное, можно уверенно выделить интересную тенденцию тяги благородного металла к галогенам:
- золото +1 отлично себя чувствует во многих соединениях;
- золото +3 также можно получить через некоторое количество реакций, большая часть которых как-то включает в себя галогены;
- золото +5 нестабильно, если с ним не соединен самый агрессивный галоген — фтор.
Более того, связь золота и фтора позволяет добиться очень неожиданных результатов: пентафторид золота при взаимодействии со свободным, атомарным фтором, приводит к образованию крайне неустойчивых AuF VI и VII, то есть молекуле, состоящей из атома золота и шести, а то и семи атомов окислителя.
Для металла, который когда-то считался крайне инертным, это очень нетипичный результат. AuF6 дисмутирует с образованием AuF5 и AuF7 соответственно.
Для провоцирования реакции галогенов с золотом рекомендуется использовать порошок золота и дигалогениды ксенона в условиях повышенной влажности.
Кроме того, химики советуют избегать в быту контактов золота с йодом и ртутью.
При восстановлении из окисленного состояния оно имеет тенденцию образовывать коллоидные растворы, чья окраска варьируется в зависимости от процента содержания тех или иных элементов.
Золото играет немаловажную роль в белковых организмах, а соответственно, встречается в органических соединениях. Примерами могут послужить этилдибромид золота и ауротилоглюкоза. Первое соединение представляет собой молекулы золота, окисленного совместными усилиями обычного этилового спирта и брома, а во втором случае золото принимает участие в структуре одного из видов сахара.
Кроме того, криназол и ауранофин, также содержащие в своих молекулах золото, применяются в лечении аутоимунных заболеваний. Многие соединения золота токсичны и при накоплении их в определенных органах, могут приводить к патологиям.
Каким образом химические особенности золота обеспечивают его физические свойства?
Большая молярная масса делает блистательный металл одним из самых тяжелых элементов. По весу его обгоняют только плутоний, платина, иридий, осмий, рений и несколько других радиоактивных элементов. Но радиоактивные элементы в вопросе массы являются вообще особенными — их атомы в сравнении с атомами обычных элементов гигантские и очень тяжелые.
Большой радиус, способность формировать до 5 ковалентных связей и расположение электронов на последних осях электронной структуры обеспечивают следующие качества металла:
Пластичность и тягучесть — связи атомов этого металла легко разрываются на молекулярном уровне, но в то же время они медленно восстанавливаются. То есть атомы перемещаются с разрывом связей в одном месте и возникновением в другом. Благодаря этому проволоку из золота можно делать огромной длины, и именно поэтому существует сусальное золото.
 Мягкость — золото высших проб можно поцарапать ногтем и погнуть зубами.
Мягкость — золото высших проб можно поцарапать ногтем и погнуть зубами.- Отличная электропроводность — кристаллическая решетка в молекулах золота широкая и электроны легко путешествуют по золотым деталям. По этому параметру золото уступает только серебру и меди. Но из-за его тягучести, для решения некоторых инженерных задач оно подходит гораздо лучше.
- Отражение инфракрасного излучения. Чтобы объяснить, почему золото хорошо отражает инфракрасные лучи, придется написать отдельную статью с объяснениями из квантовой механики. Но грубо говоря, свободные электроны в кристаллической решетке гасят частицы излучения. Это позволяет использовать данный элемент в космонавтике, особенно актуально для защиты глаз космонавтов.
- Устойчивость к коррозии и окислению — результат инертности атомов, из-за которой в правильных условиях хранения изделия из золота могут вечно сохранять свои качества. Кроме того, из-за этого качества сплавы золота применяются для конструирования аппаратуры, которая предназначена для работы в сверхагрессивной среде.
Выходит, что тот или иной элемент все же перегоняет золото по одному из его полезных особенностей. Но золото держит марку именно потому, что оно имеет комбинацию из важных атрибутов.
Связь химических свойств золота с его редкостью и особенностями добычи
Этот элемент почти всегда встречается в природе в двух видах: самородки или почти микроскопические крупицы в руде другого металла. При этом, распространенный штамп о том, что самородок блестит и вообще хоть как-то похож на слиток, следует забыть. Самородки встречаются нескольких видов: электрум, палладиевое золото, медистое, висмутовые.
И во всех случаях имеется существенный процент примесей, будь то серебро, медь, висмут или палладий. Месторождения с крупицами называются рассыпными. Получение золота — сложный технический и химический процесс, суть которого заключается в отделении драгоценного металла из руды, руды или породы посредством амальгамирования, или применения ряда реагентов.
При этом, оно относится к рассеянным элементам, то есть тем, которые не встречаются особо крупными месторождениями и не попадаются крупными кусками чистого элемента. Это — результат его низкой активности и стабильности некоторых соединений с ним.
Источник: http://VseoZolote.ru/interesno/zoloto-himicheskij-element.html
Золото — свойства атома и сплавов
 |
Атомы — Lego природы. |
Золото (лат. Aurum), Au, химический элемент 1 группы периодической системы Менделеева; атомный номер 79, атомная масса 196,9665; тяжёлый металл жёлтого цвета, относящийся к благородным. Состоит из одного устойчивого изотопа 197Au.
Обзоры приведены в соответствии с энциклопедическими статьями С. А. Погодина и А. И. Стадниченко.
Разделы страницы о золоте как веществе и материале:
- Физические и физико-химические свойства золота
- Химические свойства золота и его соединений — см. также геохимию золота
- Золото в природе — см. также золоторудные поля и золотоносные узлы
- Историческая справка об использовании золота
- Извлечение золота — см. также разведку и добычу золота
- Золото в ноосфере (применение)
- Золото в биосфере и в медицине — см. также о биогенной концентрации золота
- Сетевые обзоры о золоте
- Сетевые новости о золоте
- Библиография по золоту
 ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0 : Аи+ : Аu2+ : Аu3+ соответственно равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6). 3олото — желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m. Золото — мягкий, очень пластичный, тягучий металл (может быть проковано в листки толщиной до 8·10-5 мм, протянуто в проволоку, 2 км которой весят 1 г): твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа. Золото хорошо проводит тепло и электричество. ЗОЛОТО (Aurum) Au, хим. элемент I гр. периодич. системы, ат. н. 79, ат. м. 196,9665; относится к благородным металлам. В природе один стабильный изотоп 197Аu. Конфигурация внеш. электронной оболочки 5d106s1; степени окисления +1, +3, редко +5; энергии ионизации Аu0 : Аи+ : Аu2+ : Аu3+ соответственно равны 9,2258, 20,5 и 30,5 эВ; электроотрицательность по Полингу 2,4 сродство к электрону 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы (в скобках указаны координац. числа) Аu+ 0,151 нм (6), Аu3+ 0,082 нм (4), 0,099 нм (6). 3олото — желтый металл; кристаллич. решетка гранецентрир. кубическая, а = 0,40786 нм, z = 4, пространств. группа Fm3m. Золото — мягкий, очень пластичный, тягучий металл (может быть проковано в листки толщиной до 8·10-5 мм, протянуто в проволоку, 2 км которой весят 1 г): твердость по Моосу ~ 2,5, по Бринеллю 220-250 МПа; модуль упругости 81 ГПа; sраст 10-25 МПа. Золото хорошо проводит тепло и электричество. |
- Кристаллическая решётка золота гранецентрированная кубическая, а = 4,704 A.
- ⚛ Атомный радиус 1,44 A, ионный радиус Au1+ 1,37 A.
- tпл 1064,43°С, tkип 2947°С (приводится также величина 2880 °С); термический коэффициент линейного расширения 14,2·10-6 (0—100°С);
- температурные коэф. линейного расширения (5,98-19,10).10-6 К-1 (40-1200 К), объемного (1,79-5,73).10-5 К-1 (40-1200 К); теплопроводность 318 Вт/(м.К) при 273 К; r (2,06-2,84).10-8 Ом.м (273-373 К), температурный коэф. r 4,0.10-3 К-1 (273-373 К);
- удельная теплопроводность 311,48 вт/(м·К) [0,744 кал/см (сек·°С]; удельная теплоёмкость 132,3 дж/(кг·К) [0,0316кал/г·°С] (при 0°—100°С);
- удельное электросопротивление 2,25·10-8ом (м (2,25·10-6 ом (см) (при 20°С); температурный коэффициент электросопротивления 0,00396 (0—100°С).
- С0p 25,39 Дж/(моль.К); DH0пл 12,55 кДж/моль, DH0исп 348 кДж/моль; S0298 47,40 Дж/(моль.К);
- ур-ния температурной зависимости давления пара: для твердого 3. lgp (гПа) = 3,94 — 19820/T — 0,3061gT — 0,16.10-3 Т (298-1337 Т), для жидкого lgp(Пa) = 10,710 + 17866/Т (1337-3150 К);
- диамагнетик, магн. восприимчивость —29,59.10-6.
- Плотность твердого золота 19,32 г/см3 (при 20°С), жидкого 17,22 г/см3 (1100°С);
- Модуль упругости 79·103Мн/м2 (79·102кгс/мм2), для отожжённого золота предел прочности при растяжении 100—140 Мн/м2 (10—14 кгс/мм2), относительное удлинение 30—50%, сужение площади поперечного сечения 90%.
- После пластической деформации на холоду предел прочности повышается до 270—340 Мн/м2 (27—34 кгс/мм2). Твёрдость по Бринеллю 180 Мн/м2 (18 кгс/мм2) (для золота отожжённого около 400 °С).
Золото весьма стойко против химических воздействий. Оно устойчиво на воздухе и в воде. С О2, Н2, N2, P, Sb и С непосредственно не взаимодействует. Фосфид Аu2Р3 (DH0обр -102 кДж/моль) и антимонид AuSb2 (DH0обр — 13 кДж/моль) получают косвенным путем.
3олото не растворяется в р-рах щелочей и к-тах, раств. в горячей H2SeO4, смесях к-т — Н2SО4 с HNO3, H2SO4 с НМnО4, а также в царской водке (НСl + НNO3): Аu + HNO3 + 4НСl : H[AuCl4] + NO + 2Н2О; после осторожного выпаривания выделяются желтые кристаллы комплексной золотохлористоводородной к-ты НАuСl4.3Н2О.
В водных р-рах цианидов (Na, Ca, К) при доступе О2 или др. окислителей золота раств. с образованием дицианоаурат-иона (цианирование): 2Au + 4CN- + Н2О + 0,5О2 : 2[Au(CN)2]- + 2OH-, что лежит в основе важнейшего пром. способа извлечения золота из руд. С галогенами в отсутствие влаги золото без нагревания не взаимод., при нагр.
порошка золота в атмосфере галогенов образуются золота галогениды.
С многими металлами золото дает сплавы. На легком образовании амальгамы золота основан один из методов извлечения золота из горных пород. Соед. золота неустойчивы, в водных р-рах гидролизуются, легко восстанавливаются до металла.
Конфигурация внешних электронов атома золота 5d10 6s1. В соединениях золото имеет валентности 1 и 3 (известны комплексные соединения, в которых золото 2-валентно).
Для золота характерна лёгкая восстановимость его из соединений до металла и способность к комплексообразованию. Существование закиси золота, т. е. оксида золота (I) Au2O — сомнительно.
С неметаллами (кроме галогенов) золото не взаимодействует. С галогенами золото образует галогениды, например 2Au + 3Cl2 =2AuC13. В смеси соляной и азотной кислот золото растворяется, образуя золотохлористоводородную кислоту H [AuCl4].
В растворах цианида натрия NaCN (или калия KCN) при одновременном доступе кислорода золото превращается в цианоаурат (I) натрия 2Na [Au (CN)2]. Эта реакция, открытая в 1843 П. Р. Багратионом, получила практическое применение только в конце 19 в. (см. Цианирование).
Хлорид золота (I) AuCl получается при нагревании хлорида золота (III): AuC13 = AuCl + C12.
Хлорид золота (III) AuC13 получается действием хлора на порошок или тонкие листочки золота при 200 °С. Красные иглы AuCl3 дают с водой коричнево-красный раствор комплексной кислоты: AuC13 +Н2О=Н2[AuOC13].
При осаждении раствора AuC13 едкой щёлочью выпадает амфотерная жёлто-коричневая гидроокись золота(III) Au(OH)3 c преобладанием кислотных свойств; поэтому её называют золотой кислотой, а её соли — ауратами (III). При нагревании гидроокись золота (III) превращается в окись золота Au2O3, которая выше 220° разлагается по реакции: 2Au2O3 = 4Au + 3O2.
При восстановлении солей золота хлоридом олова (II) 2AuC13 + 3SnCl2 = 3SnCl4 + 2Au образуется весьма стойкий пурпуровый коллоидный раствор золота (кассиев пурпур); это используется в анализе для обнаружения золота. Количественное определение золота основано на его осаждении из водных растворов восстановителями (FeSO4, H2SO3, H2C2O4 и др.) или на применении пробирного анализа.
Гидроксид Au(OH)3 — темно-коричневые кристаллы; при нагревании дегидратируется с образованием сначала АuО(ОН), а затем сесквиоксида Аu2О3, к-рый выше 160°С разлагается на золото и О2; растворимость в воде 2,4.
10-12 моль/л при 20°С, в р-рах НNО3 — до 0,38 моль/л при 25 °С, в растворах NaOH — до 8.10-4 моль/л при 25°С. В последнем случае в растворе золото находится в виде гидроксоаурат-ионов [Аu(ОН)4]- (рН 7-13).
Образуется Аu(ОН)3 при добавлении концентрированного раствора щелочи или Mg(OH)2 к растворам Н[АuСl4].
Ауpaты неустойчивы, легко разлагаются при нагревании.
Аураты щелочных металлов хорошо растворяются в воде, растворимость растет с увеличением ионного радиуса катиона; аураты Mg, Ca, Sr, Ba, Тl(I) ограниченно растворимы.
Аураты с некоторыми органическими веществами образуют взрывчатые смеси. Предполагают, что при действии на гидроксид золота растворов щелочи образуются аурат-анионы [Н2АuО3]-, [HAuO3]2-, [AuO3]3-. См. также табл. 2.
Другие кислородные соединения золота неустойчивы, легко образуют взрывчатые смеси. Соединение Аu2О3 с аммиаком Au2O3.4NH3 называется «гремучим золотом»; взрывается при 145°С, иногда и при более низких температурах; без взрыва растворяется в растворах цианидов щелочных металлов.
Гемисульфид золота Au2S — черно-коричневые кристаллы; DG0обр 29 кДж/моль; плохо раств. в воде (произведение р-римости 4.10-69 при 25 °С), раств. в р-рах цианидов и полисульфидов щелочных металлов. Получают взаимод. конц. р-ра K[Au(CN)2] с H2S с послед. нагреванием до кипения с избытком соляной к-ты.
Сесквисульфид Au2S3 — черные кристаллы; разлагается при нагр. до 200 °С; не раств. в соляной и серной к-тах, раств. в HNO3 с выделением элементарного золота, р-рах KCN, бромной воде. Получают взаимод. H2S с АuСl3 или комплексными хлоридами золота в безводном эфире на холоду. Известны комплексные соед.
, содержащие анионы [AuS3]2-, [AuS2]-, [AuS]-, [Au(SO3)2]3-, [Au(S2O3)2]3- .
Моноселенид AuSe существует в двух кристаллич. модификациях моноклинной сингонии. При обработке солянокислых р-ров золота на холоду селеноводородом осаждается сесквиселенид Au2Se3.H2Se, устойчивый (после сушки) в интервале 40-390°С; при 535-650°C разлагается с выделением элементарного золота.
Селенат (IV) Au2(SeO3)3.3H2SeO3 лимонно-желтые кристаллы; не раств. в воде, раств. в соляной и селенистой (при нагр.) к-тах.
Селенат (VI) Au2(SeO4)3 желтые кристаллы; DH0обр — 954 кДж/моль; не раств. в воде, разлагается соляной к-той, раств. в H2SO4, HNO3 и горячей конц. H2Se04.
Теллурид (гемителлурид) АuТе2 — кристаллы от латунно-желтого до серебристо-белого цвета с металлич. блеском; плотн. 9,3 г/см, DH0обр — 11 кДж/моль; хрупок, твердость по Моосу 2,5-3.
Тиоцианат AuSCN — бесцв. кристаллы; не раств. в воде и орг. р-рителях; при 140°С разлагается до металлич. золота и (SCN)n; под действием воды образует в р-рах прочные комплексные анионы [Au(SCN)2]- и [Au(SCN)4]- .
При восстановлении золота в разб. р-рах его солей, а также при электрич. распылении золота в воде образуются коллоидные р-ры золота, окраска к-рых зависит от степени дисперсности частиц, а интенсивность окраски от их концентрации. Частицы золота в коллоидном р-ре отрицательно заряжены. Гидрофобный золь золота в солянокислом водном р-ре можно представить схемой:
[Аu]m — ядро мицеллы (число атомов т в зависимости от условий может меняться от неск.
сотен до миллионов единиц); АuСl4- — ионы, определяющие отрицательный заряд коллоидной частицы золота и величину потенциала адсорбционного слоя толщиной d0; Н+ — противоионы, определяющие потенциал диффузионного слоя (электрокинетич.
потенциал), из к-рых х ионов находится в размытой части двойного слоя толщиной d; n — кол-во ионов АuСl4-, адсорбированных на поверхности ядра мицеллы, при этом п
Источник: http://www.garshin.ru/evolution/chemistry/atoms/aurum.html
Изотопы золота
jpg» alt=»Изотопы химического элемента золото — Aurum» width=»186″>Изотопы золота – это разновидности атомов химического элемента золота, имеющие разное содержание нейтронов в ядре.
Все изотопы золота, за исключением одного стабильного, радиоактивны. Наиболее устойчивыми являются 195Au (период полураспада – 186,098 суток), 196Au (период полураспада – 6,1669 суток) и 199Au (период полураспада – 3,139 суток).
Изотопы золота характеризуются различной атомной массой. Это объясняется тем, что при постоянном числе протонов и электронов (по 79 элементарных частиц каждого типа) в них присутствует различное число не имеющих заряда нейтронов. Атомная масса изотопов золота может находиться в пределах от 169 до 205, если учитывать все известные разновидности атомов в настоящее время.
Природное золото состоит из единственного стабильного изотопа – 197Au. Его атомная масса выражается верхним индексом и составляет примерно 196,9666. Зарядовое число ядра, то есть количество протонов, составляет 79.
Это порядковый номер золота в Периодической системе химических элементов. Следующий изотоп 198Au широко используется в радиотерапии и медицинской диагностике, в исследованиях с применением радиоактивных индикаторов.
Средневековые алхимики не одно десятилетие искали способ получения золото из других химических веществ: серебра, ртути, свинца, алюминия. В настоящее время учёные доказали теоретическую возможность такого процесса.
Всем известно, что атомы состоят из протонов, нейтронов и электронов, причём число протонов в ядре совпадает с числом электронов (электрическая нейтральность). Количество протонов p+, а следовательно, и количество электронов e– соответствует порядковому номеру атома в таблице Менделеева.
К примеру, нейтральный атом золота Au содержит 79 протонов и 79 электронов, а нейтральный атом ртути Hg – 80 протонов и 80 электронов.
Превращение одного вещества в другое посредством изменения в каждом атоме числа элементарных частиц – ещё очень и очень далёкое будущее нашей цивилизации.
Многие учёные опровергают возможность такого процесса, поскольку он должен занимать невозможно огромное количество энергии, что делает само превращение крайне невыгодным. К тому же, очень мало шансов, что после полной трансформации вещество сохранит целостность и получит необходимую структуру.
Хотя вполне вероятно, что через 5-8 тысячелетий утюги будут спокойно трансформироваться в телевизоры и микроволновые печи, а автомобили превращаться в самолёты и космические корабли…
Ценная информация продоставлена сайтом по покупке серебра и золота — Металл Дисконт
← Импортное золото↑ Информация о золотеДобыча золота →
Источник: http://metall-discont.ru/informacziya-o-zolote/izotopyi-zolota.html




