Относится к элементам d — семейства. Металл. Обозначение – Cu. Порядковый номер – 29. Относительная атомная масса – 63,546 а.е.м.
Электронное строение атома меди
Атом меди состоит из положительно заряженного ядра (+29), внутри которого есть 29 протонов и 35 нейтронов, а вокруг, по четырем орбитам движутся 29 электронов.
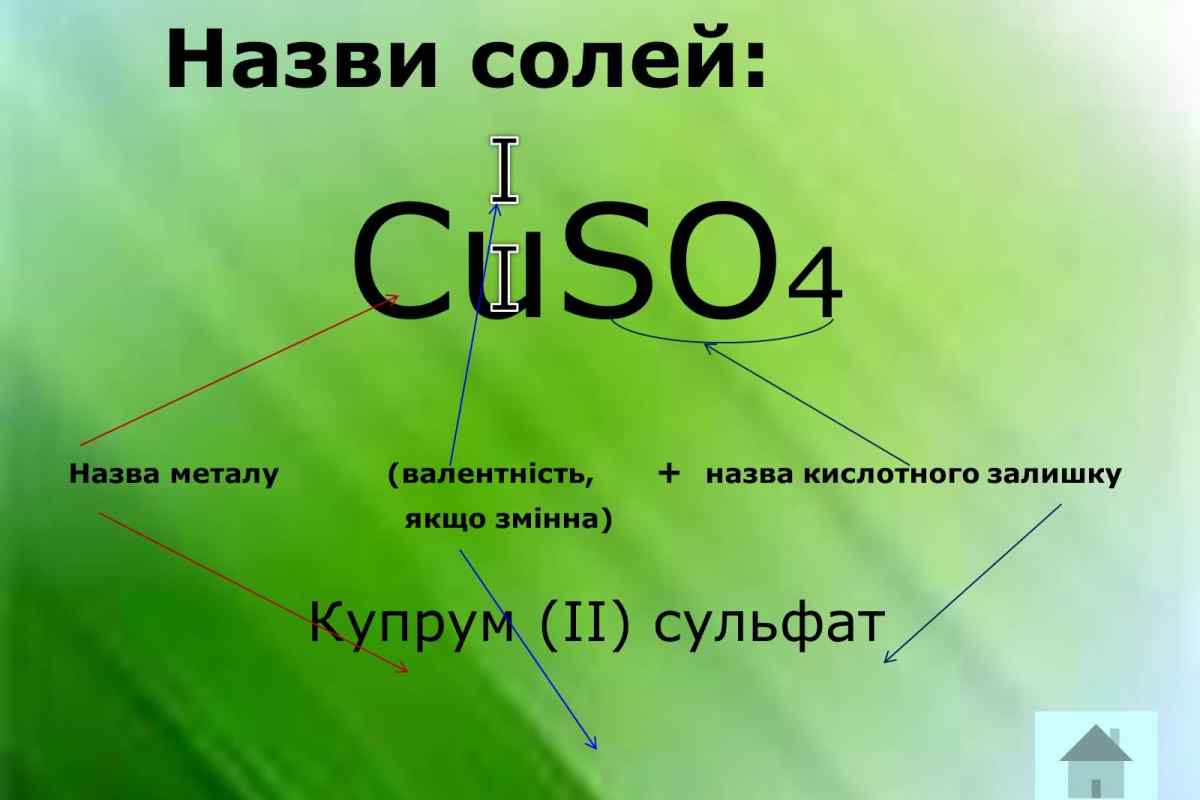
Рис.1. Схематическое строение атома меди.
- Распределение электронов по орбиталям выглядит следующим образом:
- Состояние считается более энергетически выгодным, если на d-подуровне находится 5 или 10 электронов, поэтому в случае меди мы наблюдаем проскок: один электрон s-подуровня переходит на d-подуровень для того, чтобы положение было устойчивым.
- Энергетическая диаграмма основного состояния принимает следующий вид:

Примеры решения задач
| Задание | Сравните электронные конфигурации атомов азота и фосфора. Какие валентности и степени окисления они могут проявлять в химических соединениях? Приведите формулы соединений этих элементов с водородом и их высших оксидов. |
| Ответ | Дадим характеристику химическому элементу фосфору :
|


- p-элемент, неметалл.
- Высший оксид – P2O5 — проявляет кислотные свойства:
Гидроксид, соответствующий высшему оксиду – H3PO4, проявляет кислотные свойства:
- Минимальная степень окисления «-3», максимальная – «+5».
Дадим характеристику химическому элементу азоту :
- N – азот.
- Порядковый номер – 7. Элемент находится в 2 периоде, в V группе, А (главной) подгруппе.
- Z=7 (заряд ядра), M=14 (массовое число), e=7 (число электронов), p=7 (число протонов), n=14-7=7 (число нейтронов).
- 7N 1s 2 2s 2 2p 3 – электронная конфигурация, валентные электроны 2s 2 2p 3 .
- Основное состояние

- p-элемент, неметалл.
- Высший оксид – N2O5 — проявляет кислотные свойства:
Самое максимальное разрешение экрана
Гидроксид, соответствующий высшему оксиду – HNO3, проявляет кислотные свойства:
- Минимальная степень окисления «-3», максимальная – «+5»
| Задание | Приведите электронную формулу атома хрома. Сколько неспаренных электронов имеет атом хрома в основном состоянии? |
| Ответ | +24 Cr)2)8)13)1; |
Энергетическая диаграмма основного состояния принимает следующий вид:

Количество неспаренных электронов в атоме хрома равно шести.
Проскок электрона — отступления от общей для большинства элементов последовательности заполнения электронных оболочек, связанные с тем, что эти “нарушения правил” обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек “по правилам”.
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р 3 ; р 6 ; d 5 ; d 10 ; f 7 ; f 14 ).
Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d– подуровня за счёт проскока ( или повала) электрона с внешнего s– подуровня на нижележащий (предвнешний) d– подуровень.
- Для ряда элементов закономерные проскоки приведены в таблице 1.
- Таблица 1– Проскоки электронов
- Атомная валентная зона
- Согласно приведенным электронным конфигурациям медь одновалентна, так как в атоме только один неспаренный электрон.
На практике оказывается, что Cu проявляет валентность, равную двум. Следовательно, возможен, вопреки правилу, переход одного проскочившего электрона с предпоследнего 3d- подуровня на внешний 4р- подуровень. На рисунке 5 показано расширение атомной валентной зоны атома меди.
3d 4s 4p 3d 4s 4p
![]()
Рисунок 5– Расширение атомной валентной зоны атома меди
В этом случае максимальная валентность меди будет равна трем. На практике медь проявляет валетность (В) равную единице и двум.
Для золота характерна валентность В = 1; 2; 3. Расширение валентной зоны происходит таким же образом, как у меди. На практике золото обычно имеет валентность, равную трем, поскольку оно стоит в шестом периоде и электроны ядром удерживаются слабее.
Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице.
Хром и молибдена имеют одинаковое строение АВЗ и проявляют одинаковую валентность от двух до шести.
Редми нот 4 есть ли нфс
2 Периодическая система элементов
- В современной формулировке периодический закон звучит так: свойства химических элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов.
- Периодическая система состоит из периодов и групп.
- Периодом называется последовательный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns 1 до ns 2 np 6 (или до ns 2 у первого периода).
Все периоды начинаются с s-элемента и заканчиваются p-элементом (у первого периода s-элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства. Атомы элементов одной и той же группы имеют одинаковое число валентных электронов.
Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент.
Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги).
В главных подгруппах расположены s–элементы (I, II групп) и p–элементы (III-VIII групп). В атомах элементов главных подгрупп валентные электроны находятся на s– и р–подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
В побочных подгруппах располагаются d— и f—элементы. Валентные электроны в атомах d—элементов находятся на s—подуровне внешнего и d—подуровне предпоследнего энергетических уровней.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Медь в таблице менделеева занимает 29 место, в 4 периоде.
| Символ | Cu |
| Номер | 29 |
| Атомный вес | 63.5460000 |
| Латинское название | Cuprum |
| Русское название | Медь |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема меди
Cu: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10
Короткая запись: Cu: [Ar] 4s 1 3d 10
Порядок заполнения оболочек атома меди (Cu) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Самсунг галакси s6 edge быстро разряжается
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Медь имеет 29 электронов, заполним электронные оболочки в описанном выше порядке:
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 6 электронов на 3p-подуровне
- 1 электрон на 4s-подуровне
- 10 электронов на 3d-подуровне
Степень окисления меди
Атомы меди в соединениях имеют степени окисления 4, 3, 2, 1, 0.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы меди
Валентность Cu
Атомы меди в соединениях проявляют валентность IV, III, II, I.
Валентность меди характеризует способность атома Cu к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cu
Квантовые числа определяются последним электроном в конфигурации, для атома Cu эти числа имеют значение N = 3, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif):


Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник: https://sportpit4u.ru/skolko-valentnyh-jelektronov-u-medi/
Валентность химических элементов


Время на чтение: 12 минут 
Общая характеристика
Валентность представляет способность атомов создавать химические соединения, добавлять другие атомы. С давних времен известны исторические данные о молекулярной, атомной структуре веществ.
Необходимость и основные понятия

Определение в переводе характеризует силу, создание. Главное суждение введено до открытия строения атома. Природа химических соединений заключается в делении между собой пары частиц на валентные электроны.
Число обобществленных связей, которыми атом соединяется с другими элементами, называется валентностью. В учет не берется полярность связей, поэтому показатель не имеет знака и не равен 0. В химических сочетаниях атомные частицы находятся в числовом соотношении.
Соединения водорода H с разными микрочастицами:
- Хлороводород (HCl).
- Вода (H2O).
- Аммиак (NH3).
- Метан (CH4).
Атом Cl (хлора) связан с одним А. водорода, О2 (кислорода) — с двумя, азота (N)-с тремя, а углерода — с 4 атомными частицами. В молекуле углекислого газа СО2 частица Н связана с двумя атомами кислорода.

А. соединяются по-разному с другими элементами. Такая способность выражается численной характеристикой.
Обозначение валентности:
- HCl (I I).
- H2O (I II).
- HN3 (III I).
- CH4 (IV I).
Один атом водорода соединяется только с одной частью другого элемента, соответственно, валентность принимают за 1. Объясняя «химическим» языком, атомная частица водорода обладает единицей валентности (В), он одновалентен.
Образование химических связей атома любого элемента соответствует количеству соединившихся мелких частиц водорода. В молекуле хлороводорода валентность Cl равна 1, а в молекуле воды у атома кислорода — двум. В структурной составляющей метана В. углерода равна 4. Условно в химии обозначают единицы валентности римскими цифрами I-Х.
Историческая справка и взгляды ученых
Скудные знания о строении молекулярных и атомных частицах 19 века не позволяли объяснить причины, по которым атомы образуют связи с другими элементами. Валентность как основной принцип химии изучается до сих пор.

Ученый Э. Франкленд ввел терминологию «связь» в научные труды для характеристики взаимодействия атомов между собой. Специалист выяснил, что некоторые элементы образуют соединения с одними и теми же атомами. Азот прикрепляет три водородных частицы в молекуле аммиака.
Позже ученый выдвинул теорию о существовании конкретных чисел химической связи и назвал ее «соединительной силой». Труды Франклина стали значимым вкладом в структурную химию.
Мнения, научные работы доказаны в 1860 г. немецким деятелем Ф. Кекуле. По его мнению, углерод является из четырех основным, в самом простейшем его соединении частиц (метане) образуются связи с 4 атомами Н.

В Советском союзе информацию о строении веществ систематизировал А. Бутлеров. Последующее развитие связей получило введение периодической теории Д. Менделеева. Он подтвердил, что валентность Э. в соединениях и прочие свойства обусловлены занятым положением в периодической системе.
Главным преимуществом теории В. является возможность наглядного изображения молекулярного строения. Первые модели возникли в середине 19 века, а позже использовались структурные формулы в виде окружности с химическим знаком. Между обозначений атомов черточкой выделяется связь, а число линий соответствует В.
Основная классификация
Элементы распределяются с постоянной и переменной валентностью. Углерод соединяется с различными атомами кислорода, поэтому имеет переменную валентность. Многие элементы имеют неустойчивую величину.
| Валентность | |||
| Постоянная | Переменная | ||
| Элемент | В | Элемент | В |
| H (Водород) | I | I (Йод) | I |
| Li (Литий) | S (Сера) | II, IV, VI | |
| Na (Натрий) | N (Азот) | I-V | |
| K (Калий) | F | II, III | |
| F (Фтор) | Cu | I, II | |
| Al (Алюминий), B, Р | III, V | C, Si | II, IV |
| O (Кислород), Mg (Магний), Ca (Кальций), Ba (Барий), Zn (Цинк) | II | Cl, Br, I | I, III, V, VII |
Водород образует связь не с каждым элементом, а кислородные соединения имеются почти у всех. В таких сочетаниях атомы О2 проявляют двукратную валентность.
Ковалентная связь осуществляется из-за образования общих электронных пар. Когда между 2 атомными структурами (А) существует совместная электронная пара, она называется одинарной, при наличии двух — двойной, трех — тройной.

Валентность азота N в связи NH3 составляет III, поскольку один атом Н связан с тремя частицами N. Валентность углерода в метане (СН4), по тому же принципу будет 4 (IV).
Валентность хлора в молекуле хлороводорода равна единице, индекс не применяется. Одному атому H соответствует 1 атом Cl. Если образованная химическая связь углерода © в метане равна 4, валентность Н — всегда 1. Рядом с Н ставится индекс 4, а формула метана выглядит следующим образом: CH4.
Постоянной одной В. остается H, K, F. Двухвалентные — кислород, магний, кальций, цинк, а трехвалентные — алюминий. Валентность брома, железа, меди, хлора или прочих элементов модифицируется, когда они формируют различные соединения.
Йод представлен в таблице 53 по счету. Присутствие одного неспаренного электрона говорит о способности проявлять низшую В., равную единице в соединениях. Зная валентность, можно легко составить формулы соединений.

Определение по формуле
Если под рукой нет таблицы Менделеева, то существует возможность установления В. элемента с помощью несложных расчетов. Для примера выбирается формула оксида марганца — Mn2O7.
Кислород двухвалентный, а для определения марганца В. кислорода умножают на число атомов газа в сочетании 2*7, получается 14. Это число делится на количество мелких атомных частиц Mn:14/2 = 7. В полученном соединении валентность составляет VII.
Индексы в молекулярных веществах отображают число А., входящих в состав. Получив формулу вещества, в котором известна В. одного элемента, можно определить В. другого. В веществе, состоящем из молекул число В. обоих элементов равно. Используется минимальное общее кратное для определения неизвестной В.

Например, в образовании формулы связи оксида железа Fe2O3 участвуют пара атомов Fe с валентностью III и три атома O с двойной валентностью. Минимальным общим кратным будет 6.
Для правильной формулировки записи оксида фосфора учитывается В кислорода (II) и фосфора (V). Наименьшее общее кратное для Р и О получается десять. Обозначение записывается Р2О5.
Понимая и зная свойства элементов, проявляющих в разных сочетаниях, можно находить валентность по внешнему параметру соединений. Оксиды меди (купрум) имеют красный (Cu2O) и черный (CuО) цвет. Гидроксиды меди будут желтыми (CuОН) и синими (Cu (ОН)2).
Чтобы составить формулу бинарных соединений элементов, достаточно определить валентность. Если требуется записать формулу кислородного соединения хлора (ClO), в котором валентность Cl равна 7, соблюдают последовательность:
- Записывают символы элементов и валентность. Это VII II ClO.
- Найти меньшее кратное валентностей двух элементов. VII*II, получается 14.
- Делят наименьшее кратное на В. каждого элемента, находят значение индексов. 14/2 = 7, 14/7 = 2.
Записывают индексы возле знаков элементов. Получается Cl2O7.
Труды Менделеева
Согласно электронной теории, В. атома определяется из числа непарных электронов (Э)., участвующих в формировании пар с Э. других атомов. Понятие В. связано с созданием закона Менделеева.
Теория электронов
Атомы представляют положительную основу (ядро), вокруг которой расположены отрицательно заряженные электроны. Наружная оболочка последних бывает недостроенной, а завершенная структура устойчивее, она включает восемь электронов.
Создание связи за счет общих пар электронов приводит к благоприятному состоянию атомов.
Максимальная В. — это величина Э. во внешней оболочке атома. Химические связи составляют Э., находящиеся на наружной оболочке атома. Изучив таблицу Менделеева, можно определить, что положение веществ в периодической системе и его В. взаимосвязаны.
Валентность:
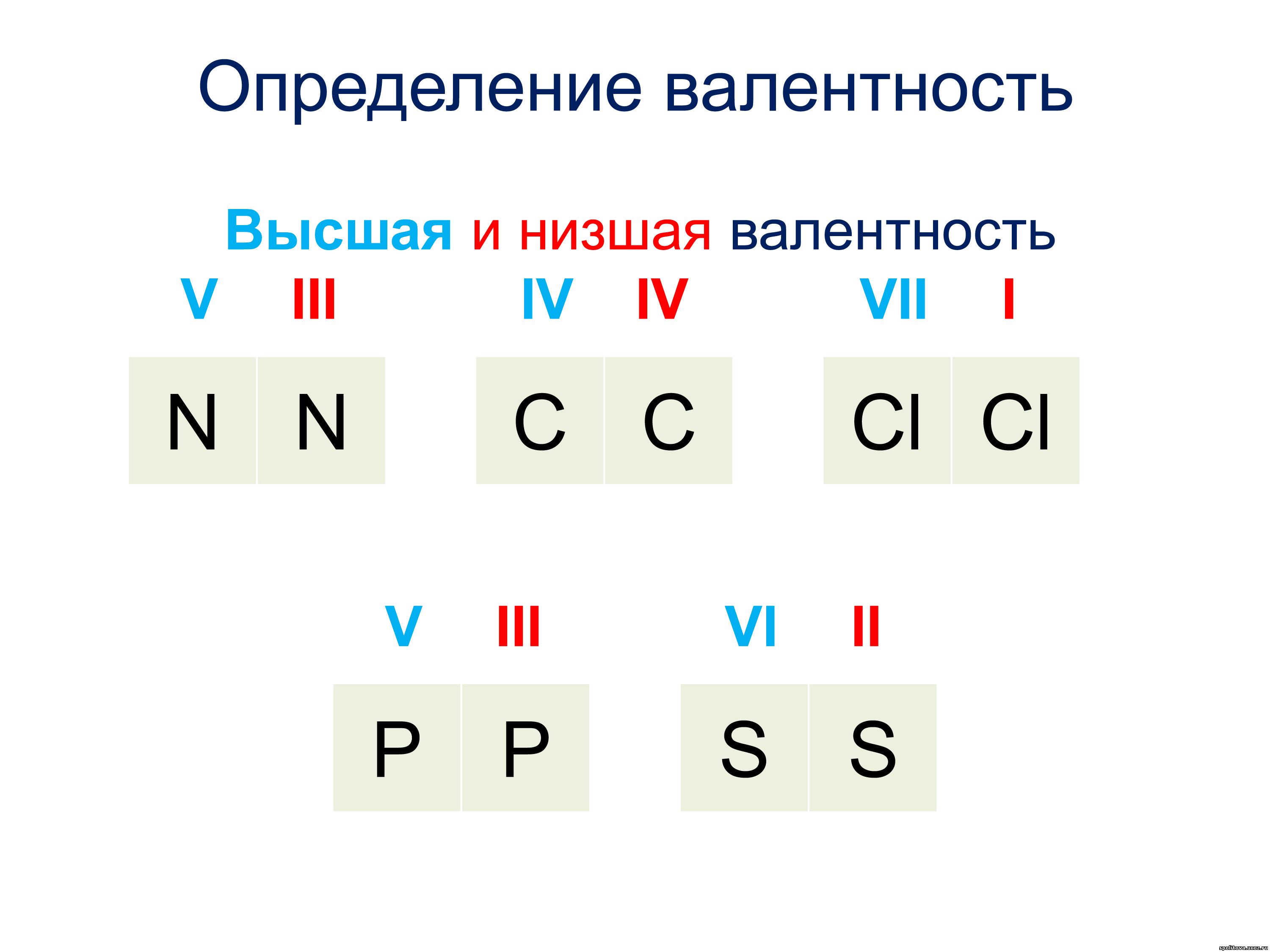
- Высшая. Соответствует порядковому № группы.
- Низшая. От числа вида по табличным данным отнимают номер интересующего элемента.
- Основанием для образования соединений является прием электронов.
- Виды электронов:
- Спаренные. Расположены на одной орбитали.
- Неспаренные. Это 1 электрон на орбитали.
Когда атом отрицательно заряжен частицами без пары для взаимодействия, то они образуются в таком количестве, сколько имеется неспаренных электронов.
В молекулярной структуре водорода и серы H2S последнее вещество приобретает двойную валентность (-), потому что каждый атом участвует в образовании 2 электропар. Знак черточка или тире указывает на притяжение пары к более отрицательному элементу. У менее отрицательного к валентности добавляют знак плюс.
Распределение свойств
В периодической таблице указаны все 118 химических элементов (водород, литий, бор, натрий, магний, кальций, ванадий, уран и другие).
Химические и физические свойства каждого вещества похожи с предшествующим ему в таблице элементом. Закономерность проявляется у всех, кроме нескольких первых, потому что они не включают перед собой элементов, аналогичных по атомному объему.
Валентность металлов:
| Элемент | В |
| Серебро | I-III |
| Ртуть | I-II |
| Золото | I-III |
| Никель | I- IV |
| Мышьяк | -III, II, III, V |
| Свинец | II-IV |
| Кобальт | II-IV |
| Олово | II, IV |
В периодической таблице элементы классифицированы, упорядочены с учетом атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды называются периодами, а столбцы — группами. В самой первой таблице содержалось не более шестидесяти элементов, теперь продолжительность списка увеличили до 118 элементов. Систематизированы не только химические вещества, но и их свойства.
Достаточно ученому-химику взглянуть на таблицу, и он сможет ответить на разные экзаменационные, научные вопросы.
Говоря о степени окисления, предполагают, что атом в веществе ионной природы имеет заряд, и если валентность нейтральная, то уровень окисления будет нулевым, положительным или отрицательным. Узнать информацию можно из таблицы Менделеева.
Для атома одного и того же Э., в зависимости от элементов, с которыми он сформирует химическое соединение, В. и стадия окисления совпадают (Н2О, СН4) и различаются (Н2О2, HNO3). Само понятие валентности ученые-химики не используют по Менделеевской таблице.
Источник: https://nauka.club/khimiya/valentnost-khimicheskikh-elementov.html
Химические и физические свойства меди

Химические свойства меди определяются положением ее в периодической системе Д. И. Менделеева. Обозначение данного металла Cu (купрум, cuprum), он имеет 29-й порядковый номер, находится в первой группе (побочной подгруппе), в 4 большом периоде.
Выделяется отдельный ее вид: черновая медь, которая является при конвертировании продукта кислородом. Атомная (молярная) масса равна 63,5 г/моль, молекулярная масса — 63,5 а. е. м.
В зависимости от соединения, в котором металл находится, он может иметь валентность +1 и +2, но в редких случаях степень окисления может быть +3 и +5, что является исключением. Строение атома Cu и электронная формула показаны на рисунке:
Кристаллическая решетка меди представляет собой каркас в форме куба, который образован прямыми линиями. Решетка довольно прочная, молекулярная, так как в узлах находятся молекулы.
Физические свойства и характеристика
Медь в чистом виде – это довольно ковкий, тягучий, вязкий металл, имеющий красновато-коричневый цвет.

Его твердость достигается путем добавления в состав различных примесей. Она имеет высокую электропроводность и теплопроводность, но примеси, которые зачастую добавляют в сплав, ухудшают эти показатели.
Преимуществом данного металла является устойчивость к коррозии. Температура плавления равна 1085 градусов по Цельсию, а температура кипения – 2562 градуса. Плотность равна 8900 кг/м3. Удельный вес равен 8930 кг/м3.

Медь в чистом виде является диамагнетиком, то есть магнитными свойствами не обладает. Магнититься могут только ее сплавы, где концентрация непосредственно самой меди не более 50%.
С чем реагирует
Медь НЕ реагирует с водородом, углеродом, азотом, а так же кремнием.
Реагирует с кислотами и солями, оксидами, галогенами, кислородом и неметаллами, но не может реагировать со щелочами, так как находится в электрохимическом ряду после водорода. Так же не может реагировать с фтором, бромом, хлором.
Отношение к кислороду
По отношению к кислороду металл проявляет слабую активность, но при длительном нахождении на воздухе покрывается очень тонкой, почти незаметной зеленоватой пленкой, которая и является оксидом меди.

В зависимости от температуры, при которой протекает реакция, купрум образует 2 оксида: CuO и Cu2O.
Взаимодействие с водой
По причине того, что медь находится в ряду электрохимического напряжения после водорода, она не вытесняет водород из воды. Но если присутствует кислород, водород может вытеснять молекулы металла, за счет чего и происходит окислительно-восстановительная реакция.
Реакции с кислотами
Из-за своего положения в электрохимическом ряду, не вытесняет водород из кислот, поэтому некоторые из них на нее не действуют. Но при достаточном доступе кислорода, растворяются в них, образуя соответствующие кислотам соли.
Отношение к галогенам и неметаллам
С галогенами медь реагирует довольно хорошо. В обычных условиях изменения не особо заметны, но на поверхности со временем образуется очень тонкий слой галогенидов. А при повышенных температурах реакция происходит очень быстро и бурно.

Cu реагирует с серой, в зависимости от температуры образуются следующие сульфиды: Сu2S, CuS.
Может образовывать йодиды (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми оксидами неметаллов, что зависит от неметалла, температуры и других условий протекания химической реакции.
Химические свойства меди

Одновалетной
Ион Cu+ крайне неустойчив, особенно в водных растворах. Примерами одновалентной меди могут служить:
- оксид (I) – Cu2O,
- сульфид (I) – С
- Двухвалентной
- Это наиболее характерная степень окисления для меди. Так же более устойчивая и распространенная, например:
- Трехвалентной
- Наиболее редкая и нестабильная степень окисления этого металла, которая является исключением, например:
- оксид (III) – Cu2O3,
- купрат (III).
Заключение
Медь – распространенное вещество, которое незаменимо во многих отраслях, так как является очень гибким и плавким. Имеет высокие показатели, во многом сравнимые с железом, что позволяет изготавливать из нее многие незаменимые детали в производстве и механике.
Источник: https://tvercult.ru/nauka/himicheskie-i-fizicheskie-svoystva-medi
Медь Cu
Медь в таблице менделеева занимает 29 место, в 4 периоде.
| Символ | Cu |
| Номер | 29 |
| Атомный вес | 63.5460000 |
| Латинское название | Cuprum |
| Русское название | Медь |
Как самостоятельно построить электронную конфигурацию? Ответ здесь Cu: 1s2 2s2 2p6 3s2 3p6 4s1 3d10 Короткая запись:
Cu: [Ar] 4s1 3d10
- Порядок заполнения оболочек атома меди (Cu) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
- На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
- Медь имеет 29 электронов, заполним электронные оболочки в описанном выше порядке:
- Элемент Cu является исключением!
- 2 электрона на 1s-подуровне
- 2 электрона на 2s-подуровне
- 6 электронов на 2p-подуровне
- 2 электрона на 3s-подуровне
- 6 электронов на 3p-подуровне
- 1 электрон на 4s-подуровне
- 10 электронов на 3d-подуровне
Степень окисления меди
Атомы меди в соединениях имеют степени окисления 4, 3, 2, 1, 0.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы меди
Cu 0
Валентность Cu
Атомы меди в соединениях проявляют валентность IV, III, II, I.
Валентность меди характеризует способность атома Cu к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Cu
Квантовые числа определяются последним электроном в конфигурации, для атома Cu эти числа имеют значение N = 3, L = 2, Ml = -2, Ms = ½
Видео заполнения электронной конфигурации (gif): 

Источник: https://k-tree.ru/tools/chemistry/periodic.php?element=Cu




