


Определение и физическая характеристика
Бром, обозначаемый символом Вг, является галогеном и входит в VII группу периодической таблицы химических элементов. Вещество имеет атомный номер 35, а его атомная масса составляет 79,904 дальтонов.
Молярная масса составляет 79,904 г/моль. Относительная молекулярная масса молекулы равна 159,808, а её молярная масса — 160 г/моль.
Бром, встречающийся в природе, состоит из двух нуклидов с массовыми числами 79 и 81.
Существует множество искусственных радиоактивных изотопов. Среди них самым интересным считается 80Вr, поскольку на его примере советский физик И. В. Курчатов открыл изомерию атомных ядер.

Вещество представляет собой жидкость красно-бурого оттенка, отличающуюся сильным неприятным запахом. Температура застывания брома составляет -7,2°С. Замёрзший элемент имеет форму красно-коричневых игольчатых кристаллов, блестящих как металл. Кипит элемент при температуре 58,78 °С, превращаясь в пар жёлто-бурого цвета. Плотность вещества в жидком виде — 3,1 г/см3.
Бром плохо растворяется в воде. Так, если её температура не превышает 5,84 °С, то вещество образует тёмно-красные кристаллы. Лучше всего для его растворения подходят органические составы. Извлекать элемент из различных водных соединений позволяет именно это физическое свойство.
Бром в любом физическом виде состоит из двухатомных молекул. Распад на атомы становится хорошо заметен при температуре 800 °C. Но также его можно наблюдать при действии света.
Химическое строение и свойства
Внешние электроны атома имеют конфигурацию 4s24p5. Необходимо отметить, что такое химическое свойство брома, как степень окисления, разнится в зависимости от соединения, к примеру, у гипобромитов этот показатель равен +1, а у броматов он составляет +5.
В соединениях валентность брома переменна. Атом вещества имеет заряд только тогда, когда является ионом, заряд ядра атома составляет 35. Представить электронную формулу брома можно следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Структурная же формула имеет вид: Br-Br.

Неметалл является химически активным, а потому по способности к реакции располагается между хлором и йодом. Сильное разогревание, иногда сопровождающееся горением, возникает, когда вещество взаимодействует со следующими реагентами:
- сера;
- селен;
- теллур;
- фосфор;
- мышьяк;
- сурьма.
Так же протекает реакция вещества с некоторыми металлами, к примеру, калием и алюминием. Но большинство металлических элементов плохо реагирует с безводным бромом, потому что на их поверхности образуется защитная плёнка бромида, который не растворяется в этом реагенте.
Самыми устойчивыми к такой реакции, даже при высокой температуре и наличии воды, считаются следующие металлы:
- платина;
- свинец;
- серебро;
- тантал.

У золота с бромом взаимодействие проходит довольно активно. Кислород, азот и углерод не создают с элементом прямых соединений даже при повышенной температуре.
Чтобы эти вещества соединились, химики применяют различные косвенные методы. К примеру, очень непрочный оксид Вr3О8 получают посредством воздействия озона на бром при 80 °C.
Реагировать непосредственно с элементом способны галогены, в результате их взаимодействия образуются BrF3, BrCl и другие соединения.
Бром относится к сильным окислителям. Элемент способен вытеснить из химических соединений йод. Само же вещество подвергается вытеснению хлором и фтором.
Выделить чистый неметалл из бромидов на основе воды можно посредством использования сильных окислителей, поместив все реагенты в кислую среду. Растворяясь в воде, вещество вступает с нею в слабую реакцию, результатом которой становится образование бромистоводородной и бромноватистой кислот. Водный раствор элемента называется бромной водой.
Неметалл растворяется в щелочах:
- При низких температурах соединение брома и гидроксидов даёт бромиды и гипобромиты.
- При температуре около 100 °C получаются бромиды и броматы.
Взаимодействие брома и органических соединений чаще всего проходит с характерным присоединением углерода по двойной связи и замещением водорода. Обычно это происходит при воздействии различных катализаторов или света.
Ещё одной распространённой химической реакций является бромирование, суть которого заключается во введении атома реагента в соединение посредством химической реакции вещества с ненасыщенной молекулой или замещения водорода.
Нахождение в природе

Основная часть природного брома рассеяна в земной коре. Больше всего вещества содержится в породах, сформированных магмой. Этот элемент можно обнаружить рядом с хлором. Так, соли элемента встречаются в солевых хлорных отложениях, в морской воде, насыщенном растворе соляных озёр и рассолах, находящихся под землёй, которые зачастую связаны с месторождениями соли и нефти. Так как вещество хорошо растворяется в воде, его соли скапливаются в рассолах, оставшихся на месте озёр и заливов.
Неметалл перемещается в форме хорошо растворимых соединений, а потому его довольно сложно встретить в твёрдой минеральной форме. Минералами становятся бромирит AgBr, эмболит Ag (Cl, Вг) и йодэмболит Ag (Cl, Вr, I), которые образуются в зонах окисления сульфидных месторождений серебра, сформировавшихся в областях пустынь и полупустынь.
Промышленное получение
В промышленности для получения брома используют морскую воду, озёрные и подземные рассолы, а также калийные щёлоки. Для выделения вещества применяют хлор. Процедура состоит из следующих этапов:

- В гранитные, керамические или другие устойчивые к бромовому воздействию колонны сверху подают подогретое сырьё.
- Снизу в них направляют хлор и водяной пар или воздух.
- После выхода из устройства бромовые пары оседают в виде жидкости в специальных холодильных установках.
- Полученное вещество отделяют от воды.
- Посредством дистилляции его очищают от хлора.
- Из смеси реактива и воздуха бром выделяют с помощью химических поглотителей. В таких установках может использоваться газообразный сернистый ангидрид. Он реагирует с реактивом при наличии водяного пара, образуя бромистоводородную и серную кислоты.
- Для получения чистого вещества полупродукты подвергают воздействию хлора или кислоты.
- При необходимости проводится их переработка на бромистые соединения без выделения искомого элемента.
Метод с применением воздуха позволяет получать бром из рассолов даже с небольшим количеством вещества. Применять к таким смесям паровой способ экономически невыгодно, поскольку на выделение малого количества реагента тратится значительное количество пара.
Применение вещества
Прежде всего, вещество является основой для создания бромистых солей и различных производных на основе органики. Но и сам реактив, и его соединения довольно широко используются во многих областях жизнедеятельности человека:

- Органические бромиды — синтезирование красителей и лекарств.
- Бромиды щелочных металлов — успокоительные препараты, используемые для лечения неврозов, повышенной раздражительности, гипертонии, эпилепсии.
- Бромид серебра — фотография.
- Бром — изготовление бромистого этила и дибромэтана, участвующих в производстве этиловой жидкости, которую добавляют к бензинам, чтобы снизить их способность к детонации.
- Бромистый метил — инсектициды.
- Органические соединения вещества — производство эффективных огнетушителей.
- Бромная вода — химические анализы, позволяющие определять многие вещества.
Бром в организме
Вещество содержится в тканях всех животных и растений. Его обнаружили практически во всех жидкостях тела. Если человек здоров, то в его организме уровень брома составляет от 0,11 до 2,00 мг/%. Для поддержания этого показателя в сутки необходимо получать не больше 0,8−1 г реактива.
Радиоактивный бром позволил выявить, что вещество поглощается щитовидной железой, почками и мозгом. Бромиды, которые были введены в животные организмы, увеличили концентрацию процессов торможения, проходящих в головном мозге. Они способствовали приведению в норму нервной системы, которая пострадала от чрезмерного напряжения, возникшего в результате подобного процесса.

Но следует учитывать, что химический элемент задерживается в щитовидной железе, вступая в конкуренцию с йодом. Это влияет на работу органа, что отражается на обмене веществ.
Бром плохо усваивается, если в реакции будут участвовать хлор, алюминий, йод и фтор. Чтобы избежать такой ситуации, перед началом лечения препаратами, содержащими бромные соли, необходимо проконсультироваться с врачом.
Опасность и вред
Элементарный бром представляет собой сильнодействующий яд, отнесённый ко второму классу опасности. Его ни в коем случае нельзя принимать внутрь.
Очень опасны пары вещества:
- При концентрации 1 мг/м3 и более газ вызывает кашель, насморк, кровотечение из носа, головокружение и головную боль.
- При концентрациях, превышающих указанный порог, у человека может начаться отёк лёгких, удушье, бронхит, в некоторых случаях возможен смертельный исход.
- Максимальное допустимое значение — 2 мг/м3.
Во избежание отравления все работы с реагентом необходимо осуществлять в специальных шкафах, оборудованных хорошей вытяжной системой.
Если же защититься от паров не удалось, то следует подышать сильно разбавленным водным раствором аммиака, возможно применение раствора на этиловом спирте.
Для устранения боли в горле, возникшей из-за воздействия отравляющего газа, нужно выпить хорошо нагретое молоко.
В жидком виде попавшее на кожу вещество вызывает ожоги, которые плохо заживают. В случае поражения кожи реагент необходимо тщательно смыть большим количеством воды или сдуть мощной воздушной струёй. Место ожога следует смазать ланолином.
Представителям профессий, требующих постоянной концентрации внимания, к примеру, водителям и альпинистам, применять лекарства на основе брома не рекомендуется. Это обусловлено свойством вещества снимать возбуждённое состояние нервной системы, расслаблять её.
Признаки избытка и нехватки
Чаще всего переизбыток вещества в организме возникает при неправильном употреблении бромосодержащих препаратов. Это состояние может привести к серьёзным проблемам со здоровьем. Признаки избытка микроэлемента:
- Кожные воспаления и высыпания.
- Нарушения в работе пищеварительной системы.
- Ощущение усталости, вялости и подавленности.
- Частые бронхиты и риниты при отсутствии простудных и вирусных заболеваний.
Нехватка брома не менее серьёзная проблема. Из-за отсутствия в организме необходимого количества вещества у беременных женщин повышается вероятность выкидыша на разных сроках.
Проявляться недостаток микроэлемента может в виде таких симптомов:
- бессонница;
- замедление роста у детей;
- понижение уровня гемоглобина.
Эти проблемы редко ассоциируются именно с нехваткой брома, но всё же лучше обратиться к врачу и сдать необходимые анализы. Такая мера позволит установить причину недомогания и исключить возможность развития более серьёзных заболеваний.
Бром является важным химическим элементом. Он необходим для нормальной жизнедеятельности растений и животных. Недостаток этого неметалла, как и его избыток, может привести к развитию заболеваний. Кроме того, вещество активно применяется в различных сферах деятельности человека. На его основе создаются лекарственные препараты, химические реагенты и инсектициды.
Источник: https://nauka.club/khimiya/element-brom-br.html
Бром
| Атомный номер | 35 |
| Внешний вид простого вещества |  красно-бурая жидкость с сильным неприятным запахом красно-бурая жидкость с сильным неприятным запахом |
| Атомная масса (молярная масса) | 79,904 а. е. м. (г/моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 1142,0 (11,84) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p5 |
| Ковалентный радиус | 114 пм |
| Радиус иона | (+5e)47 (-1e)196 пм |
| Электроотрицательность (по Полингу) | 2,96 |
| Электродный потенциал | 0 |
| Степени окисления | 7, 5, 3, 1, -1 |
| Плотность | 3,12 г/см³ |
| Молярная теплоёмкость | 75,69 Дж/(K·моль) |
| Теплопроводность | 0,005 Вт/(м·K) |
| Температура плавления | 265,9 K |
| Теплота плавления | (Br—Br) 10,57 кДж/моль |
| Температура кипения | 331,9 K |
| Теплота испарения | (Br—Br) 29,56 кДж/моль |
| Молярный объём | 23,5 см³/моль |
| Структура решётки | орторомбическая |
| Параметры решётки | a=6,67 b=4,48 c=8,72 Å |
| Отношение c/a | — |
| Температура Дебая | n/a K |
| Br | 35 |
| 79,904 | |
| [Ar]3d104s24p5 | |
| Бром |
Бром — элемент главной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 35. Обозначается символом Br (лат. Bromum). Химически активный неметалл, относится к группе галогенов. Простое вещество бром (CAS-номер: 7726-95-6) при нормальных условиях — тяжёлая жидкость красно-бурого цвета с сильным неприятным запахом. Молекула брома двухатомна (формула Br2).
История
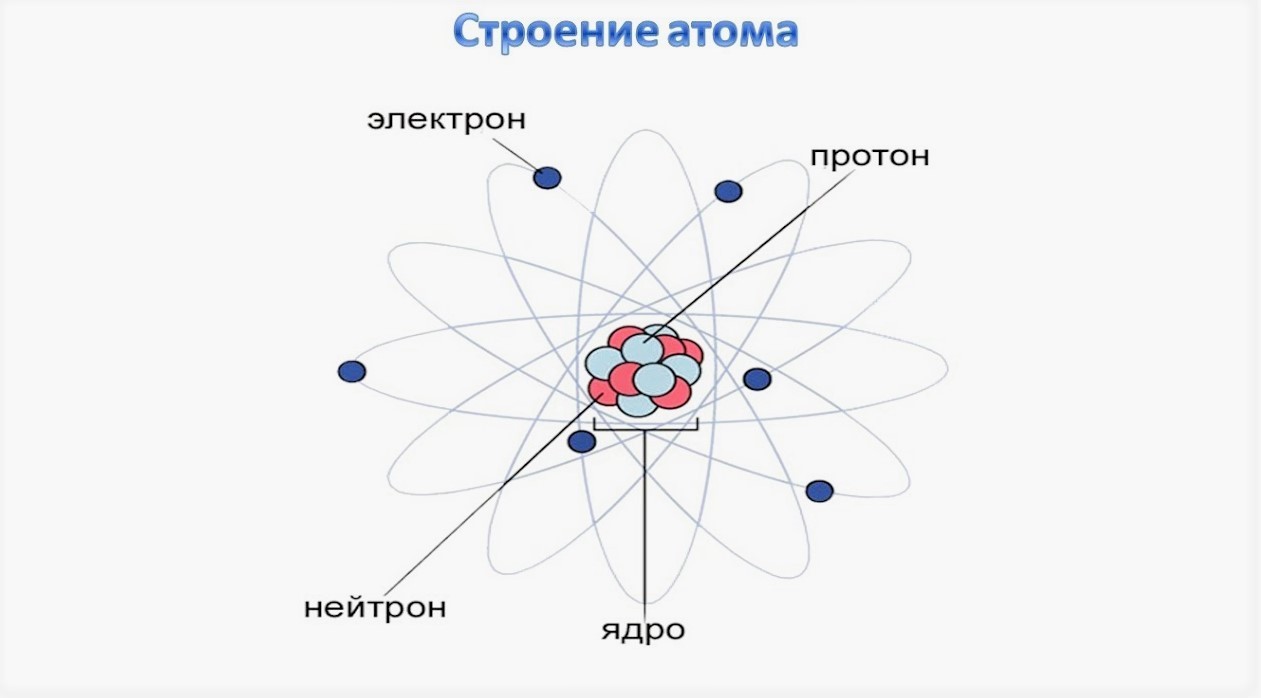
 Схема атома брома
Схема атома брома
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорченный тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда. Фраза-то была, но принадлежала она не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Сорбонне занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Происхождение названия
Название элемента происходит βρῶμος — зловоние.
Получение
Бром получают химическим путём из рассола Br-:
![]()
Физические свойства
При обычных условиях бром — красно-бурая жидкость с резким неприятным запахом, ядовит, при соприкосновении с кожей образуются ожоги. Плотность при 0 °C — 3, 19 г./см³.
Температура плавления (затвердевания) брома −7,2 °C, кипения 58,8 °C, при кипении бром превращается из жидкости в буро-коричневые пары, при вдыхании раздражающие дыхательные пути.
Стандартный электродный потенциал Br²/Вr- в водном растворе равен +1,065 В.
Обычный бром состоит из изотопов 79Br (50,56 %) и 81Br (49,44 %). Искусственно получены радиоактивные изотопы.
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
- Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
- Br2 + H2O → HBr + HBrO.
- С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
- По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
- Br2 + 2KI → I2↓ + 2KBr.
- Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
- Cl2 + 2NaBr → Br2 + 2NaCl.
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl.
Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.).
Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами.
Например, со фтором бром образует неустойчивые BrF3 и BrF5, с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др.
Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C2H4 + Br2 → C2H4Br2.
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
- При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
- При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
- 3Br2 + 3Na2CO3 → 5NaBr + NaBrO3+ 3CO2↑.
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Применение
В химии
Вещества на основе брома широко применяются в основном органическом синтезе.
В технике
— Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
— Используется для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам.
— Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива. — 1,2-дибромэтан в настоящее время применяют как антидетонирующую добавку в моторном топливе, взамен тетраэтилсвинца.
— Растворы бромидов используются в нефтедобыче.
В медицине
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
В производстве оружия
Со времен Первой Мировой войны бром используется для производства боевых отравляющих веществ.
Физиологическое действие
Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома 0,5 мг/м³. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г.
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух; для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача.
Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками.
Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде.
Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо залить раствором сульфита натрия Na2SO3
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения.
Этот миф не имеет под собой никаких оснований — влечение успешно снижают физические нагрузки, а действительно добавляемые в еду добавки чаще всего оказываются аскорбиновой кислотой для предотвращения авитаминоза.
К тому же, препараты брома соленые на вкус и не влияют ни на влечение, ни на потенцию. Они обладают снотворным и успокаивающим эффектом.
Источник: http://himsnab-spb.ru/article/ps/br
Бром (Br, Bromum)
Открытие брома произошло в первой трети XIX столетия, независимо друг от друга немецкий химик Карл Якоб Лёвих в 1825 году, а француз Антуан Жером Балар – в 1826 представили миру новый химический элемент. Интересный факт – изначально Балар назвал свой элемент муридом (от латинского muria – рассол), потому что открытие своё сделал, изучая средиземноморские соляные промыслы.

Общая характеристика Брома
Бром (от древне-греческого βρῶμος , в дословном переводе «вонючий», «зловоние», «вонючка») является элементом главной подгруппы VII группы четвёртого периода периодической системы химических элементов Д.И.
Менделеева (в новой классификации – элементом 17-й группы). Бром – галоген, химически активный неметалл, с атомным номером 35 и молекулярной массой 79,904.
Для обозначения применяется символ Br (от латинского Bromum).
Нахождение брома в природе
Бром – широко распространённый химический элемент, во внешней среде встречается практически везде. Особенно много брома находится в солёной воде – морей и озёр, там он имеется в виде бромида калия, бромида натрия и бромида магния. Наибольшее количество брома образуется при испарении морской воды, есть он и в некоторых горных породах, а также в растениях.
В организме человека находятся до 300 мг брома, в основном в щитовидной железе, так же бром содержит кровь, почки и гипофиз, мышцы и костная ткань.
Физические и химические свойства брома
Бром обычно представляет собой едкую тяжёлую жидкость, имеет красно-бурый цвет и резкий, очень неприятный (зловонный) запах. Является единственным из неметаллов, при комнатной температуре находящийся в жидком состоянии.
Бром (а также – пары брома)– токсичное и ядовитое вещество, при работе с ним необходимо применять средства химической защиты, потому что при попадании на кожу и слизистые человека бром образует ожоги.
Состав природного брома – два стабильных изотопа (79Br и 81Br), молекула брома состоит из двух атомов и имеет химическую формулу Br2.
Суточная потребность организма в броме
Потребность здорового организма в броме – не более 0,8-1 г.
Продукты питания богатые бромом
Наряду с имеющимся в организме, бром человек получает с пищевыми продуктами. Основными поставщиками брома являются орехи (миндаль, фундук, арахис), бобовые (фасоль, горох и чечевица), пшеница и макаронные изделия из твёрдых сортов пшеницы, ячневая крупа, молочные продукты, водоросли и практически все виды морской рыбы.

Опасность и вред брома
Элементарный бром – сильнодействующий яд, принимать внутрь его категорически запрещено. Пары брома могут вызвать отёк лёгких, особенно у тех, кто склонен к аллергическим реакциям или имеет заболевания лёгких и дыхательных путей (очень опасны пары брома для астматиков).
Не рекомендуется применять препараты брома людям, в силу специфики работы нуждающимся в стабильной концентрации внимания (водителям, альпинистам, монтажникам-высотникам).
Признаки избытка брома
Переизбыток данного вещества обычно бывает при передозировке препаратов брома, для людей категорически нежелательна, потому что может представлять реальную опасность для здоровья.
Основные признаки избытка брома в организме – воспаления и высыпания на коже, сбои в работе пищеварительной системы, общая вялость и подавленность, постоянные бронхиты и риниты, не связанные с простудами и вирусами.
Признаки нехватки брома
Нехватка в организме брома проявляется бессонницей, замедлением роста у детей и подростков, понижением уровня гемоглобина в крови, но, не всегда эти симптому связывают именно с недостаточным количеством брома, поэтому для подтверждения подозрений, нужно посетить доктора и сдать необходимые анализы. Часто из-за нехватки брома повышается риск самопроизвольного прерывания беременности (выкидыш на разных сроках, вплоть до третьего триместра).
Полезные свойства брома и его влияние на организм
Бром (в виде бромидов) применяется при различных заболеваниях, основное его действие – седативное, поэтому препараты брома часто назначаются при нервных расстройствах и нарушениях сна.
Соли брома являются эффективным средством для лечения заболеваний, вызывающих судороги (особенно эпилепсии), а также нарушений деятельности сердечно-сосудистой системы и некоторых желудочно-кишечных недугов (язвы желудка и двенадцатиперстной кишки).
Усвояемость брома
Усвояемость брома замедляют хлор, алюминий, йод и фтор, поэтому принимать препараты, содержащие соли брома нужно только после консультации с врачом.
Бром и его влияние на мужскую потенцию
Вопреки ничем не подтверждённым слухам (больше похожим на анекдоты), бром не оказывает угнетающего воздействия на половое влечение и потенцию мужчин.
Якобы бром в виде белого порошка добавляют в еду молодым бойцам в армии, а также пациентам мужского пола в псих-диспансерах и заключённым в тюрьмах и колониях.
Этому нет ни одного научного подтверждения, а слухи можно объяснить способностью брома (его препаратов) оказывать успокаивающее воздействие.
По некоторым источникам, бром способствует активизации половой функции у мужчин и увеличению как объёма эякулянта, так и количества сперматозоидов, в нём содержащихся.
Применение брома в жизни
Бром применяется не только в медицине (бромид калия и бромид натрия), но и в других областях, например в фотографии, нефтедобыче, в производстве моторного топлива. Бром используется при изготовлении боевых отравляющих веществ, что ещё раз подчёркивает необходимость осторожного обращения с данным элементом.
Источник: http://www.calorizator.ru/element/br
№35 Бром
Капля брома в ампуле

К открытию брома привели исследования французского химика А. Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость.
Эту жидкость он назвал муридом (от лат. muria -рассол) и послал сообщение о своем открытии в Парижскую академию наук.
Комиссия назвала новый элемент бромом в связи с тем, что у брома тяжелый, неприятный запах паров (от греческого brwmoz — зловоние).
Нахождение в природе, получение:
Содержание брома в земной коре (1,6*l0-4% по массе) оценивается в 1015-1016 т. Бром — постоянный спутник хлора.
Бромистые соли (NaBr, KBr, MgBr2) встречаются в отложениях хлористых солей (в поваренной соли до 0,03%, в калийных солях — сильвине и карналлите — до 0,3%), а также в морской воде (0,065%), рапе соляных озёр (до 0,2%) и подземных рассолах, обычно связанных с соляными и нефтяными месторождениями (до 0,1%).
Исходным сырьём для промышленноого получения брома служат морская вода, озёрные и подземные, содержащие бром в виде бромид-иона. Бром выделяют при помощи хлора и отгоняют из раствора водяным паром или воздухом. Из получаемой бромовоздушной смеси бром улавливают химическими поглотителями.
Для этого применяют растворы бромистого железа. Из полученных полупродуктов бром выделяют действием хлора или кислоты. Далее бром отделяют от воды и очищают от примеси хлора дистилляцией.
В лабораториях также используют процессы, основанные на окислении бромидов:
6KBr + K2Cr2O7 + 7H2SO4 = 3Br2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
Физические свойства:
Бром — единственный неметалл, жидкий при комнатной температуре. Простое вещество представляет собой тяжелую красно-бурую жидкость с неприятным запахом (плотность при 20°C — 3,1 г/см3, температура кипения +59,82°C), пары брома имеют желто-бурый цвет.
При температуре -7,25°C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском. В воде бром растворим лучше других галогенов (3,58 г/100 г Н2О при 20°С) — «бромная вода«.
Значительно лучше растворим бром в органических растворителях, чем пользуются для извлечения его из
водных растворов.
Химические свойства:
- Бром является сильным окислителем, он непосредственно реагирует почти со всеми неметаллами (за исключением инертных газов, кислорода, азота и углерода) и многими металлами: 2P + 3Br2 = 2PBr3; 2Al + 3Br2 = 2AlBr3
В водной среде бром окисляет нитриты до нитратов, аммиак до азота, иодиды до свободного иода, серу и сульфиты до серной кислоты: - 2NH3 + 6Br2 = N2+ 6HBr; 3Br2 + S + 4H2O = 6HBr + H2SO4
- Br2 + 2NaOH = NaBr + NaBrO + H2O (при t < 0°C); 3Br2 + 6NaOH = 5NaBr + NaBrO3 + 3H2O
При взаимодействии брома с растворами щелочей образуются соответствующие бромиды и гипобромиты (на холоду) или броматы: Для брома характерны соединения с нечетными степенями окисления: -1, +1, +3, +5, +7.
Важнейшие соединения:
Бромоводород HBr — ядовитый бесцветный газ с резким запахом, дымящий на воздухе из-за взаимодействия с парами воды. Хорошо растворим в воде: при 0° C в одном объеме воды растворяется 612 объемов бромоводорода. Раствор — сильная одноосновная бромоводородная кислота.
Соли — бромиды бесцветные кристаллы, хорошо растворимые в воде (нерастворим AgBr, бледно-желтого цвета).
Оксид брома(I) Br2O., газ коричневого цвета. Образуется при действии брома на HgO в CCl4. Свойства …
Бромноватистая кислота HBrO— сильный окислитель.
Образуется при растворении брома в воде, под действием света разлагается на HBr и кислород; обладает слабыми кислотными свойствами, существует только в растворе. Соли — гипобромиты, KBrO, NaBrO — получены в свободном состоянии в виде кристаллогидратов.
Все они очень неустойчивы, при нагревании (или подкислении растворов) распадаются на бромид и бромат: 3КВrO = 2KBr + KBrO3
Бромиты, соли неизвестной даже в растворе бромистой кислоты HBrO2 — образуются при окислении гипобромитов бромом в щелочной среде: Ba(BrO)2 + 2Br2 + 4KOH = Ba(BrO2)2 + 4KBr + 2H2O Бромноватая кислота, HBrO3 — концентрированный раствор представляет собой бесцветную сиропоообразную жидкость. Соли — броматы. Бромноватая кислота и броматы являются сильными окислителями:
2S + 2NaBrO3 = Na2SO4 + Br2+ SO2
Бромная кислота HBrO4 существует в водных растворах с концентрацией, не превышающей 6 моль/л. Несмотря на то, что HBrO4 — самый сильный окислитель среди кислородных кислот брома, реакции с ее участием протекают очень медленно.
Трехфторид брома, BrF3 — красная жидкость с т. кип. 126°C , образуется в результате прямой реакции брома с фтором. С водой и органическими веществами взаимодействует со взрывом. По отношению к неорганическим соединениям ведет себя как сильный фторирующий агент.
Применение:
Бром и его соединения широко применяются в основном органическом синтезе. Бромид серебра AgBr применяется в фотографии как светочувствительное вещество.
Соединения брома используются для создания антипиренов — добавок, придающих пожароустойчивость пластикам, древесине, текстильным материалам. Пентафторид брома иногда используется как очень мощный окислитель ракетного топлива.
1,2-дибромэтан применяют как антидетонирующую добавку в моторном топливе. Растворы бромидов используются в нефтедобыче.
В медицине бромид натрия и калия применяют как успокаивающие средства.
Биологическая роль и токсичность:
Бром в виде простого вещества ядовит. Жидкий бром вызывает трудно заживающие ожоги.
Пары брома в концентрации 1 мг/м3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м3) — удушье и смерть.
В организме человека бром, в виде бромид-ионов, участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода.
Петрова М.А., Пухова М.С.
ХФ ТюмГУ, 572 группа.
Источники:Неорганическая химия: В 3 т./ Под ред. Ю.Д. Третьякова. Т.2/ — М.: «Академия», 2004.
Энциклопедия «Кругосвет»: http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/BROM.html
Сайт «WebElements»: http://webelements.narod.ru/elements/Br.htm
| КонТрен – Химия для школьников, студентов, учителей … подготовка к экзаменам и олимпиадам |
Источник: http://www.kontren.narod.ru/x_el/info35.htm
Br — Бром

БРОМ (лат. Bromum), Br, химический элемент VII группы периодической системы, атомный номер 35, атомная масса 79,904, относится к галогенам.
Природный бром представляет смесь двух нуклидов с массовыми числами 79 (в смеси 50,56% по массе) и 81. Конфигурация внешнего электронного слоя 4s2p5. В соединениях проявляет степени окисления –1, +1, +3, +5 и +7 (валентности I, III, V и VII), причем наиболее характерны степени окисления –1 и +5.
Расположен в четвертом периоде в группе VIIА периодической системы элементов Менделеева.
Радиус нейтрального атома брома 0,119 нм, ионные радиусы Вr–, Вr3+, Вr5+ и Вr7+ равны, соответственно, 0,182; 0,073; 0,045 и 0,039 нм. Энергии последовательной ионизации нейтрального атома брома равны, соответственно, 11,84; 21,80; 35,9; 47,3 и 59,7 эВ. Сродство к электрону 3,37 эВ. По шкале Полинга электроотрицательность брома 2,8.
Название: связано с тем, что у брома тяжелый, неприятный запах паров (от греческого bromos — зловоние).
История открытия: к открытию брома привели исследования французского химика А.Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость.
Эту жидкость, полученную также из морской воды, он назвал муридом (от лат. muria — соляной раствор, рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия, созданная для проверки этого сообщения, не приняла название Балара и назвала новый элемент бромом.
Открытие брома сделало молодого и мало кому известного ученого знаменитым. После появления статьи Балара оказалось, что склянки с аналогичным веществом ждали исследования у немецких химиков К. Левига и Ю. Либиха.
Упустивший возможность открыть новый элемент, Либих воскликнул: “Это не Балар открыл бром, а бром открыл Балара”.
Свойства: при обычных условиях бром — тяжелая (плотность 3,1055 г/см3) красно-бурая густая жидкость с резким запахом. Бром относится к числу простых веществ, жидких при обычных условиях (кроме брома, таким веществом является еще ртуть (Hg)). Температура плавления брома –7,25°C, температура кипения +59,2°C. Стандартный электродный потенциал Вr2/Вr– в водном растворе равен +1,065 В.
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800°C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 0,323 нм, межъядерное расстояние в этой молекуле 0,228 нм.
- Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20°C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
- Br2 + H2O = HBr + HBrO.
- С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
- По химической активности бром занимает промежуточное положение между хлором (Cl) и иодом (I). При реакции брома с растворами иодидов выделяется свободный иод (I):
- Br2+ 2KI = I2+ 2KBr.
- Напротив, при действии хлора (Cl) на бромиды, находящиеся в водных растворах, выделяется свободный бром:
- Cl2 + 2NaBr = Br2 + 2NaCl.
При реакции брома с серой (S) образуется S2Br2, при реакции брома с фосфором (P) — PBr3 и PBr5. Бром реагирует также с неметаллами селеном (Se) и теллуром (Te).
Реакция брома с водородом (H) протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl.
Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.).
Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка AgBr, практически нерастворимого как в воде, так и в азотнокислом растворе.
С кислородом (O) и азотом (N) бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами.
Например, со фтором (F) бром образует неустойчивые BrF3 и BrF5, с иодом (I) — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др.
Устойчивы к действию брома тантал (Ta) и платина (Pt), в меньшей степени — серебро (Ag), титан (Ti) и свинец (Pb).
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т.д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C2H4 + Br2 = C2H4Br2.
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
- При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
- При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия (Na) или калия (K) образуются соответствующие бромиды и броматы, например:
- Br2 + 3Na2CO3 = 5NaBr + NaBrO2 + 3CO2.
Нахождение в природе: бром — довольно редкий в земной коре элемент. Его содержание в ней оценивается в 0,37·10–4% (примерно 50-е место).
Химически бром высоко активен и поэтому в свободном виде в природе не встречается. Входит в состав большого числа различных соединений (бромиды натрия (Na), калия (K), магния (Mg) и др.), сопутствующих хлоридам натрия, калия и магния.
Собственные минералы брома — бромаргирит (бромид серебра (Ag) AgBr) и эмболит (смешанный хлорид и бромид серебра (Ag)) — чрезвычайно редки. Источником брома служат воды горьких озер, соляные рассолы, сопутствующие нефти и различным соляным месторождениям, и морская вода (65·10–4%), более богато бромом Мертвое море.
В настоящее время бром обычно извлекают из вод некоторых горьких озер, одно из которых расположено, в частности, в нашей стране в Кулундинской степи (на Алтае).
Применение: бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты.
Следует отметить, что расхожее выражение: “врач прописал бром по столовой ложке после еды” означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром.
Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Особенности работы с бромом: при работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3.
Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье.
При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г.
При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде.
Склянки с бромом располагают в емкостях с песком, который предохраняет склянки от разрушения при встряхивании.
Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда ядовитая жидкость окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо немедленно покрыть кашицей из влажной соды Na2CO3.
Источник: http://WebElements.narod.ru/elements/Br.htm
Урок №65. Сравнительная характеристика галогенов — ХиМуЛя.com
Галогены (от
греч. halos — соль и genes —
образующий) — элементы главной подгруппы VIIгруппы периодической системы: фтор,
хлор, бром, йод, астат.
- В свободном
состоянии галогены образуют вещества, состоящие из двухатомных молекул F2,
Cl2, Br2, I2. - НАХОЖДЕНИЕ В ПРИРОДЕ
- Галогены в
природе находятся только в виде соединений.
Фтор встречается исключительно в виде
солей, рассеянных по различным горным породам. Общее содержание фтора в земной
коре составляет 0,02% атомов. Практическое значение имеют минералы фтора: CaF2
— плавиковый шпат, Na2AlF6 — криолит, Ca5F(PO4)3
— фторапатит.
Важнейшим природным соединением хлора является хлорид натрия
(галит), который служит основным сырьем для получения других соединений хлора.
Главная масса хлорида натрия находится в воде морей и океанов. Воды многих озер
также содержат значительное количество NaCl – таковы, например озера Эльтон и
Баскунчак. Встречаются другие соединения хлора, например, KСl — сильвин, MgCl2*KCl*6HO
— карналлит, KCl*NaCl — сильвинит.
Бром
встречается в природе в виде солей
натрия и калия вместе с солями хлора, а также в воде соленых озер и морей.
Бромиды металлов содержатся в морской воде. В подземных буровых водах, имеющих
промышленное значение, содержание брома составляет от 170 до700мг/л. Общее
содержание брома в земной коре 3*10-5% атомов.
Соединения
йода имеются в морской воде, но в столь малых количествах, что
непосредственное выделение их из воды очень затруднительно. Однако существуют
некоторые водоросли, которые накапливают йод в своих тканях, например
ламинарии.
Зола этих водорослей служит сырьем для получения йода. Значительное
количество йода( от 10 до 50мг/л.) содержатся в подземных буровых водах.
Содержание йода в земной коре 4*10-6 % атомов.
Существуют незначительные залежи
солей йода — KIO3 и KIO4 — В Чили и Боливии.
Общая масса астата
на земном шаре по оценкам не превышает 30 г.
Таблица. Электронное строение и некоторые свойства
атомов и молекул галогенов
| Символ элемента | F | Cl | Br | I | At |
| Порядковый номер | 9 | 17 | 35 | 53 | 85 |
|
2s22p5 | 3s23p5 | 4s24p5 | 5s25p5 | 6s26p5 |
| Относительная электроотрицательность (ЭО) | 4,0 | 3,0 | 2,8 | 2,5 | ~2,2 |
| Радиус атома, нм | 0,064 | 0,099 | 0,114 | 0,133 | – |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | – | ||
| Агрегатное состояние | Бледно-зел. газ | Зел-желт. газ | Бурая жидкость | Темн-фиол. кристаллы | Черные кристаллы |
| t°пл.(°С) | -219 | -101 | -8 | 114 | 227 |
| t°кип.(°С) | -183 | -34 | 58 | 185 | 317 |
| ρ (г/см3 ) | 1,51 | 1,57 | 3,14 | 4,93 | – |
| Растворимость в воде (г / 100 г воды) | реагирует с водой | 2,5 : 1 по объему | 3,5 | 0,02 | – |
| Название | Схема строения атома | Электронная формула |
| Фтор | F +9)2)7 | …2s22p5 |
| Хлор | Cl +17)2)8)7 | …3s23p5 |
| Бром | Br +35)2)8)18)7 | …4s24p5 |
| Йод | I +53)2)8)18)18)7 | …5s25p5 |
- 1)
Общая электронная конфигурация внешнего энергетического уровня — nS2nP5. - 2)
С возрастанием порядкового номера элементов увеличиваются радиусы атомов,
уменьшается электроотрицательность, ослабевают неметаллические свойства
(увеличиваются металлические свойства); галогены — сильные окислители,
окислительная способность элементов уменьшается с увеличением атомной массы. - 3)
С увеличением атомной массы окраска становится более темной, возрастают
температуры плавления и кипения, а также плотность. - ПОЛУЧЕНИЕ ГАЛОГЕНОВ
- 1.
Электролиз растворов и расплавов галогенидов: - 2NaCl + 2H2O = Cl2+ H2+ 2NaOH
- 2KF = 2K + F2 (единственный способ полученияя F2)
- 2. Окисление
галогенводородов: - 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O – Лабораторный способ получения
хлора - 14HBr+K2Cr2O7=2KBr+2CrBr3+3Br2+7H2O
- MnO2 + 4HHal = MnHal2 + Hal2 + 2 H2O– Лабораторный — (Для получения
хлора, брома, иода) - 3.
Промышленный способ – окисление хлором (для брома и йода): - 2KBr+Cl2=2KCl+Br2
- 2KI + Cl2=2KCl + I2
- Химические свойства
- Рассмотрим
свойства галогенов на примере хлора:
| 1.Взаимодействие с металлами | 2K + Cl2→2KCl опытMg + Cl2→MgCl2 |
| 2.Реакции с неметаллами | H2 + Cl2 → 2HCl |
| 3.Взаимодействие со щелочами на холоду | 2NaOH + Cl2 → NaCl + NaClO + H2O |
| 4.Взаимодействие со щелочами при нагревании | 6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O |
| 5.Вытеснение менее активных галогенов из галогенидов | 2KBr + Cl2 → 2KCl + Br2 |
| 6. С водой | H2O + Cl2 ↔ HCl + HClO (хлорная вода) |
ПРИМЕНЕНИЕ ГАЛОГЕНОВ
| Фтор | широко применяют как фторирующий агент при получении различных фторидов (SF6, BF3, WF6 и других), в том числе и соединений инертных газов ксенона (Xe) и криптона (Kr). Гексафторид урана UF6 применяется для разделения изотопов урана (U). Фтор используют в производстве тефлона, других фторопластов, фторкаучуков, фторсодержащих органических веществ и материалов, которые широко применяют в технике, особенно в тех случаях, когда требуется устойчивость к агрессивным средам, высокой температуре и т. п. |
| Хлор | применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. |
| Бром | бром применяют при получении ряда неорганических и органических веществ, в аналитической химии. Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии. Широко известны содержащие бром лекарственные препараты. Следует отметить, что расхожее выражение: “врач прописал бром по столовой ложке после еды” означает, разумеется, лишь то, что прописан водный раствор бромида натрия (или калия), а не чистый бром. Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе. |
| Иод | иод применяют для получения высокочистого титана (Ti), циркония (Zr), гафния (Hf), ниобия (Nb) и других металлов (так называемое иодидное рафинирование металлов). При иодидном рафинировании исходный металл с примесями переводят в форму летучих иодидов, а затем полученные иодиды разлагают на раскаленной тонкой нити. Нить изготовлена из заранее очищенного металла, который подвергают рафинированию. Ее температуру подбирают такой, чтобы на нити могло происходить разложение только иодида очищаемого металла, а остальные иодиды оставались в паровой фазе. Используют иод и в иодных лампах накаливания, имеющих вольфрамовую спираль и характеризующихся большим сроком службы. Как правило, в таких лампах пары иода находятся в среде тяжелого инертного газа ксенона (Xe) (лампы часто называют ксеноновыми) и реагируют с атомами вольфрама (W), испаряющимися с нагретой спирали. Образуется летучий в этих условиях иодид, который рано или поздно оказывается вновь вблизи спирали. Происходит немедленное разложение иодида, и освободившийся вольфрам (W) вновь оказывается на спирали. Иод применяют также в пищевых добавках, красителях, катализаторах, в фотографии, в аналитической химии. |
- Фтор
- Хлор
- Бром
- Пары йода
Тренажёр 1 —
Характеристика фтора по положению в Периодической системе элементов Д. И.
Менделеева
Тренажёр 2 —
Характеристика хлора по положению в Периодической системе элементов Д. И.
Менделеева
- Тренажёр 3 — Физические
свойства галогенов - Тренажёр 4 — Химические
свойства галогенов - Тренажёр 5 — Получение
галогенов - Биологическое значение
галогенов - Применение фтора, брома,
йода и их соединений - Применение хлора и его
соединений
Источник: https://www.sites.google.com/site/himulacom/zvonok-na-urok/8-klass/urok-no65-sravnitelnaa-harakteristika-galogenov




