Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.

Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2
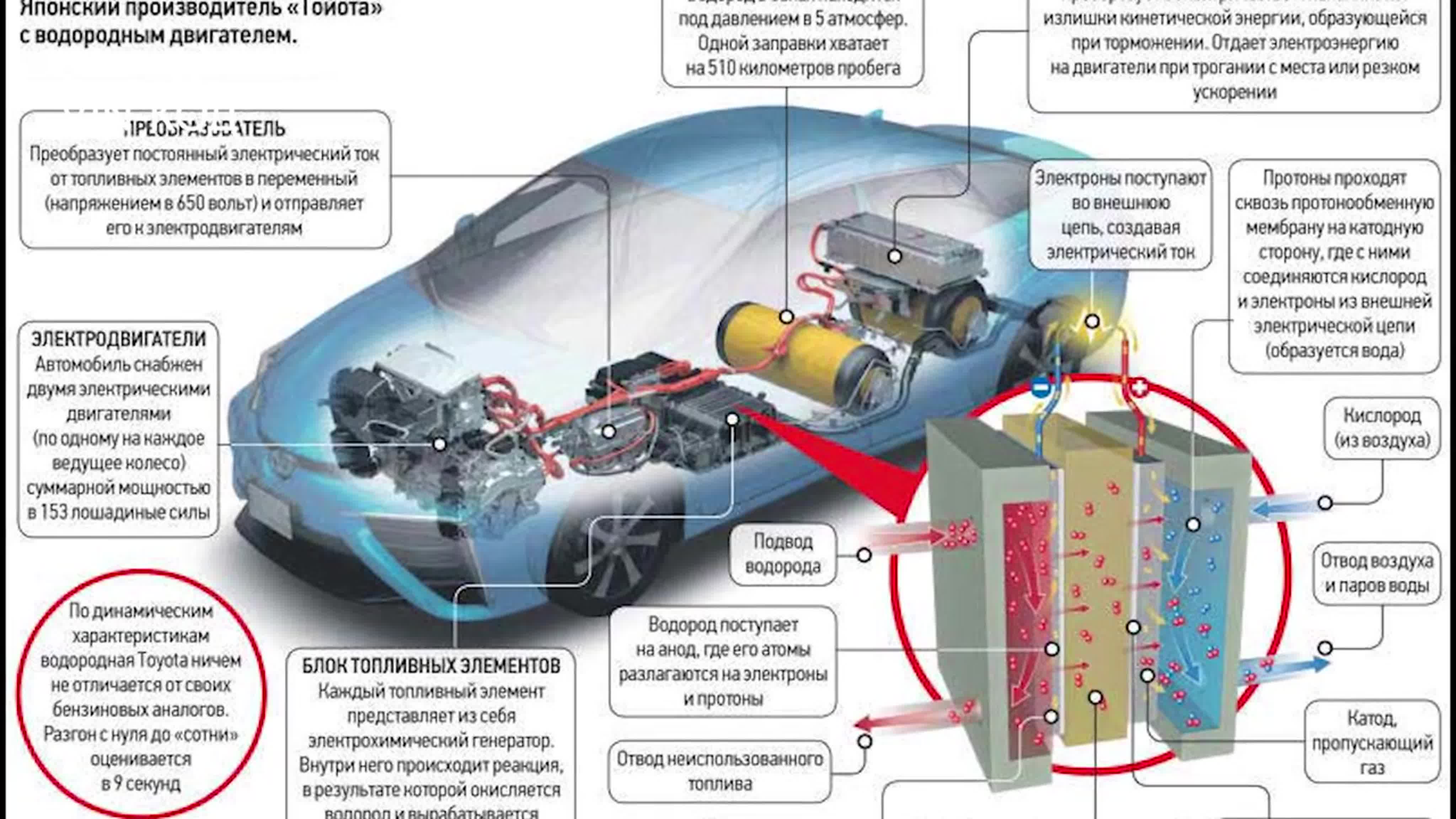
Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
- H2 + O2 → (t) H2O
- H2 + F2 → HF (со взрывом в темноте)
- H2 + Cl2 → (t) HCl (со взрывом только на свету)
- H2 + N2 → NH3
- H2 + S → H2S
- H2 + ZnO → Zn + H2O
- Как окислитель реагирует с металлами

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- C + H2O → CO + H2
- H2O + CO → (кат.) CO2 + H2
- H2O + CH4 → (кат.) CO + H2
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды. K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами — с образованием соответствующих кислот. Не забывайте сохранять степени окисления! CaO + H2O → Ca(OH)2 P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой — по аниону (Na2CO3). Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания) Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании) 
Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
- Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
- K2O2 + H2O → KOH + H2O2
- BaO2 + H2SO4 → BaSO4 + H2O2
- В разбавленных растворах пероксид водорода легко разлагается:
- H2O2 → H2O + H2↑
- Также перекись проявляет окислительные свойства:
- KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
Источник: https://studarium.ru/article/162
Если кислород является самым распространенным химическим элементом на Земле, то водород – самый распространенный элемент во всей Вселенной. Наше Солнце (и другие звезды) примерно на половину состоит из водорода, а что касается межзвездного газа, то он на 90% состоит из атомов водорода. Немалое место этот химический элемент занимает и на Земле, ведь вместе с кислородом он входит в состав воды, а само его название «водород» происходит от двух древнегреческих слов: «вода» и «рожаю». Помимо воды водород присутствует в большинстве органических веществ и клеток, без него, как и без кислорода, была бы немыслима сама Жизнь.
История открытия водорода
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом.
Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Водород в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода.
То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему.
Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы водорода
Водород это газ, молекула его состоит из двух атомов.

Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства водорода
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства водорода
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить водород?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Применение водорода
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Водород, видео
И в завершение образовательное видео по теме нашей статьи.

При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник: https://www.poznavayka.org/himiya/vodorod/
в„–1 Р’РѕРґРѕСЂРѕРґ

Рлектрический разряд РІ РІРѕРґРѕСЂРѕРґРµ (Википедия)
Катастрофа «Р“инденбурга»
Дирижабль «Р“инденбург» Германия (200 Рј3 РІРѕРґРѕСЂРѕРґР°) потерпел катастрофу 5.05.1937, РІ РќСЊСЋ-Йорке.
Начиная с XV века, многие исследователи отмечали выделение горючего газа при взаимодействии кислот с металлами.
Первое РїРѕРґСЂРѕР±РЅРѕРµ описание РІРѕРґРѕСЂРѕРґР°, РїРѕРґ названием «РіРѕСЂСЋС‡РёР№ РІРѕР·РґСѓС…» Рё «РґРµС„логистированный РІРѕР·РґСѓС…» дал английский С…РёРјРёРє Генри Кавендиш РІ 1766 РіРѕРґСѓ.
В 1783 году Антуан Лавуазье доказал что водород входит в состав воды и включил его в свою таблицу химических элементов под названием hydrogеne (рождающий воду).
Р СѓСЃСЃРєРѕРµ название «РІРѕРґРѕСЂРѕРґ» предложил С…РёРјРёРє Рњ. Р¤. Соловьев РІ 1824 РіРѕРґСѓ — РїРѕ аналогии СЃ «РєРёСЃР»РѕСЂРѕРґРѕРј» Рњ.Р’. Ломоносова.
Нахождение в природе и получение:
На долю водорода приходится около 92% всех атомов Вселенной. Он основная составная часть вещества звезд и межзвездного газа, в виде соединений образует атмосферу многих планет.
РќР° Земле доля атомов РІРѕРґРѕСЂРѕРґР° 17%, РѕРЅ РІС…РѕРґРёС‚ РІ состав самого распространенного вещества — РІРѕРґС‹, РІ состав соединений образующих живые организмы, РіРґРµ доля его атомов около 50%.
В то же время массовая доля водорода на Земле (земная кора + гидросфера) около 1,5% Основным методом получения водорода в лаборатории являются взаимодействие металлов (Zn, Fe) с разбавленными кислотами, а также электролиз растворов щелочей. В промышленности водород получают при электролизе растворов солей (NaCl), конверсией или каталитическим окислением метана, при крекинге или риформинге углеводородов (нефтепереработка).
Конверсия метана: CH4 + H2O CO + 3H2
Физические свойства:
Р’РѕРґРѕСЂРѕРґ встречается РІ РІРёРґРµ трёх изотопов, которые имеют индивидуальные названия Рё символы: 1H — протий (Рќ), 2Рќ — дейтерий (D), 3Рќ — тритий (T).
Природный РІРѕРґРѕСЂРѕРґ содержит 99,99% протия Рё 0,01% — дейтерия. Тритий содержится РІ РїСЂРёСЂРѕРґРµ РІ очень малых количествах, РѕРЅ радиоактивен СЃ периодом полураспада 12,32 лет.
Простое вещество H2, самый лёгкий газ, без цвета, запаха Рё РІРєСѓСЃР°, температура плавления -259,1, кипения -252,8В°C, малорастворим РІ РІРѕРґРµ — 18,8 РјР»/Р».
Водород хорошо растворим во многих металлах (850 объёмов на 1 объём Pd), способен легко диффундировать через металические мембраны.
Тяжелый водород D2 имеет вдвое большую плотность и несколько более высокие температуры плавления и кипения (-254,5°C и -249,5°C)
Химические свойства:
При обычных температурах водород реагирует только с очень активными металлами (напр. с кальцием) и неметаллами: фтором (без освещения, со взрывом), хлором (на свету, со взрывом).
РЎ большинством неметаллов реагирует РїСЂРё нагревании (СЃ кислородом реакция протекает РїСЂРё поджигании мгновенно). Смесь кислорода СЃ РІРѕРґРѕСЂРѕРґРѕРј 1:2 называется «РіСЂРµРјСѓС‡РёРј газом».
Обладает ярко выраженными восстановительными свойствами, восстанавливая оксиды металлов: железа, меди, свинца, вольфрама и т.д.
В присутствии катализаторов (Pt, Ni) присоединяется по кратным связям органических соединений (реакция гидрирования).
Важнейшие соединения:
РћРєСЃРёРґ РІРѕРґРѕСЂРѕРґР°, H2O — РІРѕРґР° — бесцветная жидкость, без цвета, без запаха, без РІРєСѓСЃР°.
Аномальные физические свойства воды (Тпл = 0°С, Ткип = 100°С) обусловлены образованием межмолекулярных водородных связей.
Является амфолитом, диссоциируя СЃ образованием РёРѕРЅРѕРІ РіРёРґСЂРѕРєСЃРѕРЅРёСЏ Рё РіРёРґСЂРѕРєСЃРёРґ-РёРѕРЅРѕРІ, однако степень диссоциации 1,8*10-16, поэтому чистая РІРѕРґР° почти РЅРµ РїСЂРѕРІРѕРґРёС‚ электрический ток. Р’РѕРґР° — весьма реакционноспособное вещество. Основные реакции:
— реакции соединения СЃ оксидами активных металлов Рё неметаллов, СЃ образованием соответствующих РіРёРґСЂРѕРєСЃРёРґРѕРІ РѕСЃРЅРѕРІРЅРѕРіРѕ или кислотного характера; — реакции гидролиза (обратимого Рё необратимого) РјРЅРѕРіРёС… неорганических Рё органических веществ;
— реакции гидратации — присоединение РІРѕРґС‹ РїРѕ кратным СЃРІСЏР·СЏРј органических соединений.
Пероксид РІРѕРґРѕСЂРѕРґР° — H2O2 — бесцветная сиропообразная жидкость, без цвета, без запаха, СЃ неприятным металлическим РІРєСѓСЃРѕРј. Р’ максимальной концентрации — жидкость (СЃ плотностью около 1,5 Рі/СЃРј3), РўРїР» -0,43В°C, РўРєРёРї 150В°C.
В воде, этиловом спирте, этиловом эфире растворяется в любых соотношениях. В концентрированных растворах пероксид водорода неустойчив, разлагается на воду и кислород со взрывом. Вызывает сильные ожоги.
Обычно применяется в виде разбавленных (3%-30%) растворов. Окислитель? на чем использовано его применение как отбеливателя, дезинфицирующего средства и т.д.
В природе встречается в нижних слоях атмосферы, в атмосферных осадках.
Гидриды ионные — MHx — соединения РІРѕРґРѕСЂРѕРґР° СЃ щелочными Рё щелочноземельными металлами, РіРґРµ РІРѕРґРѕСЂРѕРґ имеет степень окисления -1. Солеподобные твердые вещества. Восстановители. Р’РѕРґРѕР№ Рё кислотами разлагаются СЃ выделением РІРѕРґРѕСЂРѕРґР°: NaH + H2O в†’ NaOH + H2↑
Гидриды ковалентные — HxX — соединения РІРѕРґРѕСЂРѕРґР° СЃ неметаллами, РіРґРµ РІРѕРґРѕСЂРѕРґ имеет степень окисления +1. Газы, РјРЅРѕРіРёРµ ядовиты. Восстановители Р·Р° счет неметалла.
Свойства меняются от инертных (метан) до кислотных (галогенводороды). Аммиак NH3 и, слабее, фосфин PH3 проявляют основные свойства.
За исключением галогенводородов горючи с образованием соответствующих оксидов.
Применение:
РћРґРЅРѕ РёР· первых применений РІРѕРґРѕСЂРѕРґР° — летательные аппараты легче РІРѕР·РґСѓС…Р°: воздушные шары Рё дирижабли. Р�Р·-Р·Р° высокой пожароопасности РІРѕРґРѕСЂРѕРґР° это применение было прекращено, Р·Р° исключением метеозондов.
Атомарный РІРѕРґРѕСЂРѕРґ используется для атомно-РІРѕРґРѕСЂРѕРґРЅРѕР№ сварки. Р–РёРґРєРёР№ РІРѕРґРѕСЂРѕРґ — РѕРґРёРЅ РёР· РІРёРґРѕРІ ракетного топлива.
В водородно-кислородных топливных элементах водород используется для непосредственного преобразования энергии химической реакции в электрическую.
Как восстановитель при получении некоторых металлов, для получения твердых жиров гидрированием растительных масел.
Р’ химической промышленности — получение аммиака, хлороводорода Рё РґСЂ.
Пероксид водорода: 3%-ный раствор применяют в медицине, косметологии, в промышленности для отбеливания соломы, перьев, клея, мехов, кожи и т.д.
, 60%-ный раствор применяют для отбеливания жиров и масел.
Сильно концентрированные растворы (85-90%) в смеси с некоторыми горючими веществами применяются для получения взрывчатых смесей, как окислитель в ракетных и торпедных двигателях.
Дейтерид лития-6: как источник дейтерия и трития в термоядерном оружии (водородная бомба). См. Ядерные реакции дейтерида лития. (анимированные модели).
Новикова О., Пасюк Е.
ТюмГУ, 502 группа, 2013 г.
Источник: http://www.kontren.narod.ru/x_el/info01.htm
Урок по химии для 8 класса по теме "Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства."
Урок химии Класс:8
УМК: учебник Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 класс»
Боровских Т.А. Рабочая тетрадь по химии: 8 кл.: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 класс» 2015 «Экзамен»
Боровских Т.А. Тесты по химии. Первоначальные химические понятия. Кислород. Водород. Вода. Растворы. Основные классы неорганических соединений: 8 кл.: к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана «Химия. 8 класс»2013«Экзамен»
Тема урока: Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства.
Цель урока: Изучить характеристику водорода как химического элемента и простого вещества. Сформировать представления о способах получения и собирания водорода в лаборатории.
Демонстрация: Получение водорода в аппарате Киппа, проверка водорода на чистоту. Собирание водорода различными методами.
Планируемые результаты обучения:
Предметные: Знать состав молекулы водорода, способы получения в лаборатории и промышленности. Уметь характеризовать физические свойства водорода, собирать водород методом вытеснения воздуха, доказывать его наличие, проверять водород на чистоту. Изучить правила ТБ при работе с водородом.
- Метапредметные: Развивать умения организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками; формулировать, аргументировать и отстаивать своё мнение.
- Личностные: Формировать осознанное, уважительное и доброжелательное отношение к другому человеку, умение слушать, самостоятельность.
- Этапы урока:
1.Орг. момент. Повторение темы: «Воздух и его состав». Закончите предложения:
Воздух состоит в основном из …. .
- Без воздуха не проходят процессы … и ….
- При горении веществ в воздухе образуются … .
- Воздух – бесценный дар природы, его нужно … .
- Запишите уравнения реакций горения следующих веществ: этана С2Н6, ацетилена С2Н2,сульфида меди (II) CuS.
2.Мотивация: Тема нашего урока связана с известным вам элементом и веществом. «Угадай-ка!»
- Этот элемент — самый распространённый во Вселенной.
- Этот элемент составляет около 70 % массы Солнца и звезд
- В гидросфере этот элемент входит в состав воды.
- Это — самый лёгкий газ.
- Этот первый элемент, который использовали для заполнения Дирижаблей.
- В средние века химики называли это вещество «горючим газом».
- Это экологически чистое топливо т.к. при горении образует воду.
- В 1784 году французский химик А. Лавуазье дал этому элементу название «гидрогениум», что означает «рождающий воду».
- Это самый первый элемент периодической системы.
3. Записываем тему урока в тетрадь. Исходя из темы, формулируем цель урока.
- узнать (Что?)
- понять (Что?)
- научиться (Чему?)
- закрепить (Что?)
- зачем это надо?
- 4. Дадим характеристику водорода, как химического элемента:
- Химический знак элемента, произношение, латинское название.
- Положение водорода в ПСХЭ (Порядковый номер элемента, в каком периоде и какой группе находится?)
- Относительная атомная масса
- Валентность
- Распространённость элемента в природе (использовать учебник стр 93)
5. Охарактеризуем водород, как простое вещество. Пользуемся учебником стр 97.
Информацию преобразуем в таблицу, которая находится на стр. 72 в тетради с печатной основой.
- Формула простого вещества
- Относительная молекулярная масса
- D(по возд)
- D(по О2)
- Агрегатное состояние (при обычных условиях)
- Цвет
- Запах
- Растворимость
- в воде
- t кип
- О водороде как простом веществе в стихах звучит так:
- Я, газ легчайший и бесцветный,
- Неядовитый и безвредный.
- Соединяясь с кислородом,
- Я для питья даю вам воду.
6.Закрепим изученное, выполнив упр №1 на стр. 72 в тетради с печатной основой.

Проверяем.
7. Изучим способы получения водорода в лаборатории. Делаем записи в тетради.
- 1. Разложение воды под действием электрического тока:
- 2Н2О →2Н2 ↑ + О2 ↑
- Определите к какому типу химических реакций относится данное уравнение.
- 2.Взаимодействие металлов с кислотами
- (Обратить внимание на электрохимический ряд напряжений металлов)
- Для получения водорода можно использовать любую кислоту (кроме HNO3, H2SiO3) и металлы, стоящие в ряду активности до водорода.
- Zn +2HCl = ZnCl2+H2↑
- Определите к какому типу химических реакций относится данное уравнение.
- 3.Взаимодействие активных металлов с водой:
- 2Na + 2H2O = 2NaOH + H2↑
- Определите к какому типу химических реакций относится данное уравнение.
- 8.Наблюдаем за демонстрацией: получение водорода в аппарате Киппа
Знакомство с аппаратом Киппа. Аппарат Киппа — универсальный прибор для получения газов действием растворов кислот и щелочей на твёрдые вещества.
Аппарат Киппа изготовлен из стекла и состоит
из нескольких частей:
-
-
- Колба-реактор с резервуаром;
-
-
-
- Воронка с длинной трубкой;
-
-
-
-
-
- Ловушка для улавливания паров соляной кислоты.
-
-
-
Нижний резервуар прибора служит для того, чтобы газ не выделялся через воронку во время опыта, он имеет тубулус, закрытый притёртой стеклянной пробкой, он необходим для слива жидкости после использования прибора.
Нижний резервуар и колба-реактор разделены резиновой прокладкой с отверстиями, через них проходит в нижний резервуар длинная трубка воронки, на прокладку насыпают твёрдые вещества. Колба-реактор также имеет тубулус, в который вставляется газоотводная трубка, снабженная краном или зажимом Мора.
В колбу-реактор с резервуаром вставлена воронка с длинной трубкой, трубка практически доходит до дна нижнего резервуара.
Принцип действия аппарата Киппа прост. На дне среднего резервуара есть решетка, на которой расположены гранулы цинка. В аппарат наливают кислоту (серную или соляную). Когда кран на газоотводной трубке закрыт, кислота находится в верхней воронке и нижнем резервуаре.
Как только открывают кран, кислота течет из воронки и заполняет нижнюю часть второго резервуара, в результате начинается реакция с цинком, выделяется водород. Когда эксперимент окончен, кран закрывают, и водород перестает выходить из аппарата Киппа. Давление газа вытесняет кислоту в воронку до тех пор, пока контакт кислоты и цинка не прекратится. Выделение водорода останавливается.
Если открыть кран (на газоотводной трубке), кислота снова попадет из воронки во второй резервуар и поток водорода возобновится.
- Учащиеся, наблюдают за демонстрационным экспериментом и отвечают на вопросы:
- Для чего необходимо проверять водород на чистоту?
- Почему работать с водородом опасно?
Какими методами можно собрать водород? На каких физических свойствах водорода они основываются?
9. Закрепление:
1.Как можно установить присутствие водорода в пробирке? Как горит чистый водород?
2.Как горит смесь водорода и воздуха?
3.Смесь каких газов называют гремучим газом?
4. Как необходимо держать пробирку, наполненную водородом? Почему?
5.Как перелить водород из одной пробирки в другую?
(Ответы: Водород без примеси сгорает спокойно. Однако смесь водорода с кислородом или воздухом взрывается. Наиболее взрывчата смесь, состоящая из двух объемов водорода и одного объема кислорода,- гремучий газ. Если взрыв произойдет в стеклянном сосуде, то его осколки могут поранить окружающих.
Поэтому, прежде чем поджигать водород, необходимо проверить его на чистоту. Для этого собирают водород и пробирку, которую в положении вверх дном подносят к пламени. Если водород чистый, то он сгорает спокойно, с характерным звуком «п-пах». Если услышим хлопок со свистом, то водород загрязнён. Если же водород с примесью воздуха, то он сгорает со взрывом.
При работе с водородом следует соблюдать правила техники безопасности.)
10.Получение водорода в промышленности.
Если бы перед вами стояла задача: получить большое количество водорода, — какое сырьё вы бы выбрали и почему? Правильно, воду. Её много и она доступна. Да, электролизом воды получают водород в промышленности, но не так уж часто.
Основной метод промышленного получения водорода — это взаимодействие метана с водяным паром при высокой температуре по реакции СН4 + 2Н2О = СО2 + 4Н2. Кроме того, много водорода получается в качестве побочного продукта при крекинге нефти (разложение углеводородов нефти). Если этот водород отделить от других продуктов крекинга, то можно не пользоваться никакими другими методами.
- 11.Зписываем домашнее задание:
- Прочитать п.28
- Выполнить всем упр №3 из тетради с печатной основой на стр 72.
- Обучающимся на 4-5 решить задачу: Рассчитайте, где больше массовая доля водорода в природном газе метане СН4 или в воде Н2О.
12. Рефлексия. Подведение итогов урока, выставление оценок
- Сегодня на уроке я узнал…
- Было необычным ….
- Теперь я могу …
- Мне это пригодится…
- Дополнение: Используемая во время урока таблица:
Источник: https://infourok.ru/urok-po-himii-dlya-klassa-po-teme-vodorod-ego-obschaya-harakteristika-i-nahozhdenie-v-prirode-poluchenie-vodoroda-i-ego-fiziches-746860.html
Водород и его характеристики
Водород является одним из наиболее распространенных химических элементов – его доля составляет около 1% от массы всех трех оболочек земной коры (атмосферы, гидросферы и литосферы), что при пересчете на атомные проценты дает цифру 17,0.
Основное количество этого элемента находится в связанном состоянии. Так, вода содержит около 11 вес. %, глина – около 1,5% и т.д. В виде соединений с углеродом водород входит в состав нефти, горючих природных газов и всех организмов.
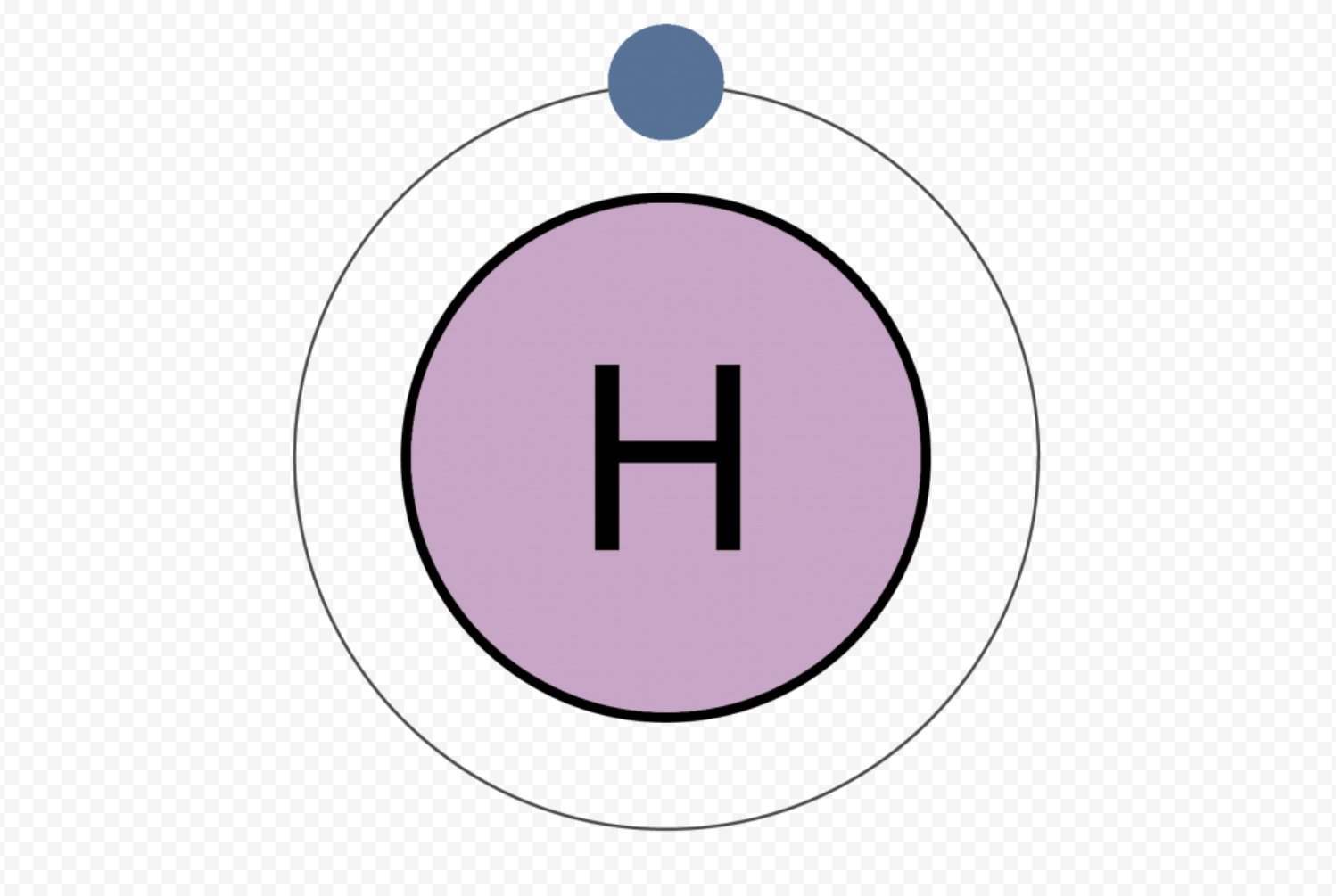
Водород представляет собой газ без цвета и запаха (схема строения атома представлена на рис. 1). Его температуры плавления и кипения лежат весьма низко (-259oС и -253oС соответственно).
При температуре (-240oС) и под давлением водород способен сжижаться, а при быстром испарении полученной жидкости переходить в твердое состояние (прозрачные кристаллы). В воде он растворим незначительно – 2:100 по объему.
Характерна для водорода растворимость в некоторых металлах, например, в железе.

Рис. 1. Строение атома водорода.
Атомная и молекулярная масса водорода
Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного водорода равна 1,008 а.е.м.
- Массы молекул, также как массы атомов выражаются в атомных единицах массы.
- Известно, что молекула водорода двухатомна – H2. Относительная молекулярная масса молекулы водорода будет равна:
- Mr(H2) = 1,008 × 2 = 2,016.
Изотопы водорода
Водород имеет три изотопа: протий 1H, дейтерий 2Н или D и тритий 3Н или Т. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий – радиоактивен (период полураспада 12,5 лет). В природных соединениях дейтерий и протий в среднем содержатся в отношении 1:6800 (по числу атомов). Тритий находится в природе в ничтожно малых количествах.
Ядро атома водорода 1H содержит один протон. Ядра дейтерия и трития включают кроме протона один и два нейтрона.
Ионы водорода
- Атом водорода может либо отдавать свой единственный электрон с образованием положительного иона (представляющего собой «голый» протон), либо присоединять один электрон, переходя в отрицательный ион, имеющий гелийную электронную конфигурацию.
- Полный отрыв электрона от атома водорода требует затраты очень большой энергии ионизации:
- Н + 315 ккал = Н+ + е.
- Вследствие этого при взаимодействии водорода с металлоидаими возникают не ионные, а лишь полярные связи.
- Тенденция того или иного нейтрального атома к присоединению избыточного электрона характеризуется значением его сродства к электрону.
У водорода оно выражено довольно слабо (однако это не говорит о невозможности существования такого иона водорода):
- Н + е = Н— + 19 ккал.
Молекула и атом водорода
Молекула водорода состоит из двух атомов – Н2. Приведем некоторые свойства, характеризующие атом и молекулу водорода:
| Энергия ионизации атома, эВ | 13,60 |
| Сродство атома к электрону, эВ | 0,75 |
| Относительная электроотрицательность | 2,1 |
| Радиус атома, нм | 0,046 |
| Межъядерное расстояние в молекуле, нм | 0,0741 |
| Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль | 436,1 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/vodorod-i-ego-xarakteristiki/
Водород
Продажа
Производство
Доставкамарка 4.6марка 5.0марка 6.0марка 7.0технический марка «Б»технический марка «В»чистый I сорттехнический марка «А»технический марка «Б»технический марка «В»
Водород (лат.
Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H — протон.
Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и рядеметаллов: железе, никеле, палладии, платине.
История
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом».
При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом.
Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия
Лавуазье дал водороду название hydrogène — «рождающий воду». Русское наименование «водород» предложил химик М. Ф. Соловьев в 1824 году — по аналогии сломоносовским «кислородом».
Распространённость
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа.
В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17 % (второе место после кислорода, доля атомов которого равна ~ 52 %).
Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода.
В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005 % по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50 %.
Получение
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения.
Так, кислород, имеющийся в свободном состоянии, получают физическим способом — выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы.
В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода — реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 + 2Н2O = CO2↑ + 4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество.
Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода.
Один из лабораторных способов получения водорода, который иногда применяется и в промышленности, — разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
В промышленности
- 1.Электролиз водных растворов солей:
- 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
- 2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
- H2O + C ? H2 + CO
3.Из природного газа.
- Конверсия с водяным паром:
- CH4 + H2O ? CO + 3H2 (1000 °C)
- Каталитическое окисление кислородом:
- 2CH4 + O2 ? 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
- Zn + 2HCl → ZnCl2 + H2↑
- 2.Взаимодействие кальция с водой:
- Ca + 2H2O → Ca(OH)2 + H2↑
- 3.Гидролиз гидридов:
- NaH + H2O → NaOH + H2↑
- 4.Действие щелочей на цинк или алюминий:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
- Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
Физические свойства
Водород может существовать в двух формах (модификациях) — в виде орто- и пара- водорода. В молекуле ортоводорода o-H2 (т. пл. −259,10 °C, т. кип.
−252,56 °C) ядерные спины направлены одинаково (параллельны), а у параводорода p-H2 (т. пл. −259,32 °C, т. кип. −252,89 °C) — противоположно друг другу (антипараллельны).
Равновесная смесь o-H2 и p-H2 при заданной температуре называется равновесный водород e-H2.
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1.
Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25).
Без катализатора превращение происходит медленно (в условиях межзвездной среды — с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре.
Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому.
Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.
), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация).
Практически не растворим в серебре.
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз).
Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79 % пара-Н2, 0,21 % орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии,пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,9885 ± 0,0070 % и 0,0115 ± 0,0070 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4 — 7 и периодами полураспада 10−22 — 10−23 с.
Природный водород состоит из молекул H2 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
|
|
|
|
|
|
| H2 | 13.96 | 20,39 | 13,96 / 7,3 | 32,98 / 1,31 | 70,811 / 1,316 |
| D | 16,65 | 22,13 | 16,60 / 12,8 | 35,91 / 1,48 | 114,80 / 1,802 |
| HT | 22,92 | 17,63 / 17,7 | 37,13 / 1,57 | 158,62 / 2,310 | |
| D2 | 18,65 | 23,67 | 18,73 / 17,1 | 38,35 / 1,67 | 162,50 / 2,230 |
| DT | 24.38 | 19,71 / 19,4 | 39,42 / 1,77 | 211,54 / 2,694 | |
| T2 | 20,63 | 25,04 | 20,62 / 21,6 | 40,44 / 1,85 | 260,17 / 3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
- Доля диссоциировавших молекул водорода
- Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
- Н2 = 2Н − 432 кДж
- Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
- Ca + Н2 = СаН2
- и с единственным неметаллом — фтором, образуя фтороводород:
- F2 + H2 = 2HF
- С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
- О2 + 2Н2 = 2Н2О
- Он может «отнимать» кислород от некоторых оксидов, например:
- CuO + Н2 = Cu + Н2O
- Записанное уравнение отражает восстановительные свойства водорода.
- N2 + 3H2 → 2NH3
- С галогенами образует галогеноводороды:
- F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
- Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
- С сажей взаимодействует при сильном нагревании:
- C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
- При взаимодействии с активными металлами водород образует гидриды:
- 2Na + H2 → 2NaH
- Ca + H2 → CaH2
- Mg + H2 → MgH2
- Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
- CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
- Оксиды восстанавливаются до металлов:
- CuO + H2 → Cu + H2O
- Fe2O3 + 3H2 → 2Fe + 3H2O
- WO3 + 3H2 → W + 3H2O
Гидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр.Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
Геохимия водорода
- На Земле содержание водорода понижено по сравнению с Солнцем, планетами-гигантами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
- Свободный водород H2 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
- В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением . Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водородпожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение.
Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75(74) % объёмных.
Экономика
Стоимость водорода при крупнооптовых поставках колеблется в диапазоне 2-5$ за кг.
Применение
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
- При производстве аммиака, метанола, мыла и пластмасс
- При производстве маргарина из жидких растительных масел
- Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Пищевая промышленность
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколькокатастроф, в ходе которых дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Топливо
Водород используют в качестве ракетного топлива.
Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
«Жидкий водород»
Источник: https://tgko.ru/spravka/gaz/vodorod




