Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

- В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
- NH4NO2 → (t) N2 + H2O
- Также азот можно получить путем восстановления азотной кислоты активными металлами.
- HNO3(разб.) + Zn → Zn(NO3)3 + N2 + H2O

Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- N2 + Li → Li3N (нитрид лития)
- N2 + Mg → (t) Mg3N2
- N2 + Al → (t) AlN
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств. N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.

- Получение
- В промышленности аммиак получают прямым взаимодействием азота и водорода.
- N2 + H2 ⇄ (t, p) NH3
- В лабораторных условиях сильными щелочами действуют на соли аммония.
- NH4Cl + NaOH → NH3 + NaCl + H2O
- Химические свойства
- Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Как основание аммиак способен реагировать с кислотами с образованием солей.
- NH3 + HCl → NH4Cl (хлорид аммония)
- NH3 + HNO3 → NH4NO3 (нитрат аммония)
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак. NH3 + H2O ⇄ NH4OH

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов. NH3 + FeO → N2↑ + Fe + H2O NH3 + CuO → N2↑ + Cu + H2O Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO. NH3 + O2 → (t) N2 + H2O NH3 + O2 → (t, кат) NO + H2O
Соли аммония
- Получение
- NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
- 3NH3 + H3PO4 → (NH4)3PO4
- Химические свойства
- Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
- NH4+ + H2O ⇄ NH4OH + H+
- NH4OH ⇄ NH3 + H2O
- Реакции разложения
- NH4Cl → (t) NH3↑ + HCl↑
- (NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
- NH4NO2 → (t) N2↑ + H2O
- NH4NO3 → (t) N2O↑ + H2O
- (NH4)3PO4 → (t) NH3↑ + H3PO4
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак. NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
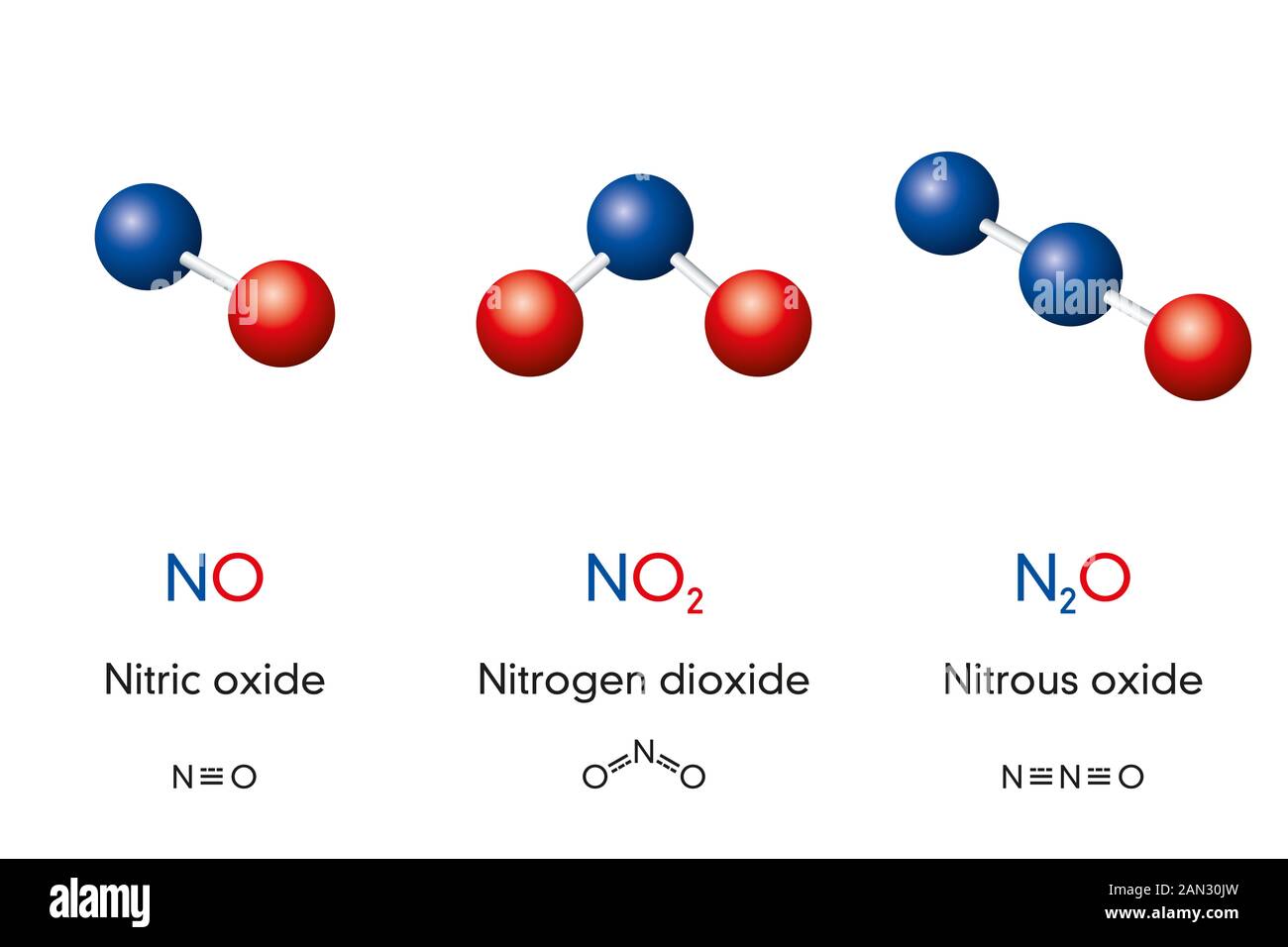
Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.
- Получают N2O разложением нитрата аммония при нагревании:
- NH4NO3 → N2O + H2O
- Оксид азота I разлагается на азот и кислород:
- N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
- Получение
- В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
- NH3 + O2 → (t, кат) NO + H2O
- В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
- Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
- Химические свойства
- На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
- NO + O2 → NO2
Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.
- Получение
- Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем охлаждением полученной смеси газов до температуры — 36 °C.
- As2O3 + HNO3 → H3AsO 3 + NO↑ + NO2↑
- При охлаждении газов образуется оксид азота III.
- NO + NO2 → N2O3
- Химические свойства
Является кислотным оксидом. соответствует азотистой кислота — HNO2, соли которой называются нитриты (NO2-). Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.
Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O
- Cu(NO3)2 → (t) CuO + NO2 + O2
- Pb(NO3)2 → (t) PbO + NO2 + O2
- Химические свойства
- Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
- NO2 + C → CO2 + N2
- NO2 + P → P2O5 + N2
- Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
- SO2 + NO2 → SO3 + NO
- Реакции с водой и щелочами
- NO2 + H2O → HNO3 + HNO2
- NO2 + LiOH → LiNO3 + LiNO2 + H2O
- Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
- NO2 + H2O + O2 → HNO3
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Источник: https://studarium.ru/article/168
Технический азот: применение. Основные направления использования азота
Технический азот, реализуемый в баллонах, широко используется в различных технологических процессах. Этот газ не токсичен, а его стоимость относительно невелика, поэтому приобретение этого вещества возможно даже частными лицами. Продажа баллонов с азотом осуществляется обычно в объеме 40 л, но возможна продажа газа и в меньших резервуарах. Применяться этот газ может как на производстве, так и в быту, но прежде чем говорить о применение азота, следует разобраться в основных свойствах этого вещества.
Этот загадочный азот: из истории открытия газа

Британец сообщил о своих исследованиях коллеге Джозефу Пристли, который трудился над решением аналогичной задачи. Пристли выяснил, что если в закрытом помещении длительное время горит свеча или находится живое существо, то таким воздухом невозможно дышать. Швед Карл Шееле смог получить в лабораторных условиях кислород. Также он указал, что воздух состоит из кислорода, который может гореть, и азота, который не горит.
Однако официально первооткрывателем азота считают шотландца Резерфорда, который смог установить основные свойства азота.
АЗОТ: ОСНОВНЫЕ ХАРАКТЕРИСТИКИ

Точка кипения этого газа составляет -196ºС, но уже при -209,8ºС жидкость превращается в твёрдое, снегоподобное вещество. Азот обладает высокой степенью инертности, но соединения этого элемента часто бывают очень активны и небезопасны для человека.
| Химические свойства | Физические свойства |
|
|
|
|
|
|
Применение технического азота

Наибольшее распространение этот инертный газ получил в следующих сферах промышленности:
- Производстве металла.
- Пищевой индустрии.
- Химической индустрии.
- Обработке отходов.
- Нефтегазовой отрасли.
- Медицинской отрасли.
Также этот газ может быть использован при изготовлении электроники и производстве стекла. В газообразном состоянии азот используется в качестве защитного газа при сварке металлов. В процессе соединения металла с помощью азота вытесняется кислород, тем самым снижая разрушительное действие этого окислителя.
Инертные качества этого газа могут применяться в установках пожаротушения. Азот не поддерживает горение, а, попадая в очаг возгорания, уменьшает концентрацию кислорода, что приводит к прекращению процесса окисления вещества.
В медицине жидкий азот используется для удаления различных новообразований на поверхности кожи. В этом агрегатном состоянии вещество может применяться при проведении омолаживающих процедур.
Криогенная терапия хорошо воздействует на весь организм, активируя защитные и восстановительные свойства иммунной системы.
В химической промышленности азот применяется для производства азотных удобрений и аммиака.
В чем хранят и как перевозят технический азот
- Газообразный азот заправляют в стальные баллоны различной вместимости, которые находятся под давлением 15-20 Мпа.
- Четырехокись азота можно заправлять в баллоны из легированной стали или алюминия. В условиях обычной температуры воздуха давление внутри таких баллонов невысокое, поэтому их и используют для хранения азота.
- Жидкий азот хранят в сосудах Дьюара. Такие сосуды с вакуумной изоляцией наиболее подходящий вариант для хранения и перевозки низкокипящих жидкостей.
- Азот особой чистоты можно заправлять в такие баллоны.
Все азотные баллоны должны периодически подвергаться проверке.
К ним предъявляются высокие требования системы ГОСТ.
Азот разрешено перевозить морским и железнодорожным транспортом, а также автотранспортом. Транспортировка азота в большом количестве считается перевозкой опасных грузов и разрешена определенным компаниям. В процессе перевозки и хранения баллоны не должны подвергаться ударам, падениям и перегреву. При сильном ударе или нагреве существует риск взрыва.
Источник: https://ballonis.ru/stati/tehnicheskiy-azot-primenenie
Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония
 Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л H2O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства азота: Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Характерная валентность – 3 и 4.
Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. В обычных условиях азот подобен инертному газу.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li3N. При нагревании (то есть активации молекул N2) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
N2 + 3H2 ↔ 2NH3
N2 + 2B → 2BN
3Si + 2N2 → Si3N4
3Ca + N2 → Ca3N2
N2 + O2 → 2NO.
Получение азота. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). Полученный азот содержит примеси благородных газов (аргона).
- В лабораториях обычно используется азот, доставляемый с производства в стальных баллонах под повышенным давлением или жидкий азот в сосудах Дьюара. Можно получать азот разложением некоторых его соединений:
- NH4NO2 → N2 + 2H2O (при to)
- (NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O (при to)
- 2N2O → 2N2 + O2 (при to)
- Особо чистый азот получают термическим разложением азида натрия:
- 2NaN3 → 2Na + 3N2 (при to)
Нахождение в природе: в природе азот встречается в основном в свободном состоянии. Содержание азота в воздухе — его объемная доля 78,09 %.
В небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – ДНК и РНК – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цитизила и уридила. Общее содержание азота в земной коре – 0,01 %.
Из минералов промышленное значение имеют чилийская селитра NaNO3 и индийская селитра KNO3.
Источник: http://himege.ru/azot-ximicheskie-svojstva/
Элемент АЗОТ (N) его свойства, получение, изотопы, применение
 Азот (N) — это химический элемент 15 группы (или подгруппы V(a) короткой формы), 2-го периода таблицы Менделеева с атомным номером 7. Чистый азот N2 представляет безцветный газ, без вкуса и запаха, плохо растворимый в воде, при сильном охлаждении и под высоки давлением превращается в жидкость. Один из самых распространённых элементов на Земле. По химическим свойствам инертен, но реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), при разделение которого получают промышленный азот. Применяется как инертная среда для множества технологических процессов; жидкий азот – хладагент. Азот – один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
Азот (N) — это химический элемент 15 группы (или подгруппы V(a) короткой формы), 2-го периода таблицы Менделеева с атомным номером 7. Чистый азот N2 представляет безцветный газ, без вкуса и запаха, плохо растворимый в воде, при сильном охлаждении и под высоки давлением превращается в жидкость. Один из самых распространённых элементов на Земле. По химическим свойствам инертен, но реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), при разделение которого получают промышленный азот. Применяется как инертная среда для множества технологических процессов; жидкий азот – хладагент. Азот – один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот.
Основные свойства элемента Азот (N) и его параметры таблица
| Название | Азот / Nitrogenium |
| Символ | N |
| Номер | 7 |
| Атомная масса (молярная масса) | [14,00643; 14,00728] а. е. м. (г/моль) |
| Электронная конфигурация | 1s22s22p3 |
| Радиус атома | 92 пм |
| Кларковое число (кларк) | 19 г/т |
| Ковалентный радиус | 75 пм |
| Радиус иона | 13 (+5e) 171 (-3e) пм |
| Электроотрицательность азота | 3,04 (шкала Полинга) |
| Валентность азота | III, IV |
| Степени окисления азота | 5, 4, 3, 2, 1, 0, −1, −2, −3 |
| Энергия ионизации (первый электрон) | 1401,5 (14,53) кДж/моль (эВ) |
| Плотность (при нормальных условиях) | 0,808 г/см3 (-195,8 °C); при н. у. 0,001251 г/см3 |
| Температура плавления | 63,29 K (-209,86 °C) |
| Температура кипения азота | 77,4 K (-195,75 °C) |
| Удельная теплота плавления | (N2) 0,720 кДж/моль |
| Удельная теплота испарения | (N2) 5,57 кДж/моль |
| Молярная теплоёмкость | 29,125 (газ N2) Дж/(K·моль) |
| Молярный объём | 17,3 см3/моль |
| Структура решётки азота | кубическая |
| Параметры решётки | 5,661 Å |
| Теплопроводность азота | (300 K) 0,026 Вт/(м·К) |
| Номер CAS | 7727-37-9 |
История открытия Азота
Примерно 200 лет назад ученые установили, что в воздухе есть газ, без которого невозможны дыхание и горение. Его назвали «жизненным воздухом».
В 1772 году шотландский химик, ботаник и врач Даниэль Резерфорд (1749–1819) установил, что при сжигании в стеклянном сосуде фосфора и других горючих веществ объем воздуха уменьшался примерно на 20%, то что осталось он назвал «испорченным воздухом».
В том же году английский физик и химик Генри Кавендиш (1731–1810) удалил из воздуха кислород (раскаленным углем) и углекислый газ (щелочью). Оставшийся газ он назвал «удушливым воздухом». В 1787 г.
французский химик ЛавуазьеАЛ установил, что составные части воздуха – «жизненный воздух» и «удушливый воздух» – это простые вещества, то есть в каждом из них есть атомы только одного сорта. Лавуазье назвал эти газы кислородом и азотом (франц. oxygene и azote). Слово azote он произвел от греческого zoos – живой и отрицательной приставки – «не поддерживающий жизни».
Получение азота
| Получение в промышленности | Азот в промышленности получают фракционной перегонкой жидкого воздуха. Сначало отгоняется азот (tкип=-195,8°C), а затем кислород (tкип=-183°C) |
| Получение азота в лаборатории |
|
Азот в природе
- Различают азот как химический элемент N с порядковым номером 7; молекулярный азот N2 как простое газообразное вещество; белковый азот, содержащийся в белках; нитратный азот, входящий в состав соединений в виде нитрогруппы; связанный азот, входящий в любое химическое соединение (исключая молекулярный азот); и усваиваемый азот, находящийся в форме, усваиваемой растениями.
- Содержание азота в атмосфере (в форме N2) по массе составляет 75,6%.
- Общее содержание азота в земной коре в виде его соединений составляет 0,01%.
Природный азот состоит из двух стабильных изотопов 14N – 99,635 % и 15N – 0,365 %. В лаборатории получены еще 14 радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами.
Таблица всех изотопов азота

Примененине Азота и его соединений
| Область применения Азота | Цели применения |
| В химической промышленности | Синтез аммиака N2+ ЗН2 → t°,p,кат. → 2NH3 (производство азотной кислоты) |
| В электротехнической промышленности | Создание инертной среды при заполнении азотом электрических ламп |
| В химикотермической обработке металлов | Азотирование поверхности стальных изделий путем насыщения азотом при высокой температуре |
| В сельском хозяйстве | Азотсодержащие соединения NaNO3, KNO3, NH4NO3, (NH4)SO4 в качестве удобрений |
| В военном деле и в геологоразведочных работах | KNO3 — составная часть пороха (KNO3 + S + С); NH4NO3— составная часть взрывчатого вещества аммонала (NH4NO3 + С + Аl) |
| В медицине | Аминокислоты, белки, нитроглицерин и другое. |
- ____________
- Источник информации:
- 1. Химическая энциклопедия в пяти томах / Москва, 1990
2. Большая энциклопедия химических элементов / И.А. Леенсон, — М.: 2014.
3. Материалы сайта ru.wikipedia.org
Источник: https://infotables.ru/khimiya/69-khimicheskie-elementy/659-azot-n
Азот и его характеристики
Большая часть азота находится в свободном состоянии. Свободный азот является главной составной частью воздуха, который содержит 78,2% (об.) азота.
Неорганические соединения азота не встречаются в природе в больших количествах, если не считать натриевую селитру NaNO3, образующую мощные пласты на побережье Тихого океана в Чили.
Почва содержит незначительные количества азота, преимущественно в виде солей азотной кислоты. Но в виде сложных органических соединений – белков – азот входит в состав всех живых организмов.
Общее содержание азота в земной коре (включая гидросферу и атмосферу) составляет 0,04% (масс.).
В виде простого вещества азот – это бесцветный газ, не имеющий запаха и весьма мало растворимый в воде. Он немного легче воздуха: масса 1 л азота равна 1,25 г.
Атомная и молекулярная масса азота
Относительной атомной массой элемента называют отношение массы атома данного элемента к 1/12 массы атома углерода. Относительная атомная масса безразмерна и обозначается Ar (индекс «r» — начальная буква английского слова relative, что в переводе означает «относительный»). Относительная атомная масса атомарного азота равна 14,0064 а.е.м.
Массы молекул, также как массы атомов выражаются в атомных единицах массы. Молекулярной массой вещества называется масса молекулы, выраженная в атомных единицах массы.
Относительной молекулярной массой вещества называют отношение массы молекулы данного вещества к 1/12 массы атома углерода, масса которого равна 12 а.е.м. Известно, что молекула азота двухатомна – N2.
Относительная молекулярная масса молекулы азота будет равна:
Mr(N2) = 14,0064× 2 ≈ 28.
Изотопы азота
В природе азот существует в виде двух стабильных изотопов 14N (99,635%) и 15N (0,365%). Их массовые числа равны 14 и 15 соответственно. Ядро атома изотопа азота 14N содержит семь протонов и семь нейтронов, а изотопа 15N – такое же количество протонов и шесть нейтронов.
Существует четырнадцать искусственных изотопов азота с массовыми числами от 10-ти до 13-ти и от 16-ти до 25-ти, из которых наиболее стабильным является изотоп 13Nс периодом полураспада равным 10 минут.
Ионы азота
- На внешнем энергетическом уровне атома азота имеется пять электронов, которые являются валентными:
- 1s22s22p3.
- Схема строения атома азота представлена ниже:

В результате химического взаимодействия азот может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
- N0 –5e → N2+;
- N0-4e → N4+;
- N0-3e → N3+;
- N0-2e → N2+;
- N0-1e → N1+;
- N0+1e → N1-;
- N0+2e → N2-;
- N0+3e → N3-.
Молекула и атом азота
Молекула азота состоит из двух атомов – N2. Приведем некоторые свойства, характеризующие атом и молекулу азота:
| Энергия ионизации атома, эВ | 14,53 |
| Сродство атома к электрону, эВ | 0,27 |
| Относительная электроотрицательность | 3,07 |
| Радиус атома, нм | 0,071 |
| Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль | 945 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! |
Источник: http://ru.solverbook.com/spravochnik/ximiya/ximicheskie-elementy/azot-i-ego-xarakteristiki/
Азот — урок. Химия, 8–9 класс
Азот — химический элемент № (7). Он расположен в VА группе Периодической системы химических элементов.
N7+7)2e)5e
На внешнем слое атома азота содержатся пять валентных электронов, до его завершения не хватает трёх электронов. Поэтому в соединениях с металлами и водородом азоту характерна степень окисления (–3), а при взаимодействии с более электроотрицательными кислородом и фтором он проявляет положительные степени окисления от (+1) до (+5).
Азот в виде простого вещества содержится в воздухе. Его объёмная доля составляет (78) %. В земной коре соединения азота встречаются редко. Известно месторождение нитрата натрия NaNO3 (чилийская селитра).
Азот относится к жизненно важным элементам, так как входит в состав молекул белков и нуклеиновых кислот.
Молекулы простого вещества состоят из двух атомов, связанных прочной тройной связью:
N:::N…., N≡N.
- При обычных условиях азот — бесцветный газ без запаха и вкуса, малорастворимый в воде.
- Не ядовит.
- Азот химически малоактивен из-за прочной тройной связи и в химические реакции вступает только при высоких температурах.
- При комнатной температуре он реагирует только с литием с образованием нитрида лития:
- 6Li0+N20=2Li+13N−3.
- При нагревании образует нитриды и с некоторыми другими металлами:
- 3Ca+N2=tCa3N2.
- С водородом азот реагирует только при высоком давлении, повышенной температуре и в присутствии катализатора. В реакции образуется аммиак:
- N20+3H20⇄t,p,k2N−3H3+1.
- В реакциях с металлами и водородом азот проявляет окислительные свойства.
- Восстановительные свойства азота проявляются в реакции с кислородом:
- N20+O20⇄t2N+2O−2.
Реакция возможна только при очень высокой температуре ((3000) °С) и частично протекает в атмосфере во время грозы. Образуется оксид азота((II)).
Большое количество азота используется для получения аммиака и азотных удобрений.
Применяется он для создания инертной среды при проведении химических реакций. Жидкий азот находит применение в медицине, используется для охлаждения в химических и физических исследованиях.
Чистый азот получают из воздуха.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/azot-i-ego-soedineniia-161796/re-c79e2cf3-4588-479f-88f0-348ec0688712
Азот
АЗОТ, N (лат. Nitrogenium * а. nitrogen; н. Stickstoff; ф. azote, nitrogene; и. nitrogeno), — химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067. Открыт в 1772 английским исследователем Д. Резерфордом.
Свойства азота
При обычных условиях азот — газ без цвета и запаха. Природный азот состоит из двух стабильных изотопов: 14N (99,635%) и 15N (0,365%). Молекула азота двухатомная; атомы связаны ковалентной тройной связью NN. Диаметр молекулы азота, определённый разными способами, 3,15-3,53 А. Молекула азота очень устойчива — энергия диссоциации 942,9 кДж/моль.
Молекулярный азот
Константы молекулярного азота: f плавления — 209,86°С, f кипения — 195,8°С; плотность газообразного азота 1,25 кг/ м3, жидкого — 808 кг/м3.
Характеристика азота
В твёрдом состоянии азот существует в двух модификациях: кубической а-форме с плотностью 1026,5 кг/м3 и гексагональной b-форме с плотностью 879,2 кг/м3. Теплота плавления 25,5 кДж/кг, теплота испарения 200 кДж/кг.
Поверхностное натяжение жидкого азота в контакте с воздухом 8,5•10-3 Н/м; диэлектрическая проницаемость 1,000538. Растворимость азота в воде (см3 на 100 мл Н2О): 2,33 (0°С), 1,42 (25°С) и 1,32 (60°С). Внешняя электронная оболочка атома азота состоит из 5 электронов.
Степени окисления азота меняются от 5 (в N2О5) до -3 (в NH3).
Соединение азота
Азот при нормальных условиях может реагировать с соединениями переходных металлов (Ti, V, Mo и др.), образуя комплексы либо восстанавливаясь с образованием аммиака и гидразина.
С такими активными металлами, как литий, кальций, магний, азот взаимодействует при нагревании до сравнительно невысоких температур. С большинством других элементов азот реагирует при высокой температуре и в присутствии катализаторов. Хорошо изучены соединения азота с кислородом: N2О, NO, N2О5.
С водородом азот соединяется только при высокой температуре и в присутствии катализаторов; при этом образуется аммиак NH3. С галогенами азот непосредственно не взаимодействует; поэтому все галогениды азота получают только косвенным путём, например фтористый азот NF3 — при взаимодействии фтора с аммиаком.
С серой также не происходит непосредственного соединения азота. При взаимодействии раскалённого кокса с азотом образуется циан (CN)2.
При действии на обычный азот электрических разрядов, а также при электрических разрядах в воздухе может образоваться активный азот, представляющий собой смесь молекул и атомов азота, обладающих повышенным запасом энергии. Активный азот весьма энергично взаимодействует с кислородом, водородом, парами серы, фосфором и некоторыми металлами.
Азот — один из самых распространённых элементов на Земле, причём основная его масса (около 4•1015 т) сосредоточена в свободном состоянии в атмосфере. Ежегодно при вулканической деятельности в атмосферу выделяется 2•106 т азота.
Незначительная часть азота концентрируется в литосфере (среднее содержание в литосфере 1,9•10-3%). Природные соединения азота — хлористый аммоний и различные нитраты (селитры).
Нитриды азота могут образовываться только при высоких температурах и давлениях, что, по-видимому, имело место на самых ранних стадиях развития Земли. Крупные скопления селитры встречаются только в условиях сухого пустынного климата (Чили, Индия, Египет, Испания и др.).
Небольшие количества связанного азота находятся в каменном угле (1-2,5%) и нефти (0,02-1,5%), а также в водах рек, морей и океанов. Азот накапливается в почвах (0,1 %) и живых организмах (0,3%). Азот входит в состав белковых молекул и многих естественных органических соединений.
Круговорот азота в природе
В природе осуществляется круговорот азота, который включает цикл молекулярного атмосферного азота в биосфере, цикл в атмосфере химически связанного азота, круговорот захоронённого с органическим веществом поверхностного азота в литосфере с возвратом его обратно в атмосферу. Азот для промышленности ранее добывался целиком из месторождений природных селитр, число которых в мире весьма ограничено. Особенно крупные залежи азота в виде азотнокислого натрия находятся в Чили; добыча селитры в отдельные годы составляла более 3 млн. т.
Применение азота
Азот получают главным образом разделением предварительно сжиженного воздуха, который затем подвергается разгонке. Основная часть получаемого азота используется для производства аммиака, который затем перерабатывается на азотную кислоту, удобрения, взрывчатые вещества.
Свободный азот применяют во многих отраслях промышленности как инертную среду при разнообразных химических и металлургических процессах. Жидкий азот находит применение в различных холодильных установках.
Ведутся работы по использованию жидкого азота для замораживания неустойчивых пород (главным образом глинистых) при проходке шахтных стволов, в качестве безопасного энергоносителя для шахтных машин, а также для борьбы с рудничными пожарами, где применение азота позволяет резко снизить содержание кислорода в очаге пожара.
При разработке нефтяных месторождений закачиванием азота в нефтяные пласты эффективно вытесняют нефть после заводнения. Азот используется также для поддержания давления в скважинах при бурении.
Источник: http://www.mining-enc.ru/a/azot
АЗОТ: история открытия, нахождение в природе, биохимический цикл азота
История открытия азота.
В 1772 г. Д. Резерфорд установил, что воздух, оставшийся под колпаком, где жила мышь, после сжигания в нем фосфора не поддерживает горения и дыхания. Этот газ он назвал «ядовитым воздухом». В этом же году Д. Пристли, получив «ядовитый воздух» иным путем, назвал его «флогистированным воздухом». В 1773 г. К.
Шееле, шведский аптекарь из города Штральзунда, установил, что воздух состоит из двух газов, и назвал газ, не поддерживающий горения и дыхания, «дурным или испорченным воздухом». В 1776 г. известный французский ученый А. Лавуазье, подробно исследуя «ядовитый», «флогистированный» и «дурной» воздух, установил тождество между ними.
И лет спустя, будучи членом комиссии по выработке новой химической номенклатуры, он предложил назвать эту часть воздуха азотом (от греческих слов «а» — означающего отрицание, и «zoos» — жизнь). Латинское название азота происходит от слова «нитрогениум», что значит «рождающий селитру» («селитрообразователь»).
Этот термин введен в науку в 1790 г. Ж. Шапталом.
Нахождение в природе.
Азот вслед за водородом, гелием и кислородом является четвертым по распространенности элементом Солнечной системы.
Азот обнаружен в спектрах звезд, в том числе в фотосфере Солнца, в метеоритах, кометах, солнечном ветре и в межзвездных облаках газа.
Молекулярный азот наблюдается в атмосферах Венеры и Марса, а аммиак характерен для Юпитера и Сатурна. Во всех космических объектах азот встречается только в восстановленном состоянии.
В земной коре по распространенности азот занимает 20-е место. Подавляющая его часть сосредоточена в следующих основных резервуарах: атмосфере (3,86*1015 т), литосфере (1,7*1015 т), гидросфере (2,2 *1013 т) и биосфере (~ 1010 т). В атмосфере свободный азот в виде молекулярного N2 составляет 78,09% по объему (или 75,6% по массе), не считая незначительных примесей его в виде аммиака и оксидов.
В литосфере среднее содержание азота составляет 6*10-3 вес. %. Основная масса азота в силикатах находится в химически связанном состоянии в виде NH4+, изоморфно замещающего ион калия в силикатной решетке.
Кроме того, в природе встречаются и азотные минералы: нашатырь (NH4C1), выделяющийся из вулканов в довольно больших количествах, баддингтонит (NH4AlSi3O8- *0,5 Н2O) единственный найденный аммониевый алюмосиликат с цеолитной водой. В самых приповерхностных областях литосферы обнаружен ряд минералов, состоящих в основном из нитратных солей.
Среди них широко известная селитра (NaNO3), крупные скопления которой характерны для сухого пустынного климата (Чили, Средняя Азия). Долгое время селитра была главным источником связанного азота. (Сейчас основное значение имеет промышленный синтез аммиака из азота воздуха и водорода.
) По сравнению с силикатными минералами ископаемое органическое вещество существенно обогащено азотом. Нефть содержит от 0,01 до 2% азота, а каменный уголь — от 0,2 до 3%. Как правило, повышенное содержание азота имеют алмазы (до 0,2%).
В гидросфере среднее содержание азота составляет 1,6- *10-3 вес. %.
Основную часть этого азота составляет молекулярный азот, растворенный в воде; химически связанный азот, которого примерно в 25 раз меньше, представлен нитратной и органической формами.
В меньших количествах в воде содержится аммиачный и нитритный азот. Концентрация связанного азота в океане примерно в 104 раз меньше, чем в почвах, пригодных для сельскохозяйственного производства.
Хотя название азота означает «не поддерживающий жизни», на самом деле это необходимый для жизнедеятельности элемент. В растительных организмах его содержится в среднем 3%, в живых организмах до 10% от сухого веса. Азот накапливается в почвах (в среднем 0,2 вес.%). В белке животных и человека среднее содержание азота составляет 16%.
Между атмосферой, литосферой и биосферой происходит непрерывный обмен, с которым связана и смена химических форм азота. Этот обмен и определяет круговорот азота в природе. Обмен азота между атмосферой и биосферой получил название биохимического цикла азота.
Основным процессом движения азота в биосфере является его переход из одной химической формы в другую в замкнутом цикле. Постоянная смена химических форм азота является источником жизни для многих организмов начиная от микроорганизмов и кончая высокоорганизованными формами жизни.
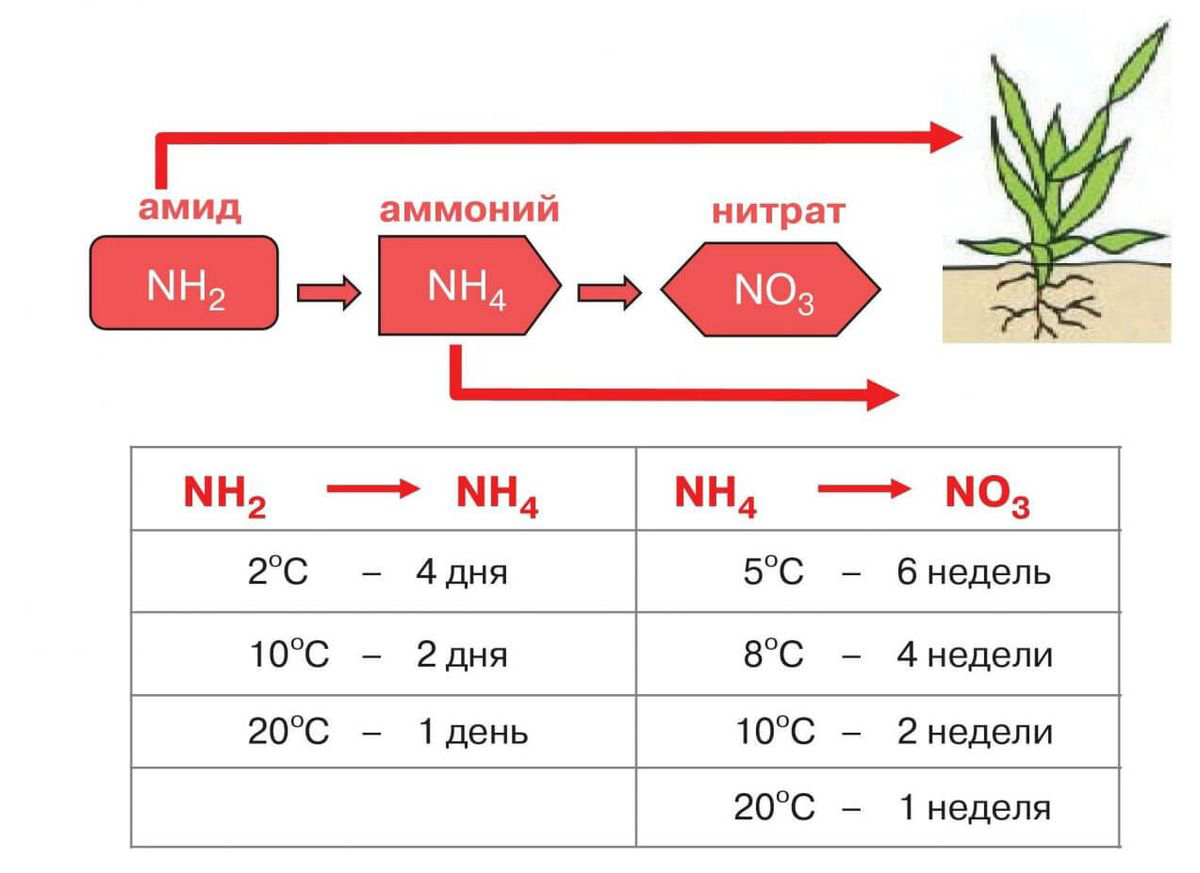
Накопленные в почве запасы связанного азота служат источником питания высших растений, откуда связанный азот может поступать и в организмы животных. Растения и животные, отмирая, дают начало органическому азоту, находящемуся главным образом в аминокислотах.
В процессе аммонификации органических остатков азот органических соединений переходит в аммонийную (аммиачную) форму. Последняя с помощью микроорганизмов переходит в нитритную форму. При этом выделяется около 70 ккал/молъ. Другая группа микроорганизмов завершает окисление аммиака до нитрата.
Полученный в процессе нитрификации нитрат усваивается растениями, и цикл движения азота в биосфере замыкается.
Главными неорганическими соединениями азота в почвах являются нитрат, аммоний и в редко встречающихся в природных условиях нитрит. Поведение первых двух компонентов в почве совершенно различно.
Если нитрат является легкоподвижным соединением, не сорбируется минералами почвы и остается в растворенном в воде состоянии, то аммоний легко хемосорбируется глинистыми минералами, хотя это не мешает ему в определенных условиях легко окисляться до нитрата. Такое различие в подвижности нитрата и аммония предопределяет источники азотного питания растений.
С энергетических позиций аммонийная форма азота более предпочтительна, так как валентность азота в ней одинакова с валентностью азота в аминокислотах.
Нитратная форма служит основным источником азотного питания растительности в силу своей подвижности, несмотря на необходимость траты дополнительной энергии, связанной с восстановлением нитрата растением.
Неиспользованные живым веществом запасы химически связанного азота под действием микроорганизмов непрерывно преобразовываются в формы, доступные для азотного питания растений.
Так, фиксированный глинистыми минералами аммоний окисляется до нитратов.
В определенных условиях при отсутствии свободного кислорода и наличии неиспользованного живым веществом нитрата может происходить обусловленное процессом денитрификации восстановление азота до молекулярного с уходом последнего в атмосферу.
Количества азота, выведенные денитрифицирующими бактериями из биосферы, компенсируются процессами фиксации азота из атмосферы азотфиксирующими бактериями.
Последние подразделяются на две группы: живущие самостоятельно и живущие в симбиозе с высшими растениями или с насекомыми. Первая группа бактерий фиксирует примерно 10 кг/га. Симбионты высших растений фиксируют значительно большие количества азота.
Так, симбионты бобовых культур фиксируют до 350 кг/га. С осадками выпадает азота порядка нескольких килограммов на гектар.
В балансе фиксируемого азота все большее значение приобретает искусственно синтезированный аммиак, причем его количество удваивается каждые 6 лет. Уже в ближайшее время это может вызвать дисбаланс между процессами фиксации и денитрификации в биосфере.
Следует отметить подцикл круговорота аммиака и окислов азота через атмосферу, особенно если учесть, что этот подцикл регулирует масштабы развития биосферы. Источниками атмосферного аммиака служат биохимические процессы в почве и, в первую очередь, аммонификация.
Окисляясь, аммиак дает основную массу окислов азота в атмосфере. Получающаяся в процессе денитрификации закись азота ответственна за содержание окислов азота в стратосфере, которые каталитически разрушают озон, защищающий живое вещество биосферы от губительного действия жесткого ультрафиолетового излучения.
Таким образом в природе установились определенные пределы развития биосферы.
Деятельность человека грозит нарушить установившееся равновесие. Так, подсчет показал, что количества окиси азота, выделившиеся при планируемых полетах сверхзвуковых самолетов в стратосфере, будут сравнимы с поступлениями ее из природных источников.
Таким образом, завершается цикл движения молекулярного азота через биосферу. В этом геохимическом цикле само существование азотной атмосферы Земли определяется скоростями процессов фиксации и денитрификации.
При резком разбалансе этих скоростей азотная атмосфера Земли может исчезнуть всего за несколько десятков миллионов лет.
Помимо атмосферы, биосфера определяет существование и другого крупного резервуара азота в земной коре — литосферы, так как именно взаимодействие живого вещества с молекулярным азотом играет главную роль в процессе круговорота поверхностного азота через земную кору.
Небольшая часть накопленного в биосфере связанного азота вместе с осадками увлекается вглубь земной коры. В резко восстановительных условиях из осадочных пород исчезает нитратная форма азота.
С увеличением температуры и давления и выходом за границы биосферы реакции превращения органического вещества становятся односторонними и сдвигаются в сторону разрушения органической формы азота. Основной формой связанного азота становится ион аммония.
С увеличением степени метаморфизма осадочных пород начинает разрушаться и уходить из пород и аммонийный азот. На высоких ступенях метаморфизма этот процесс практически заканчивается, а с ним заканчивается цикл обращения поверхностного азота в земной коре. Время жизни азота в этом цикле составляет около 1 млрд. лет.
Изотопы азота.
Азот — единственный элемент на Земле, у которого наиболее распространенными являются ядра изотопа 14N нечетно-нечетного типа (7 протонов, 7 нейтронов). Содержание 14N и 15N в воздухе составляет 99,634 и 0,366% соответственно.
В верхних слоях атмосферы под действием нейтронов космического излучения 14N превращается в радиоактивный изотоп 14С, на чем основана геохронологическая датировка геологических образцов, содержащих «древний» углерод.
В настоящее время возможно получение химических соединений азота, искусственно обогащенных тяжелым изотопом 15N до 99,9 атомн.%. Обогащенные по 15N образцы используются при исследованиях в биохимии, биологии, медицине, химии и физической химии, физике, в сельском хозяйстве, в технологии и химическом машиностроении, в аналитической химии и т. д.
Источник: www.chemanalytica.ru
www.chemanalytica.ru лаборатория химического анализа воды г.Москва.
Источник: https://www.chemanalytica.ru/stati/article_post/azot-istoriya-otkrytiya-nakhozhdeniye-v-prirode-biokhimicheskiy-tsikl-azota
Азот — безжизненный газ, который так необходим для жизни
Азот химический элемент, атомный номер 7, атомная масса 14,0067. В воздухе свободный азот (в виде молекул N2) составляет 78,09%. Азот немного легче воздуха, плотность 1,2506 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -195,8°C. Критическая температура -147°C и критическое давление 3,39 МПа.
Азот бесцветный, без запаха и вкуса, нетоксичен, невоспламеняемый, невзрывоопасен и не поддерживающий горение газ в газообразном состоянии при обычной температуре обладает высокой инертностью. Химическая формула — N. В обычных условиях молекула азота двухатомная — N2.
Производство азота в промышленных масштабах основано на получении его из воздуха (см. Способ получения азота).
До сих пор ведутся споры о том, кто был первооткрывателем азота. В 1772 г.
шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи — получил газ, который он назвал «ядовитый газ».
Оказалось, что горящая лучинка, внесенная в сосуд, наполненный азотом, гаснет, а живое существо в атмосфере этого газа быстро гибнет.
Данный опыт можно посмотреть на видео: Горящая лучинка в азоте гаснет.
В тоже время, проводя подобный опыт, азот получили британский физик Генри Кавендшин (Henry Cavendish) назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) — «испорченный воздух».
Окончательное имя «азот» данному газу дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier). Слово «азот» греческого происхождения и означает «безжизненный».
Как мы уже писали в статье «Карбид кальция и ацетилен — друзья не разлей вода!» — азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт — цианамид кальция.
Жидкий азот бесцветная жидкость без запаха с температурой кипения -195,8°C при давлении 101,3 кПа и удельным объемом 1,239 дм3/кг при температуре -195,8°C и давлении 101,3 кПа. Жидкий азот используется как хладагент. Жидкий азот может вызвать обморожение кожи и поражение слизистой оболочки глаз. Закись азота бесцветный газ, имеет сладковатый вкус и слабый, приятный запах. Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им — веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота — окисел, не дающий кислот, он относится к несолеобразующим окислам.
Закись азота (N2O) не может быть получена из газообразного кислорода и азота, она образуется из азотно-кислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
NH4NO3 = N2O + 2H2O
Газообразный азот относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм3/кг при давлении около 105 Па и температуре 20°C.
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом — литием, образуя при этом нитрид лития:
N2 + 6Li = 2Li3N
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства металла и поэтому его концентрацию в зоне плавления стремятся ограничить.
Газообразный азот чаще всего применяют:
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например — сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Азот является инертным по отношению к меди и ее сплавам (он не растворяется в меди и не реагирует с ней) даже при высоких температурах. Поэтому его используют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%).
Также газообразный азот используют для сварки аустенитных нержавеющих сталей — исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если азот образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание азота увеличивает тепловую мощность дуги. Из-за этой особенности, азот чаще всего используют не для сварки, а для плазменной резки.
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень азота в воздухе сокращает содержание кислорода на 75% или ниже нормальной концентрации.
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный азот 1-го (99,6% азота) и 2-го (99,0% азота) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949. Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.
Коэффициенты перевода объема и массы газа при Т=15°C и Р=0,1 МПа
| 1,170 | 1 | 1,447 |
| 0,809 | 0,691 | 1 |
| 1 | 0,855 | 1,237 |
Коэффициенты перевода объема и массы газа при Т=0°C и Р=0,1 МПа
| 1,251 | 1 | 1,548 |
| 0,809 | 0,646 | 1 |
| 1 | 0,799 | 1,237 |
Газ в баллоне
| 40 | 7,37 | 6,3 |
Давление газа в баллоне при различной температуре окружающей среды
| -40 | 11,2 |
| -30 | 11,9 |
| -20 | 12,6 |
| -10 | 13,4 |
| 14,0 | |
| +10 | 14,7 |
| +20 | 15,3 |
| +30 | 15,9 |
Источник: https://weldering.com/azot-bezzhiznennyy-gaz-kotoryy-neobhodim-zhizni




