Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
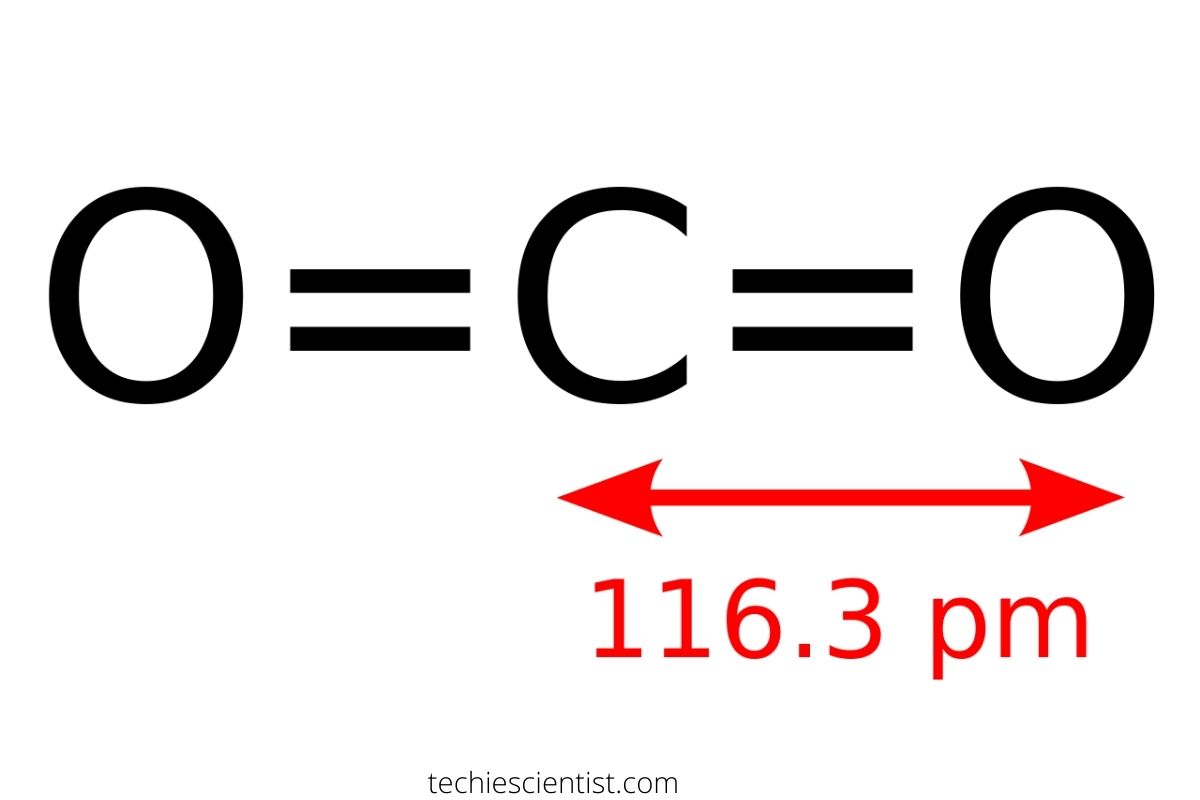
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2

Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)

Химические свойства
- Реакции с неметаллами
- При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
- C + H2 → (t) CH4 (метан)
- 2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
- С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
- С + F2 → (t) CF4
- Реакции с металлами
- Ca + C → CaC2 (карбид кальция, СО углерода = -1)
- Al + C → Al4C3 (карбид алюминий, СО углерода -4)
- Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
- Восстановительные свойства
- Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
- Fe2O3 + C → Fe + CO2
- ZnO + C → Zn + CO
- FeO + C → Fe + CO
- Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
- SiO2 + C → (t) Si + CO
- Может восстановить и собственный оксид:
- CO2 + C → CO
- Реакция с водой
- Реакции с кислотами
- В реакциях с кислотами углерод проявляет себя как восстановитель:
- C + HNO 3(конц.) → (t) CO2 + NO2 + H2
- C + HNO3 → CO2 + NO + H2O
- C + H2SO4(конц.) → CO2 + SO2 + H2O
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.


Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
- Получение
- В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
- CO2 + C → (t) CO
- C + H2O → (t) CO + H2
- В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
- HCOOH → (H2SO4) CO + H2O
- Химические свойства
- Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
- CO + O2 → CO2
- Fe2O3 + CO → Fe + CO2
- FeO + CO → Fe + CO2
- Образование карбонилов — чрезвычайно токсичных веществ.
- Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
- Получение
- В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
- CaCO3 → (t) CaO + CO2↑
- C6H12O6 → C2H5OH + CO2↑
- В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
- CaCO3 + HCl → CaCl2 + H2O + CO2↑
- Углекислый газ образуется при горении органических веществ:
- C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания), кислые — гидрокарбонаты (при избытке кислотного оксида).
- 2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
- KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
- Na2O + CO2 → Na2CO3
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ. CO2 + H2O ⇄ H2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
- Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
- CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)
- Средние и кислые соли
- Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
- Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
- LiHCO3 + LiOH → Li2CO3 + H2O
- Нагревание солей угольной кислоты
- При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на соответствующий оксид металла, углекислый газ и воду.
- MgCO3 → (t) MgO + CO2
- KHCO3 → (t) K2CO3 + CO2↑ + H2O
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного газа без запаха. MgCO3 + HCl → MgCl2 + CO2↑ + H2O Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа — помутнение исчезало.
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Источник: https://studarium.ru/article/166
Химические свойства углекислого газа, реакции с другими веществами
Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота
 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония

Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO

Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж

Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q

Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
8) В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2

Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород
 Колба с пероксидом натрия
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Источник: https://UglekislyGaz.ru/dioksid-ugleroda/himicheskie-svojstva-co2/
Углерод — характеристика элемента и химические свойства
Характеристика углерода. Свойства простых веществ и соединений
 Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
Атом углерода имеет 6 электронов: 1s22s22p2. Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх, а другой, либо 2ру, либо 2рz-орбитали.
 Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Это явление, как известно, называют sp3-гибридизацией, а возникающие функции – sp3-гибридными. Образование четырех sp3-cвязeй обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи.
Помимо sp3-гибридизации у атома углерода наблюдается также sp2— и sp-гибридизация. В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp2— гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp2.

При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.

Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp2-гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил.
Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода.
Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества.
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
- — с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание: - 2C0 + O2 –t°= 2C+2O угарный газ
- — со фтором
С + 2F2 = CF4 - — с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
- — с некоторыми металлами образует карбиды
- 4Al + 3C0 = Al4C3
- Ca + 2C0 = CaC2-4
- — с водородом — метан (а также огромное количество органических соединений)
- C0 + 2H2 = CH4
- — с кремнием, образует карборунд (при 2000 °C в электропечи):
- Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита.
В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3*CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.

Неорганические соединения углерода
Ни ионы С4+ , ни С4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
- Получение
1) В промышленности (в газогенераторах): - C + O2 = CO2
- CO2 + C = 2CO
- 2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO - H2C2O4 = CO + CO2 + H2O
- Химические свойства
- При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
- 1) с кислородом
- 2C+2O + O2 = 2C+4O2
- 2) с оксидами металлов
- C+2O + CuO = Сu + C+4O2
- 3) с хлором (на свету)
- CO + Cl2 –hn= COCl2(фосген)
- 4) реагирует с расплавами щелочей (под давлением)
- CO + NaOH = HCOONa (формиат натрия)
- 5) с переходными металлами образует карбонилы
- Ni + 4CO –t°= Ni(CO)4
- Fe + 5CO –t°= Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°= CaO + CO2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
- CaCO3 + 2HCl = CaCl2 + H2O + CO2
- NaHCO3 + HCl = NaCl + H2O + CO2
- Химические свойства СO2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты - Na2O + CO2 = Na2CO3
- 2NaOH + CO2 = Na2CO3 + H2O
- NaOH + CO2 = NaHCO3
- При повышенной температуре может проявлять окислительные свойства
- С+4O2 + 2Mg –t°= 2Mg+2O + C0
- Качественная реакция
- Помутнение известковой воды:
- Ca(OH)2 + CO2 = CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Угольная кислота и её соли
- H2CO3 — Кислота слабая, существует только в водном растворе:
- CO2 + H2O ↔ H2CO3
- Двухосновная:
H2CO3 ↔ H+ + HCO3— Кислые соли — бикарбонаты, гидрокарбонаты
HCO3— ↔ H+ + CO32- Cредние соли — карбонаты - Характерны все свойства кислот.
- Карбонаты и гидрокарбонаты могут превращаться друг в друга:
- 2NaHCO3 –t°= Na2CO3 + H2O + CO2
- Na2CO3 + H2O + CO2 = 2NaHCO3
- Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
- CuCO3 –t°= CuO + CO2
- Качественная реакция — «вскипание» при действии сильной кислоты:
- Na2CO3 + 2HCl = 2NaCl + H2O + CO2
- CO32- + 2H+ = H2O + CO2
Карбиды
- Карбид кальция:
- CaO + 3 C = CaC2 + CO
- CaC2 + 2 H2O = Ca(OH)2 + C2H2 .
- Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
- 2 LaC2 + 6 H2O = 2La(OH)3 + 2 C2H2 + H2.
- Be2C и Al4C3 разлагаются водой с образованием метана:
- Al4C3 + 12 H2O = 4 Al(OH)3 = 3 CH4.
- В технике применяют карбиды титана TiC, вольфрама W2C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na2CO3 + 2 NH3 + 3 CO = 2 NaCN + 2 H2O + H2 + 2 CO2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
- C=O: [:C=N:]–
- Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
- 2 Au + 4 KCN + H2O + 0,5 O2 = 2 K[Au(CN)2] + 2 KOH.
- При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды:
KCN + S = KSCN. - При нагревании цианидов малоактивных металлов получается дициан: Hg(CN)2 = Hg + (CN)2. Растворы цианидов окисляются до цианатов:
- 2 KCN + O2 = 2 KOCN.
- Циановая кислота существует в двух формах:
- H-N=C=O; H-O-C=N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH4OCN = CO(NH2)2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC)2) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO2 + 2 NH3 = CO(NH2)2 + H2O. При 1300С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H2CO3 – слабая кислота (К1 =1,3·10-4; К2 =5·10-11). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
- H2CO3 ↔ H+ + HCO3— .
- При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO2 + H2O ↔ H2CO3 . - При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
- H+ + CO32-↔ HCO3—
- CaCO3(тв.) ↔ Ca2+ + CO32-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na2CO3) используется в производстве стекла.
Источник: http://himege.ru/uglerod-xarakteristika-elementa-i-ximicheskie-svojstva/
Оксиды углерода — урок. Химия, 8–9 класс
Оксид углерода((II)), или угарный газ
Оксид углерода((II)) CO образуется при неполном сгорании топлива. Это бесцветный газ без запаха. Он плохо растворяется в воде ((2,3) см³ в (100) см³ при (20) °С). Оксид углерода((II)) очень ядовит. При вдыхании его молекулы связываются с гемоглобином крови и препятствуют переносу кислорода.
Оксид углерода((II)) относится к несолеобразующим оксидам. При обычных условиях он не реагирует с водой, кислотами и основаниями.
Является сильным восстановителем. Восстановительные свойства проявляет в реакциях с оксидами металлов и кислородом. Оксид углерода((II)) отнимает кислород от оксидов металлов. В результате реакции образуются металл и углекислый газ:
- Cu+2O+C+2O=tCu0+C+4O2.
- Оксид углерода((II)) горит на воздухе голубым пламенем:
- 2C+2O+O02=t2C+4O−22.
- В реакции выделяется большое количество тепла.
Оксид углерода((IV)), или углекислый газ
Оксид углерода((IV)) CO2 — бесцветный газ без запаха. Он примерно в (1,5) раза тяжелее воздуха.
Малорастворим в воде (при комнатной температуре в (1) объёме воды растворяется (0,88) объёма CO2).
При охлаждении и повышенном давлении углекислый газ превращается в твёрдое вещество — «сухой лёд», который способен возгоняться, т. е. из твёрдого состояния переходить сразу в газообразное.

Сухой лёд
Оксид углерода((IV)) — типичный кислотный оксид. Он взаимодействует с водой, основными оксидами и щелочами. В реакции с водой образуется неустойчивая угольная кислота:
- CO2+H2O⇄H2CO3.
- В реакциях с основными оксидами и щелочами образуются карбонаты:
- CO2+CaO=CaCO3,
- CO2+2NaOH=Na2CO3+H2O.
- При взаимодействии щёлочи с избытком углекислого газа образуются гидрокарбонаты:
- CO2+NaOH=NaHCO3.
- В углекислом газе степень окисления углерода максимальная, поэтому он может проявлять окислительные свойства. Так, магний горит в атмосфере углекислого газа:
- C+4O2+2Mg0=t2Mg+2O+C0.
- Получение:
- в лаборатории углекислый газ получают действием кислот на карбонаты:
CaCO3+2HCl=CaCl2+H2O+CO2↑.
- В промышленности для его получения используют обжиг известняка:
- CaCO3=tCaO+CO2↑.
- В природе углекислый газ образуется при дыхании и сгорании топлива, при гниении и тлении органических веществ, а поглощается растениями в процессе фотосинтеза.
- Угарный газ используется:
- в качестве топлива;
- как восстановитель в производстве чугуна;
- для получения метанола.
Углекислый газ применяется:
- в производстве газированных напитков;
- для тушения пожаров;
- для охлаждения пищевых продуктов («сухой лёд»).
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/uglerod-i-ego-soedineniia-163475/re-52f9e0f4-9ed8-407d-997b-52c7405cc5f9
Оксид углерода — формулы, основные свойства и характеристика — Помощник для школьников Спринт-Олимпиады
Существует множество оксидов углерода, но наиболее известны угарный и углекислый газы.
Они представляют собой химические соединения одних и тех же элементов, но, несмотря на одинаковые исходные реагенты, характеристики веществ имеют отличия.
Например, первый газ известен как крайне опасный яд, образующийся при процессах горения. Второй же часто используется в качестве наполнителя для огнетушителей.
Монооксид углерода
Угарным газом называют оксид углерода с формулой CO. Кроме того, это соединение называют монооксидом и окисью углерода. Он представляет собой бесцветный безвкусный горючий газ без запаха, который легче воздуха. Вещество образуется в случаях, когда топливо сгорает не до конца. Оно плохо растворяется в воде.
У молекулы этого оксида линейное строение. Между атомами его элементов образуется тройная связь. Два неспаренных электрона обоих элементов образуют пару ковалентных связей. Третья же связь возникает, когда электронная пара кислорода размещается на свободной орбитали атома углерода.
У молекулы слабая полярность. Наличие двух неспаренных электронов говорит о том, что в этом соединении углерод проявляет валентность II.
Химические свойства
Оксид углерода (II) не образует солей и является восстановителем. Кроме того, к химическим свойствам угарного газа относятся:
- Горение синим пламенем в кислородной атмосфере.
- Окисление хлором, если присутствует катализатор или на него воздействует свет. При этом образуется ядовитое газообразное вещество — фосген. Молекулярное уравнение реакции: CO + Cl2 → COCl2.
- При повышенном давлении вещество вступает во взаимодействие с водородом. Из этой смеси, называемой синтез-газом, при различных условиях получают углеводороды, например, метан.
- При наличии давления оксид углерода (II) вступает в реакцию с щелочами. В результате появляется соль муравьиной кислоты.
- Восстановление металлов из оксидов. К примеру, взаимодействие с оксидом железа (III) даёт железо и углекислый газ.
- Реакции с сильными окислителями приводят к образованию углекислого газа или карбонатов.
Способы изготовления
Получить монооксид можно как в лабораторных условиях, так и в производственных. В первом случае для образования необходимого вещества используют концентрированную серную и муравьиную или щавелевую кислоты.
В промышленности для получения угарного газа применяют специальные газогенераторы. В них соединение вырабатывается воздухом, проходящим через раскалённый уголь. Ещё одним промышленным методом изготовления газа является паровая конверсия метана или угля. Кроме того, на производстве используют процесс неполного окисления метана.
Угарный газ присутствует и в атмосфере планеты. Он туда поступает тремя способами:
- неполное разложение органических веществ без доступа воздуха;
- сгорание биологической массы, например, лесные и степные пожары;
- выхлопные газы, которые образуются в двигателях внутреннего сгорания.
Использование соединения
Основное применение горючего вещества — изготовление генераторного или воздушного газа, для чего монооксид смешивают с азотом. Кроме того, соединяя его с водородом, получают водяной газ.
В металлургической промышленности из-за химической характеристики угарный газ используется в качестве восстановителя металлов из их руд. Также окись применяют при разложении карбонилов, что позволяет получить высокочастотные металлы.
Влияние на живые организмы
Монооксид крайне токсичен, потому что связывается с находящимся в крови гемоглобином прочнее и во много раз быстрее кислорода. Он блокирует процессы доставки жизненно необходимого вещества.
Если концентрация вещества в атмосфере превышает 0,1%, то живые организмы погибают в течение одного часа. Если же уровень оксида этого типа поднимается до 0,3%, то смерть наступает в течение нескольких минут. По этим причинам угарный газ относится к быстродействующим отравляющим веществам.
Специалистами установлено, что чаще всего люди погибают при пожарах в результате отравления указанным углеродным соединением, поскольку он является неотъемлемым продуктом горения большинства материалов. Кроме того, оксид вырабатывается двигателями автомобилей, что также приводит к гибели неосторожных граждан, например, механиков, которые пренебрегают организацией должной вентиляции в гараже.
Если отравление лёгкой степени, то пострадавшему для восстановления здоровья будет достаточно гипервентиляции лёгких кислородом. Если же отравление тяжёлое, то человеку потребуется серьёзная медицинская помощь.
Углекислый газ
Углекислый газ, двуокись или оксид углерода (IV) представляет собой газообразное бесцветное вещество, не имеющее запаха. Его химическая формула — CO2. Двуокись не горит и в минимальных концентрациях не представляет опасности для организма. Также она является необходимым элементом для нормальной жизнедеятельности растений.
Это соединение кислорода и углерода примерно в полтора раза тяжелее воздуха. Оно плохо растворяется в воде, а при повышении давления или охлаждении оксид становится твёрдым. Твёрдая углекислота известна под названием «сухой лёд». Она отличается способностью переходить из твёрдого состояния в газообразное, минуя жидкое.
У вещества линейная молекула. Из-за четырёх неспаренных электронов в своих соединениях углерод проявляет валентность, равную IV.
Атом углерода в этом соединении имеет пару двойных связей с кислородными атомами. Полярность четырёх связей делает молекулу двуокиси неполярной. Это хорошо видно в структурной формуле оксида, которая наглядно демонстрирует связь атомов внутри молекулы:
О=С=О.
Взаимодействие с другими веществами
В химии углекислота считается солеобразующим оксидом, проявляющим слабые свойства окислителя. Она прекрасно взаимодействует с водой, причём эта реакция является практически полностью обратимой.
Вещество имеет следующие химические свойства:
- Вступление в реакцию с основными оксидами и основаниями. Соединение взаимодействует лишь с щелочами и их оксидами. При этом могут образовываться кислые и средние соли. К примеру, гидроксид калия в таком случае образует гидрокарбонат калия, который является кислой солью. Если же щелочи много, то получится карбонат калия — средняя соль.
- Взаимодействие с карбонатами с последующим образованием гидрокарбонатов.
- Реакции с некоторыми восстановителями, например, с углеродом, магнием и пероксидом натрия.
Методы получения
Углекислый газ получают и в лабораториях, и в промышленности. В лабораторных условиях для его производства применяются следующие методы:
- Воздействие сильными кислотными веществами на карбонаты и гидрокарбонаты различных металлов.
- Углекислое соединение образуется, когда растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III).
- Разложение растворимых гидрокарбонатов и нерастворимых карбонатов при высоких температурах.
На производстве двуокись получают из печных газов, а также из продуктов разложения известняка и доломита. Для этого смесь веществ промывают раствором карбоната калия. Реагент поглощает углекислоту и становится гидрокарбонатом. Получившееся вещество нагревают, что приводит к его разложению и высвобождению оксида углерода. Затем газ закачивают в баллоны.
Применение углекислоты
Химические и физические характеристики соединения позволяют использовать его в самых разных областях. Так, вещество активно применяется в химической промышленности, металлургии и при производстве бумаги.
А также углекислота применяется в следующих сферах деятельности:
- сварка;
- сельское хозяйство;
- медицина;
- фармацевтика;
- приборы и оборудование;
- защита окружающей среды;
- пищевая промышленность;
- пневматическое оружие.
Очень востребован этот вид оксида углерода в системах пожаротушения. Им наполняют специальные огнетушители. Их принцип действия основан на том, что углекислота не горит и весит больше воздуха. За счёт этого вещество окутывает очаг возгорания и перекрывает для огня источник кислорода, которые необходим для поддержания процесса горения. В таких условия пламя довольно быстро гаснет.
Физиологическое действие
Углекислота — нетоксичное вещество. Но если в воздухе её становится слишком много, то все живые организмы, дышащие кислородом, могут испытывать приступы удушья, способные привести к смерти. По этой причине углекислому газу присвоен четвёртый класс опасности.
Если уровень находящегося в воздухе углеродного соединения составляет от 2 до 4%, то человек чувствует сонливость и слабость. Когда концентрация двуокиси достигает 7—10%, начинают появляться симптомы удушья, похожи на признаки высотной болезни:
- головная боль;
- головокружение;
- слуховые расстройства;
- потеря сознания.
Чем выше концентрация газа в атмосфере, тем длительнее проявляются симптомы. При очень высокой концентрации оксида человек или животное быстро погибает от удушья, которое вызывается гипоксией.
Само по себе вдыхание воздуха с высоким содержанием двуокиси неопасно, а потому не влечёт за собой длительных проблем со здоровьем. После того как пострадавший переносится в атмосферу с обычным уровнем углекислоты, его самочувствие приходит в норму.
ПредыдущаяСледующая
Источник: https://Sprint-Olympic.ru/uroki/himija/98271-oksid-ygleroda-formyly-osnovnye-svoistva-i-harakteristika.html
Кислородные соединения углерода
В соединениях с кислородом атомы углерода проявляют, как правило, устойчивую положительную степень окисления +4.Наиболее важными в практическом отношении являются диоксид углерода СО2 и соли несуществующей в свободном состоянии угольной кислоты — карбонаты.
Кроме того, есть небольшая группа килородсодержащих соединений углерода, в которых он имеет степень окисления +2. Это монооксид углерода СО и его производные.
СО — оксид углерода (II), угарный газ. В молекуле СО существует тройная связь. Две из трех связей образованы по обменному механизму, а одна — по донорно-акцепторному.
Это самая прочная из всех двухатомных молекул (энергия связи 1069 кДж/моль), поэтому СО является химически малоактивным веществом.
Наличие неподеленных электронных пар у атомов углерода и кислорода обусловливает возможность образования прочных комплексных соединений с d-элементами
Физические свойства
При обычной температуре СО — бесцветный газ, без запаха, очень плохо растворяется в воде, лучше — в спирте.
Монооксид углерода — ядовитый газ, разрушает комплекс гемоглобина с кислородом.
Способы получения
- 1. Промышленные:
- С + H2O → CO + Н2
- СН4 + Н2О → СО + ЗН2
- СН4 + СО2 → 2СО + 2Н2 В качестве катализаторов используют Ni, MgO, Al2О3.
- 2СН4 + 3О2 → 2СО + 4Н2О
- 2С + О2 = 2СО (горение угля в недостатке О2)
- 2. Лабораторные:
- HCOOH → CО + Н2О
- Н2С2O4 → CО + CО2+ Н2О
Химические свойства
Со — несолеобразующий оксид
При обычных условиях не реагирует с водой, кислотами, щелочами, поэтому относится к типу несо леобразующих оксидов. Однако формально его можно рассматривать как ангидрид муравьиной кислоты. Основанием для этого является его образование при дегидратации НСООН (см. выше), а также получение формиата натрия при пропускании СО через концентрированный раствор NaOH под высоким давлением:
СО + NaOH → HCOONa формиат натрия
Со — сильный восстановитель
- 1. Взаимодействие с кислородом и галогенами:
- 2СО + О2 = 2СО2
- СО + Cl2 = COCl2 фосген
- 2. Восстановление металлов из их оксидов (реакции осуществляются при Т — 300—1500°С):
- 2СО + SnО2 → Sn + 2СО2
- 4СО + Fe3O4 → 3Fe + 4CО2
- 3.
Восстановление водорода из воды:
- СО + Н2О = Н2 + CО2
- Эта реакция в присутствии катализаторов, содержащих Pt или Pd, происходит при обычной температуре, что используется для удаления СО из выхлопных газов автомобилей.
- 4.
Восстановление некоторых благородных металлов из солей (при комнатной Т):
- СО + PdCl2 + Н2О = Pd↓ + СО2↑ + 2HCl
Синтез органических соединений
- 1. Синтез метанола СО + 2Н2 → СН3ОН
- 2. Синтез метана и его гомологов: СО + 3Н2 → CН4 + Н2О
- nCO + (2n + 1)H2 → СnН2n + nН2O
Образование карбонилов металлов
- Молекулы СО довольно легко присоединяются к атомам некоторых d-металлов. В образовании донорно-акцепторных связей участвуют неподеленные электронные пары атомов углерода в молекулах СО и свободные орбитали атомов металлов:
- 4СО + Ni = [Ni(CO)4] тетракарбонил никеля
- 5СО + Fe = [Fe(CO)5] пентакарбонил железа
Образование карбокси — гемоглобина
- СО связывается с ионами Fe2+ в гемоглобине (НЬ) подобно О2. Сродство НЬ человека к СО более чем в 200 раз превышает сродство к О2, поэтому СО способен вытеснять О2 из оксигемоглобина НЬО2:
- НЬО2 + СО → НbСО + О2
- Этим и объясняется высокая токсичность угарного газа.
Диоксид углерода
СО2 — оксид углерода (IV), углекислый газ, угольный ангидрид, диоксид углерода. В молекуле СО2 атом углерода связан полярными ковалентными связями с двумя атомами кислорода: O=С=O. Молекула имеет симметричное линейное строение, вследствие чего в целом неполярна (дипольный момент равен O).
Физические свойства
При обычных условиях СО2 — бесцветный негорючий газ, значительно тяжелее воздуха, со слабым кисловатым запахом и вкусом Уже при комнатной температуре под давлением сжижается, а при более низкой температуре превращается в твердую снегообразную массу («сухой лед»). О растворении в воде — см. ниже.
Способы получения
- 1. Разложение карбонатов и гидрокарбонатов:
- СаСО3 → СаО + CО2↑
- 2NaHCО3 = Na2CО3 + CО2↑ + Н2O
- 2.
Сжигание угля и других видов топлива:
- СxНy + О2 → СО2 + Н2O
- 3. Действие сильных кислот на карбонаты и гидрокарбонаты:
- MgCО3 + 2HCl = MgCl2 + Н2O + CО2↑
- 4.
Спиртовое брожение глюкозы:
- С6Н12O6 → 2СО2↑ + 2С2Н5ОН
Химические свойства
СО2 — кислотный оксид, ангидрид угольной кислоты
Химически диоксид углерода — довольно инертное вещество. Основной тип взаимодействия СО2 связан с проявлением свойств кислотного оксида.
1. Взаимодействие с водой.
При растворении углекислого газа в воде небольшая часть его молекул (менее 1 %) соединяется с молекулами Н20, образуя очень слабую угольную кислоту:
СО2 + Н2O = Н2СО3
2. Взаимодействие со щелочами и основными оксидами.
- СО2 + 2NaOH = Na2CО3 карбонат натрия
- СО2 + NaOH = NaHCО3 гидрокарбонат натрия
- СО2 + Са(ОН)2 = СаСО3↓ + Н2O
- Эта реакция используется как качественная для обнаружения
СО2↑. - 3. Взаимодействие с водными растворами солей, образованных очень слабыми кислотами (слабее угольной):
- Na2SiО3 + СО2 + Н2O = H2SiО3↓ + Na2CО3
- С6Н5ОК + СО2 + Н2O = С6Н5ОН + КНСО3
Фотосинтез
СО2 — биохимически активное вещество. В листьях растений на свету из СО2 и Н2O образуются углеводы и кислород:
nСО2 + mН2O → Сn(Н2O)m + nО2
СО2 — окислитель в реакциях с сильными восстановителями
- При высокой температуре диоксид углерода реагирует с очень активными металлами, а также с другими сильными восстановителями (С, Н2, NH3).
Примеры реакций:
- СО2 + 2Мg = 2МgО + С
- СО2 + С = 2СО
- СО2 + ЗН2 → СН3ОН + Н2O
- а) Синтез мочевины (карбамида):
- СО2 + 2NH3 → CO(NH2)2 + Н2O
- б) Получение питьевой соды по методу Сольвэ:
- NaCl + NH3 + СО2 + Н2O = NaHCO3 + NH4Cl
Угольная кислота и карбонаты
Растворимость угольного ангидрида в воде при обычных условиях сравнительно невелика (в 1 л воды — 1 л СО2), при этом только очень небольшая его часть (менее 1 %) соединяется с водой, образуя непрочную угольную кислоту:
СО2 + Н2O → Н2СО3
Н2СО3 — слабая двухосновная кислота
- Будучи 2-основной кислотой, Н2СО3 диссоциирует ступенчато с образованием гидрокарбонат- и карбонат-анионов:
- Н2СО3 → Н+ + НСО3-
- НСО3- → Н+ + СО32-
- Угольная кислота существует только в водных растворах, где количество ее молекул и анионов в сотни раз меньше, чем количество растворенных молекул СО2.
- Н2СО3 как индивидуальное вещество не имеет никакого значения, но ее соли очень устойчивы и весьма распространены.
Карбонаты
Растворимость в воде. Гидролиз
Растворимыми в воде солями являются карбонаты щелочных металлов и аммония. Вследствие высокой степени гидролиза их водные растворы имеют сильнощелочную реакцию и в целом ряде случаев ведут себя как основания средней силы.
Na2СО3 + Н2O = NaOH + NaHСО3
СО32- + Н2O = ОН- + НСО3-
Химические свойства
Карбонаты щелочных Me при нагревании до т. пл. (~ 800 — 1000°С) не разлагаются. Все остальные карбонаты разлагаются, не достигнув т. пл., образуя углекислый газ и соответствующий оксид МеО. Термическое разложение СаСО3 широко используется для получения негашеной извести и СО2:
- СаСО3 = СаО + СО2↑
- При температуре от 700 до 900″С эта реакция обратима, ее равновесие смещают путем изменения давления СО2.
Особенно легко разлагается карбонат аммония: - (NH4)2CО3 = 2NH3↑ + СО2↑ + Н2O
Взаимодействие с кислотами
- Почти все кислоты, даже такие слабые, как уксусная, легко разлагают карбонаты, вытесняя из них угольную кислоту в виде СО2 и Н2O:
- Na2CО3 + 2HCl = 2NaCl + Н2O + CО2↑
- СаСО3 + 2HNO3 = Са(NO3)2 + Н2O + CО2↑
- (NH4)2CО3 + 2СН3СООН = 2CH3COONH4 + CО2 + Н2O
Превращение в гидрокарбонаты
- При пропускании СО2 в растворы карбонатов или при постепенном добавлении к ним кислот происходит образование кислых солей — гидрокарбонатов:
- Na2C3 + СО2 + Н2O = 2NaHC3
- Na2C3 + HCI = NaHCO3 + NaCl
- В природе происходит медленное растворение известняков под действием атмосферных осадков и СО2:
- СаСО3 + Н2O + СО2 = Са(НСO3)2
Гидрокарбонаты
Катионы NH4+, щелочных и щелочноземельных Me, а также некоторые другие 2-зарядные катионы образуют с анионами НСО3- соли — гидрокарбонаты. Все они легко растворяются в воде, за исключением NaHCО3.
- При кипячении растворов гидрокарбонатов происходит их превращение в карбонаты или гидроксиды металлов с отщеплением СО2:
- Са(НСО3)2 = СаСО3↓ + Н2O + СО2↑
- Mg(HCО3)2 = Мg(ОН)2↓ + Н2O + 2СО2↑
- Водные растворы гидрокарбонатов также имеют щелочную среду вследствие гидролиза, но рН значительно меньше, чем у растворов карбонатов. Гидролиз аниона НСО3- протекает по схеме:
- НСО3- + Н2O → ОН- + Н2СО3
Питьевая сода NaHCО3
- Сода — один из главных продуктов неорганического синтеза.
В промышленности ее получают ам миачно-хлоридным способом, основанном на малой растворимости NaHCО3 в воде (метод Сольвэ):
- NH3 + CО2 + Н2O = NH4HCО3
- NH4HCО3 + NaCl = NaHCО3 + NH4Cl
- NH3 + CО2 + Н2O + NaCI = NaHCО3 + NH4Cl
- При прокаливании NaHCО3 разлагается с образованием Na2CО3, СО2 и воды.
Качественная реакция на карбонат — анионы
- 1. Распознавание карбонатов в виде твердых веществ производится с помощью HCl или H2SО4 (разбавленных растворов) Выделяющийся при их взаимодействии СО2 определяют по помутнению известковой воды:
- СО32- + 2Н+ = СО2↑ + Н2O
- СО2 + Са(ОН)2 = СаСО3↓ + Н2O
- При избытке СО2 помутнение исчезает и раствор вновь становится прозрачным:
- СаСО3 + Н2O + СО2 = Са(НСО3)2
2. Распознавание карбонат-анионов в растворе можно осуществить введением катионов Са2+ , что приводит к выпадению в осадок нерастворимого СаСО3.
Исторические и технические названия некоторых карбонатов
- Na2CО3•10Н2O — Кристаллическая сода
- Na2CО3 — Кальцинированная сода
- NaHCО3 — Питьевая сода
- К2СО3 — Поташ
- СаСО3 — Кальцит, известняк, мел, мрамор
- MgCО3 — Магнезит
- СаСО3•МgСО3 — Доломит
- (СиОН)2СО3 — Малахит, основной карбонат меди
- FeCО3 — Шпатовый железняк
Источник: http://examchemistry.com/content/lesson/neorgveshestva/oksidugleroda.html




