


Уникальное в своем роде вещество считается одним из самых распространенных во всей Вселенной, уступая пальму первенства в своем объеме только водороду, ведь его доля составляет около 23 процентов от общей массы этого безграничного пространства. Близкие к рекордным показатели демонстрируют и другие физические свойства гелия, которые стоит рассмотреть более подробно.
Физические особенности
Химический элемент относят к практически полностью инертным газам, он не является токсичным и не имеет вкуса и запаха.
Одиночное строение атома гелия остается таковым при любых условиях, чего не скажешь о других его характеристиках, зависящих от атмосферного давления, температурного режима и многих других параметров.
Самый легкий идеальный газ после водорода, гелий обладает следующими физическими свойствами:

- Молярная масса атома газа составляет 4,002601 грамма на моль. Что касается молярного объема, то этот показатель равен 31,81 сантиметра кубических на моль, тогда как молярная теплоемкость составляет 20,79 Дж/Кмоль.
- Плотность вещества напрямую зависит от температурного режима, соответствуя 0,147 грамма на сантиметр кубический при падении столбика термометра ниже отметки в минус 270 градусов Цельсия и 0,000117846 градуса при нагревании до плюс 20 градусов и выше.
- Температура кипения у гелия является наиболее низкой, если сравнивать его с любым другим химическим элементом. Так, вещество имеет свойство закипать при температуре, равной 4,2152 Кельвина, что эквивалентно минус 268,94 градуса Цельсия.
- Температурный режим плавления соответствует 0,95 Кельвина или минус 272,2 градуса Цельсия при давлении, равном 2,5 МПа. При этом удельная теплота плавления составляет 0,0138 килоДжоуля на моль при удельной теплоте испарения 0, 0829 кДж/моль.
- Получение вещества в твердом виде становится возможным только при атмосферном давлении выше 25 атмосфер, тогда как при любых других показателях (даже нулевых) он не переходит в эту фазу.
- Гелий, найденный в природных условиях, всегда состоит из двух изотопов стабильного типа, один из которых имеет высокий процент распространения, близком к сотне, тогда как другой встречается гораздо реже, причем в совершенно разных естественных источниках (до 0,00014%). Помимо прочего, науке известны еще как минимум 6 радиоактивных гелиевых изотопов искусственного происхождения.

Стоит отметить, что для качественного определения вещества сегодня используется анализ эмиссионного спектра излучения, тогда как для количества применимым остается хроматографическое и масс-спектрометрическое тестирование. Кроме того, актуальными являются простейшие методы идентификации, подразумевающие измерение таких основных параметров, как плотность, молярная масса и теплопроводность.
Гелий в своем газообразном состоянии очень тяжело растворяется в воде (гораздо сложнее, чем любой другой газ).
Так, в литре воды, температура которой составляет 20 градусов Цельсия, объем растворимого газа составляет не более 8,8 миллилитра из 100.
Еще худшую растворимость можно наблюдать в этиловом спирте, так как ее показатель не превышает 2,8 мл/л при 15-градусной температуре и 3,2 мл при нагревании этанола до 25 градусов Цельсия.
А вот скорость диффузии гелия превышает актуальный для воздуха показатель в три раза, опережая даже водород, у которого коэффициент проникаемости ниже на 65%. Абсолютным рекордсменом гелий является и по коэффициенту преломления, максимально приближаясь к единице. Эффект Джоуля — Томсона у гелия имеет отрицательное значение в нормальной среде из-за его слишком быстрого охлаждения.
Что касается остывания в процессе дросселирования, то оно становится возможным только при 40 К и нормальном атмосферном давлении.
Если же температура продолжит опускаться, то становится возможным переход гелия из газообразного в жидкое состояние, но только при условии применения охлаждения расширительного типа, обеспечить которое реально только с помощью специального преобразователя относительной потенциальной энергии в механическую.
Химические свойства
Гелий является наименее активным элементом из всех известных, относясь к 18-й группе периодической таблицы и имея общепринятое обозначение He.
Такой же является и химическая формула гелия (электронная состоит из двух протонов и такого же количества нейтронов, дающих массовое число 4), который имеет в своей основе кристаллическую решетку гексагонального типа с параметрами 3,570 для показателя a и 5,84 для c, дающих соотношение 1,633. Что касается других химических характеристик вещества, то среди них стоит выделить:

- Величина ковалентного радиуса равна 28 пм при радиусе иона, соответствующем 93 пм.
- Уровень электроотрицательности по шкале Полинга соответствует 4,5 баллам.
- Электродный потенциал, как степени окисления, а следовательно, и валентность элемента имеют нулевые значения.
- Энергия ионизации первого электрона равна 2361,3 кДж/моль.
- Показатель теплопроводности элемента соответствует 300 К.
- Молекулярная ионная энергия равна 58 ккал/моль.
- Равновесное расстояние между ядрами химически связанных элементов соответствует 1,09 А.
Что касается соединений вещества, то сегодня известной является его связь LiHe. Сам элемент имеет свойство образовывать двухатомные молекулы фторида и хлорида, обозначение первого из которых HeF, а второго HeCl, притом что их получение становится возможным только при воздействии электрического разряда или УФ-излучения на смесь описываемого элемента с фтором или хлором, соответственно.
Совершенно другими свойствами обладает гелий в газообразном состоянии. Не последнюю роль в этом вопросе играет воздействие на газ различного рода физических и химических процессов.
К примеру, если пропустить ток через трубочку с гелием, то можно наблюдать его радужное свечение, сила которого будет зависеть от создаваемого давления в закрытом пространстве.
Если же не прибегать к подобным приемам, то останется один только желтый спектр, считающийся привычным для гелия в его нормальном состоянии.
Ввиду содержания в веществе нескольких линий спектра по мере уменьшения атмосферного давления происходит изменение его цветового излучения, которое начинает меняться от желтого к оранжевому, розовому и зеленому.
Всего же учеными принято выделять два основных спектра — единичный и триплетный, первый из которых свойственен атомам в их нормальном состоянии.
Что касается перехода в триплетное состояние, то он становится возможным только при использовании разряда в 19,77 эВ.

Вывести атом из его привычного состояния можно и другими методами воздействия, один из которых заключается в искусственно созданном столкновении с другими атомами вещества с последовательной передачей энергии между ними.
А вот обратный переход из триплетного состояния в синглетное естественным путем практически невозможен.
Такое состояние называется метастабильным и для того, чтобы перевести газ в стандартное положение вновь, приходится прибегать к различным методам внешнего воздействия.
Интересные факты о гелии
Название элемента происходит от греческого «Гелиос», что означает «Солнце» и латинского «гелиум», притом что второе наименование было выбрано отнюдь не случайно.
Так, не секрет, что окончание «ум» применяется по отношению к металлам, к которым и относился гелий на момент своего открытия.
И хотя на самом деле вещество является неметаллом, иногда его так и называют по-латыни, что не является ошибкой.
Немного истории
Сегодня уже мало кто вспомнит, что открытие элемента произошло еще 18 августа 1868 года, когда известный французский ученый решил исследовать солнечную хромосферу в момент полного затмения звезды в одном из индийских городов. Примечательно, что всего лишь через 3 месяца такое же открытие было сделано в Англии, правда, тогда о его неактуальности еще никто не знал, ввиду более сложной корреспонденции научных данных.
В 1881 году итальянский вулканолог Луиджи Пальмери, исследовавший Везувий, также идентифицировал это вещество, поспешив сообщить о своей находке общественности.
Но самое важное событие в области открытия гелия произошло 27 годами позже, когда он был впервые выявлен в недрах планеты.
Тогда газ удалось добыть из такого распространенного минерала, как клевеит, и со временем именно он использовался учеными для того, чтобы установить величину его удельного веса и других физических параметров.

Со временем исследователи научились получать гелий в жидком виде, для чего впервые довелось применить процедуру дросселирования.
В отличие от этого попытки добывать твердый гелий долгое время не увенчивались успехом.
Ситуация изменилась только в 1926 году, когда вдобавок к охлаждению было применено и критическое понижение атмосферного давления до 35 атм, в результате чего удалось выделить кристаллическую решетку вещества.
Получение и применение
Удивительно, но, несмотря на свое внушительное распространение во всей Вселенной, гелий довольно редко встречается на Земле.
Разной является и природа образования этого элемента на Земле и в космосе, так как в первом случае его выделение происходит за счет распада альфа-частиц тяжелых элементов.
В итоге часть вещества проходит через земные породы, сливаясь с природным газом и демонстрируя концентрацию от 7 процентов от общего объема и выше.
В настоящее время месторождения, в которых наблюдаются большие залежи гелия, имеются на территории таких стран, как Индия, Бразилия, Россия и Танзания.
Естественно, речь идет о гелийсодержащих газах, которые используются в промышленности для выведения чистого элемента или его производных.
Для этого применяется процедура охлаждения посредством дросселирования, и в этом случае сложность разжижения элемента в значительной мере облегчает процесс.
На выходе удается получить смесь, состоящую не только из гелия, но и из водорода и неона, после чего производится очистка. В итоге доля сырого гелия будет составлять около 70−90 процентов от общего объема.
После финишной фильтрации продукт, который, как известно, не может гореть, а следовательно, и не представляет никакой угрозы, транспортируясь в металлических баллонах, изготовленных в соответствии с ГОСТ 949–73 .
Если же стоит вопрос о перевозке сжиженного газа, то в ход идут специальные сосуды марки СТГ-10 и СТГ-25.

Что касается применения, то гелий используется в следующих сферах:
- Металлургия.
- Пищевая промышленность.
- Для изготовления хладагентов для различных агрегатов и рабочих установок.
- Для наполнения различных судов воздухоплавания и шариков.
- В дайвинге для приготовления дыхательных смесей, необходимых для погружения.
- В ракетных установках в качестве одной из составляющих теплоносителя.
- Для наполнения трубок газорезного типа.
- В сфере газовой хроматографии.
- Для поиска утечек в трубопроводах и всевозможных инфраструктурных установках.
Естественно, на этом применение элемента не заканчивается, ввиду чего производство гелия является очень развитым и востребованным в настоящее время.

Среди прочих преимуществ газа — его высокие перспективы в сфере термоядерной энергетики, благо, мировые запасы гелийсодержащих веществ не позволяют отнести его в разряд дефицитного.
Так, современные эксперты называют цифру в 45,6 миллиарда метров кубических, притом что объемы производства перевалили за 110 миллионов еще в 2003 году.
Источник: https://nauka.club/khimiya/geliy.html
Гелий, свойства атома, химические и физические свойства
![]()
![]()
![]()
![]()
He 2 Гелий
4,002602(2) 1s2
Гелий — второй элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 2. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), первом периоде периодической системы.
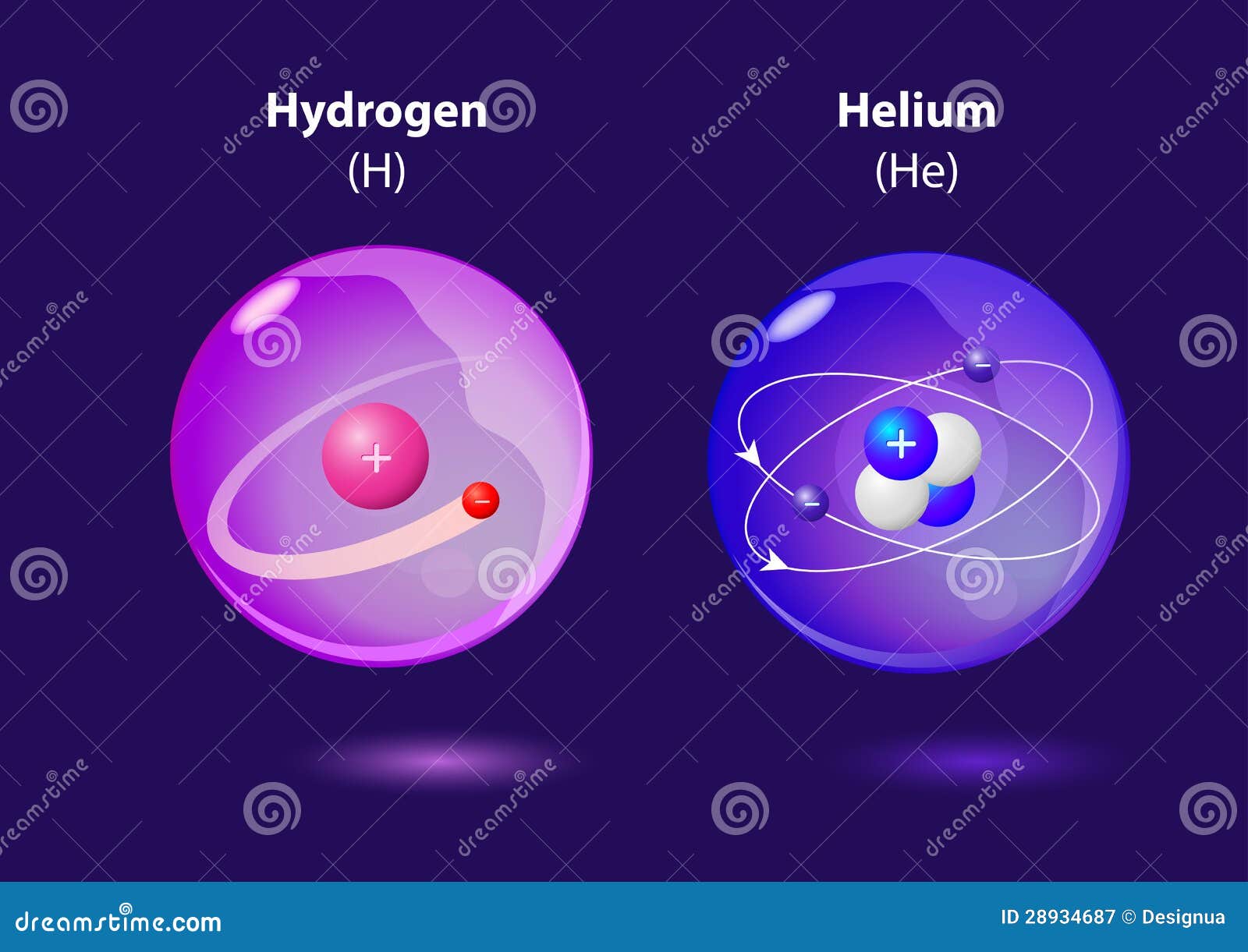
Атом и молекула гелия. Формула гелия. Строение атома гелия
- Изотопы и модификации гелия. Гелий-I и гелий-II
- Свойства гелия (таблица): температура, плотность, давление и пр.
- Физические свойства гелия
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием
Получение гелия
Применение гелия
Таблица химических элементов Д.И. Менделеева
Атом и молекула гелия. Формула гелия. Строение атома гелия:
Гелий (He, лат. helium) – химический элемент VIII группы короткой формы (18-й группы длинной формы) периодической системы химических элементов первого периода системы химических элементов Д. И. Менделеева, с атомным номером 2.
Гелий возглавляет группу инертных газов в периодической таблицы химических элементов Д. И. Менделеева.
- Как простое вещество представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
- Молекула гелия одноатомна.
- Химическая формула гелия He.
Электронная конфигурация атома гелия 1s2. Потенциал ионизации (первый электрон) атома гелия равен 24,47 эВ (2361,3 кДж/моль).
Строение атома гелия. Атом гелия состоит из положительно заряженного ядра (+2), вокруг которого по атомной оболочке (s-орбитали) движутся два электрона. Поскольку гелий расположен в первом периоде, оболочка всего одна. В свою очередь ядро атома гелия состоит из двух протонов и двух нейтронов.
Радиус атома гелия составляет 31 пм.
Атомная масса атома гелия 4,002602(2) а. е. м. (г/моль).
Гелий – практически инертный химический элемент.
Изотопы и модификации гелия. Гелий-I и гелий-II:
Изотопы гелия – разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре.
Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Остальные представляют собой шесть искусственных радиоактивных изотопа.
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость – 99,99986 %) и гораздо более редкого 3He (0,00014 %, содержание гелия-3 в разных природных источниках может варьировать в довольно широких пределах).
Гелий в атмосфере, почти весь состоящий из тяжёлого нуклида 4He, является продуктом α-распада тяжёлых радиоактивных элементов (урана, тория, актиния), лишь незначительная его часть является реликтовой (то есть захваченной миллиарды лет назад уплотнявшейся космической пылью, из которой образовалась Земля). Ежегодно накапливается в доступных для изучения толщах Земли и вод (25-28)⋅106 м³ гелия.
Содержание 3He в выделенном из атмосферы гелии ничтожно мало, отношение 3He/4He для воздуха равно 1,1⋅10−6, а для гелия из природных газов 1,4⋅10−7. Установлено, что 3He получается в результате β-распада тяжёлого нуклида водорода – трития, который образуется в ряде ядерных реакций в земной коре и верхних слоях атмосферы.
- Звёздный гелий (гелий Вселенной) – продукт термоядерной реакции синтеза ядер водорода, протекающей на Солнце и звездах по протон-протонному и углеродно-азотному циклам.
- Искусственно получены также другие – тяжёлые радиоактивные изотопы гелия с массовыми числами 5-10:
- – 5He, состоящий из двух протонов и трех нейтронов,
- – 6He, состоящий из двух протонов и четырех нейтронов,
- – 7He, состоящий из двух протонов и пяти нейтронов,
- – 8He, состоящий из двух протонов и шести нейтронов.
- – 9He, состоящий из двух протонов и семи нейтронов.
- – 10He, состоящий из двух протонов и восьми нейтронов.
Свойства гелия (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Гелий/ Helium |
| Символ | Нe |
| Номер в таблице | 2 |
| Тип | Неметалл |
| Открыт | Норман Локьер, Англия, 1868 г., Жюль Жансен, Франция, 1868 г. |
| Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| Содержание в земной коре | 5,5×10-10 % |
| Содержание в океане | 7,2×10-10 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 4,002602(2) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 |
| Радиус атома | 31 пм |
| Химические свойства | |
| Степени окисления | |
| Валентность | |
| Ковалентный радиус | 28 пм |
| Радиус иона | 93 пм |
| Электроотрицательность | 4,5 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 2361,3 кДж/моль (24,47 эВ) |
| Электродный потенциал | |
| Физические свойства | |
| Плотность (при +20 °C и нормальных условиях, состояние вещества газ) | 1,7846×10-4 г/см3 |
| Плотность (при –269 °C и нормальных условиях, состояние вещества жидкость) | 0,13 г/см3 |
| Температура плавления (при 2,5 МПа) | -272,2 °C (0,95 K) |
| Температура кипения | -268,928 °C (4,222 K) |
| Уд. теплота плавления (энтальпия плавления ΔHпл) | 0,0138 кДж/моль |
| Уд. теплота испарения (энтальпия кипения ΔHкип) | 0,0829 кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 31,8 см³/моль |
| Теплопроводность (при 300 K) | 0,152 Вт/(м·К) |
| Критическая температура | -267,95 °C |
| Критическое давление | 0,229 МПа |
| Критическая плотность | 0,0693 г/см3 |
| Давление паров | 1 мм.рт.ст. (при -271,9°C), 10 мм.рт.ст. (при -271,4°C), 100 мм.рт.ст. (при -270,5°C) |
| Стандартная энтальпия образования ΔH (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энергия Гиббса образования ΔG (при 298 К, для состояния вещества – газ) | 0 кДж/моль |
| Стандартная энтропия вещества S (при 298 К, для состояния вещества – газ) | 126,04 Дж/(моль·K) |
| Стандартная мольная теплоемкость Cp (при 298 К, для состояния вещества – газ) | 20,79 Дж/(моль·K) |
| Диэлектрическая проницаемость | 1,000068 (при 0°C), 1,0555 (при -271,095°C) |
| Электропроводность в твердой фазе | |
| Сверхпроводимость при температуре | |
| Твёрдость | |
| Структура решётки | гексагональная |
| Параметры решётки | a = 3,570 Å, c = 5,84 Å |
| Отношение c/a | 1,633 |
| Температура Дебая |
Физические свойства гелия:
При стандартных температуре и давлении гелий – бесцветный, не имеющий запаха и вкуса, нетоксичный, инертный одноатомный газ с химической формулой He.
При нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом.
Гелий – лёгкий газ. Гелий легче воздуха в 7,26 раза, но тяжелее водорода. Так, один кубический метр воздуха, который состоит из смеси разных газов, весит 1,293 кг, а один кубический метр гелия 0,178 кг. Поэтому, например, мыльные пузыри, наполненные гелием, на воздухе стремятся вверх. Один кубический метр гелия может поднять предмет массой 1,115 кг.
Плотность гелия (Нe) составляет 0,00017846 г/см3 при 20 °C и нормальных условиях, а при –269 °C плотность жидкого гелия составляет 0,13 г/см3.
Теплопроводность гелия при 300 K составляет 0,152 Вт/(м·К). Гелий обладает большей теплопроводностью, чем у всех других газов, за исключением водорода. Теплопроводность гелия примерно в 6,255 раз выше теплопроводности воздуха – 0,0243 Вт/(м·К).
Гелий (Нe) почти не растворяется в воде и органических растворителях. Так, растворимость гелия в воде составляет 0,000179 г/100 г (при температуре 30 °C).
- Гелий не растворяется в металлах, как, например, водород.
- Скорость диффузии гелия сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
- При обычных условиях и выше −250 °С при расширении гелий разогревается, а не охлаждается как большинство газов (“нормально” он начинает себя вести ниже −250 оС).
- Температура кипения гелия (Нe) составляет −268,928 °C.
Точка кипения гелия (T = 4,222 K для 4He) наименьшая среди всех веществ. При атмосферном давлении гелий не переходит в твёрдую фазу даже при абсолютном нуле.
При 2,17 К и обычном давлении гелий претерпевает фазовый переход второго рода (от гелия I к гелию II), сопровождающийся резким изменением ряда свойств: теплоемкости, вязкости, плотности. Для гелия II (ниже 2,17 K) характерна сверхтекучесть – способность протекать без трения через узкие щели (размером менее 100 нм).
У гелия-II отсутствует вязкость. Гелий II также обладает огромной теплопроводностью. Поэтому в отличие от бурно кипящего гелия I, выглядит как спокойная жидкость с ясно видимым мениском.
Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики.
Наглядно сверхтекучесть жидкого гелия проявляется, например, в ходе следующего опыта. Если сверхтекучий жидкий гелий налить в сосуд, он начнет вытекать наружу через его края в направлении более высокой температуры, даже если уровень жидкости сильно ниже краев этого сосуда.
Жидкий гелий практически не растворяет другие вещества.
Гелий – единственное вещество не затвердевающее при обычном давлении даже вблизи 0 K, он кристаллизуется только под давлением выше 2,5 МПа. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Температура плавления гелия (Нe) при давлении 2,5 МПа составляет −272,2 °C.
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску.
По мере уменьшения давления происходит смена цветов на розовый, оранжевый, жёлтый, ярко-жёлтый, жёлто-зелёный и зелёный. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра.
Важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия.
Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от красного к фиолетовому краю видимого спектра.
Критические параметры гелия (Нe) очень низкие: критическая температура гелия − 267,95 °C и критическое давление гелия 0,229 МПа. Этим объясняются трудности при сжижении гелия.
Скорость звука в гелии (Нe) составляет: 1056 м/с (при 30 °C, состояние вещества – газ), 965 м/с (при 0 °C, состояние вещества – газ), 237,66 м/с (при -272,165 °C, состояние вещества – жидкость), 231,4 м/с (при -271,39 °C, состояние вещества – жидкость), 221,7 м/с (при -270,97 °C, состояние вещества – жидкость), 223,3 м/с (при -270,65 °C, состояние вещества – жидкость), 179,8 м/с (при -268,93 °C, состояние вещества – жидкость).
Динамическая вязкость гелия (Нe) составляет: 0,0188 мПа·с (при 0°C, состояние вещества – газ), 0,0229 мПа·с (при 100°C, состояние вещества – газ), 0,0269 мПа·с (при 200°C, состояние вещества – газ), 0,0342 мПа·с (при 400°C, состояние вещества – газ),
0,0407 мПа·с (при 600°C, состояние вещества – газ).
Химические свойства гелия. Взаимодействие гелия. Реакции с гелием:
- При нормальных условиях гелий химически инертен.
- Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние.
- Например, гелий образует двухатомные молекулы He+2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Получение гелия:
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя его свойство сжижаться труднее всех остальных газов.
Жидкий гелий впервые получен в 1908 г., твердый – в 1926 г.
Применение гелия:
- Гелий используется во многих областях промышленности и быту:
- – в металлургии в качестве защитного инертного газа для выплавки чистых металлов;
- – в пищевой промышленности (зарегистрирован в качестве пищевой добавки E939) как пропеллент и упаковочный газ;
- – в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние);
- – для наполнения воздухоплавающих судов (дирижаблей и аэростатов). В отличие от водорода гелий в силу негорючести абсолютно безопасен;
- – в дыхательных смесях для глубоководного погружения;
- – для наполнения воздушных шариков и оболочек метеорологических зондов;
- – для заполнения газоразрядных трубок;
- – как компонент рабочего тела в гелий-неоновых лазерах;
- – в качестве носителя в газовой хроматографии;
- – и пр.
Таблица химических элементов Д.И. Менделеева
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
-



- карта сайта
- гелий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле гелия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Источник: https://xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai/geliy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Гелий газ. Свойства, добыча, применение и цена гелия
Не поддается законам классической механики. Ученые пытаются разгадать тайну гелия-4. Это легкий, не радиоактивный изотоп элемента. На него, собственно, приходятся 99,9% гелия на Земле.
Так вот, если 4-ый изотоп охладить до -271-го градуса Цельсия, получится жидкость. Только вот свойства ее для жидкости не типичны. Наблюдается, к примеру, сверхтекучесть.

Если поместить гелий в сосуд и поставить его вертикально, жидкость нарушит законы гравитации. Через несколько минут содержимое емкости вытечет из нее. Из сего же вытекает, что гелий – элемент любопытный, а любопытство надо удовлетворять. Начнем знакомство со свойств вещества.
Свойства гелия
Не. Это не частица отрицания, а обозначение 2-го элемента периодической системы Менделеева, то есть, гелия. Газ в обычном состоянии, он сгущается лишь при минусовых температурах. Причем, минус этот должен быть в пару сотен градусов Цельсия.
При этом, в свойства газа гелия вписана нерастворимость в воде. То есть, если сам элемент не жидкий, то его молекулы находятся в одной фазе, не переходя в другие. Между тем, именно смена фаз вещества является определением образования раствора.
Гелий – инертный газ. Его инертность проявляется не только в отсутствии «желания» растворяться в воде. Вещество не спешит вступать и в прочие реакции. Причина: — стабильная внешняя оболочка атома.
На ней находятся 2 электрона. Разбить крепкую пару, то есть, удалить одну из частиц с оболочки атома, сложно. Поэтому, открыли гелий не в ходе химических опытов, а при спектроскопическом исследовании протуберанцев Солнца.
Произошло это во второй половине 19-го века. Прочие инертные газы, а их 6, открыли еще позже. Примерно в это же время, то есть, в начале 20-го века, удалось перевести гелий в жидкую форму.
Гелий – одноатомный газ без цвета, вкуса и запаха. Это тоже выражение инертности элемента. Связывается он лишь с тремя «коллегами» по таблице Менделеева, — литием, хлором и фтором. Сама реакция не запустится.
Нужен ультрафиолет, или разряды тока. Зато, чтобы гелий «убежал» из пробирки, или другого объемного и твердого тела, усилий не нужно. У 2-го элемента самая малая адсорбция, то есть, способность концентрироваться на плоскости или в объеме.

Хранят газ гелий в баллонах. Они должны быть абсолютно герметичными. Иначе, адсорбция сыграет с поставщиками злую шутку. Вещество просочится через малейшие щели. А будь баллоны из пористого материала, гелий уйдет сквозь него.
Плотность газа гелия в 7 раз уступает кислороду. Показатель последнего – 1,3 килограмма на кубический метр. У гелия же плотность равна всего 0,2 кило. Соответственно герой статьи легок. Молярная масса гелия равна 4-ем граммам на моль.
Для сравнения у воздуха в целом показатель равен 29-ти граммам. Становится ясно, почему популярен гелий для шаров. Разница в массах 2-го элемента и воздуха тратится на подъем грузов. Вспомним, что моль равен 22-ум литрам. Получается, что 22 литра гелия способны поднять 25-граммовый груз. Кубометр газа потянет уже более килограмма.
Напоследок заметим, что у гелия отличная электропроводность. По крайней мере, это касается газов. Среди них 2-ой элемент уже не на втором, а на первом месте. А вот по содержанию на Земле гелий – не передовик. В атмосфере планеты героя статьи миллионные доли процента. Так откуда же тогда добывают газ. Выуживать его из атмосферы нецелесообразно.
Добыча гелия
Формула гелия является составной не только атмосферы, но и природного газа. В разных месторождениях разнится и содержание 2-го элемента. В России, к примеру, наиболее богаты гелием залежи Дальнего Востока и востока Сибири.
Однако, месторождения газа в этих регионах плохо освоены. Подстегивает к их разработке 0,2-0,8-процентное содержание гелия. Пока же, его добывают лишь на одном месторождении страны. Оно находится в Оренбурге, признано бедным на гелий. Тем не менее, 5 000 000 кубов газа в год добывают.
Общемировое производство гелия в год равно 175 000 000 кубических метров. При этом, запасы газа – 41 миллиард кубов. Большая часть из них скрыта в недрах Алжира, Катара и США. Россия тоже входит в список.
Из природного газа гелий получают путем низкотемпературной конденсации. Получается концентрат 2-го элемента с его содержанием не менее 80%. Еще 20% приходятся на аргон, неон, метан, водород и азот. Какой газ гелию мешает? Никакой. Но, людям примеси мешают. Поэтому, концентрат очищают, превращая 80% 2-го элемента в 100%.

Проблема состоит в том, что у экспертов есть так же, 100-процентная уверенность, что планету ждет дефицит гелия. Уже к 2030-му году мировое потребление газа должно достигнуть 300 000 000 кубометров.
Производство гелия через 10 лет не сможет перешагнуть планку в 240 000 000 из-за дефицита сырья. Оно является невосполнимым ресурсом. Второй элемент выделяется по крупицам при распаде радиоактивных пород.
Скорости природного производства не угнаться за нуждами людей. Поэтому, специалисты прочат резкий скачок цен на гелий. Пока, низкую стоимость обесценивает распродажа резервного фонда США, который стране стало невыгодно содержать.
Национальный запас создали в начале прошлого века, дабы наполнять военные дирижабли и коммерческие воздушные суда. Хранилище расположено в штате Техас.
Применение гелия
Найти гелий можно в топливных баках ракет. Там 2-ой элемент соседствует с жидким водородом. Лишь гелий, при этом, способен оставаться газообразным, а значит, создавать в баках двигателей нужное давление.
Наполнение аэростатов, — еще одно дело, в котором пригождается газ гелий. Углекислый, к примеру, не подойдет, поскольку тяжел. Легче гелия лишь один газ, это водород. Только вот, он взрывоопасен.
В начале прошлого века водородом наполнили дирижабль «Гинденбург» и лицезрели, как тот воспламенился во время полета. С тех пор выбор сделан в пользу инертного, хоть и чуть более тяжелого, гелия.

Популярен гелий и как охлаждающий агент. Применение связано со способностью газа порождать сверхнизкие температуры. Гелий закупают для адронных коллайдеров и спектрометров ядерного магнитного резонанса. Пользуются 2-ым элементом так же, в аппаратах МРТ. Там гелий закачивают в сверхпроводящие магниты.
МРТ проходили многие. Близки массовому потребителя и сканеры на кассах, считывающие штрих-коды. Так вот, в магазинские лазеры закачены гелий и неон. Отдельно гелий помещают в ионные микроскопы. Они дают лучшую картинку, чем электронные, можно сказать, тоже считывают данные.
В системах кондиционирования воздуха 2-ой элемент нужен для диагностики утечек. Пригождается сверхпроницаемость героя статьи. Если он находит куда просочиться, значит, могут «утечь» и прочие компоненты.
Речь о системах кондиционирования автомобилей. Кстати, подушки безопасности тоже заполняются гелием. Он просачивается в спасительные емкости быстрее иных газов.
Цена гелия
Пока, на газ гелий цена равна примерно 1 300 рублям за полтора куба. В них вмещаются 10 литров 2-го элемента. Есть баллоны и по 40 литров. Это почти 6 кубов гелия. Ценник на 40-литровые упаковки равен примерно 4 500 рублей.

Кстати, для пущей герметичности, на баллоны с газом надевают защитные чехлы. Они тоже стоят денег, обычно, около 300-от рублей для 40-литровой тары и 150-ти рублей для баллонов на 10 литров.
Источник: https://tvoi-uvelirr.ru/gelij-gaz-svojstva-dobycha-primenenie-i-cena-geliya/
ГЕЛИЙ
Содержание статьи
ГЕЛИЙ, He (helium), химический элемент из семейства благородных (инертных) газов He, Ne, Ar, Kr, Xe, Rn, составляющих VIIIA подгруппу в периодической системе элементов, или, как ее еще называют, нулевую группу.
История открытия
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.
Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле.
В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.
Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.

Распространенность в природе
Содержание гелия в мировом пространстве составляет 28% (второе место после водорода). Гелий – основной компонент звездной материи. В результате углеродного цикла (сложная цепь ядерных реакций), впервые изученного Х.Бете в 1939, водород в звездном веществе превращается в гелий, при этом происходит значительное выделение энергии (см.
также ЯДЕРНЫЙ СИНТЕЗ). В земной атмосфере гелий составляет всего 0,0005% об., так как он чрезвычайно легок и слабо удерживается гравитационным полем земли. Гелий образуется при распаде тяжелых радиоактивных элементов, находящихся в расплавленном земном ядре, и медленно диффундирует через земную мантию.
Тепловая энергия, выделяющаяся при ядерных процессах, поддерживает ядро земли в расплавленном состоянии. Природный метан, добываемый из скважин, содержит ок. 1,75% гелия и 0,5% CO2. После удаления CO2, глубокого охлаждения природного газа до –185° C и сжатия образуется жидкий метан, а в газовой фазе остаются гелий и азот.
Метод глубокого охлаждения позволяет получать гелий чистотой 98% и выше.
Свойства
Гелий имеет одну-единственную электронную оболочку, занятую двумя электронами, т.е.
его оболочка полностью заполнена электронами, которые испытывают сильное притяжение ядра, а значит, очень устойчивы; поэтому гелий не вступает в химические реакции, не образует химические соединений и не имеет степеней окисления.
Гелий – бесцветный одноатомный газ без запаха; он не вступает в реакции ни с одним химическим элементом, и его атомы не соединяются даже между собой. Наиболее распространенный изотоп 4He содержит в ядре два протона и два нейтрона, поэтому его массовое число равно 4.
Более редкий изотоп 3He с одним нейтроном был открыт в 1939 Л.Альваресом и Р.Кернегом. Содержание 3He составляет 10–5% гелия, находящегося в природном газе, добываемом из скважин. 3He получается в ядерных реакциях при распаде трития (3H-изотоп водорода). Гелий – необычное вещество, по свойствам он близок к состоянию идеального газа
| СВОЙСТВА 4He | |
| Атомный номер | 2 |
| Атомная масса | 4,0026 |
| Плотность, г/см3 | 0,178 |
| Температура плавления, °С | –272,2 (при 26 атм) |
| Температура кипения, °С | –268,93 |
| Критическая температура, К | 5,25 |
| Критическое давление, МПа | 0,23 |
| Содержание в земной коре, % | 0,0000003 |
| Степени окисления | – |
Жидкий и твердый гелий
Жидкий гелий обладает рядом уникальных свойств; он имеет самую низкую температуру кипения: 4He кипит при 4,22 K, а 3He – 3,19 K. Это свойство гелия используют для создания низких температур.
Гелий – единственное вещество на земле, которое при нормальном давлении не кристаллизуется вблизи абсолютного нуля, что объясняется слабым межатомным взаимодействием и квантовыми свойствами. Жидкий гелий бесцветен, очень текуч и имеет очень низкое поверхностное натяжение. Изотопы гелия в жидком состоянии сильно различаются.
Так, 4He имеет две формы: при температурах выше 2,18 K существует 4He, а ниже 2,18 K происходит необычный переход (фазовый переход второго рода) в 4He-II. Если пустой стеклянный сосуд погрузить в 4He-II, то жидкость будет медленно подниматься вверх по стенкам и перетекать внутрь до выравнивания уровней жидкости снаружи и внутри.
Если сосуд приподнять, то процесс пойдет обратно до нового выравнивания уровней жидкостей. Это – пленочное движение; оно характерно только для 4He-II. Другое аномальное свойство 4He-II – способность жидкости перетекать из области более низких температур в область более высоких.
4He-II обладает сверхтекучестью (явление сверхтекучести открыл П.Л.Капица в 1938) – свойством, известным только для жидкого гелия. Явление сверхтекучести объясняется на основе двухжидкостной модели.
Согласно ей, 4He-II состоит из двух полностью взаимопроникающих жидкостей – нормальной и сверхтекучей; последняя является идеальной жидкостью и не испытывает сопротивления при протекании через узкие капилляры. Согласно теории, в 4He-II существуют необычные температурные волны (второй звук). Объяснение аномалий 4He-II дается на основе представлений квантовой механики.
Жидкие 3He и 4He называются квантовыми жидкостями. 4He не имеет ядерного спина, а у 3He он равен 1/2 в единицах постоянной Планка. Удивительное различие состоит также в том, что 4He-II – сверхтекучая жидкость, а сопротивление текучести 3He резко возрастает с уменьшением температуры.
Гелий-3 становится, однако, сверхтекучим при температуре примерно 0,001 К, как было открыто в 1972. Это явление аналогично явлению сверхпроводимости, которая рассматривается как сверхтекучесть «электронной жидкости» (см. также СВЕРХПРОВОДИМОСТЬ). В 3He обнаружен новый тип звука при очень низких температурах, нулевой звук, предсказанный Л.Д.
Ландау и относящийся к волнам, характерным для ионизованных газов (плазмы). См. также СВЕРХТЕКУЧЕСТЬ.
Растворы изотопов гелия также необычны. Ниже 0,9 K раствор спонтанно делится на две части, образуя раствор, обогащенный 3He и текущий над раствором, обогащенным 4He. 6% 3He растворимы в 4He, но 4He не растворяется в 3He при абсолютном нуле.
Твердый гелий можно получить сжатием 4He до 25 атм или 3He до 34 атм при низких температурах. Твердый гелий – кристаллическое прозрачное вещество, причем границу между твердым и жидким гелием трудно обнаружить, так как их рефракции близки.
Применение
Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии.
Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля.
Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений.
При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, – постоянный и опасный спутник работы водолаза. Смеси He–O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов. Другие применения гелия – для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения.
В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств.
Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3He и 4He для создания и поддержания температур ниже 0,005 K.
Источник: https://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/GELI.html
ГЕЛИЙ

Гелий — второй порядковый элемент периодической системы химических элементов Д. И. Менделеева, с атомным номером 2. Возглавляет группу инертных газов в периодической таблице. Обозначается символом He (лат. Helium). Простое вещество гелий — инертный одноатомный газ без цвета, вкуса и запаха. Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода
Физические свойства
Гелий является вторым по лёгкости (после водорода) химическим элементом. Простое вещество гелий — нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ.
Жидкий гелий – бесцветная жидкость без запаха с температурой кипения при нормальном атмосферном давлении 101,3 кПа (760 мм.рт.ст.) 4,215 К (минус 268,9°С) наименьшей среди всех простых веществ и плотностью 124,9 кг/м3.
Твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. При нормальных условиях гелий ведёт себя практически как идеальный газ. Фактически при всех условиях гелий моноатомный. Плотность 0,17847 кг/м3.
Он обладает теплопроводностью (0,1437 Вт/(м·К) при н.у.) большей, чем у других газов, кроме водорода, и его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж/(кг·К) при н.у., для сравнения — 14,23 кДж/(кг·К) для Н2).
При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску.
По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 (15 °C), 3,2 (25 °C). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Химические свойства
Гелий — наименее химически активный элемент восьмой группы (Инертные газы) таблицы Менделеева. Для создания немногочисленных химических соединений гелия необходимы экстремальные условия, все они нестабильны при нормальных условиях.
Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние.
Гелий образует двухатомные молекулы He2, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или УФ излучения на смесь гелия газа и фтора (хлора)).
Получение
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие более 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов.
Охлаждение производят дросселированием в несколько стадий очищая его CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Сырой гелий (70-90 % по объёму гелий) очищают от водорода (4-5 %) с помощью CuO при 650—800 К.
Окончательная очистка достигается охлаждением сырого гелия кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
В России газообразный гелий получают из природного и нефтяного газов. В настоящее время гелий извлекается на гелиевом заводе ООО «Газпром добыча Оренбург» в Оренбурге из газа с низким содержанием гелия (до 0,055 % об.), поэтому российский гелий имеет высокую себестоимость.
Актуальной проблемой является освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири с высоким содержанием гелия (от 0,15 до 1 %), что позволит намного снизить его себестоимость.
Применение
Инертная среда для дуговой сварки: Особенно магния и его сплавов. Многие технологические процессы и операции нельзя вести в воздушной среде.
Чтобы избежать взаимодействия получаемого вещества (или исходного сырья) с газами воздуха, создают специальные защитные среды, и нет для этих целей более подходящего газа, чем гелий. В медицине: Смеси He-O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей.
В химии: При получении Si, Ge, Ti и Zr. В дыхательных смесях для работ под давлением: Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений.
При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, — постоянный и опасный спутник работы водолаза.
Военно-промышленный комплекс: Инертный, легкий, подвижный, хорошо проводящий тепло гелий — идеальное средство для передавливания из одной емкости в другую легковоспламеняемых жидкостей и порошков; именно эти функции выполняет он в ракетах и управляемых снарядах.
Ядерная промышленность: В гелиевой защитной среде проходят отдельные стадии получения ядерного горючего. В контейнерах, заполненных гелием, хранят и транспортируют тепловыделяющие элементы ядерных реакторов.
С помощью особых течеискателей, действие которых основано на исключительной диффузионной способности гелия, выявляют малейшие возможности утечки в атомных реакторах и других системах, находящихся под давлением или вакуумом. В качестве теплоносителя в некоторых типах ядерных реакторов.
Пищевая промышленность: Зарегистрирован в качестве пищевой добавки E939, в качестве пропеллента и упаковочного газа. При консервировании в среде гелия пищевые продукты сохраняют свой первоначальный вкус и аромат. В наружной рекламе Для заполнения газоразрядных трубок в смеси с другими благородными газами. В точных приборах Для газовой смазки подшипников в различных приборах и оборудовании систем навигации (гироскопы), в счетчиках нейтронов (гелий-3), в газовых термометрах, в рентгеновской спектроскопии, в течеискателях.
- Как компонент рабочего тела в гелий-неоновых лазерах.
- В переключателях высокого напряжения в качестве изолирующего газа.
- Используется в качестве хладагента для получения сверхнизких температур (в частности, для перевода металлов в сверхпроводящее состояние).
- Поскольку гелий негорюч, его добавляют к водороду для заполнения оболочки дирижаблей.
- И наконец всем известное применение гелия как легкого газа для наполнения воздушных шаров и оболочек метеорологических зондов.
Хранение и перевозка гелия
Гелий газообразный перевозят в стальных баллонах (ГОСТ 949-73) коричневого цвета и специализированных контейнерах, предназначенных для перевозки гелия, всеми видами транспорта в соответствии с правилами перевозок грузов, действующими на данном виде транспорта.
Жидкий гелий перевозят в специальных транспортных сосудах типа СТГ-10, СТГ-25 и СТГ-40 светло-серого цвета объемом 10, 25 и 40 литров соответственно. Сосуды с жидким гелием должны транспортироваться и храниться в вертикальном положении.
Могут перевозиться железнодорожным, автомобильным и другими видами транспорта в соответствии с правилами перевозок грузов, действующими на данном виде транспорта.
Опасные факторы и меры безопасности
Гелий не токсичен, не горюч, не взрывоопасен. Оказывает вредное воздействие лишь в той мере, в какой своим присутствием будет снижать концентрацию кислорода в организме, что может создать условия невозможные для дыхания.
При высоких концентрациях в воздухе вызывает состояние кислородной недостаточности и удушье. Жидкий гелий – низкокипящая жидкость, которая может вызвать обморожение кожи и поражение слизистой оболочки глаз.
Поэтому при работе с жидким гелием необходимо соблюдать те же меры безопасности, что и при работе с другими криогенными жидкостями.
Источник: http://www.gas-weld.ru/component/content/article/87-geliy.html




